Introducción
La caída o aborto de flores y frutos inmaduros es una de las limitantes mayores de la producción en Capsicum annuum (Minges y Warholic, 1973; Greenleaf et al., 1978; McGraw y Greig, 1986; Wien et al., 1989). Esto genera fluctuaciones amplias en las cosechas semanales, con rendimientos máximos que varían entre 5 y 10 frutos por m2 y periodos intermedios con menos de 2 frutos por m2 (Buwalda et al., 2006). Este patrón cíclico de crecimiento consta de periodos con gran carga de frutos y crecimiento lento, alternando con periodos de poca carga y crecimiento rápido (Kato y Tanaka, 1971; Hall, 1977; Marcelis, 1992; Marcelis y BaanHofman-Eijer, 1995; Heuvelink et al., 2004).
Diferentes factores abióticos promueven la abscisión de frutos (Figura 1). La disminución de la intensidad de la luz afecta la producción de flores (Kato y Tanaka, 1971; Quagliotti et al., 1974; Park y Jeong, 1976; Sawahata et al., 1980) y produce la caída hasta de 60 % de las estructuras reproductivas en los primeros cuatro nudos (Wien, 1990). Además, el aumento de la densidad de plantas disminuye la disponibilidad de luz y promueve aborto floral mayor (Marcelis et al., 2004). También, en ambientes con temperaturas altas, la producción mayor de etileno promueve la abscisión de flores y esto se intensifica en los períodos con temperaturas nocturnas altas (Aloni et al., 1991). Además, el aborto floral incrementa con la deficiencia de agua (Fernández et al., 2005).
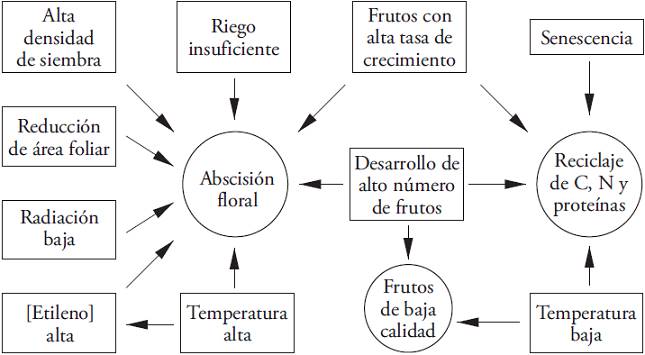
Figura 1: Interacciones entre los factores bióticos y abióticos involucrados en la abscisión floral en Capsicum annuum.
Los frutos en desarrollo también aumentan drásticamente la abscisión floral (Bakker, 1989; Wien et al., 1989; Marcelis y BaanHofman-Eijer, 1997; Heuvelink et al., 2004; Marcelis et al., 2004). Las fluctuaciones cíclicas se relacionan con la fuerza elevada de la demanda de carbohidratos que representa cada fruto en desarrollo (Hall, 1977; Bakker, 1989; Marcelis et al., 2004; González-Real et al., 2008) y con la competencia por asimilados entre estos últimos, las flores fecundadas y los primeros frutos (Aloni et al., 1996; Marcelis et al., 2004; Jaimez et al., 2010). El aumento de la fuerza de la demanda durante la fase de crecimiento mayor del fruto coincide con una tasa elevada de asimilación de CO2 (A) y concentración alta de N en las hojas cercanas a estos frutos (González-Real et al., 2009). Además, la A es menor en hojas aledañas a los frutos maduros o ubicadas en nudos donde ya se ha cosechado (Hall, 1977; Gucci y Flore, 1989; González-Real et al., 2009). Esto permite inferir que al aumentar los carbohidratos disponibles para el crecimiento de los frutos, disminuirá la tasa de aborto.
Para C. annuum no hay información precisa que relacione el crecimiento de los frutos con la eficiencia de la fotosíntesis a distintas alturas de la planta. No se ha establecido si el manejo del número inicial de flores influye en la acumulación de biomasa en los frutos y la competencia concomitante por asimilados. Aunque existe evidencia de que la presencia de los primeros frutos influye en la disminución de la producción total de la planta (Jaimez et al., 2010), este resultado no se ha relacionado con la tasa de aborto. Hasta ahora, se desconoce el efecto de la cosecha de un fruto sobre la tasa de crecimiento de los siguientes. Al disminuir la fuerza de la demanda con la eliminación de flores, se esperaría que aumente la tasa de crecimiento de los frutos. La relación fuente-fuerza de la demanda debe comprenderse con mayor precisión en C. annuum antes de proponer un sistema de manejo que eleve la calidad de los frutos y disminuya la fluctuación de la producción.
En este estudio consideramos que la fuente de asimilados disponible antes de la etapa reproductiva aumenta gradualmente con la intensidad de la eliminación de flores (Jaimez et al., 2010); y que la fuerza de la demanda se refleja en el diámetro de los frutos, lo cual está muy relacionado con la tasa de crecimiento (Bozokalfa y Kilic, 2010). Este estudio tuvo como objetivos evaluar como la variación inicial de la fuerza de la demanda afecta la tasa de crecimiento de los frutos, la dinámica de fructificación y el aborto; y relacionar la fuerza de la demanda a varias alturas de la planta con la A y actividad fotoquímica.
Materiales y Métodos
La investigación se realizó en invernaderos de la estación experimental Santa Rosa del Instituto de Investigaciones Agropecuarias de la Universidad de Los Andes en Mérida, Venezuela (8° 37’ 38.7” N y 71° 9’ 23.6” O) a 1936 msnm. Las características de los invernaderos son las reportadas por Jaimez et al. (2013). La temperatura media máxima y mínima durante el estudio fue 26.5 °C y 13.2 °C.
Las plántulas se obtuvieron de semillas del híbrido P1216 (Syngenta®), sembradas en bandejas con sustrato comercial. A los 45 d se trasplantaron a bolsas de polietileno (12 kg) con sustrato preparado con arena cernida mezclada con cáscaras de arroz-estiércol de caballo (1:1). Cada planta recibió 450 mL de agua diarios, a las 09:00, 12:00 y 15:00 h. La fertilización diaria fue 1 g L‒1, con fertilizantes comerciales completos NPK en relación 18-18-18 y al iniciar la floración 15-05-30. Calcio (1 g L‒1) se agregó a los 150 d después del trasplante (ddt). Todas las plantas se tutorearon a dos tallos.
Experimento 1: Efecto de la intensidad de la eliminación de flores sobre la tasa de crecimiento, tasa de aborto, tamaño y número de frutos
Las plantas se establecieron a una densidad de seis plantas por m2, el diseño experimental fue completamente aleatorizado, con tres repeticiones y unidades experimentales de 16 plantas. Los tratamientos fueron: 1) eliminación de la flor del primer nudo u horqueta central de la planta (27 ddt), 2) eliminación de las flores de los dos primeros nudos (46 ddt) y, 3) eliminación de las flores de los tres primeros nudos (53 ddt).
En las tres plantas centrales de cada parcela se midió cada semana la longitud y diámetro de los frutos, iniciando una vez alcanzados 15 mm. En los frutos cosechados se midió el diámetro y la longitud y se pesaron. Cosechas semanales se realizaron desde 119 ddt y terminaron a los 319 ddt.
Plantas adicionales se usaron para retirar frutos durante el crecimiento, en todos los estadios hasta la madurez. Se midió (diámetro y longitud), pesó, secó en estufa y pesaron de nuevo. Dos curvas de regresión se elaboraron para el peso fresco y para la biomasa, en función del producto de las dimensiones de los frutos (diámetro×longitud).
Con las medidas de los frutos muestreados y las ecuaciones de regresión se estimaron el peso fresco y la biomasa acumulada semanalmente durante el crecimiento. Los datos de diámetro, longitud, peso fresco y biomasa se trataron de la misma manera y por separado, ajustando un modelo no lineal (logístico):
donde Y: variable respuesta; D: días de observación; φ 1: valor de la asíntota o valor máximo de Y alcanzado; φ 2: tiempo en el cual se alcanza la mitad del valor de la asíntota; φ 3: tiempo transcurrido entre el momento de haber alcanzado la mitad y 3⁄4 de la asíntota
Como resultado de este modelo, se estimaron las tasas instantáneas de crecimiento, aplicando la primera derivada en función del día de observación. También, se contabilizaron las estructuras reproductivas abortadas y desarrolladas hasta el 15° nudo.
Experimento 2: Influencia de la fuerza de la demanda sobre la tasa de asimilación de CO 2 en diferentes nudos de la planta
Las plantas fueron instaladas dentro del invernadero en nueve hileras. Cinco plantas distribuidas al azar en la hilera central se usaron cada semana para medir el diámetro de los primeros cinco frutos: uno del primer nudo (central), dos del segundo nudo y dos del tercer nudo (sin poda floral).
En las mismas plantas, los parámetros del intercambio de gases (asimilación de CO2 (A), conductancia estomática (gs), transpiración (E), radiación (PAR), concentración de CO2 ambiental (Ca) y concentración intercelular de CO2 (Ci), se midieron con un analizador de gases tipo IRGA abierto (Infra-Red Gas Analyser) ADC, modelo LCA4. Las hojas que acompañaban a los cinco primeros frutos y una hoja apical extendida se tomaron en cuenta. Las mediciones de intercambio de gases se hicieron a los 109, 126 y 150 ddt.
Con un fluorómetro modelo PAM-2100 se midió la fluorescencia de la clorofila a en las mismas hojas empleadas para medir el intercambio de gases. Las variables de fluorescencia fueron: rendimiento cuántico del fotosistema II
La fluorescencia de la clorofila a se midió en tres épocas del cultivo (119, 167 y 185 ddt), esto es plena producción de frutos, poscosecha y fase final de las hojas; a 28 °C de temperatura y 1000 𝛍mol m‒2 s de densidad de flujo de fotones (DFFF).
En todos los casos, se aplicó la prueba de clasificación por rangos de Kruskal Wallis con p≤0.05.
Resultados y Discusión
Efecto de la intensidad de la eliminación de flores sobre la tasa de crecimiento, tasa de aborto, tamaño y número de frutos
La producción mostró fluctuaciones en los tres tratamientos y en todos se registraron dos periodos de producción alta (p≤0.05). El primero de estos ocurrió entre 119 y 167 ddt y el segundo entre 230 y 245 ddt (Figura 2). El desfase de inicio de la producción entre tratamientos se relaciona con la intensidad de la eliminación de las flores, procedimiento que causó retraso en la fructificación. El desfase desapareció y todas las plantas coincidieron en el siguiente máximo de cosecha (217 ddt). Durante los periodos de producción alta el rendimiento fue similar para los tres tratamientos (p>0.05).
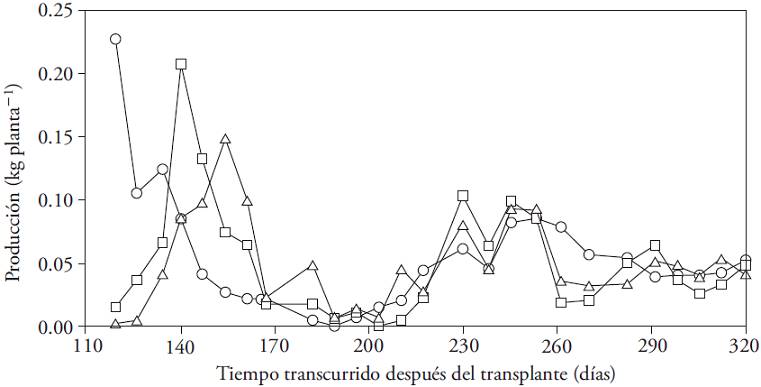
Figura 2: Dinámica de producción (kg por planta) de Capsicum annuum (cv. P1216) cultivado en tres condiciones de eliminación de flores: en el primer nudo (○), hasta el segundo nudo (□), hasta el tercer nudo (∆).
Este comportamiento cíclico parece característico del género Capsicum, en vista de lo reportado para cultivares de C. annuum con diferentes tamaños de frutos (Wubs et al., 2009a) y para Capsicum chinense (Jaimez et al., 2000; Jaimez y Rada, 2006).
En el cultivo de C. annuum la tasa de florecimiento disminuye durante el desarrollo de frutos y el crecimiento vegetativo se alterna con el reproductivo (Fontes et al., 2005). Cuando la tasa de fructificación se acerca a cero, aumenta rápidamente la tasa de crecimiento de vástago, raíz y botones florales (Clapham y Marsh, 1987), lo que resulta en diferentes intensidades de fructificación durante el ciclo. El tiempo que transcurre entre los máximos de cosechas varía entre cultivares (Wubs et al., 2009a).
En todos los tratamientos las flores del primer nudo permanecieron en la planta y desarrollaron frutos maduros. En el segundo nudo se alcanzó 100 % de cosechas con la eliminación menor de flores y 99 % bajo los otros dos tratamientos. En ningún otro nudo se alcanzó este porcentaje alto de fructificación, sin importar cuánto se redujera inicialmente la fuerza de la demanda. Excepto los dos primeros nudos, el aborto de estructuras reproductivas siempre fue mayor a 40 % en las plantas de los dos tratamientos con remoción menor de flores, y a 60 % en las de mayor intensidad de remoción de flores (Figura 3). Con los tratamientos de eliminación de flores hasta el primer y segundo nudo se obtuvieron patrones similares de aborto-fructificación. Posterior a la producción máxima en los dos primeros nudos, hubo disminución total de fructificación. Esto ocurrió en el quinto y sexto nudo de las plantas del primer tratamiento (sin flores en el primer nudo) y en el séptimo nudo de las plantas del segundo tratamiento (sin flores hasta el segundo nudo). El porcentaje de fructificación aumentó hasta 60 % desde el séptimo y octavo nudo en las plantas del primer y segundo tratamiento, respectivamente. El desarrollo de frutos fue máximo en los nudos 12° y 13° con la eliminación de flores en el primer nudo y en los nudos 9° y 10° con la eliminación de flores hasta el 2° nudo.
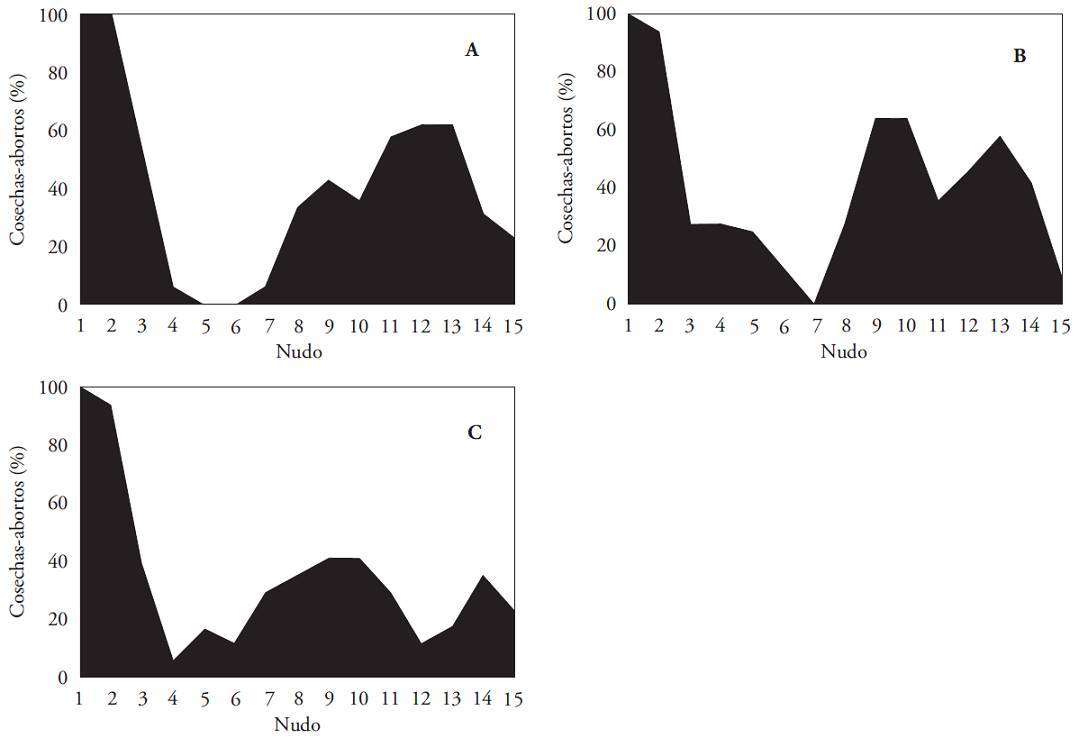
Figura 3: Relación porcentual entre frutos cuajados y abortos en los quince primeros nudos de plantas de Capsicum annuum cultivadas bajo tres condiciones de eliminación de flores: A) en el primer nudo, B) hasta el segundo nudo, C) hasta el tercer nudo.
La diferencia más importante en el comportamiento de las plantas con eliminación mayor de flores fue la ausencia de nudos con 100 % de flores abortadas; aunque se observó el mismo patrón que en los tratamientos uno y dos. Una zona con preponderancia de pérdida floral pudo delimitarse entre el cuarto y sexto nudo y un aumento en fructificación de los frutos entre el 7° y 11° nudo; la fructificación máxima (40 %) ocurrió en los nudos 9° y 10°.
El desarrollo de frutos en nudos inferiores se relaciona con la competencia entre estructuras reproductivas de los nudos superiores y con el aumento del aborto floral. En otro estudio se mostró que con el aumento de la fuerza de la demanda disminuye la relación fuente/demanda y aumenta linealmente la tasa de aborto total (Hall, 1977; Clapham y Marsh, 1987). En conjunto se relaciona el aumento en la tasa de aborto total de la planta las tasas elevadas de crecimiento de los frutos (Marcelis et al., 2004).
Los tres tratamientos de eliminación de flores no causaron un efecto significativo sobre la producción (p>0.05) (Cuadro 1). Este resultado no coincide con el paradigma establecido desde los estudios iniciales de este fenómeno, de que la acumulación de materia seca en la raíz y la eficiencia de la fructificación aumentan al eliminar las flores (Hall, 1977; Clapham y Marsh, 1987). En otros estudios (Jaimez et al., 2005) el rendimiento fue mayor (kg por planta y kg por m2) al eliminar flores en el segundo nudo.
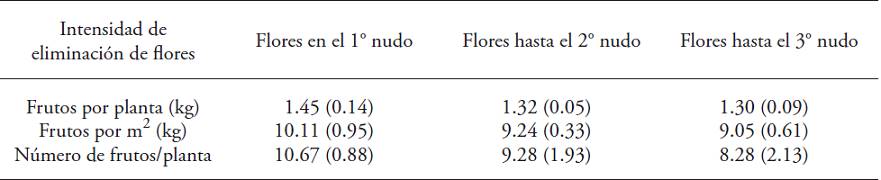
Entre paréntesis, el error estándar. No hubo diferencias estadísticas entre tratamientos (Kruskal-Wallis; p>0.05)
Cuadro 1: Producción promedio de frutos (kg por planta, kg m‒2 y frutos por planta) de Capsicum annuum en tres tratamientos de intensidad de eliminación de flores, cultivadas durante 320 d en invernadero.
Los frutos del tratamiento con eliminación de flores máxima alcanzaron el peso promedio mayor (158 g±53); en los tratamientos uno y dos el peso promedio de los frutos fue menor (140 g±67 y 136±62), respectivamente (p≤0.05). No hubo diferencia significativa en la productividad de las plantas con diferente eliminación de flores (p>0.05).
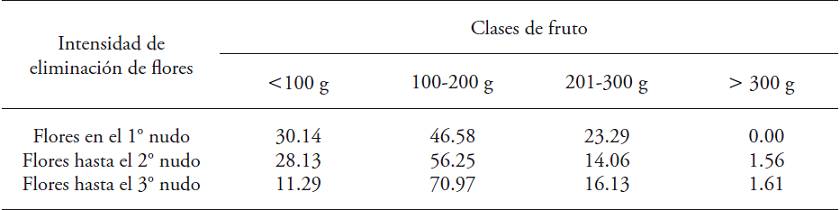
La calidad de los frutos varió en relación con la eliminación de flores (p≤0.05) (Cuadro 2). Con menor eliminación de flores la distribución de los frutos entre las clases de peso fue más homogénea.
Prueba ji-cuadrado:
Cuadro 2: Distribución porcentual por clases según el peso fresco (g) de frutos de Capsicum annuum. Plantas sometidas a tres intensidades de eliminación de flores y cultivadas durante 320 días en invernadero.
En todos los tratamientos la producción de frutos con peso mayor a 300 g fue baja. La diferencia en la cantidad de frutos cosechados con peso menor a 100 g fue evidente entre tratamientos, considerados como los de calidad menor. Las plantas de los dos tratamientos con eliminación menor de flores tuvieron porcentaje mayor de frutos con estas características (30 % y 28 %). En las plantas con eliminación mayor de flores, los frutos de esa clase sólo representaron 11 % de la producción total.
Los frutos de cualquiera de los tratamientos mostraron la misma velocidad de crecimiento en el lapso previo al alcance de la tasa instantánea máxima de acumulación de peso fresco. Luego de ese punto (unos 20 d), la velocidad de crecimiento fue mayor, pero aumentó la eliminación de flores (Figura 4).
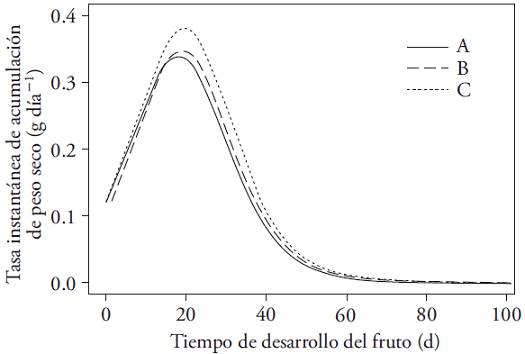
Figura 4: Velocidad instantánea de crecimiento (g d‒1) en peso seco de los frutos de Capsicum annuum hasta la cosecha. Plantas sometidas a tres intensidades de eliminación de flores (A) en el primer nudo, (B) hasta el segundo nudo, (C) hasta el tercer nudo.
La tasa de crecimiento máxima del fruto en plantas con eliminación de flores mayor ocurrió 1 o 2 d después de los frutos de los otros dos tratamientos (Cuadro 3). Este comportamiento desaparece luego del día 60, cuando la velocidad de crecimiento del fruto se hace mínima e invariable en todos los tratamientos. Esto permite vincular la alta tasa de crecimiento de los frutos del tratamiento de mayor eliminación de flores con la tasa total de aborto floral en esas mismas plantas. Wubs et al. (2009b) reportaron que cultivares con promedio de frutos superior a 140 g alcanzan las mayores tasas de crecimiento relativo en el día 20. Sin embargo, en la literatura revisada no había investigaciones que relacionen la intensidad de eliminación de flores con clasificación de los frutos por peso, ni con la tasa instantánea de crecimiento.
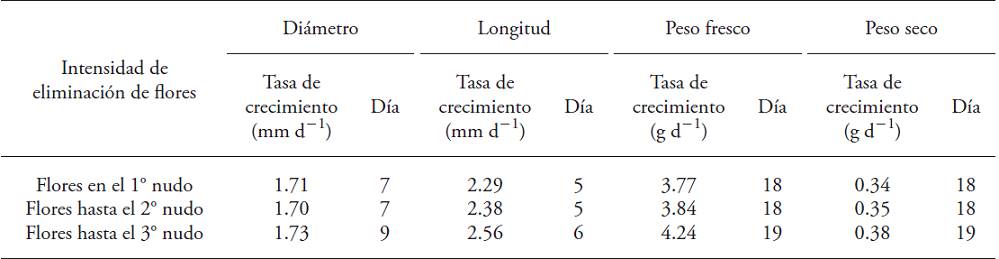
Cuadro 3: Máximas tasas instantáneas de crecimiento (mm d‒1 o g d-1) y tiempo en el cual se alcanzan (d) el desarrollo de frutos de plantas de Capsicum annuum sometidas a tres intensidades de eliminación de flores.
A través de la clasificación de los frutos según el peso fresco se demostró que luego de los 260 d de cultivo la calidad de los frutos disminuyó mucho, sin importar el tratamiento de eliminación de flores aplicado. Esta disminución en la calidad de los frutos coincide con resultados de Khah y Passam (1992), quienes afirman que en el transcurso del cultivo de C. annuum en condiciones de invernadero se reduce el tamaño del fruto y el número de semillas progresivamente. Así, nosotros proponemos que en condiciones tropicales de montaña se establezca un periodo de cultivo de 260 d para optimizar la calidad de las cosechas y aprovechar el tiempo restante para realizar una nueva siembra. Entonces, durante un año se podría aprovechar la estructura del invernadero para desarrollar un cultivo completo y un tercio de otro.
Los frutos crecieron rápidamente en diámetro y longitud durante la primera fase del desarrollo. Después de que los frutos alcanzaron 15 mm de diámetro, transcurrieron entre 7 a 9 d para el incremento mayor del diámetro y entre 5 a 6 d para el de la longitud; mientras que la ganancia máxima en peso ocurrió entre los días 18 y 19 (Cuadro 3). El atraso de la ganancia de masa con respecto al crecimiento dimensional no se relacionó con los tratamientos de eliminación de flores.
La reducción inicial de la fuerza de la demanda (por la eliminación de flores) y el concomitante aumento del crecimiento vegetativo previo a la fructificación podrían aumentar la tasa de acumulación de biomasa durante el desarrollo de los frutos. Sin embargo, no hay evidencias de que este efecto en la planta se mantenga por tiempo indefinido, porque las observaciones se realizaron hasta el 15° nudo.
Relación entre las dimensiones y el peso de los frutos durante su desarrollo
La relación entre el peso fresco de los frutos y el producto del diámetro × la longitud se describe con la ecuación: Y=6.473e‒7X2+0.016X‒4.426 (R2=0.95). La relación entre el peso seco de los frutos (biomasa) y el producto del diámetro × longitud se describe con la ecuación: Y=2.112e‒8X2+1.673e‒3X‒1.140 (R2=0.91). Con estas ecuaciones se pudo estimar el peso fresco y seco de los frutos aún unidos a las plantas. Este resultado concordó con los de Bozokalfa y Kilic (2010), quienes mostraron que el volumen del fruto de C. annuum depende, en 95 %, de la relación entre el diámetro, longitud y peso fresco. La diferencia principal entre sus resultados y los nuestros es que ellos consiguieron la estimación volumétrica del fruto, que se usa en el cálculo de rendimiento productivo (fines comerciales); y en este estudio se usó la estimación del peso fresco y seco de los frutos, para aplicar un modelo de crecimiento y calcular la tasa diaria de ganancia en peso.
Influencia de la fuerza de la demanda sobre la tasa de asimilación de CO 2 de los órganos foliares a diferentes alturas de la planta
El diámetro de los frutos al momento de la cosecha fue un carácter prácticamente invariable en cualquier fruto, sin importar el nudo donde se formó (Figura 5); pero, el peso fresco promedio al momento de la cosecha sí presentó variaciones amplias. Existió la tendencia a la disminución del peso del fruto con el ascenso de su posición dentro de la planta. Los frutos formados en el primer nudo fueron significativamente más pesados que los provenientes del segundo y tercero (p≤0.05).
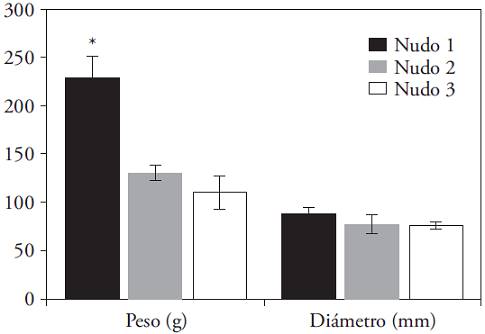
Figura 5: Peso final promedio (g) y diámetro final promedio (mm) de los frutos de C. annuum obtenidos en los tres primeros nudos. (*) Indica diferencia significativa entre nudos (Kruskal-Wallis; p≤0.05). Barras indican error estándar.
Con el aumento del diámetro del fruto la g s de la hoja acompañante disminuyó y A mostró un comportamiento similar (Figura 6) y tres grupos de hojas, con diferencias significativas se definieron. Las hojas apicales, con las A mayores (14.55 𝛍mol m‒2 s‒1); las hojas de los nudos dos y tres, con tasas intermedias (9.81-10.82 𝛍mol m‒2 s‒1) y las hojas del primer nudo con A de 5.93 𝛍mol m‒2 s‒1.
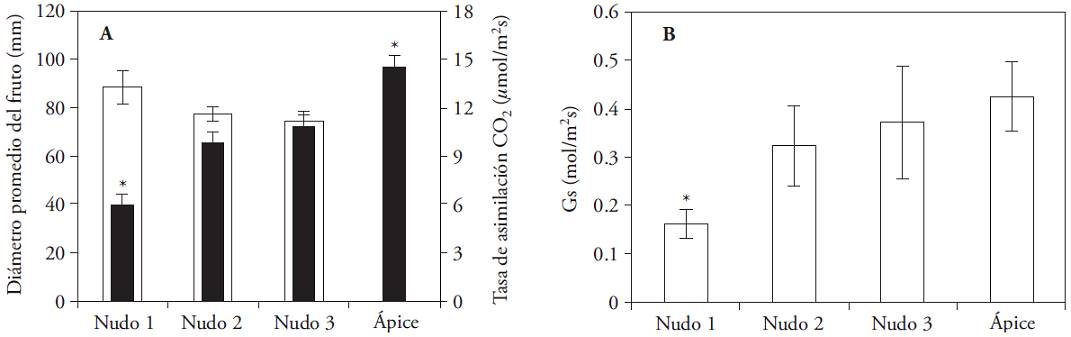
Figura 6: (A) Diámetro final promedio (mm) de los frutos de C. annuum en los tres primeros nudos (barras blancas) y tasas de asimilación de CO2 (𝛍mol m‒2 s‒1) (barras negras)(± error estándar). (B) Conductancia estomática promedio (mol m‒2 s‒1) en las hojas acompañantes y apical (± error estándar). Radiación promedio 900 𝛍mol m‒2 s‒1 y temperatura promedio 30 °C. (*) Indica diferencias significativas entre nudos (Kruskal-Wallis; p≤0.05).
Las hojas de nudos con frutos maduros o donde ya hubo cosecha poseen A menor, debido a la disminución del N orgánico foliar y a la demanda baja del fruto; las hojas próximas a frutos en desarrollo poseen la A mayor (González-Real et al., 2009). Nuestros resultados coincidieron con este planteamiento, pues A disminuyó con el aumento del diámetro del fruto aledaño, en la fase última del desarrollo de este. Sin embargo, la A en las hojas apicales fue superior que en las hojas que acompañaban a los frutos en desarrollo; lo cual contradice publicaciones previas (González-Real et al., 2009). Esto último se atribuyó a discrepancia en las características de la hoja apical utilizada en ambas investigaciones.
La medición simultánea de A y del crecimiento del fruto mostró que la capacidad de asimilación de las hojas declinó al aumentar su diámetro (Figura 7). Esto muestra que ante la demanda de los frutos en desarrollo se movilizan compuestos nitrogenados desde las hojas aledañas, lo cual reduce la fotosíntesis (González-Real et al., 2009). En tal sentido, el manejo del recambio y del número de hojas por nudo puede impactar positivamente la relación fuente/demanda de carbohidratos, y con eso la productividad.
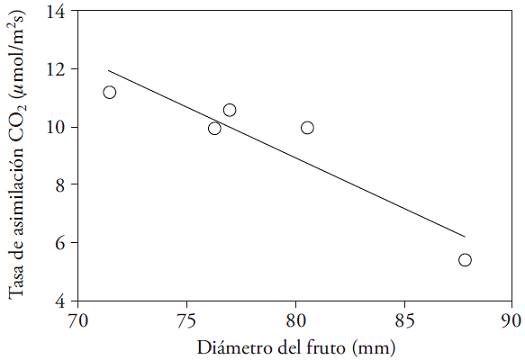
Figura 7: Tasa de asimilación de CO2 (𝛍mol m‒2 s‒1) en función del diámetro (mm) del fruto aledaño a la hoja para dos cultivares de la especie Capsicum annuum. Y=‒0.35X+37.00 (R2=0.86).
El aparato fotoquímico del fotosistema II disminuyó su eficiencia al envejecer la hoja. Es decir, cuando las hojas senescen, el rendimiento fotoquímico y el coeficiente de extinción fotoquímica (q P ) disminuyó y el coeficiente de extinción no-fotoquímica (q N ) aumentó (Figura 8). Esto significa que con el tiempo, los mecanismos de fotoprotección aumentan en la medida que se reduce la proporción de fotones destinados para la fijación de CO2. Esta tendencia hacia la disminución del rendimiento fotoquímico (Φ PSII ) de las plantas se evidenció de forma muy marcada en las hojas basales, que acompañaron a un fruto cosechado. Además, en el primer experimento no se encontró relación entre la disminución progresiva en el peso de los frutos y los tratamientos de eliminación de flores aplicados. Esto permite suponer que tal disminución se debe al envejecimiento de las plantas y a la concomitante reducción de la capacidad fotosintética.
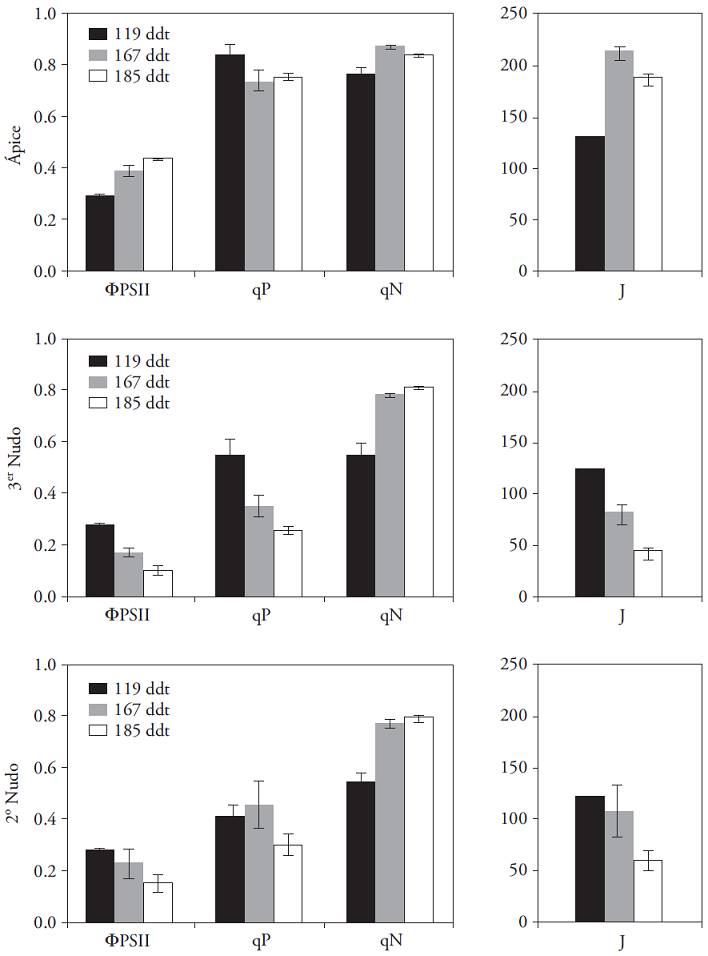
Figura 8: Parámetros de la fluorescencia de la clorofila a de Capsicum annuum en hojas apicales, del tercer y segundo nudo (±error estándar). Valores obtenidos en tres momentos del cultivo. Radiación promedio 1000 𝛍mol m‒2 s‒1 y temperatura constante (28 °C).
Esta disminución en la capacidad fotosintética durante el envejecimiento se correlaciona con un decrecimiento en el contenido de clorofila, de nitrógeno foliar, proteínas foliares y la actividad de la enzima Rubisco (Field, 1987). De acuerdo con esta propuesta, Imai et al. (2008) mostraron que la síntesis de Rubisco disminuye con la senescencia foliar. Olesinski et al. (1989) plantearon que la disminución en las tasas fotosintéticas, conforme envejecen las hojas, responde a la redistribución de los recursos durante la cual se favorece a las hojas más jóvenes. Esto convertiría a las hojas senescentes en fuente de recursos para las restantes que, eventualmente, acompañan frutos en desarrollo que demandan carbohidratos.
El recambio de hojas en el vástago depende de la disponibilidad de N en el suelo y en la planta y de la tasa de distribución-fijación de carbono en la planta. Este proceso de recambio foliar maximiza la eficiencia en el uso de los recursos y puede determinar el éxito en la competencia y dominancia entre órganos de demanda vecinos (Kouki, 2005). En nuestro estudio, el aporte de N fue continuo durante el ciclo del cultivo, por lo cual éste no sería un factor limitante; sin embargo, González-Real et al. (2009) mostraron que aun con fertilización contínua, el contenido de N orgánico foliar disminuye en función de la senescencia de la hoja.
En consecuencia, el reciclaje de recursos desde las hojas basales (senescentes), la distribución del N o el cambio en la tasa de síntesis de enzimas responsables de la fijación de CO2 podrían ser algunos de los factores que determinaron la disminución en la capacidad fotosintética de las hojas en el tiempo.
Conclusiones
El manejo del cultivo de C. annuum debe propiciar la renovación de las hojas para mantener la eficiencia fotosintética y la eliminación de flores hasta el tercer nudo, para que un número mayor de hojas trascienda de órgano de demanda a órgano fuente antes de la fructificación. Con esto aumenta la disponibilidad de fotoasimilados, disminuye la competencia entre órganos, se reduce el aborto floral y mejora la calidad de los frutos.











 texto em
texto em 



