INTRODUCCIÓN
Durante el Pleistoceno Tardío (12600-11700 años AP), Chiapas, entidad ubicada en el suroeste de México, fue el hábitat de una multitud de especies de mamíferos, destacándose aquellos que se denominan como megafauna, animales que medían entre 0.5 y 4 m de altura y pesaban más de 45 kg, como los bisontes, Bison sp., los caballos, Equus conversidens, los camellos, Camelops hesternus, los gliptodontes, Glyptotherium sp., los gonfoterios, Cuvieronius hyodon, el león americano, Panthera atrox, los mamutes Mammuthus columbi, el perezoso terrestre, Eremotherium laurdillardi, entre otras especies (Carbot-Chanona y Ovalles-Damian, 2013). Sin embargo, durante la transición del Pleistoceno al Holoceno la mayor parte de estos animales desaparecieron de la entidad y solo algunos sobrevivieron, lo cual sugiere que posiblemente las condiciones ambientales cambiaron y no fueron propicias para la existencia de tales animales en Chiapas y en el mundo (Koch y Barnosky, 2006; Wolverton et al., 2009; Ceballos et al., 2010).
Aunque en Chiapas se han realizado diversos estudios con este grupo de animales, la mayor parte de estos han sido desde un enfoque taxonómico (e.g.Montellano-Ballesteros y Carbot-Chanona, 2009; Carbot-Chanona, 2010) y pocos son lo que han tratado de inferir algunos aspectos paleoecológicos como la dieta de los caballos usando mesodesgaste (Carbot-Chanona y Gómez-Pérez, 2013) o el ambiente en el cual vivieron dichos mamíferos (Gómez-Pérez y Carbot-Chanona, 2012). Estos últimos se han basado en la presencia de algunas especies, por lo que en este trabajo nosotros inferimos la dieta y el hábitat de cuatro especies de herbívoros y una de carnívoro, así como las posibles condiciones ambientales en las localidades de Villa Corzo y Villaflores ubicadas en la Depresión Central de Chiapas, usando los marcadores biogeoquímicos δ13C y δ18O.
Isótopos estables de carbono y oxígeno
El empleo de las relaciones isotópicas de carbono y oxígeno presentes en diversos elementos óseos, como los huesos y los dientes, se ha vuelto una herramienta útil para inferir la dieta y el hábitat de mamíferos herbívoros y carnívoros del Cenozoico (Koch, 1998; Nieto y Rodríguez, 2003; Sponheimer y Cerling, 2014).
En el caso del carbono, éste ingresa a las plantas por medio de la fotosíntesis, de la cual existen tres formas: las vías C3, C 4 y CAM (O´Leary, 1988). La vía C3 es propia de los árboles y arbustos, así como algunos pastos de zonas frías y posee valores isotópicos de carbono de -23‰ a -35‰ (Smith y Epstein, 1971; van der Merwe y Medina, 1991; Drucker y Bocherens, 2009). En el caso de la vía C 4, ésta tiene un valor promedio de -10‰ con un intervalo de valores de -12‰ a -14‰ y es propia de los pastos y otras herbáceas, así como algunos árboles y arbustos de zonas cálidas (Cerling et al., 1997). Existen diversos factores que controlan la abundancia de las plantas C3 y C4 en los ecosistemas; uno de ellos es la temperatura. En temperaturas menores a 25 ºC las plantas C4 comienzan a disminuir y las C3 se hacen más abundantes (Medrano y Flexas, 2000). De la misma manera, niveles bajos de CO2 atmosférico favorecen a las plantas C4 (McInerney et al., 2011). En el caso de la humedad, las plantas C4 toleran condiciones bajas de humedad en comparación a las C3 (Stowe y Teeri, 1978). Así, en las zonas desérticas del norte de México y sur de Estados Unidos, la presencia de lluvias en invierno crean las condiciones favorables para el establecimiento de plantas C3, mientras que en verano, son las plantas C4 las que predominan (Ehleringer y Monson, 1993). En contraste, en zonas templadas, ambos tipos de plantas coexisten todo el año en sitios que posean las condiciones adecuadas de humedad y temperatura para su existencia (Ehleringer y Monson, 1993).
La última vía fotosintética, la CAM (Metabolismo Ácido de las Crasuláceas, por sus siglas en inglés), es propia de plantas suculentas como cactáceas u orquídeas, que poseen valores de δ 13C de -10‰ a -35‰ lo que las hace indistinguibles de las plantas C3 y C4 (Gröcker, 1997; Andrade et al., 2007). Su distribución se halla limitada por su tolerancia a bajas temperaturas e influenciadas por la aridez, dividiéndose en dos grupos, aquellas que habitan en zonas áridas o semiáridas como las cactáceas y las que prefieren zonas tropicales o subtropicales, como las orquídeas (Ehleringer y Monson, 1993).
Los animales, al consumir las plantas, van a incorporar el carbono de éstas a sus tejidos, por lo que tendrán valores isotópicos de carbono semejantes al de las plantas que consumieron; en el caso del esmalte dental, éstos tendrán un aumento entre 12‰ y 14.1‰ (Cerling y Harris, 1999). Así, los herbívoros que se alimenten de plantas C 3 exhibirán valores de δ13C de -19‰ a -9‰; y aquellos animales que consuman plantas C4 tendrán valores de -2‰ a 2‰, mientras los que se alimentan de ambos tipos de plantas mostrarán valores isotópicos de carbono de -9‰ a -2‰ (MacFadden y Cerling, 1996).
En el caso de los carnívoros, los valores isotópicos de carbono de estos animales van a estar determinados por las presas que consuman, así como la parte de éstas que sea ingerida, como músculos, órganos o huesos (Palmqvist et al., 2003; Coltrain et al., 2004; Kohn et al., 2005; Feranec y DeSantis, 2014). Por esta razón los valores isotópicos de los carnívoros mostrarán un enriquecimiento de 1.3‰ ± 2‰ en relación a los valores isotópicos de los herbívoros de los cuales se alimentan (Clementz et al., 2009).
El oxígeno en cambio, ingresa a los mamíferos herbívoros y carnívoros principalmente por el agua que es ingerida y en menor proporción, por el agua que es consumida en los alimentos y el oxígeno que se inhala y se halla en balance con aquel que se pierde a través de la orina, el sudor y las heces (Koch, 2007). Factores como la fisiología, el clima y el hábitat afectan este balance (Sánchez, 2005), dado que el oxígeno que se incorpora procede del agua ingerida, y ésta a su vez procede del agua de lluvia, la cual es afectada por la latitud, la longitud, la cantidad de precipitación, pero principalmente la temperatura (Dansgaard, 1964). Sin embargo, la relación entre la temperatura y los valores isotópicos de oxígeno del agua sólo se cumple en latitudes altas y no es válida en latitudes medias o ecuatoriales (Castillo et al., 1985). Por lo tanto, la composición isotópica del oxígeno es usada principalmente en trabajos paleoecológicos y en ocasiones, en estudios paleoclimáticos de zonas ubicadas en latitudes altas (Longinelli y Nuti, 1973; Iacumin et al., 1996; Kohn, 1996; Schoeninger et al., 2000).
Contexto geográfico y geológico
Los municipios de Villa Corzo y Villaflores se encuentran en la Depresión Central de Chiapas (Carbot-Chanona et al., 2004; Villalobos-Sánchez, 2013) (Figura 1). En el municipio de Villa Corzo se ubican las localidades La Simpatía y La Tejería, mientras que para Villaflores se conocen las localidades El Reparito, Los Amates, Gliptodonte y Los Mangos. En todas las localidades se ha establecido que la fauna pertenece al Rancholabreano con base en la asociación faunística. A continuación se da una breve descripción de las localidades.
La Simpatía. Se encuentra cerca del rancho La Simpatía, en el camino a Monterrey, Villa Corzo en las coordenadas 16º09'05" N y 98º18´55" W. Los afloramientos están expuestos en las paredes de un arroyo. La litología está compuesta por arcilla arenosa, arena fina y limo. De esta localidad han sido rescatados restos de tortugas, armadillos, gliptodontes, mamutes, gonfoterios, bisontes, leones, caballos y ratones (Carbot-Chanona y Vázquez-Bautista, 2006; Luna-Espinosa y Carbot-Chanona, 2009; Gómez-Pérez y Carbot-Chanona, 2012; Carbot-Chanona, 2010, Carbot-Chanona y Gómez-Pérez, 2014b). Esta localidad está fechada en 12600 ± 60 años AP (Carbot-Chanona y Gómez-Pérez, 2014a).
La Tejería. Esta localidad está ubicada en las inmediaciones del poblado de San Pedro de Buena Vista, Villa Corzo en las coordenadas 16º08´19" N y 93º09´29" W. En esta localidad se extrae material para la elaboración de ladrillos y tejas. Una sección de 5 m de espesor está expuesta, y se compone en su parte superior por arena gruesa y gui-jarros. La parte inferior está compuesta por arcilla arenosa y materia orgánica. Restos de Glyptotherium sp., Panthera atrox, Cuvieronius hyodon y Equus conversidens se encuentran en esta parte del afloramiento (Montellano-Ballesteros y Carbot-Chanona, 2009).
El Reparito. La localidad fue ubicada por Eliseo Palacios Aguilera a principios de la década de 1940. Se ubica a 35 km de la cabecera municipal de Villaflores en las coordenadas 16º22´56" N y 93º12´19" W. En esta localidad aflora un corte al lado de un arroyo, de aproximadamente 2 metros de espesor, conformado por arena fina con pequeños cantos rodados. Restos de Cuvieronius hyodon fueron rescatados de esta localidad (Gómez-Pérez, 2011).
Los Amates. Esta localidad fue ubicada originalmente por Eliseo Palacios Aguilera en 1941; se ubica en 16º14´33" N y 93º15´45" W. En esta localidad aflora una secuencia de arena y arcilla de cerca de 4 m de espesor expuesta en la rivera del río Villaflores, que se encuentra en los límites de la ciudad. Restos de Mammuthus columbi fueron recuperados en asociación con Glyptotherium floridanum (Gómez-Pérez y Carbot-Chanona, 2012).
Gliptodonte. Este es un terreno donde se extrae material para la elaboración de ladrillos y tejas. Se ubica en las inmediaciones del poblado de Villaflores, a tan solo 1 km de la salida rumbo a Villa Corzo en las coordenadas 16º12´55" N y 93º19´58" W. En esta localidad aflora una secuencia estratigráfica de 8 m de espesor. La parte superior de la sección está compuesta por grava y arena gruesa, con guijarros de mediano tamaño. Las partes inferior y media de la sección están compuestas por arcilla arenosa y arena fina de color gris marrón, que intemperiza a rojo marrón; capas finas de arcilla con restos de plantas se encuentran intercaladas en esta porción de la secuencia. Restos de Glyptotherium floridanum, Eremotherium laurillardi, Odocoileus virginianus y Equus conversidens así como polen de plantas arbustivas y acacias se han encontrado en la parte media e inferior de la sección (Carbot-Chanona, 2009; Gómez-Pérez y Carbot-Chanona, 2012).
Los Mangos. Esta localidad se encuentra cerca del poblado de Villaflores en las coordenadas 16º14´25" N y 93º13´28" W. Aflora una sección de 3 m de espesor compuesta principalmente por arena fina, arena gruesa y arcilla arenosa. Restos de Glyptotherium floridanum, Odocoileus virginianus y Equus conversidens se recuperaron de esta sección (Gómez-Pérez y Carbot-Chanona, 2012).
MATERIALES Y METÓDOS
Material examinado
Se examinaron molares aislados de un bisonte (Bison sp), cuatro caballos (Equus conversidens), cinco gonfoterios (Cuvieronius hyodon), un león americano (Panthera atrox), un mamut (Mammuthus columbi) y un perezoso terrestre (Eremotherium laurillardi). El material examinado se resume en la Tabla 1 y se halla albergado en el Museo de Paleontología "Eliseo Palacios Aguilera", con las siglas IHNFG.
Extracción y preparación de muestras
Las muestras de esmalte dental se extrajeron de dos maneras: en el caso de los molares de caballos se eligieron los M3 para extraer de cada uno de ellos entre siete y trece muestras. La elección de estos molares se debió a que estas piezas se forman después del destete, por lo que no existe aportación de leche materna como en las demás piezas, y con ello sus valores isotópicos reflejan fielmente lo que estos animales consumieron (Higgins y MacFadden, 2004; Hoppe et al., 2004). En el caso del ejemplar IHNFG-2683 se usó también el molar m3 y se contrastó la información obtenida con la procedente del M3 del mismo individuo. Cada muestra fue tomada entre 2 y 4 mm de separación entre ellas, obteniéndose 10 mg de esmalte dental de cada muestra. Las muestras se tomaron comenzando desde la unión o cerca de la unión raíz-corona hacia la zona oclusal. En el caso de los gonfoterios, el bisonte, el león americano, el perezoso terrestre y el mamut, sólo se obtuvo una muestra de 20 mg de cada uno de los ejemplares.
Una vez extraídas las muestras, éstas se prepararon siguiendo la metodología de Koch et al. (1997), que describiremos a continuación de forma resumida. Como primer paso, el esmalte dental o la osteodentina se pulverizó con un mortero y pistilo de ágata, y se tamizó con la malla 400 para obtener un polvo fino y uniforme. Se le agregó 10 ml de agua oxigenada al 30% por dos horas para eliminar la materia orgánica; posteriormente se centrifugó y se descartó el agua oxigenada y se hicieron tres lavados a las muestras, descartando con agua destilada el agua en cada lavada. Una vez concluido el enjuague, se agregó una solución buffer de ácido acético y acetato de calcio, dejándose reposar durante nueve horas. Posteriormente la solución buffer se descartó y las muestras volvieron a ser enjuagadas con agua destilada tres veces. Finalmente, para eliminar el agua se les agregó alcohol etílico y se dejaron secar en un horno a 90 ºC durante 12 horas. Posteriormente, las muestras tratadas fueron enviadas al Laboratorio de Isótopos Estables del Instituto de Geología de la Universidad Nacional Autónoma de México (UNAM), donde fueron analizadas en un espectrómetro de Masas Finnigan MAT 253, con sistema dual de introducción de muestras y un equipo auxiliar denominado "Gas Bench" con automuestreador GC Pal, con plancha de aluminio de temperatura controlada y acoplado al espectrómetro de masas (Révész y Landwehr, 2002). Los resultados fueron reportados como δ13CVPDB y δ18OVPDB y fueron normalizados usando NBS-19 y LSVEC siguiendo el procedimiento descrito por Coplen (1988), Coplen et al. (2006) y Werner y Brand (2001). Con esta técnica se obtiene una desviación estándar de 0.2 ‰ para el carbono y oxígeno de los carbonatos.
Análisis estadístico
Los valores obtenidos por las series de muestras fueron graficados en conjunto siguiendo el modelo propuesto por Feranec y MacFadden (2000), con la finalidad de observar si existía algún patrón que mostrara un cambio en los valores isotópicos de carbono debido a posibles variaciones en el clima (Figuras 2, 3, 4 y 5).
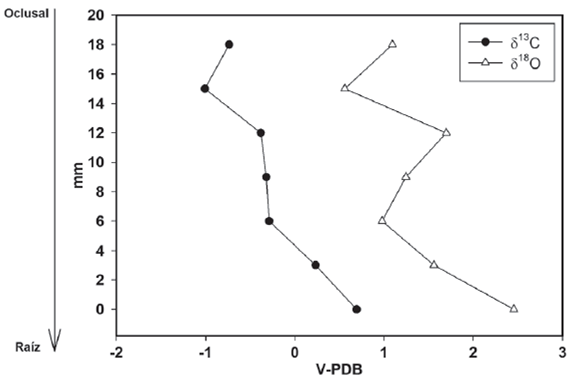
Figura 2 Valores isotópicos de carbono y oxígeno del individuo INHFG-2685. Los valores de V-PDB están expresados en ‰.
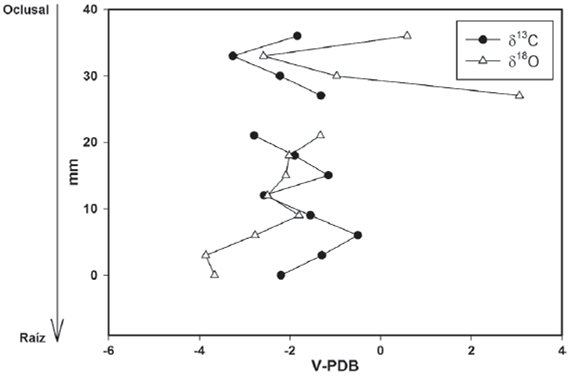
Figura 3 Valores isotópicos de carbono y oxígeno del individuo INHFG-4698. Los valores de V-PDB están expresados en ‰.
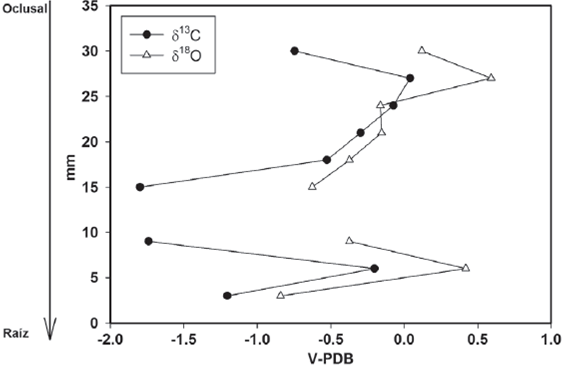
Figura 4 Valores isotópicos de carbono y oxígeno del M3 del individuo INHFG-2683. Los valores de V-PDB están expresados en ‰.
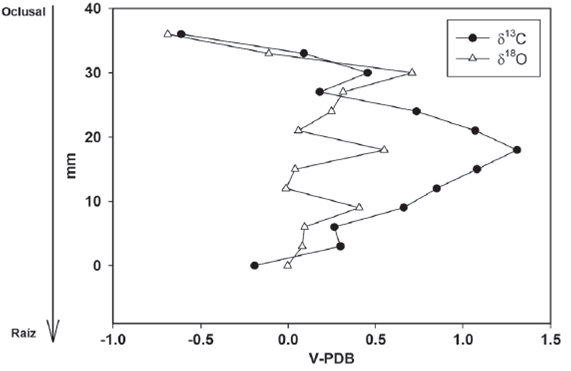
Figura 5 Valores isotópicos de carbono y oxígeno del m3 individuo INHFG-2683. Los valores de V-PDB están expresados en ‰.
A los valores isotópicos de oxígeno de todos los ejemplares estudiados, se les calculó la media, la desviación estándar y los valores máximos y mínimos. Posteriormente fueron convertidos a V-SMOW usando la fórmula de Faure (1977): δ18OV-SMOW: 01.030901* δ18OV-PDB + 30.91 y transformados en δ18O de agua empleando la fórmula de Iacumin et al. (1996): δ18Oagua = δ18OV- SMOW-33.63/0.998, para ser comparados con los valores isotópicos de oxígeno del agua de lluvia
calculados por Bowen y Wilkinson (2002), Bowen y Revenaugh (2003), Bowen et al. (2005) y Bowen (2008) para Villa Corzo, Villaflores y Tuxtla Gutiérrez, así con los exhibidos por muestras de agua de río y de manantial obtenidas en estas localidades (Tablas 2 y 3).
Tabla 2 Valores isotópicos de oxígeno del agua de Tuxtla Gutiérrez (TX), Villa Corzo (VC) y Villaflores (VF) inferidos por Bowen y Wilkinson (2002), Bowen y Revenaugh (2003), Bowen et al. (2005) y Bowen (2008). E: Enero, F: Febrero, M: Marzo, A: Abril, MY: Mayo, J: Junio, JL: Julio, A: Agosto, S: Septiembre, O: Octubre, N: Noviembre, D: Diciembre µ: promedio. Los valores de δ18O están expresados en V-SMOW‰.
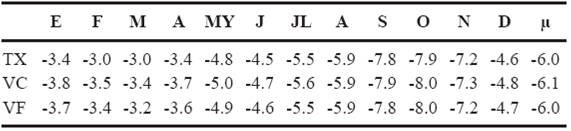
Tabla 3 Valores obtenidos de agua colectada en Tuxtla Gutiérrez, Villa Corzo y Villaflores en el mes de abril del 2014. * En el caso de Villaflores se tomó una muestra de agua adicional durante el mes de agosto de 2014.

En el caso de los valores isotópicos de carbono se obtuvieron también la media, los valores máximos y mínimos y la desviación estándar de cada una de las especies analizadas. Finalmente, los valores de δ13C fueron graficados en conjunto con los de δ18O para observar diferencias o semejanzas entre ellos (Figura 6).
RESULTADOS
Serie de muestras
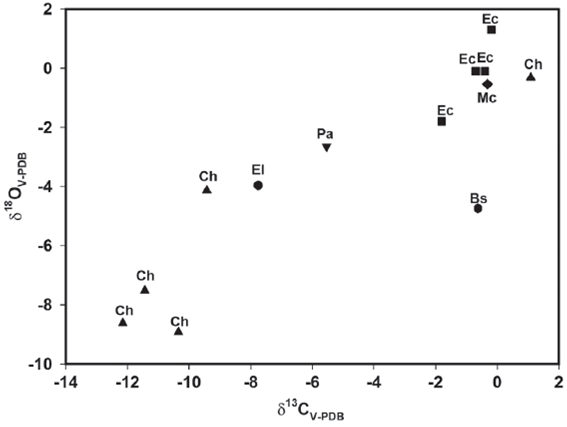
A continuación se dan los resultados de las series de muestras de los cuatro molares de caballo. Para el individuo IHNFG-2685 se obtuvieron siete muestras de esmalte dental; el valor promedio de δ13C fue de -0.2‰ con un intervalo de valores de -1.0‰ a -0.7‰ (Tabla 4). En el caso de los valores isotópicos de oxígeno, éstos van de 0.5‰ a 2.4‰ con un promedio de 1.3‰. En la Figura 2 se puede observar que existe un descenso en los valores isotópicos de oxígeno en el área cercana a la zona oclusal, la cual representa la primera etapa de mineralización del molar, al pasar de 1.1‰ a 0.5‰ en la segunda muestra. Posteriormente, el valor de δ18O se incrementa a 1.7‰ y vuelve a disminuir en la quinta muestra (0.9‰). Finalmente, el valor isotópico de oxígeno tiende a aumentar quedando en 2.4‰ en la última muestra, la cual representa la última etapa de mineralización del molar.
Tabla 4 Valores isotópicos de carbono y oxígeno del individuo IHNFG-2685. Los valores isotópicos de carbono y oxígeno están expresados en V-PDB‰ mientras que los de oxígeno del agua en V-SMOW‰.
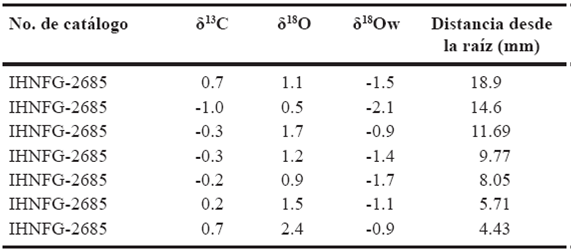
Para los valores de δ13C de este mismo ejemplar, se observa que hay un pequeño descenso en el valor isotópico de carbono de la primera muestra a la segunda, de 0.7‰ a -1.0‰ y posteriormente aumenta a -0.3‰ en la tercera muestra, manteniéndose este valor semejante hasta la cuarta muestra y posteriormente comienza a aumentar finalizando en 0.7‰ (Figura 2).
En el caso del caballo IHNFG-4698 se tomaron 14 muestras de esmalte dental, sin embargo, solo se obtuvieron valores isotópicos de carbono y oxígeno de 13 muestras, ya que una de ellas fue muy pequeña para ser analizada (Tabla 5). El intervalo de valores de δ13C es de -3.2‰ a -0.5‰ con un promedio de -1.8‰, mientras que para el oxígeno va de -3.8‰ a 3.0‰ con un promedio de -1.8‰. Se aprecia que los valores de δ18O de las dos muestras cercanas a la zona oclusal sufren un descenso, al pasar de 0.5‰ a -2.5‰; pero posteriormente aumentan hasta 3 en la cuarta muestra. Dado que no se obtuvieron valores de δ13C y δ18O en la quinta muestra se tiene un vacío en la información, aunque por el valor mostrado para la sexta muestra, -1.3‰, sugiere que éste descendió. Este descenso en los valores isotópicos de oxígeno se mantiene hasta la novena muestra (-2.4‰) y posteriormente sufre un pequeño aumento (-1.8‰), descendiendo nuevamente hasta -3.8‰ y concluir en -3.6‰ (Figura 3).
Tabla 5 Valores isotópicos del individuo IHNFG-4698. Los valores isotópicos de carbono y oxígeno están expresados en V-PDB‰ mientras que los de oxígeno del agua en V-SMOW‰.
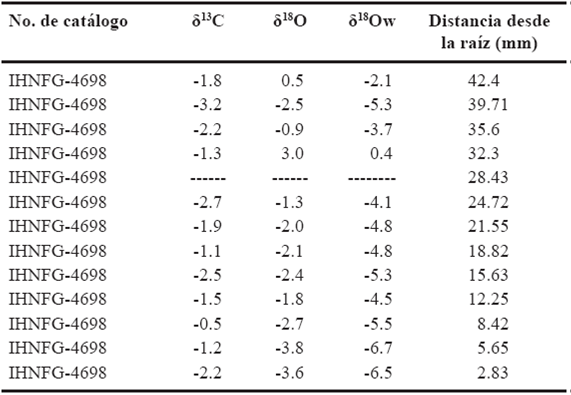
En el caso de los valores de δ13C, se puede observar un descenso de -1.8‰ a -3.2‰ en las dos primeras muestras y posterior aumen-tan hasta -1.3‰. Dado que no existe un valor de δ13C para la quinta muestra, en la sexta comienza en -2.7‰, lo que sugiere que hubo un descenso en el valor isotópico de carbono. Asimismo, se observa que el valor de δ13C aumenta a -1.5‰ y posteriormente tiende a descender a -2.5‰, incrementándose nuevamente a -0.5‰ para volver a descender y concluir en -2.2‰ (Figura 3).
Para el ejemplar IHNFG-2683 se tomaron diez muestras del molar M3, sin embargo sólo se obtuvieron resultados para nueve de ellas (Tabla 6). El valor promedio de δ13C fue de -0.7‰ con un intervalo de valores de -1.8‰ a 0.04‰, mientras que para el oxígeno el promedio fue de -0.1‰ con un intervalo de valores de -0.8‰ a 0.5‰. La Figura 4 muestra un aumento en el valor de δ18O de la primera a la segunda muestra, de 0.1‰ a 0.5‰ y posteriormente éste desciende a -0.1‰ manteniéndose este valor en la cuarta muestra y disminuyendo a -0.6. Dado que no se tiene un valor de δ18O para la séptima muestra, no es posible indicar si el valor isotópico de oxígeno aumenta, disminuye o se mantiene constante. En la octava muestra el valor isotópico de oxígeno fue de 0.3‰ el cual aumenta a 0.4‰ y finalmente disminuye a -0.8‰.
Tabla 6 Valores isotópicos de carbono y oxígeno del molar M3 del individuo IHNFG-2683. Los valores isotópicos de carbono y oxígeno están expresados en V-PDB‰ mientras que los de oxígeno del agua en V-SMOW‰.
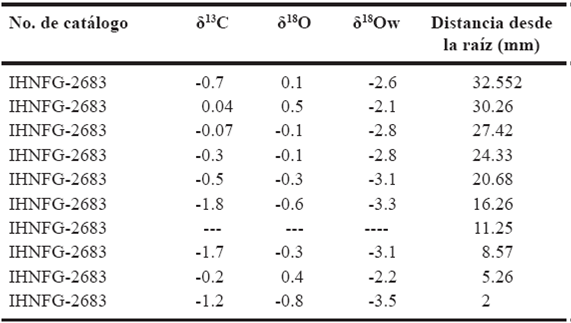
Para los valores de δ13C, se aprecia que existe un aumento al pasar de -0.7‰ en la primera muestra a 0.09‰ y posteriormente comienza a disminuir hasta -1.8‰ en la sexta muestra. De manera similar a lo que sucede con el δ18O, la falta de la séptima muestra no permite infe-rir si el valor isotópico aumenta, disminuye o se mantiene constante. La octava muestra exhibe un valor de δ13C de -1.7‰ el cual aumenta posteriormente a -0.2‰ y finalmente desciende a -1.2‰ (Figura 4).
Finalmente, del molar m3 IHNFG-2683 se obtuvieron 13 muestras (Tabla 7). El intervalo de valores isotópicos de carbono fue de -0.6‰ a 1.3‰ con un promedio de -0.4‰ y para la δ18O el promedio fue de -0.1‰ con un intervalo de valores de -0.6‰ a 0.7‰.
Tabla 7 Valores isotópicos del m3 del individuo IHNFG-2683. Los valores isotópicos de carbono y oxígeno están expresados en V-PDB‰ mientras que los de oxígeno del agua en V-SMOW‰.
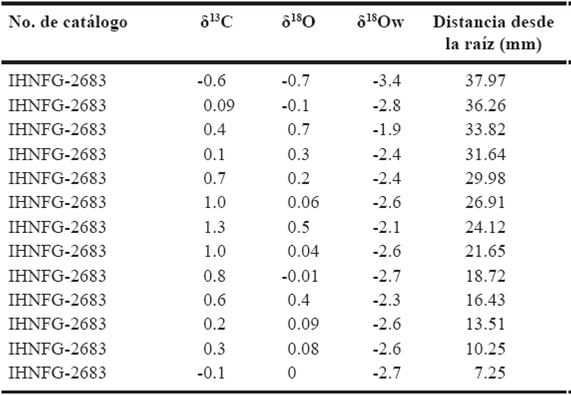
Así mismo, la Figura 5 muestra que el primer valor de δ18O del m3 de este individuo fue de -0.7‰, el cual aumenta hasta la tercera muestra en 0.7‰ y comienza a disminuir hasta 0.06‰ en la sexta muestra. Posteriormente hay un aumento de 0.5‰ disminuyendo hasta -0.01‰ en la octava muestra, volviendo aumentar a 0.4‰ y descendiendo hasta finalizar en 0.0‰. Con respecto a los valores isotópicos de carbono, el primer valor fue de -0.6‰, el cual aumenta hasta -0.4‰ en la tercera muestra; posteriormente hay un descenso hasta 0.1‰ y comienza a aumentar hasta 1.3‰ en la séptima muestra, para descender hasta 0.2‰ en la undécima muestra manteniéndose este valor constante para concluir en -0.1‰.
Los valores promedios de δ18O de agua para los caballos fueron de -1.3‰ (IHNFG-2685) y -4.4‰ (IHNFG-4698); en el caso del individuo IHNFG-2683, el M3 posee un valor isotópico de oxígeno del agua de -2.8‰, mientras que para su m3, éste fue de -2.5‰. Comparándolos con los valores de δ18 O del agua de las localidades, muestran una diferencia entre 1.6‰ y 4.8‰.
Fauna completa
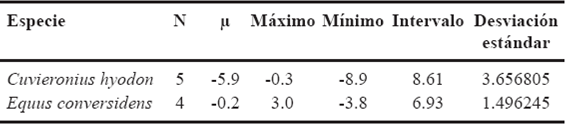
En la Tabla 1 se pueden ver los valores isotópicos de carbono y oxígeno de cada especie analizada. El valor promedio de δ13C de los caballos fue de -0.6 ‰ con un intervalo de valores de -3.2‰ a 1.3‰; para el caso de los gonfoterios, éste va de -12.1‰ a 1.0‰ con un promedio de -8.4‰ (Tabla 8). El león americano mostró un valor isotópico de carbono de -5.5‰, el del bisonte fue de -0.6 ‰, mientras que el valor de δ13C exhibido por el perezoso terrestre fue de -7.7‰ y el del mamut fue de -0.3 ‰. Para los valores isotópicos de oxígeno los caballos muestran un intervalo de valores que va de -1.6‰ a 1.3‰ con un promedio de -0.06‰, mientras que para los gonfoterios, éstos van de -8.9‰ a -0.3‰ con un promedio de -5.9‰ (Tabla 9). En cambio, el bisonte tiene un valor de δ18O de -4.7‰, para el perezoso terrestre fue de -3.9‰, mientras que para el mamut fue de -0.5‰ y en el caso del león americano fue de -2.6‰.
Tabla 8 Valores de δ13C promedios, máximos, mínimos, intervalo de valores y desviación estándar de los caballos y gonfoterios; n: número de individuos, µ: promedio.
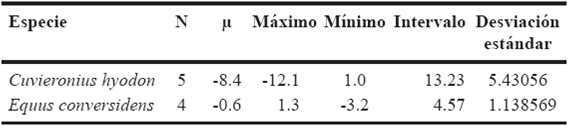
Tabla 9 Valores de δ18 O promedios, máximos, mínimos, rango de valores y desviación estándar de los caballos y gonfoterios; n: número de individuos, µ: promedio. Los valores de δ18O están expresados en V-PDB‰.
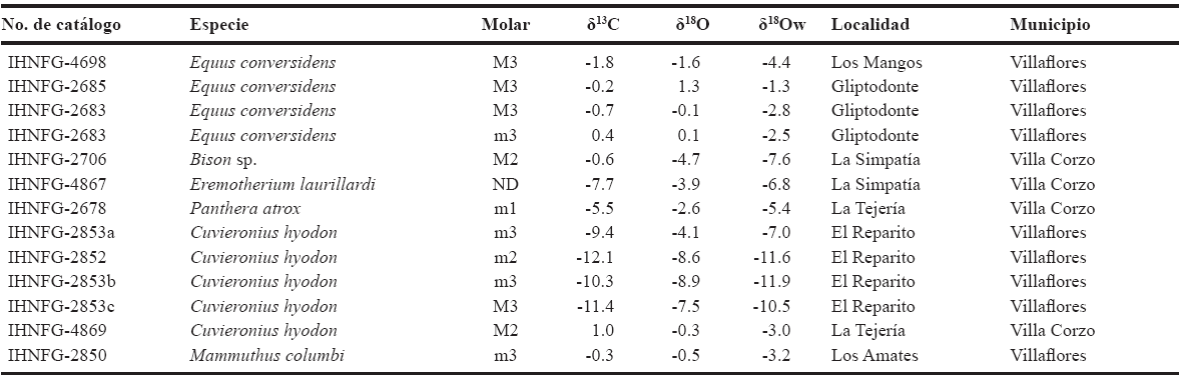
La comparación de los valores de δ13C y δ18O de las especies analizadas muestra que tres gonfoterios forman un grupo, mientras que un gonfoterio se agrupa con el perezoso. En contraste los caballos, el mamut, el bisonte y un gonfoterio forman un grupo separado de los anteriores, mientras que el león se halla cerca de este último grupo (Figura 6).
DISCUSIÓN
Dieta
La dieta del individuo IHNFG-2685 estaba sólo basada en el consumo de plantas C4, la cual como se puede observar se mantuvo constante en el tiempo. Un caso semejante sucede con el ejemplar IHNFG-2683 cuyos molares M3/m3 indican que se alimentaba exclusivamente de plantas C4. En contraste, en el individuo IHNFG-4698 las series de muestras indican que este individuo incluyó en su dieta pequeñas cantidades de plantas C3. Los análisis isotópicos y estudios de meso- y microdesgaste realizados por Pérez-Crespo et al. (2009) y Barrón-Ortíz et al. (2014) en ejemplares de Equus conversidens del Cedral, San Luis Potosí, muestran que esta especie de caballo basaba la mayor parte de su dieta en la ingesta de plantas C4, aunque existían algunos individuos con dietas mixtas C3/C4.
El bisonte muestra también una dieta basada exclusivamente en plantas C4, similar a lo hallado en algunos ejemplares del Cedral y de Tequixquiac (Pérez-Crespo et al., 2014). En contraste los gonfoterios en promedio exhiben una dieta mixta C3/C4, pero la mayoría de los ejemplares se alimentaban exclusivamente de plantas C3 y solo uno muestra una dieta basada en plantas C4. Tradicionalmente los gonfoterios en México han sido catalogados como animales ramoneadores, sin embargo los análisis isotópicos realizados con ejemplares mexicanos muestran que estos animales eran flexibles en su dieta (Pérez-Crespo et al., 2014). En el caso de Cuvieronius hyodon, Sánchez et al. (2004) hallaron ejemplares con dieta basadas sólo en plantas C3 y otros con una dieta mixta pero con un importante consumo de plantas C4, por lo que argumentan que este animal se adaptaba a los recursos alimentarios de las zonas donde habitaban (Prado et al., 2012).
El perezoso terrestre tenía una dieta mixta C3/C4, pero con un importante consumo de plantas C3. Sin embargo, los análisis morfo-funcionales han considerado que esta especie se alimentaba de las hojas de las copas de los árboles similar a las jirafas actuales (McDonald, 2005; Vizcaíno et al., 2008). Por el contrario los análisis isotópicos realizados en algunos ejemplares mexicanos muestran una dieta basada en plantas C3 (Pérez-Crespo et al., 2014). Análisis isotópicos realizados en ejemplares brasileños muestran que algunos ejemplares tenían dietas mixtas C 3/C4, semejantes al individuo de Chiapas y otros exclusivamente C 3, lo cual indica que esta especie no era especialista en el consumo de plantas C3 (Vianna et al., 2011; Dantas et al., 2013).
El mamut mostró una dieta basada en plantas C4; esta especie en México ha mostrado tener individuos con dietas basadas en plantas C3 o C4, semejantes al individuo de Chiapas, así como individuos con dietas mixtas C3/C4, lo cual ha llevado a proponer que estos animales fueron generalistas en su dieta (Pérez-Crespo et al., 2014). Finalmente el valor isotópico de carbono mostrado por el león americano, indica que se alimentaba de animales cuyas dietas estaban basada en plantas C4 o de dieta mixta pero con un importante consumo de plantas C4 como son los caballos, los bisontes y los mamutes. Aunque los análisis isotópicos realizados en ejemplares de P. atrox en Alaska por Fox-Dobbs et al. (2008) indican que se alimentaban de herbívoros cuyas dietas estaban basadas en plantas C3, como alces, bisontes, caballos y mamutes sub-adultos, estos herbívoros posiblemente se alimentaban de herbáceas C3 y por lo tanto las presas que consumían el ejemplar de Chiapas fueron similares a los mostrados por los especímenes de Alaska, al preferir herbívoros que consumían herbáceas independientemente de la vía fotosintética que estas plantas exhibían.
Ambiente
Los valores isotópicos de oxígeno obtenidos de las series de muestras de los caballos muestran que existen pocas diferencias entre el valor mínimo con relación al valor máximo. Una excepción es el individuo INHFG-4698 cuyo valor máximo de δ18O es de 3.0‰ y el mínimo de -3.8‰ una diferencia de 6.8‰; una posibilidad es que el valor 3.0‰ exhibido sea un error analítico debido a la pequeña cantidad de muestra que se obtuvo para ser analizada por el espectrómetro.
Comparando los valores de δ18O de las series de muestras con sus contrapartes de carbono, se puede observar que en algunas zonas de cada figura, un incremento o descenso en los valores isotópicos de oxígeno tienen una respuesta semejante en los valores de carbono (Figuras 2, 3, 4 y 5). Feranec y MacFadden (2000) indican que los cambios en los valores de δ13C señalan variaciones en la abundancia de las plantas C3 y C4 de un sitio debido a los cambios en la temperatura, los cuales son observados en los valores de oxígeno. Esto es debido a que a temperaturas menores a 25 ºC, las plantas C3 comienzan a abundar y las C4 a disminuir (Medrano y Flexas, 2000). Así, en zonas cuyos veranos sean muy cálidos y los inviernos muy fríos, el modelo de Feranec y MacFadden (2000) mostrará un patrón sinusoidal, donde los valores altos de δ13C y δ18O indicarán abundancia de plantas C4 y temperaturas altas, y los valores isotópicos de carbono y oxígeno bajos, abundancia de plantas C3 y bajas temperaturas.
Sin embargo, como se puede observar en las Figuras 2, 3, 4 y 5, los valores isotópicos de oxígeno no tienden a descender lo suficiente como para provocar que las plantas C4 sean completamente sustituidas por las plantas C3. Aunque en el caso del individuo IHNFG-4698 existen valores de δ13C que muestran la aparición de plantas C3, posiblemente éstas no hayan sido tan abundantes como para sustituir completamente a las C4. Otro factor que afecta a la distribución y abundancia de las plantas C3 y C4 es la humedad. Ehleringer y Monson (1993) indican que las plantas C4 toleran niveles más bajos de humedad que las plantas C3, por lo que en zonas áridas son las plantas C4 las que abundan, mientras que en zonas con alta humedad son las C3 las que dominan. Un bajo nivel de humedad en la zona puede ser el factor que explique por qué aun cuando los valores de δ18O disminuyen, los valores isotópicos de carbono muestran la abundancia de plantas C4.
Esto puede ser corroborado por los valores de δ18O del agua estimados para Villa Corzo y Villaflores, así como para Tuxtla Gutiérrez por Bowen y Wilkinson (2002), Bowen y Revenaugh (2003), Bowen et al. (2005) y Bowen (2008) (Tabla 2). El valor promedio de δ18O para Villa Corzo es de - 6.1‰, mientras que para Tuxtla Gutiérrez y Villaflores son de -6.0. Comparándolos con los valores isotópicos del agua de los caballos existe una diferencia de entre 1.6‰ a 4.8‰. La Tabla 2 muestra el intervalo de valores de δ 18O agua para Tuxtla Gutiérrez (-3.0‰ a -7.9‰), Villa Corzo (-3.4‰ a 8.0‰) y Villaflores (-3.2‰ a -8.0‰), comparando con los que exhiben la mayor parte de los caballos (Tablas 4, 5, 6 y 7), son más bajos. Una excepción es el individuo IHNFG-4698 que posee algunos valores de δ18O de agua que entran en el intervalo de valores de oxígeno del agua de las dos localidades y Tuxtla Gutiérrez. Sin embargo, como se ve en la Tabla 3, las muestras de agua tomada de un manantial (Tuxtla Gutiérrez) y de ríos (Villa Corzo y Villaflores) en el mes de abril, muestran que el agua de estas fuentes son más negativas que las predichas para el agua de lluvia para este mismo mes, lo cual muestra que pueden existir diferencias entre el agua superficial con respecto al agua de lluvia. Un factor que puede explicar tales diferencias es la altitud; Dansgaard (1964) menciona que la altitud es un factor que afecta la composición isotópica de oxígeno del agua, ya que a mayor altitud los valores de δ18O del agua tienden a ser más negativos en comparación con aquellas fuentes de agua que se ubican a menor altitud. Dado que los afluentes que cruzan Villa Corzo y Villaflores se originan en las montañas de la Sierra Madre de Chiapas, cuyas altitudes alcanzan hasta 3000 m s.n.m. (Villalobos-Sánchez, 2013), la composición isotópica del oxígeno del agua de los ríos estaría reflejando la altitud donde se originaron y esto explicaría las diferencias que existen entre valores isotópicos de oxígeno del agua de los ríos con lo predicho por la calculada para el agua de la precipitación de los sitios. Adicionalmente, la cantidad de precipitación juega un papel importante con la variabilidad isotópica del agua. Así, en el caso de las muestras tomadas en Villaflores se puede notar que en épocas de sequía el valor de δ18O del agua del río fue de -7.8‰, mientras que en época de lluvia fue de -10.4‰, una diferencia de 2.6‰, lo cual sugiere que la lluvia, combinada con el efecto de la altitud, puede modificar la composición isotópica de oxígeno del agua de los ríos de la zona en diferentes épocas del año.
En relación a los valores isotópicos del oxígeno del agua, se puede notar en el caso de los gonfoterios, la existencia de un individuo, IHNFG-4869 cuyo valor isotópico de agua de -3.0‰, es completamente diferente a los demás (Tabla 1). Una explicación es que este individuo procedía de otro sitio. Pellegrin et al. (2008) y Widga et al. (2010) indican que individuos que tomaron agua en diferentes sitios donde ellos se alimentaban, puede tener distintas señales isotópicas de oxígeno. Otra posible explicación está relacionada con la dieta: en los proboscídeos que se alimentan de plantas C3, los respectivos valores de δ18O se hallan influenciados por el contenido del agua de las plantas ingeridas, si es que una porción sustancial de ésta proviene de la dieta y estarían empobrecidos en 18O (Ambrose y DeNiro, 1986; Harris y Cerling, 2002; Feranec y MacFadden, 2006) . En contraste, en aquellos herbívoros C4 (como se observa en el caso del espécimen IHNFG-4869), los valores isotópicos de oxígeno tenderán a estar más enriquecidos en 18O (Ambrose y DeNiro, 1986; Levin et al., 2006; Feranec y MacFadden, 2006.). El valor de δ18O en este individuo en comparación con los gonfoterios con dietas basadas en plantas C3, sugiere que la dieta no fue una fuente sustancial de obtención de agua por este animal y que mucha de ésta fue obtenida ingiriéndola de diversas fuentes.
La Figura 6 muestra que los caballos, el mamut, el bisonte, el león americano y un gonfoterio (IHNFG-4869) habitaban en una zona abierta, mientras que la mayoría de los gonfoterios y el perezoso terrestre vivieron en una zona cerrada, lo cual indica que existió un parche de vegetación y no un solo tipo de vegetación dominante. Carbot-Chanona (2009) y Gómez-Pérez (2011) basándose en los mamíferos hallados en las localidades de Villaflores y Villa Corzo, plantean que en esta zona se desarrolló un pastizal o una sabana. Así mismo, el registro palinológico de la localidad Gliptodonte en Villaflores muestra la presencia de poaceas, fabáceas, solanáceas, asteráceas y pinos, lo cual indica la existencia de un pastizal con arbustos y árboles pequeños en manchones, y cerca del pastizal un bosque de pino, lo cual sugiere un ambiente frío y árido (Carbot-Chanona et al., 2008). Esto contrasta con la vegetación actual, la cual es una selva baja caducifolia donde el componente arbóreo domina sobre el estrato herbáceo y cuyo clima es cálido húmedo (Rzedowski, 1978).
Hodell et al. (2008) y Correa-Metrio et al. (2012a), basándose en diversos estudios paleoclimaticos en Centroamérica, han indicado que hacia los 12000 años AP, las condiciones fueron frías y secas. Estas condiciones fueron favorables para el establecimiento, en el caso de Petén, Guatemala, de pastizales con algunos árboles cercanos (Correa-Metrío et al., 2012b), lo cual es semejante a lo hallado en la Depresión de Chiapas, cuya localidad la Simpatía está fechada en 12600 ± 60 años AP (Carbot-Chanona y Gómez-Pérez, 2014a). Esto explicaría por qué los valores isotópicos de oxígeno del agua de los caballos son más positivos que los exhibidos actualmente por el agua de lluvia de Tuxtla Gutiérrez, Villa Corzo y Villaflores, así como la abundancia de plantas C4 mostrada por los valores isotópicos de carbono de los caballos.
CONCLUSIONES
Las series de muestras obtenidas de los caballos revelan que las plantas C 4 fueron un componente importante en la dieta de estos animales, pero además que las condiciones fueron más áridas que en la actualidad, las cuales permitieron la abundancia de las plantas C4 sobre las C3. Así mismo, los análisis isotópicos realizados en el bisonte, el mamut y un gonfoterio revelan que estos animales consumían plantas C4; en cambio el perezoso gigante tenía una dieta mixta C3/ C4 y la mayoría de los gonfoterios se alimentaban de plantas C3. En el caso del león americano, posiblemente depredaba a los herbívoros C4. Esto indica que en la Depresión Central de Chiapas existió a finales del Pleistoceno un pastizal o sabana con un bosque cercano a él, lo cual es concordante con el registro palinológico del sitio, así como los resultados obtenidos por otras aproximaciones paleoclimáticas que muestran que aproximadamente a los 12,000 años AP, el sur de México y Centroamérica experimentaron condiciones frías y áridas.











 nova página do texto(beta)
nova página do texto(beta)