Introducción
El dolor faríngeo postoperatorio (DFPO) es una complicación frecuente caracterizada por la presencia de odinofagia1. Es una experiencia subjetiva que consiste en la sensación de malestar o dolor en la faringe posterior a la intubación endotraqueal2.
La bibliografía mundial reporta una frecuencia de entre 20 y 70%1),(3-7, aunque las últimas revisiones sistemáticas al respecto concluyen una frecuencia del 40%8. El DFPO generalmente se autolimita en menos de 96 horas; sin embargo, existen reportes que afirman que hasta el 10% de los pacientes con DFPO pueden tener una duración mayor9,10.
Se le considera como una morbilidad de importancia en el postoperatorio5,9, ya que provoca un aumento en el tiempo de estancia en la Unidad de Cuidados Postanestésicos, con el subsecuente aumento de costos y riesgos1.
Además en la actualidad es mundialmente considerado un marcador de calidad en la atención médica, ya que los pacientes han calificado al DFPO como una de las 10 condiciones más incómodas que presentaron1,5 y se le ha definido como uno de los motivos más importantes de insatisfacción del paciente5,10-12.
Los fármacos más frecuentemente descritos en la literatura mundial para la prevención del DFPO incluyen: Tramadol13, Dexametasona (RR 0.68)14-16, Budesonida17, Lidocaína (RR 0.71 IC 0.47-1.09)1,18-20, Betametasona16,18, Aspirina1,21,22, Bencidamina (RR 0.42)22, Sulfato de Magnesio6,21,23,24, Fluticasona25 y Ketamina1-3,5,11,26,27; en diferentes dosis y vías de administración; todos ellos con efectos benéficos en mayor o menor escala9,21,28-35.
Por otro lado, las medidas no farmacológicas descritas incluyen: uso de tubos endotraqueales más pequeños14,36-38, lubricación del tubo endotraqueal21, uso de humidificadores en el circuito37, relajación neuromuscular efectiva39,40, aspiración gentil1,37, presión del globo de menos de 25 cmH2O9,11, evitar la tos al momento de extubación1, desinflado completo del globo previo a la extubación9,11 y evitar en lo posible cambiar la cabeza de posición como en rotación, extensión y flexión39.
La ketamina tiene múltiples propiedades farmacológicas incluyendo: analgésicas41, antiinflamatorias5,9,42-45 y broncodilatadoras41,46. Varios estudios han validado su uso por diferentes vías de administración (nasal, oral, rectal, nebulizada)11,47-50 para obtener efectos locales.
El mecanismo de acción es a través del antagonismo no competitivo de los receptores NMDA, que se encuentran en el SNC, en los nervios periféricos y las células adyacentes a éstos9,11,51. Por ello, el bloqueo de los receptores NMDA tiene efectos antinociceptivos4 y antiinflamatorios5,9,42,43, que evitan las respuestas exageradas del sistema inmune42,43.
Otros sitios de acción de la ketamina son: en receptores opioides (μ, κ, δ) a concentraciones mayores de 30 μM, en transportadores de monoaminas (noradrenalina, dopamina, serotonina) a más de 60 μM, en receptores D2 a 0.5 μM y en receptores 5-HT2 a 15 μM. También tiene efecto de bloqueo en varios receptores tales como: nicotínicos y muscarínicos a concentraciones plasmáticas de 10-80 μM y en canales de calcio-sodio, sodio-potasio y calcio-potasio a concentraciones más altas (más de 50 μM)41,43.
Con respecto al DFPO, debido a que la fisiopatología se debe, por un lado, al trauma directo sobre la mucosa que provoca inflamación y edema52-56, y, por otro lado a la excesiva contractura muscular ejercida por el tubo41,55, varios estudios han utilizado ketamina de manera local,57 por sus propiedades antiinflamatorias ya descritas, sin presentar efectos adversos debido a su efecto local y no sistémico. Tal es el caso de la ketamina utilizada en colutorio por 30 a 40 segundos, que ha demostrado en múltiples estudios la disminución en la frecuencia de esta complicación1,5,11,41,46, alcanzando una concentración plasmática de 16 mg/mL7. Incluso se calcula un NNT de tres de acuerdo con Shaaban y colaboradores41. Ahuja y colaboradores probaron que la ketamina nebulizada es efectiva para disminuir el DFPO en la población india58. Las ventajas de esta vía de administración son: la ausencia de sabor amargo del colutorio, el menor volumen requerido y la mejor cooperación del paciente. Sin embargo, esto no se ha comprobado en nuestra población. La literatura reporta que la concentración plasmática necesaria para provocar analgesia sistémica es de 100 a 300 ng/mL41, y que los efectos adversos psicotrópicos se han visto en concentraciones plasmáticas de 50 a 300 mg/mL con concentraciones cerebrales de 500 mg/mL, de los cuales se vio que el nistagmus se presenta a los 200 ng/mL59. Finalmente se demostró que las concentraciones plasmáticas en la emersión de pacientes en los que se utilizó ketamina intravenosa como inductor en dosis anestésicas (a 2.2 mg/kg) son de 700 ng/mL a 1120 ng/mL45,60.
El objetivo del estudio es evaluar si la ketamina nebulizada en el preoperatorio es efectiva como profilaxis para la disminución del dolor faríngeo postoperatorio en cirugía electiva bajo anestesia general, en adultos de 18 a 80 años, comparada contra placebo.
Hipótesis alterna: la ketamina nebulizada es efectiva para la prevención del dolor faríngeo postoperatorio en cirugía electiva bajo anestesia general.
Hipótesis nula: la ketamina nebulizada no es efectiva para la prevención del dolor faríngeo postoperatorio en cirugía electiva bajo anestesia general.
Material y métodos
Diseño del estudio
Previa autorización del comité local de Investigación y Ética del Hospital Ángeles Lomas y una vez obtenido el consentimiento informado del paciente, se realizó un estudio prospectivo, experimental, aleatorizado, doble ciego en el cual se evaluó el DFPO. Se llevó a cabo dentro del servicio de las instalaciones de quirófanos y las habitaciones correspondientes del Hospital Ángeles Lomas.
Población de estudio
Se consideraron todos los pacientes programados para cirugía dentro del período de febrero hasta julio del 2016. Los siguientes fueron los criterios de inclusión: pacientes adultos entre 18 y 80 años, de cualquier género, estado físico I o II según la American Society of Anesthesiologists (ASA), con valoración preoperatoria que especifique que se utilizará: anestesia general, para cirugía programada y cuyo anestesiólogo programado estuviera de acuerdo con el manejo estandarizado para el estudio. Los criterios de exclusión fueron: pacientes con enfermedad pulmonar previa, infección de vías aéreas superiores, alergia conocida a la ketamina, deformidades de la vía aérea congénitas o adquiridas, estado de consciencia que les impidiera entender las explicaciones, incapacidad de entender la escala numérica para la evaluación del dolor, pobre comprensión del idioma español, plan de anestesia regional como método anestésico, plan de egreso de quirófano orointubados o directo a la Unidad de Terapia Intensiva, uso de tubo selectivo, embarazo, lactancia materna o que fueran programados para cirugías consideradas de exclusión (cuello, laringe, amígdalas).
Los criterios de eliminación consistieron en que los pacientes presentaran: uso de óxido nitroso en el transoperatorio, eventualidades durante la emersión como tos o espasmo laríngeo, vómito postoperatorio, incapacidad para asignar el valor de ENA en alguna de las dos tomas, cambio de técnica anestésica, pacientes que no fueron extubados al finalizar la cirugía y suspensión de la nebulización.
Material
Recursos humanos: anestesiólogos adscritos que previamente aceptaron apegarse al manejo establecido, residentes de anestesiología quienes administraron la nebulización de acuerdo al sobre cegado y evitaron revelar la información al resto del personal, residente de anestesiología diferente al que aplicó la nebulización, el cual realizó las entrevistas postoperatorias para investigar los datos de DFPO a través de las mismas preguntas estandarizadas: ¿tiene alguna molestia?, en caso afirmativo, ¿en la escala del 1 al 10, cómo calificaría su DFPO?28,29.
Otros recursos: dos frascos idénticos: uno con ketamina y otro con solución salina 0.9%, nebulizador jet, toma de oxígeno en el área de preoperatorio, monitoreo no invasivo (pulsioximetría, presión arterial y EKG) en la Unidad de Cuidados Postanestésicos.
Métodos
Consideraciones éticas
Se realizó previa aprobación tanto por el comité de ética como por el Comité de Investigación del Hospital Ángeles Lomas, y contando con el consentimiento informado de los pacientes.
Este protocolo ha sido diseñado con base en los principios éticos para las investigaciones médicas en seres humanos. No existen conflictos éticos para la realización de este estudio ya que a pesar de ser un estudio experimental, la maniobra evaluada no priva al paciente de ningún tratamiento; al contrario, le representa una posibilidad más de optimización en el manejo perioperatorio.
Tamaño de muestra
Para el cálculo del tamaño de la muestra se utilizó una calculadora especializada, considerando los datos previamente reportados en un ensayo clínico que comparó ketamina nebulizada contra placebo, en el cual se observó que la ketamina disminuye la frecuencia del DFPO de 46 a 20% en la población india58. Basados en esta información, se estimó un tamaño de muestra de 56 pacientes en cada grupo, para un total de 112 pacientes. Esto con la finalidad de obtener una potencia estadística de 80% y una significancia del 5%, asumiendo pérdidas del 15%.
Aleatorización y cegamiento
La aleatorización de los pacientes se realizó mediante el programa Random Allocation Software versión 1.0, validado61,62, en la cual se obtuvieron dos grupos.
Una persona ajena al estudio elaboró sobres cerrados opacos con la aleatorización, los cuales se abrieron hasta el momento de la inclusión del paciente. Los sobres decían «A» o «B». La misma persona ajena al estudio preparó dos frascos de las mismas características, uno con ketamina y otro con solución salina al 0.9%, a los cuales también asignó las letras «A» o «B».
Un primer observador en el área de preoperatorio, realizó la asignación de los pacientes a cada grupo según la aleatorización correspondiente, registrando sólo a aquellas personas que cumplieron con los criterios de inclusión al estudio.
Un residente de anestesiología administró la nebulización a 5 L/m por cinco minutos en preoperatorio de acuerdo con la asignación del sobre. Si el sobre decía «A», se nebulizó un mililitro del frasco A más 2 mililitros de solución salina. En cambio, si el sobre decía «B», se nebulizó un mililitro del frasco B más 2 mililitros de solución salina. Por lo tanto, se obtuvieron dos grupos: grupo K: ketamina nebulizada (50 mg: 1 mL de ketamina + 2 mL de solución salina 0.9%) y grupo P: placebo (nebulización de 3 mL solución salina 0.9%).
Posteriormente, la laringoscopía e intubación se llevó a cabo por personal considerado como «experto» (definido como aquél con una experiencia mayor de 100 intubaciones efectivas o > 90% de éxito en sus intentos de intubación)63, quien se mantuvo cegado ante la maniobra que recibió el paciente.
El primer observador se aseguró de que, una vez llegado el paciente al área de Unidad de Cuidados Postanestésicos, la intubación y el manejo anestésico se hubieran llevado a cabo de acuerdo con los criterios del estudio y además verificó que el paciente no presentara criterios de eliminación. Los recolectores de la información postoperatoria estuvieron todo el tiempo cegados ante la intervención recibida.
Los resultados tanto del primero como del segundo observador fueron tomados en forma independiente, y al finalizar el estudio, se analizaron los registros de ambos observadores por un tercer sujeto investigador quien hizo la base de datos y permaneció ajeno al estudio.
Finalmente, el analista de la estadística fue un cuarto sujeto observador igualmente ajeno al estudio.
Manejo anestésico
Todos los pacientes contaron con el mismo manejo anestésico, el cual consistió en lo siguiente: a la llegada del paciente a quirófano se verificó la presencia de una vía venosa periférica permeable. Se colocó monitorización no invasiva (que consistió en EKG de cinco derivaciones, toma de presión arterial no invasiva, pletismografía, pulsioximetría y EtCO2). Se realizó toma de signos basales al llegar a quirófano y se verificó que fueran similares a los basales reportados en la hoja de enfermería. El manejo anestésico debió apegarse a los siguientes fármacos: para la inducción fentanilo 3-5 μg/kg, relajante neuromuscular esteroideo (rocuronio 0.6 mg/kg, vecuronio 0.15 mg/kg), propofol (2-2.5 mg/kg). La laringoscopía se llevó a cabo con hoja curva 3 o 4, a discreción del anestesiólogo, y se tomó en cuenta si fue necesario el uso de GlideScope64. Se utilizaron tubos endotraqueales tipo Mallinckrodt®, de PVC sin látex, transparentes, con ojo de Murphy, de tipo alto volumen y baja presión, tamaño 7 o 7.5 para el género femenino y de 8 a 8.5 para el género masculino. El neumotaponamiento se realizó con aire hasta que ya no se escuchara fuga en la auscultación con el estetoscopio. Se utilizó profilaxis analgésica con paracetamol y AINE. Profilaxis antiemética con inhibidores 5-HT3 30 minutos previos a la emersión (ondansetrón) y dexametasona al inicio de la anestesia. Mantenimiento a elección del anestesiólogo a cargo del caso, ya sea con inhalado o bien con anestesia total intravenosa, dosis subsecuentes a elección del anestesiólogo a cargo. Se anotó la tasa de opioide para el análisis estadístico posterior. Todos los pacientes se mantuvieron con ventilación mecánica controlada por volumen, con un volumen tidal de 6 a 8 mL/kg, frecuencia de 12 a 14 por minuto, con FiO2 de 40 a 80%. Se verificó que la emersión no hubiera presentado criterios de eliminación (vómito, tos, espasmo), y se realizó con una FiO2 100%. La aspiración se llevó a cabo con cánula Yankauer. Al finalizar el procedimiento, el paciente pasó a la Unidad de Cuidados Postanestésicos en donde se volvió a colocar monitoreo tipo 1. En caso de presencia de dolor moderado a severo, se notificó al anestesiólogo tratante para que de acuerdo con su criterio, se llevara a cabo el manejo analgésico.
Recolección de la información
Previo a su egreso de la UCPA a piso, un segundo observador capacitado, independiente del primero, realizó la recolección de datos del postoperatorio (a los 60 minutos de la llegada del paciente a la UCPA), constatando que tuviera Ramsay de 265; es decir, que no tuviera datos de anestesia residual. Posteriormente, el segundo observador recolectó los datos a las cuatro horas de postoperatorio. El registro también incluyó: tiempo entre nebulización e intubación, clasificación de ASA del paciente, edad, sexo, tipo de cirugía y especialidad, antecedente de tabaquismo, número de intentos de intubación, Cormack-Lehane, uso de guía para la intubación, escala numérica de valoración del dolor (ENA)28,29,66 específicamente con relación a DFPO en la hora 1 y en la hora 4 de postoperatorio, signos vitales a la hora 1 y a la hora 4 de postoperatorio, dosis total de los fármacos (propofol, fentanilo, rocuronio/vecuronio, antiemético, alfa 2-agonista, paracetamol y AINE), tiempo quirúrgico, tiempo anestésico, tipo de cirugía y cambios de posición.
Análisis estadístico
El análisis de la información se llevó a cabo por medio de estadística descriptiva, medidas de tendencia central y de dispersión. La sistematización de la información se realizó con el paquete SPSS para Windows y el nivel de significancia estadística aceptado se fijó como un valor de p < 0.05.
Resultados
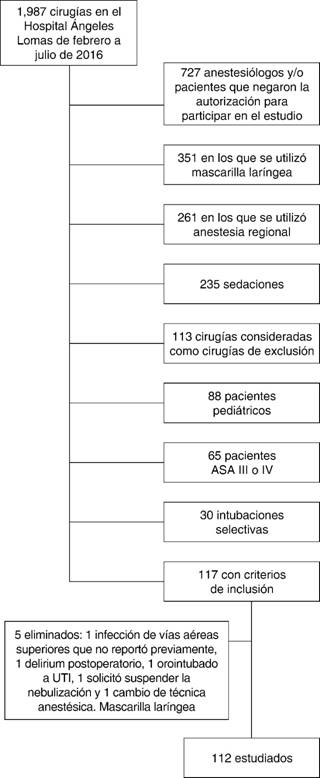
De los 1,987 pacientes programados para cirugía en el período de febrero a julio del 2016 en el Hospital Ángeles Lomas, se seleccionaron 117 pacientes. Los otros 1,870 no cumplieron con criterios de inclusión como se detalla en la Figura 1. Los 117 pacientes fueron programados a cirugía de Otorrinolaringología, Cirugía General, Neurocirugía, Ortopedia o Cirugía Plástica.
Los 117 pacientes seleccionados se aleatorizaron en dos grupos con el programa Random Allocation Software, de manera que el grupo K se compuso por 61 pacientes y el grupo P por 56. Se realizaron pruebas de normalidad en las cuales se concluyó que la muestra no sigue una distribución normal, por lo que los datos se analizaron con Kolmogórov-Smirnov y Shapiro-Wilk. Siendo escalas de medición y por tanto variables cuantitativas ordinales, la medida de tendencia central correcta a utilizar para expresar los resultados es la mediana. Debido a que los resultados obtenidos no siguen una distribución gaussiana, se obtuvo tanto la mediana como la media. Las características demográficas de ambos grupos se detallan en el Cuadro I.
Cuadro I: Características demográficas.
| Variable | Grupo K (n = 61) | Grupo P (n = 56) | Significancia estadística |
|---|---|---|---|
| Sexo | 0.811‡ | ||
| Femenino (n = 70) | 33 (47.1%) | 37 (52.8%) | |
| Masculino (n = 48) | 28 (58.3%) | 20 (41.6%) | |
| Edad (años) | 0.995‡ | ||
| Mediana | 48 DE (± 16.46) | 46 DE (± 17.496) | |
| Media | 46.07 RIQ (21.07-71.07) | 43.89 RIQ (18.89-68.89) | |
| ASA | 0.831‡ | ||
| ASA 1 (n = 65) | 32 (49.2% de ASA 1) | 33 (50.76% de ASA 1) | |
| ASA 2 (n = 52) | 29 (55.76% de ASA 2) | 23 (44.23% de ASA 2) | |
| Peso (kg) | 0.616‡ | ||
| Mediana | 71 DE (± 17.6) | 72 DE (± 16) | |
| Media | 74.82 RIQ (54.82-94.82) | 72.88 RIQ (51.88-93.88) | |
| Talla (m) | 0.700‡ | ||
| Mediana | 1.6850 DE (± 0.092 ) | 1.67 DE (± 0.098) | |
| Media | 1.69 RIQ (1.55-1.83) | 1.69 RIQ (1.55-1.83) | |
| Tabaquismo (n = 29) | 18 (62.06%) | 11 (37.93%) | 0.293* |
| Especialidad de cirugía | 0.005* | ||
| Cirugía General: 48 | 27 (56.25%) | 21 (43.45%) | |
| Cirugía Plástica: 33 | 18 (54.54%) | 15 (45.45%) | |
| Otorrinolaringología: 10 | 2 (20%) | 8 (80%) | |
| Ortopedia: 11 | 11 (100%) | 0 (0%) | |
| Neurocirugía: 15 | 3 (20%) | 12 (80%) |
*Análisis con χ2 de Pearson.
‡Análisis con U de Mann-Whitney y Kolmogórov-Smirnov.
Grupo K = grupo ketamina; grupo P: grupo placebo; ASA = American Society of Anesthesiologists; DE = desviación estándar; RIQ = rango intercuartil.
Las características de los grupos de acuerdo con las condiciones postnebulización se detallan en el Cuadro II. Se eliminaron cinco pacientes posteriormente a que se administrara la nebulización, por las causas detalladas en la Figura 1.
Cuadro II: Características postnebulización.
| Variable | Grupo K (n = 58) | Grupo P (n = 54) | Significancia estadística |
|---|---|---|---|
| Tiempo entre nebulización e intubación (minutos) | 0.452‡ | ||
| Mediana | 30 DE (± 23.55) | 30 DE (± 11.88) | |
| ± Media | 34.93 RIQ (8.93-60.93) | 28.63 RIQ (16.63-40.63) | |
| Número de tubo endotraqueal | 0.830‡ | ||
| Mediana | 7.5 DE (± 0.57) | 7.5 DE (± 0.48) | |
| Media | 7.5 RIQ (6.5-8.5) | 7.5 RIQ (6.5-8.5) | |
| Número de laringoscopías (media) | 1.26 DE (± 0.548) | 1.17 DE (± 0.505) | 0.268‡ |
| Cormack-Lehane | 0.289* | ||
| Mediana | 1.9 DE (± 0.83) | 1 DE (± 0.8) | |
| Media | 1.9 RIQ (1-2) | 1.67 RIQ (1-2) | |
| Grado 1: 48 | 21 (36.2%) | 29 (53.7%) | |
| Grado 2: 42 | 24 (41.4%) | 15 (27.8%) | |
| Grado 3: 18 | 11 (19%) | 9 (16.7%) | |
| Grado 4: 2 | 2 (3.4%) | 1 (1.9%) | |
| Tipo de anestesia | 0.646* | ||
| General balanceada | 41 (70.7%) | 38 (66.7%) | |
| Total intravenosa | 17 (29.3%) | 18 (33.3%) | |
| Relajante neuromuscular | 0.283* | ||
| Rocuronio | 48 (82.8%) | 48 (88.9%) | |
| Vecuronio | 10 (17.2%) | 6 (11.2%) | |
| Tasa de opioide | 0.677‡ | ||
| Mediana | 2.4 DE (± 1.9) | 2.3 DE (± 2.05) | |
| Media | 2.786 RIQ (1.286-4.286) | 2.767 RIQ (0.767-4.767) | |
| Posición en prono* | 5 (8.6%) | 8 (14.8%) | 0.045* |
| Posición en Trendelenburg | 8 (13.8%) | 12 (22.2%) | 0.244* |
| Cambios en la posición del paciente durante la cirugía | 11 (19%) | 9 (16.7%) | 0.751* |
| Uso de guía metálica | 10 (17.2%) | 12 (22.2%) | 0.507* |
| Dosis de dexametasona (mg) | 0.937* | ||
| Mediana | 8 DE (± 5.684) | 8 DE (± 7.969) | |
| Media | 10.62 RIQ (2.62-18.62) | 10.96 RIQ (2.96-18.96) | |
| Dosis de alfa dos agonistas (μg) | 0.837‡ | ||
| Mediana | 0 | 0 | |
| Media | 11.47 | 14.44 | |
| Minutos totales de anestesia | 0.407‡ | ||
| Mediana | 120 DE (± 66.659) | 132.50 DE (± 72.092) | |
| Media | 139.46 (48.46-139.37) | 148.86 (60.86-236.86) | |
| Dosis de opioides postoperatorios (mg) | 0.941‡ | ||
| Mediana | 0 | 0 | |
| Media | 4.71 | 6.04 |
*Análisis con χ2 de Pearson.
‡Análisis con U de Mann-Whitney y Kolmogórov-Smirnov.
Grupo K = grupo ketamina; grupo P = grupo placebo; ASA = American Society of Anesthesiologists; DE = desviación estándar; RIQ = rango intercuartil.
Para el análisis de resultados de DFPO, se realizaron las pruebas de χ2 de Pearson y estadístico exacto de Fisher. Los resultados obtenidos demuestran que no existe diferencia estadísticamente significativa entre el uso de ketamina y placebo en la hora 1 ni en la hora 4 de postoperatorio, como se detalla en los Cuadros III y IV. Se obtuvo una frecuencia de 59.29% de dolor faríngeo postoperatorio en la población del Hospital Ángeles Lomas, 40.71% en la primera hora de postoperatorio y 50.77% en la cuarta hora. Para el grupo de ketamina, se obtuvo una frecuencia total de 58.62% de DFPO, lo que favorece ligeramente a la ketamina con una diferencia de 0.66% total.
Cuadro III: Dolor en la primera hora de postoperatorio.
| Hora 1 de postoperatorio | p = 0.109* | ||
|---|---|---|---|
| Grupo K | Grupo P | p = 0.161‡ | |
| n = 58 | n = 54 | ||
| Intensidad | n (%) | n (%) | |
| Sin dolor | 34 (58.6) | 34 (63) | |
| Leve | 19 (32.8) | 9 (16.7) | |
| Moderado | 4 (6.9) | 7 (13) | |
| Severo | 1 (1.7) | 4 (7.4) | |
Dolor leve considerado como 1-3, moderado 4-6, severo 7-10 en escala de ENA.
Grupo K = grupo ketamina; grupo P = grupo placebo.
*χ2 de Pearson.
‡Estadístico exacto de Fisher.
Cuadro IV: Dolor en la cuarta hora de postoperatorio.
| Hora 4 de postoperatorio | p = 0.784* | ||
|---|---|---|---|
| Grupo K | Grupo P | p = 0.304‡ | |
| n = 58 | n = 54 | ||
| Intensidad | n (%) | n (%) | |
| Sin dolor | 35 (60.3) | 29 (53.7) | |
| Leve | 16 (27.6) | 15 (27.8) | |
| Moderado | 6 (10.34) | 8 (14.81) | |
| Severo | 1 (1.7) | 2 (3.7) | |
Dolor leve considerado como 1-3, moderado 4-6, severo 7-10 en escala de ENA.
Grupo K = grupo ketamina; grupo P: grupo placebo.
*χ2 de Pearson.
‡Estadístico exacto de Fisher.
Se encontró que también se favorece a la ketamina de manera muy discreta no estadísticamente significativa si se analiza la frecuencia por horas, en la que hay una disminución en la frecuencia de DFPO de 1.33% a la primera hora y de 10.59% en la cuarta hora.
No se observaron efectos adversos tales como disociación, nistagmo, aumento en la frecuencia cardíaca o presión arterial al momento de llegar a sala quirúrgica. Únicamente se observó mareo en cuatro pacientes (3.53%) posterior a la nebulización. En ninguno de estos pacientes el mareo persistió en el postoperatorio.
Por otro lado, también se obtuvo la frecuencia de acuerdo con el género, en donde encontramos que en el femenino fue de 54.83% y para el masculino fue de 60.86%, con una odds ratio de 0.502 (IC 0.199-1.268) y con una diferencia entre géneros de 6.03%.
Se analizaron los otros factores de riesgo de acuerdo con los reportados en la literatura. Nuestros resultados reportan que los factores de riesgo principales para la aparición de DFPO en nuestra población son el uso de guía metálica (OR 1.56 IC 1.30-1.87) y tabaquismo previo (OR 3.778 IC 1.227-11.631). Otros factores reportados históricamente, como la posición de Trendelenburg (OR 0.485 IC 0.170-1.381), uso de anestesia total endovenosa versus anestesia general balanceada (OR 1.244 IC 0.480-3.224) y el uso de GlideScope (OR 0.947 IC 0.263-3.406), no resultaron ser significativos en nuestro estudio.
En el análisis independiente sin considerar Neurocirugía, Ortopedia y Otorrinolaringología, se vio que no existe mayor riesgo de DFPO en Cirugía Plástica en comparación con Cirugía General (OR 0.854 IC 0.343-2.124).
Se realizó análisis de subgrupos para dolor intenso (moderado y severo), el cual tampoco demostró diferencias significativas.
En el análisis de U de Mann-Whitney se observó que la dosis de ketamina de acuerdo al peso fue de 0.761 mg/kg (0.34-1.0).
Observamos que hay una frecuencia de 15.17% de ronquera postoperatoria. De los 16 pacientes que la presentaron, nueve (56.25%) pertenecían al grupo de ketamina y siete (37.5%) al grupo placebo; sin embargo, la diferencia tampoco fue estadísticamente significativa (p = 0.699).
Discusión
La validez e importancia de nuestro estudio radica en que es el primer estudio en nuestro país en el que se utiliza ketamina nebulizada para la prevención del DFPO; sin embargo, consideramos que hay varias mejoras que se deberían hacer para estudios subsecuentes.
Vale la pena recordar que el dolor es una experiencia altamente personal, que involucra no sólo lo que está sintiendo físicamente el paciente, sino también los cambios fisiológicos y la manera en que éste interpreta el dolor, dadas sus experiencias previas y su estado de ánimo67. Ésta puede ser una de las razones por las que a pesar de las muchas similitudes metodológicas con el estudio de Ahuja et al., al tratarse de dos poblaciones cultural y geográficamente distintas, los resultados que ellos hayan encontrado no coincidan con los nuestros.
Nosotros no encontramos que la ketamina nebulizada represente una ventaja en el tratamiento para la prevención de DFPO. Consideramos que este resultado negativo se puede deber a varios factores: el primero es que la dosis que nosotros utilizamos, fue una dosis estándar de 50 mg para todos los pacientes, sin considerar el peso de cada uno. Nuestra media de tasa utilizada fue de 0.7 mg/kg de peso. El único otro estudio en la literatura que reporta la utilización de ketamina nebulizada con el mismo fin es el estudio de Ahuja et al.58 Ellos utilizan la misma dosis estandarizada de 50 mg; sin embargo, no reportan la tasa por kilogramo de peso. Dadas las diferencias en IMC que podemos encontrar entre nuestra población mexicana y la población de la India, consideramos que sus resultados sobre la utilidad de la ketamina para la prevención del DFPO no son realmente extrapolables a nuestra población; por lo que en futuros estudios se debería considerar una dosis por kilogramo de peso y no una estándar; así como la utilización de mediciones plasmáticas de ketamina.
La segunda posible explicación a la diferencia de resultados obtenidos en ambos estudios es el volumen y el tiempo de nebulización utilizado en cada uno. Ahuja y colaboradores utilizaron 5 mL (50 mg aforados) nebulizados durante 15 minutos, mientras que nosotros utilizamos 3 mL (50 mg aforados) nebulizados durante cinco minutos. Estamos conscientes de que esta diferencia metodológica puede haber hecho menos extrapolables los resultados entre un estudio y otro; sin embargo, dada la naturaleza de nuestra población y al ser un hospital privado de las características sociodemográficas del nuestro, permanecer más de cinco minutos en el área de preoperatorio no es algo común, por lo que se estandarizó ese tiempo para todos los pacientes, para poder así comparar un grupo contra otro dentro de nuestra misma población.
La tercera explicación que encontramos es que al realizar una revisión de la literatura sobre lo reportado en el metabolismo de los fármacos en general en la población india, encontramos algunos estudios68 que demuestran que la población india del sur tiene variaciones genéticas en el metabolismo, debido a un polimorfismo de la enzima CYP2C19. Esta variación provoca que tengan una metabolización lenta de ciertos fármacos como sertralina y omeprazol68. Algunos autores como Hijazi69 estudiaron la influencia de esta enzima en la actividad de la N-desmetilación de la ketamina, concluyendo que existe una disminución del 15% en la conversión a norketamina69. Valdría la pena considerar que estas diferencias en el metabolismo entre ambas poblaciones podrían explicar que la misma dosis de fármaco en ellos tuviera un mayor efecto que en nosotros, al considerarse «metabolizadores lentos» para ciertos fármacos.
Sería importante también considerar que el diámetro de las micropartículas que se obtienen con los diferentes tipos de nebulizadores varía: con los tipo jet, estas partículas miden de 10 a 25 micrómetros, de las cuales se considera que se pierden en el ambiente de uno a dos tercios de la dosis administrada y que logran depositarse solamente en la boca y en la vía aérea superior70. En cambio, con los nebulizadores ultrasónicos se obtienen partículas más pequeñas (de 5 a 10 micrómetros de diámetro) que son capaces de cubrir un territorio más extenso de la vía aérea70. Consideramos que en posteriores estudios se podría intentar utilizar un tipo de nebulización más efectiva que la que utilizamos tanto Ahuja et al. como nosotros.
También concluimos que se debieron monitorizar algunas otras variables como la presión del globo endotraqueal durante la cirugía1,11,36,68,71, así como el monitoreo de la relajación neuromuscular2,72, ya que en la literatura se han reportado como factores que pueden aumentar el riesgo de DFPO.
En este estudio se intentó generalizar los resultados y obtener un panorama amplio del DFPO en nuestro hospital, para que los resultados fueran aplicables a nuestra población. Por ello, se decidió incluir las cinco especialidades quirúrgicas con mayor número de intervenciones por año en nuestro hospital (Cirugía General, Cirugía Plástica, Otorrinolaringología, Ortopedia y Neurocirugía), con un porcentaje diferente de participación de cada una y con un número diferente de procedimientos quirúrgicos, lo cual puede afectar la heterogeneidad en algunos de los análisis; sin embargo, esto permite que los resultados sean aplicables a un sector mayor.
La distribución de ketamina y placebo no resultó uniforme en algunas de las especialidades (Ortopedia, Neurocirugía y Otorrinolaringología), así como en el uso de la posición de prono, por lo que inicialmente consideramos que esto podría representarnos un sesgo. Para comprobarlo, se realizaron dos análisis, uno considerando esto y otro descartando estas tres especialidades. Los resultados que encontramos fueron los mismos en ambos casos. Aun así, consideramos que la utilización de una muestra poblacional más grande podría evitar este conflicto.
Respecto a los factores de riesgo más importantes para presentar DFPO, la evidencia publicada es controversial. En el análisis de regresión logística de la revisión sistemática de El-Boghdadly y colaboradores8 se estableció que los principales factores de riesgo son: género femenino (OR 1.66), enfermedad pulmonar previa (OR 3.12), duración de la anestesia (OR 1.27) y presencia de sangre en el tubo (OR 4.81)8. A diferencia de ellos, en nuestro estudio encontramos que los principales factores de riesgo para DFPO son el uso de guía metálica y tabaquismo previo. Biro38 y colaboradores también encontraron que el tabaquismo es uno de los principales factores de riesgo, así como el género femenino, enfermedad pulmonar previa, duración de la anestesia, náusea postoperatoria y presencia de sangre en el tubo.
Acerca del género como factor de riesgo, otros estudios, incluido un metaanálisis del 201360, han demostrado que la disminución del tamaño del tubo puede disminuir el riesgo, por lo que el género femenino ha dejado de ser considerado para algunos como un factor de riesgo para el DFPO11,73-75. Se concluye que el riesgo aumentó en el estudio original de Biro et al.38 debido a que se utilizaron tubos 7.5 que no son adecuados para todas las mujeres. En nuestro estudio, 39 mujeres fueron intubadas con tubo 7.0 y 27 con tubo 7.5, sin diferencia estadística. Sin embargo, al igual que en el estudio de Canbay11, Rajkumar76 y el metaanálisis de Clayton-Smith74, no encontramos que el género femenino sea un factor de riesgo para el DFPO, por el contrario, nuestro resultado muestra que el DFPO es más común en el género masculino por 6.03% (54.83% vs. 60.86%).
Dependiendo de la fuente consultada, la frecuencia de DFPO es variable; sin embargo, en la revisión sistemática del 20168, se concluyó que es del 40%. En nuestro estudio, obtuvimos una frecuencia mayor, del 59.29%: la cual se acerca más a la reportada por Canbay11 (en el que se reportó del 60.8 al 74%) y Rudra (del 60 al 85%)26.
Jaensson y colaboradores describen que personal con poca experiencia puede aumentar el riesgo de DFPO70; sin embargo, en el estudio retrospectivo de 21,606 pacientes de Inoue11 se encontró que no había diferencia. En nuestro estudio tratamos de evitar esto, estandarizando desde un inicio que el personal intubador fuera considerado experto64.
No se encontraron diferencias significativas entre el uso de ketamina nebulizada o placebo a la primera hora de postoperatorio ni a la cuarta hora, por lo que se comprueba la hipótesis nula, al igual que en el estudio de Young-Park y colaboradores en el que se utilizó ketamina intravenosa para evitar el DFPO71. Existe una ligera diferencia no estadísticamente significativa en frecuencia que favorece a la ketamina nebulizada por 0.66%.
Observamos que hay una frecuencia de 15.17% de ronquera postoperatoria. De los 16 pacientes que presentaron ronquera en el postoperatorio, 56.25% pertenecían al grupo ketamina y 37.5% al grupo placebo. Esta frecuencia también resultó más alta que la de Satish y colaboradores que reportaron 10%9. Sin embargo, la diferencia entre grupos en nuestro estudio tampoco fue estadísticamente significativa (p = 0.699).
Con respecto al efecto adverso de mareo durante la nebulización, observamos que la tasa de ketamina fue similar en todos los pacientes que presentaron mareo, además de ser cercana a la media del grupo (0.7) por lo que concluimos que existen otros factores predisponentes que se deben analizar en un estudio posterior.
Conclusiones
Estamos conscientes de que nuestro estudio tiene varias oportunidades de mejora, como lo hemos mencionado previamente; sin embargo, al comparar nuestros resultados con los de los únicos autores que han estudiado la misma maniobra que nosotros, concluimos lo siguiente. En el estudio de Ahuja58, no se menciona el sistema de aleatorización que siguieron, ni se reportan variables importantes que se sabe que influencian el riesgo de presentar DFPO, como tabaquismo, ASA y tipo de cirugía70,77. Esto puede constituir un riesgo de sesgo ya que no sabemos si los dos grupos fueron balanceados de inicio. Por otro lado, no se menciona la proporción de intubaciones difíciles o el grado de Cormack-Lehane, por lo que tampoco sabemos si los grupos permanecieron balanceados después de la nebulización, con un sesgo de información importante. Finalmente, excluyeron un grupo amplio de población, por lo que su muestra no constituye más que una fracción muy pequeña y sus resultados son aplicables a un grupo reducido de pacientes; factores que disminuyen su validez interna y externa y que podrían llegar a explicar la diferencia de resultados encontrados entre nuestro estudio y el de ellos.
Consideramos que otra área de oportunidad para la realización de nuevos trabajos podría ser el estudio sobre los usos variados recién descubiertos de la ketamina. Tal es el caso del uso en el asma, donde se utilizó ketamina nebulizada en un modelo animal en el que se aprovecharon sus efectos antiinflamatorios78,79. La ketamina también tiene implicaciones en el síndrome de insuficiencia respiratoria aguda en pacientes admitidos a la terapia intensiva43, ya que hubo mejoría en los parámetros ventilatorios y disminución de IL-6 posterior a cinco días de tratamiento con ketamina nebulizada, o bien ketamina intravenosa63. En ortopedia, se ha implementado su uso intraarticular en cirugía de hombro y de menisco ya que ha demostrado disminuir el dolor postoperatorio56,59,80. Otra área que ha aprovechado los efectos benéficos de la ketamina es la psiquiatría, ya que existen estudios que han demostrado su efectividad en el tratamiento de la depresión mayor81-84. La vía intranasal también ha demostrado efectividad como premedicación anestésica en el paciente pediátrico41,48,85-87 y en el dolor crónico88,89. Por otro lado, la ketamina tiene aplicaciones en el dolor neuropático, en el que estudios demuestran que vía tópica (en crema) es efectiva en el tratamiento de seis a 12 meses, con la ventaja de no tener otros efectos sistémicos83,88. Finalmente, otro estudio demostró que postextracción dental, la ketamina aplicada de manera tópica en los alveolos disminuyó el dolor90,91. Talvez valdría la pena continuar estudiando las distintas posibles aplicaciones de la ketamina en nuestra población mexicana.
Existen múltiples estudios que utilizan diversos fármacos en diversas vías de administración para el DFPO. Todos ellos con efectos benéficos en mayor o menor escala9,13-16,25,27,39,92. Consideramos que probablemente en un futuro, valdría la pena realizar no sólo una revisión sistemática como la que ya existe, sino un metaanálisis que valore, de manera global, la eficacia de todos los métodos propuestos para DFPO; para así poder determinar un estándar de oro para la prevención y para el tratamiento de una complicación postoperatoria tan frecuente como el DFPO.











 nova página do texto(beta)
nova página do texto(beta)