Colletotrichum spp., agentes causales de la antracnosis, afectan a un amplio rango de hospedantes en pre y poscosecha. Las especies de Colletotrichum emplean diferentes estrategias de infección: intramural subcuticular o intracelular; incluso, ambas en distintos órganos del mismo hospedero (Perfect et al., 1999; Diéguez-Uribeondo et al., 2005). Las estrategias de infección están correlacionadas con la especificidad en el hospedante (Pring et al., 1995), por lo que es importante conocer el proceso de infección para determinar el ciclo biológico de la enfermedad, lo que podría sugerir el uso adecuado de una estrategia de control al conocer el periodo en el que se desarrolla el patógeno en el hospedante. La antracnosis es una de las principales enfermedades en el cultivo de papaya. En México, las pérdidas reportadas superan el 50 % (Torres-Calzada et al., 2012). Colletotrichum truncatum se reportó en 2008 como causante de antracnosis en papaya (Carica papaya) en México (Tapia-Tusell et al., 2008), con una incidencia de hasta 40 % (Torres-Calzada et al., 2012). Esta especie utiliza mecanismos de infección distintos, ya que se comporta como patógeno hemibiotrófico intracelular en chícharo (Pisum sativum), haba (Vicia faba) y lenteja (Lens culinaris) (O´Connell et al., 1993; Latunde-Dada y Lucas, 2007) y como patógeno intramural subcuticular en chile (Capsicum annuum), garbanzo (Cicer arietinum), cacahuate (Arachis hypogaea) y frijol (Phaseolus vulgaris) (Pring et al., 1995; Ranathunge et al., 2012). Aunque existen diversos estudios relacionados con esta especie, se desconoce el proceso de patogénesis en hojas de papaya; además, existe escasa información en donde se describa el proceso de infección de una misma cepa del patógeno en distintos hospedantes. El objetivo de este estudio fue describir los cambios histológicos que se presentan durante la infección de hojas de papaya y chícharo por C. truncatum.
Se utilizaron hojas de plantas sanas de papaya Cv. Maradol (tres meses de edad) y chícharo Cv. Lincoln (tres semanas de edad). La cepa CCM de C. truncatum se utilizó como inóculo. Previamente se aisló de un fruto de papaya con síntomas de antracnosis, se purificó mediante cultivo monospórico y se caracterizó molecularmente (KF147902). La suspensión de conidios se preparó a una concentración de 1x106 esporas/mL a partir de un cultivo de siete días de crecimiento en PDA. La superficie abaxial de 15 hojas de papaya y 30 hojas de chícharo, previamente desinfestadas con etanol al 70 %, se inoculó en seis y tres puntos de 1 cm2 respectivamente, por deposición de 10 μL de inóculo. Como tratamiento testigo, se colocaron alícuotas de 10 μL de agua destilada estéril en cinco hojas de papaya y 10 hojas de chícharo. Las hojas de papaya se colocaron en bolsas de polietileno con papel absorbente humedecido con agua destilada (Pandey et al., 2012) y las de chícharo en cajas Petri de vidrio con papel filtro Whatman N° 2 esterilizado y humedecido con agua destilada para incrementar la humedad relativa. Todas las hojas se incubaron a 25 °C ± 2 °C durante seis días. Se tomaron secciones de 5 mm de tejido de las áreas inoculadas a las 2, 4, 6, 9, 12, 18, 20, 24, 30, 36, 48, 60, 72, 96, 120 y 148 horas después de la inoculación (hdi), y se colocaron en casetes de plástico para incluirlas en parafina. Las muestras se sumergieron en solución fijadora FAA (10 % formaldehido, 5 % ácido acético, 50 % etanol al 96%) durante al menos 24 h. Posteriormente, los tejidos se deshidrataron gradualmente con alcohol etílico (50, 70, 80, 96 y 100 %) y se infiltraron en parafina (Leica) durante 3 h, previa transferencia en alcohol absoluto-xileno (v/v) y xileno (dos veces) (Rodríguez-López et al., 2013). Las muestras permanecieron en las soluciones durante 3 h y finalmente, se agitaron dos veces en un procesador de tejidos centrífugo (Thermo Scientific, STP 120, GER).
En un centro de inclusión (Thermo Scientific, HistoStar, UK), las muestras se colocaron en moldes metálicos con parafina fundida, se les colocó un casete de plástico, se agregó parafina fundida y se dejaron enfriar. Las muestras se cortaron longitudinalmente y transversalmente con respecto a la nervadura central a 6 μm de grosor en un micrótomo semiautomático (Thermo Scientific, Microm HM340E, GER). Las secciones obtenidas se tiñeron con safranina (Sigma) al 1 % en alcohol etílico al 50 % y verde-rápido (Sigma) al 1 % en etanol al 96 %, se montaron en resina Entellan (Merck) y se secaron durante 24 h (Casarrubias-Carrillo et al., 2002). Las laminillas se observaron en un microscopio óptico marca Carl Zeiss Axiostar Imager A2 con cámara integrada para identificar los daños en tejido. Se realizaron 36 observaciones por muestra. Los apresorios se midieron con el software ZEN 2012 (blue edition).
Entre las 2 y 18 hdi sólo se observaron conidios de C. truncatum sin germinar en la superficie de la hoja. La germinación inició a partir de las 20 hdi, y en el extremo apical de los tubos germinativos se formaron apresorios melanizados de color café oscuro, de forma globosa a irregular, y de 7.67 x 5.26 μm en promedio (Figura 1A). C. truncatum formó apresorios melanizados para facilitar la adhesión y la penetración, por medio de acción mecánica y lisis enzimática (Kubo et al., 2000). Las primeras hifas de infección emergieron de los apresorios a partir de las 24-48 hdi (Figura 1B). En el lapso de 24-60 hdi se observaron hifas intramurales, las cuales crecieron en las paredes celulares (Figura 1C). A las 60 hdi se observó el inicio del estado necrótrofo, ya que se observaron hifas intracelulares (Figura 1D); además, se observaron cavidades (Figura 1E), que de acuerdo con Pring et al. (1995) son indicativas de la degradación de paredes celulares. Los acérvulos (Figura 1E) se asociaron con la coloración oscura en la superficie del hospedante en contraste con la hoja testigo, la cual no presentó síntomas de enfermedad (Figura 1F). A las 96 hdi, el patógeno completó su ciclo de vida al producir acérvulos con conidios, los cuales son la fuente de inóculo para infecciones en nuevos tejidos (Ranathunge et al., 2012). El daño celular y la producción de acérvulos se asociaron con la aparición de lesiones oscuras semicirculares de coloración marrón a negro, al tercer día después de inoculación (Figura 2A), en contraste con la hoja testigo (Figura 2B).
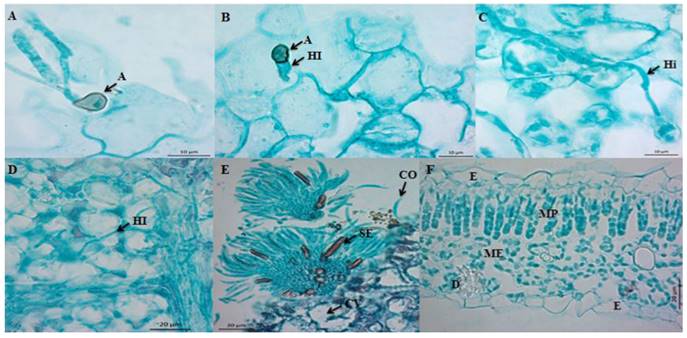
Figura 1. Microfotografías del proceso de infección de C. truncatum en hojas escindidas de papaya cv Maradol. A) Corte longitudinal de hoja a las 20 hdi, formación de apresorios melanizados (A) a partir de tubos germinativos polares de conidios. Barra = 10 μm. B) Corte longitudinal (paradermal) de hoja a las 24 hdi. Primeras hifas de infección (HI) emergiendo de apresorios (A). Barra = 10 μm. C) Corte longitudinal (paradermal) de hoja a las 60 hdi. Hifa intramural (Hi). Barra = 10 μm. D) Corte longitudinal (paradermal) de hoja a las 60 hdi. Hifa intracelular (HI). Barra = 20 μm. E) Corte trasversal de hoja de papaya infectada por C. truncatum 96 hdi, formación de acérvulo en el hospedante, conidióforos (CO), setas incrustadas (SE) y cavidades (CV). Barra = 20 μm. F) Corte transversal de hoja sana. Epidermis (E), mesófilo en empalizada (MP), mesófilo esponjoso (ME) y drusa (D). Barra = 20 μm.

Figura 2. Síntomas de antracnosis ocasionados por la cepa CCM de C. truncatum en distintos hospedantes. A) Hoja de papaya Maradol con síntomas de antracnosis a las 148 hdi; B) Hoja de papaya testigo; C) Hoja de chícharo Lincoln con síntomas de antracnosis a las 148 hdi; D) Hoja de chícharo testigo.
La estrategia de infección de C. truncatum en hojas de chícharo fue distinta. Los conidios permanecieron sin germinar hasta las 12 hdi. A las 18 hdi, los tubos germinativos emergieron de manera polar y lateral. A partir de los tubos germinativos se formaron apresorios melanizados de color café oscuro, de forma globosa a irregular, y de 8.24 x 5.92 μm en promedio. Las primeras hifas de infección emergieron de los apresorios entre las 18 y 20 hdi a diferencia de lo que ocurrió en hoja de papaya (Figura 3A). Se observaron hifas lobuladas, ramificadas intracelulares (hifas primarias) de las 36 hdi hasta las 60 hdi (Figura 3B). A pesar de que las hifas primarias de infección se presentaron en el lumen celular, no se observó lisis. La principal característica de la invasión intracelular es la formación de hifas primarias de infección; éstas pueden tener diferente morfología según la especie (O´Connell et al., 2000). La hifa primaria de C. truncatum es multilobulada, ramificada y grande (Latunde-Dada y Lucas, 2007). Durante el estado biótrofo, la hifa primaria se invaginó hacia el lumen celular (Figura 3B). De acuerdo con O´Connell et al. (2000), la hifa primaria forma una matriz interfacial compuesta de glicoproteínas ricas en prolina e hidroxiprolina que separa a la hifa de la membrana plasmática del hospedante.
Se observaron hifas de infección delgadas (hifas secundarias), las cuales emergieron de hifas primarias de infección a las 72 hdi (Figura 3C). Según Bhadauria et al. (2011), la transición del estado biótrofo al necrótrofo se asocia con el desarrollo de hifas secundarias delgadas, las cuales maceran los tejidos del hospedante. Las hifas secundarias colonizaron células de manera intracelular, lo cual ocasionó daño celular con la formación de cavidades celulares (Figura 3D). De acuerdo con CasarrubiasCarrillo et al. (2002) las cavidades celulares indican disolución celular. La formación de acérvulos inició a partir de las 96 hasta las 148 hdi y éstos contenían conidióforos, setas melanizadas y conidios (Figura 3E), en contraste con la hoja sana (Figura 3F). El daño celular se asoció con los síntomas de antracnosis (Figura 2C), en contraste con la hoja testigo, la cual no presentó síntomas (Figura 2D). A diferencia del estudio realizado por O´Connell et al. (1993), la cepa de C. truncatum utilizada en la presente investigación produjo acérvulos en chícharo. Los acérvulos con conidios se produjeron a partir de las 96 hdi, concluyendo así el ciclo de vida del patógeno. Los síntomas de antracnosis en hoja de chícharo a las 148 hdi fueron limitados en extensión, en contraste con los observados en papaya, probablemente debido a que la cepa originalmente se aisló de fruto de papaya.
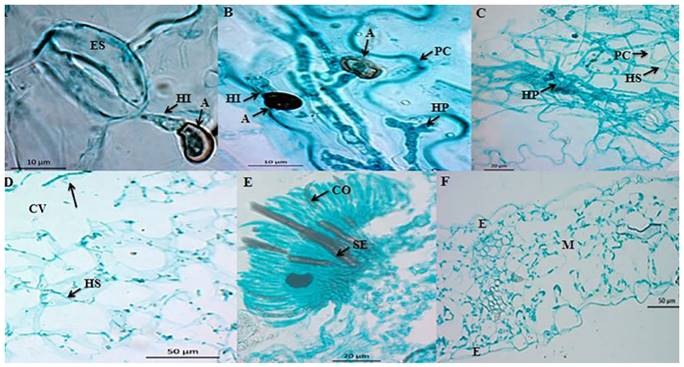
Figura 3. Microfotografías del proceso de infección de C. truncatum en hojas escindidas de chícharo cv Lincoln. A) Corte longitudinal (paradermal) de hoja a las 18 hdi. Primeras hifas de infección (HI) emergiendo de apresorios (A). Barra = 10 μm. B) Corte longitudinal (paradermal) de hoja a las 36 hdi. Hifas de infección (HI) emergiendo de apresorios (A), así como hifa primaria (HP) lobulada delimitada por la pared celular (PC) del hospedante. Barra = 10 μm. C) Corte longitudinal (paradermal) de hoja a las 72 hdi. Hifas secundarias (HS) emergiendo de hifas primarias (HP), las cuales atraviesan las paredes celulares (PC) del hospedante. Barra = 20 μm. D) Corte longitudinal (paradermal) de hoja a las 72 hdi. Hifas secundarias de infección (HS) invadiendo intracelularmente. Se observan cavidades (CV) durante el estado necrótrofo. Barra = 50 μm. E) Corte transversal de hoja de chícharo a las 96 hdi. Formación de acérvulo en la superficie del hospedante. Presencia de conidióforos (CO) y setas incrustadas (SE). Barra = 20 μm. F) Corte transversal de hoja sana. Epidermis (E) y mesófilo (M). Barra = 50 µm.











 texto em
texto em 


