Introducción
El langostino anfídromo Macrobrachium tenellum es una especie con gran potencial de producción en acuicultura, debido a su gran abundancia en la naturaleza, su amplia tolerancia a intervalos fisicoquímicos del agua y su manipulación es relativamente más sencilla comparado con especies de mayor tamaño del mismo género (García-Guerrero et al. 2013). Pero una limitante de su producción en acuicultura comercial es la falta de estudios sobre la reproducción y la nutrición de los reproductores (Sui et al. 2011).
Entre los principales factores que influyen la capacidad reproductiva de los decápodos se encuentra la alimentación; la cual es esencial, ya que debe satisfacer los requerimientos nutricionales que promuevan la maduración sexual e influyen en la condición fisiológica y morfológica de los gametos, así como la calidad del huevo y desove (Cheng et al. 2000, Millamena y Quintino 2000, Pérez-Rodríguez et al. 2019). La mayoría de los estudios sobre requerimientos nutricionales para una maduración sexual óptima en camarones carídeos marinos y dulceacuícolas están enfocados en las hembras, por tener un mayor grado de importancia en la reproducción, debido a que son las encargadas de la producción de huevos y transferencia de reservas energéticas a las larvas (Wouters et al. 2001, Racotta et al. 2003).
La especie más estudiada en aspectos de cultivo y dietas destinadas a reproductores de ambos sexos dentro del género Macrobrachium es Macrobrachium rosenbergii (Cavalli et al. 1999, New y Wagner 2008, Nhan et al. 2009). Diferentes estudios han demostrado que el uso de distintos niveles de proteínas y lípidos en dietas para reproductoras mejoran la calidad del huevo, fecundidad y calidad de larvas en condiciones controladas (Kangpanich et al. 2016). Al respecto, Benítez-Mandujano y Ponce-Palafox (2014), evaluaron dietas experimentales con varios niveles de proteína y lípidos en reproductores de M. carcinus, reportando un crecimiento mayor en dietas con 13% de lípidos; además de que los mayores niveles de proteína en la dieta (40 a 45%) favorecieron el incremento de la proteína muscular. Mientras que para M. tenellumGarcía-Ulloa et al. (2004) sugieren un requerimiento de proteína por debajo del 35% para su maduración, desarrollo gonadal y desove.
Uno de los principales problemas para imple- mentar de forma exitosa la acuicultura de langostinos dulceacuícolas, es el bajo porcentaje de supervivencia de las larvas en condiciones de cultivo (Yamasaki-Granados et al. 2013). Por lo tanto, se requieren investigaciones que analicen el efecto de la dieta de los reproductores en la calidad del huevo y larva; dicha información ayudará a la identificación de los requerimientos nutricionales específicos que conllevará a la elaboración de dietas que cubran las demandas energéticas de los reproductores y su descendencia; lo cual coadyuvara a desarrollar las biotecnologías que permitan el manejo de especies nativas potencialmente cultivables. Por lo anterior, el objetivo del presente estudio fue determinar el efecto de dietas con diferentes niveles de proteínas y lípidos suministradas a hembras de M. tenellum, en relación con la maduración ovárica y calidad de los huevos y larvas.
Materiales y métodos
Organismos experimentales
Entre mayo y agosto del 2020 se capturaron reproductores de M. tenellum (> 1.8 g y 4.0 cm) de poblaciones silvestres en el río Ameca, Jalisco, Nayarit (20°41’ 10.2” LN, 105°16’ 11.5” LO). La captura se realizó con distintos artes de pesca. Posteriormente los organismos se aclimataron a las condiciones del Laboratorio de Calidad de Agua y Acuicultura Experimental (LACUIC) del Centro Universitario de la Costa (CUC-UDG).
Formulación y fabricación de alimentos para bioensayos
Se evaluaron ocho dietas con diferentes niveles de proteína (30, 35, 40 y 45% P), con dos niveles de lípidos (4 y 12% L) cada una. Para formular las dietas se utilizó: harina y aceite de pescado, harina de maíz, grenetina, mezcla de vitaminas y minerales, vitamina C, benzoato de sodio, α-Tocoferol y fécula de maíz (Tabla 1). Se utilizaron la harina de pescado y el aceite de pescado en mayor y menor proporción para obtener los niveles adecuados de proteína y lípidos para cada dieta experimental. Para la fabricación del alimento balanceado peletizado se pesaron los ingredientes en una balanza analítica Nimbus® (ADAM® NBL:254 d = 0.0001 g) y posteriormente a eso se mezclaron en un procesador de alimentos KitchenAid® durante 15 minutos hasta lograr la consistencia deseada. Después, la mezcla se procesó en un molino de carne KitchenAid® para formar pellets de 5 mm de diámetro y se dejaron secar en un horno Novatech® (max. 320 °C) a 65 °C durante 24 h. El alimento se retiró del horno y se dejó 2 h a temperatura ambiente, posteriormente se colocó en envases de plástico en un congelador a una temperatura de -5 °C para su conservación hasta su uso.
Tabla 1 Ingredientes y composición proximal de las ocho dietas experimentales que contienen cuatro niveles de proteína (30, 35, 40 y 45% P) y dos niveles de lípidos (4 y 12% L) que se utilizaron en los bioensayos de evaluación de la maduración gonadal, calidad de huevos y larvas de Macrobrachium tenellum.
| Ingredientes (g Kg-1) | Tratamientos experimentales | |||||||
|---|---|---|---|---|---|---|---|---|
| P30L4 | P35L4 | P40L4 | P45L4 | P30L12 | P35L12 | P40L12 | P45L12 | |
| Harina de pescado1 | 356.3 | 431.9 | 507.5 | 583.7 | 356.3 | 431.9 | 507.4 | 583.1 |
| Harina de maíz | 55.0 | 55.0 | 55.0 | 55.0 | 55.0 | 55.0 | 55.0 | 55.0 |
| Aceite de pescado1 | 12.6 | 6.8 | 1.0 | 0.0 | 92.6 | 86.8 | 81.0 | 75.2 |
| Almidón de maíz | 478.7 | 408.9 | 339.2 | 264.6 | 398.7 | 328.9 | 259.2 | 189.4 |
| Gelatina | 60.0 | 60.0 | 60.0 | 60.0 | 60.0 | 60.0 | 60.0 | 60.0 |
| Mezcla de vitaminas y minerales2 | 30.0 | 30.0 | 30.0 | 30.0 | 30.0 | 30.0 | 30.0 | 30.0 |
| Vitamina C2 | 4.0 | 4.0 | 4.0 | 4.0 | 4.0 | 4.0 | 4.0 | 4.0 |
| Benzoato de sodio | 2.3 | 2.3 | 2.3 | 2.3 | 2.3 | 2.3 | 2.3 | 2.3 |
| Cloruro de colina2 | 0.9 | 0.9 | 0.9 | 0.9 | 0.9 | 0.9 | 0.9 | 0.9 |
| α-Tocoferol | 0.1 | 0.1 | 0.1 | 0.1 | 0.1 | 0.1 | 0.1 | 0.1 |
| Composición proximal (% base en materia seca)* | ||||||||
| Proteínas | 30.2 ± 1.5 | 35.0 ± 1.1 | 39.9 ± 0.3 | 44.9 ± 1.1 | 30.2 ± 1.2 | 35.6 ± 0.5 | 41.1 ± 0.5 | 45.5 ± 1.6 |
| Lípidos | 3.9 ± 0.1 | 3.9 ± 0.1 | 4.0 ± 0.1 | 3.8 ± 0.1 | 11.8 ± 0.5 | 12.7 ± 0.5 | 12.5 ± 0.3 | 12.7 ± 0.4 |
| Cenizas | 10.5 ± 0.2 | 13.0 ± 0.5 | 13.3 ± 0.2 | 15.4 ± 0.1 | 10.6 ± 0.2 | 12.3 ± 0.2 | 14.0 ± 0.2 | 15.7 ± 0.2 |
| Extracto libre de nitrógeno** | 55.3 | 48.0 | 42.6 | 35.8 | 47.4 | 39.3 | 32.3 | 26.0 |
1Proteínas Marinas y Agropecuarias, S.A. de CV, Guadalajara, Jalisco, México. 2Sistemas en Zootecnia S.A. de C.V., Tlajomulco de Zuñiga, Jalisco, México. * Los valores se expresan como media y (±) desviación estándar (n = 3), no existen diferencias significativas entre los valores de porcentajes proximales en los niveles de lípidos equivalentes y proteínas equivalentes entre las dietas (p > 0.05). ** Extracto Libre de Nitrógeno = 100 - (Proteínas + Lípidos + Cenizas).
La determinación proximal de los alimentos se realizó de acuerdo con los protocolos de la AOAC (1995). El contenido de proteínas totales se determinó con el método de micro Kjeldahl y se multiplicó por el factor de 6.25. El contenido de lípidos totales se determinó con el método de Soxhlet y se utilizó hexano como solución acarreadora. Las cenizas se determinaron mediante la calcinación de una muestra a 550 °C por 6 h en una mufla. El extracto libre de nitrógeno se calculó por la diferencia de la materia seca con la formula ELN = 100 - (% proteína cruda + % lípidos totales + % de cenizas).
Evaluación de la calidad de los huevos
Las ocho dietas experimentales se evaluaron por triplicado colocando ocho hembras por replica en reservorios de agua aforados a 200 L (capacidad máxima 600 L) y se mantuvieron machos separados de las hembras bajo las mismas condiciones. Se realizaron biometrías iniciales (peso total y longitud de la base del pedúnculo ocular a la punta del telson) a las hembras y machos. La alimentación se llevó a cabo a las 16:00 h con el 5% de la biomasa de cada reservorio.
Durante el periodo del bioensayo (120 días) se retiró todos los días el alimento sobrante y se realizó recambio de agua del 30% cada dos días. Transcurridos los 30 días de alimentación se colocaron a los machos en una relación de cuatro hembras por un macho (4H:1M) en cada reservorio para propiciar la cópula. Cada dos días se registró el número de hembras ovígeras en cada tanque. Siete días después de la fertilización, las hembras se extrajeron del tanque experimental (con las precauciones debidas para no dañar la masa ovígera), se registró el peso y talla, y se colectó la totalidad de la masa ovígera con unas pinzas de disección. De la masa ovígera se separaron dos submuestras y los huevos se contaron con ayuda de un microscopio-estereoscopio (AmScope®). Las dos submuestras, junto con los huevos restantes, se pesaron y se secaron en un horno a 60 °C durante 48 h. Se utilizó una balanza analítica Nimbus® (ADAM® NBL:254 d= 0.0001 g) para determinar el peso húmedo y el peso seco promedio de cada huevo (PSH). El PSH y la fecundidad (FC) se calcularon de acuerdo a las ecuaciones propuestas por Hernáez y Wehrtmann (2011), adaptadas por Vargas-Ceballos et al. (2018a):
Donde: MH = peso húmedo de la muestra, NH = número de huevos en la muestra, H = peso húmedo del huevo.
Donde: MS = peso seco de la muestra, NH = número de huevos en la muestra y PSH = peso seco del huevo.
Donde: PMH = peso húmedo de la masa total de huevos, H = peso húmedo del huevo, PTH = peso total de la hembra y FC (fecundidad) = número total de huevos por gramo de hembra.
El esfuerzo reproductivo (ER) fue estimado para cada hembra individual, como el porcentaje del peso de la masa ovígera en relación con el peso total de cada hembra (Kangpanich et al. 2016).
En las submuestras de huevos se midió el diámetro mayor (L) y menor (l) por medio de un microscopio-estereoscopio (AmScope®) equipado con ocular micrométrico (1 = 0.4 mm), posteriormente se hizo la conversión de su escala a mm para de- terminar el volumen (mm3) de los huevos según la siguiente ecuación (Bazán et al. 2009):
Se realizó un sistema tipo incubadora para la eclosión de los huevos. Este sistema consistió en un contenedor plástico rectangular con la temperatura controlada a 28 °C por medio de un calentador eléctrico de inmersión de 100W (Boyu HT® - 2200), una bomba de agua de flujo continuo para recirculación y una cubierta plástica para evitar perdida de calor. Conforme las hembras fueron fecundadas, en este sistema se colocaron en recipientes plásticos de 200 mL, tres submuestras de al menos 5 hembras de cada tratamiento (una submuestra por recipiente) cada hembra con 30 huevos en estadio III (Wehrtmann 1990) a punto de eclosionar y se determinó la tasa de eclosión (en porcentaje) mediante la diferencia de huevos eclosionados/no eclosionados.
Evaluación de calidad de las larvas
Se seleccionaron, al azar, al menos cinco hembras ovígeras con huevos en estadio III a punto de eclosionar de cada tratamiento, que se aislaron individualmente en peceras de 30 L hasta la eclosión de los huevos y obtención de las larvas. Una vez eclosionadas se seleccionaron 60 larvas al azar de cada hembra, para registrar la Longitud total (LTL), además de muestras de larvas para aplicar las pruebas de estrés de supervivencia larval en inanición (SLI) y supervivencia larval a 45 ups (SL45). En ambas evaluaciones se colocaron larvas recién eclosionadas en recipientes plásticos de 200 mL sumergidos parcialmente en el sistema tipo incubadora descrito anteriormente.
La SLI se evaluó durante cuatro días, con 20 larvas seleccionadas aleatoriamente de cada hembra por triplicado. La salinidad para esta prueba se ajustó a 10 ups, diluyendo agua marina con agua purificada, las larvas no se alimentaron y no se renovó el agua en el transcurso del experimento. Para luego realizar observaciones cada 12 h; las larvas que no presentaron movimiento de apéndices y no respondieron a estímulos mecánicos fueron consideradas muertas. La SL45 se realizó por triplicado con 15 larvas aleatorias de cada hembra y a una concentración salina de 45 ups. Este bioensayo tuvo una duración de una hora y se monitoreó la mortalidad cada 5 min (Cavalli et al. 2000). Las larvas que no presentaron movimiento de apéndices y no respondieron a estímulos mecánicos fueron consideradas muertas
Evaluación del Índice Gonadosomático (IGS) y Hepatosomático (IHS)
Al finalizar los bioensayos con las dietas experimentales, se separaron los machos de los tanques y una vez que las gónadas de las hembras no fecundadas estuvieran completamente maduras (ovario visible de color verde oscuro que ocupa la mayor porción dorsal del cefalotórax, abulta el exoesqueleto en esa región), se sacrificaron siete hembras por tratamiento y se obtuvieron las gónadas y hepatopáncreas por disección, y se registró su peso en una balanza analítica Nimbus® (ADAM® NBL:254 d = 0.0001g). Los índices IGS e IHS se calcularon como el porcentaje de gónada y hepatopáncreas respecto al peso corporal total, respectivamente (Cavalli et al. 2000).
Análisis estadísticos
Para determinar diferencias de los parámetros de calidad de los huevos y larvas entre los distintos tratamientos se realizaron pruebas ANOVA de una vía (p < 0.05). En el caso de diferencias se aplicó una prueba de Tukey (p < 0.05) para esclarecer dichas diferencias. Se probó la normalidad y homocedasticidad de los datos mediante las pruebas de Shapiro-Wilk y Levene, respectivamente, los datos que no cumplieron con los supuestos de normalidad y homocedasticidad se analizaron mediante la prueba no paramétrica de Kruskal-Wallis de una vía (p < 0.05). Para evaluar si las interacciones entre las distintas variables dependientes y los factores (Lípidos x Proteínas) de los parámetros de calidad de los huevos y larvas son significativas, se realizó un análisis de varianza de dos vías. Los valores porcentuales (TE, SL45 y SLI) se transformaron con la función arcoseno antes de realizar los análisis (Zar 1996). En el caso del IGS-IHS se realizaron ANOVAS para determinar diferencias entre cada índice y comparaciones por pares, pruebas U de Mann-Whitney, para comparar ambos índices. Todos los análisis estadísticos se realizaron con el software IBM SPSS Statistics®.
Resultados
Calidad de los huevos
La FC vario entre los distintos tratamientos, entre 880 y 1 407 huevos ・ g-1 hembra (Tabla 2). Los resultados indican que los langostinos alimentados con las dietas P35L4, P40L4, P30L12 y P35L12 obtuvieron los valores significativamente más altos en FC, con rango de 1 276 a 1 407 huevos ・ g-1 hembra y los valores más bajos se encontraron en las dietas P30L4 y P45L12 (855 a 880 huevos g-1 ・ hembra). Respecto al ER, los promedios más altos (masa ovígera g-1 ・ hembra g-1) en general, se obtuvieron con las dietas L12, no obstante, los análisis estadísticos demostraron que existen diferencias significativas (p < 0.05) entre la dieta P30L4 (7.68 masa ovígera g-1 ・ hembra g-1) comparada con las dietas P35L4, P30L12 y P35L12 (con rango de 11.03 a 12.09 masa ovígera g-1 ・ hembra g-1).
Tabla 2 Efectos de las ocho dietas experimentales que contienen cuatro niveles de proteína (30, 35, 40 y 45% P) y dos niveles de lípidos (4 y 12 L), respecto a la fecundidad, esfuerzo reproductivo, calidad del huevo, pruebas de estrés larval y longitud total larval de reproductoras de Macrobrachium tenellum. Los superíndices con letras distintas dentro de las mismas columnas indican diferencias estadísticas (p < 0.05). ANOVA de dos Vías (p < 0.05)
| Dieta | Peso hembra (g) | Longitud hembra (cm) | Fecundidad (huevos/g hembra) | Esfuerzo reproductivo (masa ovígera g/hembra g) | Volumen huevo (mm3) | Peso seco huevo (mg) | Tasa de eclosión (%) | Longitud total larval (mm) | Supervivencia larval a 45 ups 20 min (%) | Supervivencia larval inanición 84 h (%) |
|---|---|---|---|---|---|---|---|---|---|---|
| P30L4 | 2.37 ± 0.50 | 4.63 ± 0.28 | 880 ± 57 a | 7.68 ± 1.56 a | 0.059 ± 0.003 | 0.045 ± 0.018 | 88.40 ± 6.94 a | 1.68 ± 0.04 | 41.91 ± 15.73 abc | 24.29 ± 13.37 d |
| P35L4 | 2.38 ± 0.51 | 4.70 ± 0.35 | 1276 ± 110 bc | 11.30 ± 1.75 b | 0.058 ± 0.003 | 0.037 ± 0.010 | 93.97 ± 5.44 b | 1.69 ± 0.03 | 55.24 ± 9.20 ab | 91.18 ± 6.97 ab |
| P40L4 | 2.34 ± 0.45 | 4.74 ± 0.37 | 1312 ± 159 bc | 9.79 ± 0.81 ab | 0.058 ± 0.005 | 0.038 ± 0.012 | 88.73 ± 5.21 a | 1.66 ± 0.04 | 44.00 ± 15.89 abc | 70.00 ± 31.30 c |
| P45L4 | 2.30 ± 0.49 | 4.64 ± 0.37 | 1099 ± 183 ab | 9.77 ± 1.31 ab | 0.056 ± 0.005 | 0.036 ± 0.006 | 95.56 ± 4.24 b | 1.68 ± 0.02 | 31.67 ± 12.53 c | 91.88 ± 8.84 ab |
| P30L12 | 2.40 ± 0.48 | 4.65 ± 0.42 | 1407 ± 195 c | 11.03 ± 1.54 b | 0.054 ± 0.004 | 0.042 ± 0.009 | 96.67 ± 3.12 b | 1.69 ± 0.04 | 50.00 ± 9.19 ab | 88.22 ± 9.53 ab |
| P35L12 | 2.37 ± 0.50 | 4.69 ± 0.35 | 1281 ± 188 bc | 12.09 ± 1.25 b | 0.058 ± 0.006 | 0.035 ± 0.013 | 95.69 ± 4.34 b | 1.60 ± 0.05 | 59.05 ± 4.60 a | 82.92 ± 11.77 bc |
| P40L12 | 2.38 ± 0.50 | 4.76 ± 0.13 | 1080 ± 177 ab | 10.50 ± 0.70 ab | 0.056 ± 0.003 | 0.047 ± 0.009 | 93.85 ± 6.00 b | 1.66 ± 0.04 | 37.30 ± 4.96 bc | 96.67 ± 4.50 a |
| P45L12 | 2.42 ± 0.54 | 4.71 ± 0.39 | 855 ± 109 a | 9.99 ± 1.27 ab | 0.055 ± 0.004 | 0.042 ± 0.009 | 96.11 ± 3.33 b | 1.67 ± 0.04 | 52.38 ± 2.52 ab | 90.84 ± 5.58 ab |
| ANOVA de dos vías (valor p) | ||||||||||
| Proteína | <0.0001 | <0.0001 | 0.479 | 0.077 | <0.0001 | 0.684 | 0.001 | <0.0001 | ||
| Lípido | 0.747 | 0.006 | 0.029 | 0.334 | <0.0001 | 0.383 | 0.026 | <0.0001 | ||
| Proteína x lípido | <0.0001 | 0.062 | 0.255 | 0.214 | 0.002 | 0.360 | 0.005 | <0.0001 | ||
Los porcentajes de la TE (Tabla 2) indican que existen diferencias significativas entre las dietas P30L4 y P40L4, donde se obtuvieron los menores valores (88.40 a 88.73%), en comparación con las dietas restantes. El VH que se obtuvo en todos los tratamientos vario de 0.054 a 0.059 mm3 y el PSH mostro variaciones de 35.01 a 47.76 μg; pero no se detectaron diferencias significativas (p > 0.05) entre los tratamientos en estos dos indicadores.
El ANOVA de dos vías sugirió que en el caso de la FC existen diferencias significativas (p < 0.05) entre los niveles de proteína, independiente del porcentaje de lípidos, y también hay diferencias significativas en las interacciones entre proteína y lípido; no se encontraron diferencias significativas (p > 0.05) solo comparando los niveles de lípidos. El ER y VH solo tuvieron diferencias significativas (p < 0.05) entre las interacciones de proteína. En el caso de la TE, se observó que existen diferencias en los niveles de proteínas y lípidos, pero no existen diferencias significativas entre las interacciones. No se observaron diferencias significativas (p > 0.05) en las comparaciones de los factores proteína, lípido y su interacción en el PSH.7
Calidad de las larvas
Los resultados de la SL45 muestran porcentajes que van de 31.67 a 59.05%, el valor más alto se obtuvo en la dieta P35L12, seguido de P35L4 y el valor más bajo en P45L4; y fueron significativamente diferentes (p < 0.05). La SLI durante 84 h presento porcentajes variados, la dieta con el promedio de SLI mas alto fue P40L12 (96.67%) seguida de P45L4 (91.88%) y después P35L4 (91.18%), el promedio más bajo fue para la dieta P30L4 (24.29%), en dichas dietas se encontraron diferencias significativas.
La LTL no presento mucha variación, con promedios de 1.60 a 1.69 mm. Con respecto, a las interacciones entre los factores proteína y lípido, se observaron diferencias significativas en las interacciones de todos los factores probados (proteína, lípido, proteína x lípido) en la SLI. Además de diferencias significativas en las interacciones de la SL45, pero solo con las interacciones de los porcentajes de proteína.
Indice gonadosomatico (IGS) y hepatosomatico (IHS)
Los IGS e IHS no mostraron diferencias significativas (p > 0.05) en los distintos tratamientos (Figura 1) y tampoco se encontraron diferencias al comparar el IGS e IHS para cada dieta probada; aunque se observó una ligera tendencia a que las dietas que contenían L12 de lípidos fueron más altas en IHS y bajas en IGS. Los valores del IGS no tuvieron mucha variación en las dietas con L4 y L12, respectivamente; caso similar ocurrió con el IHS.
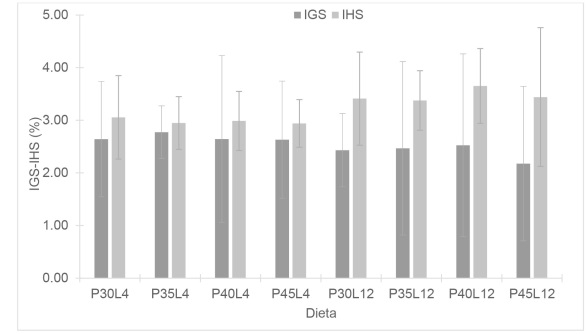
Figura 1 Índice Gonadosomático (IGS) e Índice Hepatosomático (IHS) de hembras de Macrobrachium tenellum con la gónada completamente madura, alimentadas con dietas experimentales que contienen cuatro niveles de proteína (30, 35, 40 y 45% P) y dos niveles de lípidos (4 y 12% L). No se encontraron diferencias estadísticas (p < 0.05) entre índices ni entre dietas.
Discusión
Calidad de los huevos
En los crustáceos la calidad de huevos generalmente depende de la dieta proporcionada a los reproductores (Harrison 1997); por lo que su estado nutricional puede afectar la maduración ovárica, rendimiento reproductivo, así como la calidad de su descendencia (Wouters et al. 2001, González-Ferriol et al. 2018). En el proceso de la maduración ovárica es vital la síntesis de proteínas y lípidos que se obtienen a partir de los alimentos consumidos (García-Ulloa 2000). Por lo que, el suministro adecuado de estos componentes dietarios garantizan un correcto desempeño en la etapa reproductiva de camarones y langostinos. En el presente estudio se evidencio que las proteínas y lípidos en las dietas suministradas interactúan de manera distinta dependiendo de su nivel de inclusión y combinación, y además se comprobó que dichos efectos se ven reflejados en la FC, ER y parámetros analizados de calidad de huevo y larva de M. tenellum.
Los estudios de fecundidad son fundamentales para evaluar la capacidad de aprovechar langostinos dulceacuícolas como un recurso vivo sostenible (Vargas-Ceballos et al. 2018a). El termino fecundidad (FC) hace referencia al número de huevos producidos por desove (Bertini y Baeza 2014) o el número de huevos que las hembras de algunos crustáceos cargan en su cámara abdominal (Valenti et al. 1989). En el presente estudio se demostró que la FC es un parámetro que varía en función de la cantidad de lípidos y proteínas incluidos en las dietas, aunque no se detectó una tendencia clara. Sobre lo mismo, Das et al. (1996) evaluaron dietas con distintos niveles de proteína y lípidos en M. rosenbergii, y encontraron los valores más altos en las dietas con P40L10 y P40L3 y los más bajos a P30L3 y P30L5, lo que coincide parcialmente con los resultados encontrados, ya que una de las dietas con los mayores promedios fue P40L4 y una de las dietas con los promedios más bajos fue P30L4. No obstante, una mayor FC podría ser atribuida al tamaño y peso de las hembras utilizadas, ya que el valor más alto encontrado con la dieta P30L12, fue inferior a lo reportado por Cavalli et al. (1999) , en hembras de M. rosenbergii (especie que supera en longitud y peso a M. tenellum) alimentadas con dietas P45L9. Al respecto, Hernández-Abad et al. (2018), probaron varios niveles ascendentes de lípidos, entre 10 a 20%, en dietas para reproductoras de M. acanthurus; encontrando resultados que sugieren que el número de huevos por hembra incrementa, cuando el nivel de lípidos aumenta. Al respecto tal tendencia no se observó en la FC, pero se observó que el nivel de proteína si tiene un efecto significativo en este parámetro.
En lo que respecta al efecto de las dietas en el ER, al igual que en otros parámetros evaluados en el presente estudio, no hay una significancia clara. Las hembras de M. tenellum evaluadas invirtieron entre el 7.0 y 12.0% de su peso corporal en producción de huevos, los porcentajes de ER reportados para hembras silvestres de tamaño y origen similar van de 4.1 - 16.0% (Vargas-Ceballos et al. 2018a), lo que sugiere que el ER no se ve afectado por el tipo de alimento o nivel de proteína y lípidos en la dieta. Por otro lado, Kangpanich et al. (2016) , reportan para hembras de M. rosenbergii en cautiverio alimentadas con dietas P42L9, un esfuerzo reproductivo mayor (13-16%) que el del actual estudio, lo que puede deberse a que los huevos de M. rosenbergii son más grandes (Cavalli et al. 2000, Cavalli et al. 2003) y la energía para producirlos, por ende, podría ser mayor.
Desde hace algunos años, el volumen del huevo (VH) se ha considerado un indicador del contenido de energía para el desarrollo del embrión (Levitan 1996, Nazari et al. 2003) y es utilizado en estudios de biología reproductiva, calidad reproductiva y fecundidad en decápodos (Paschoal et al. 2019, Rodrigues et al. 2022). Sin embargo, algunos estudios han evidenciado que, a pesar de la inclusión de lípidos y proteínas en las dietas experimentales, el VH no varía, como lo demostraron Cavalli et al. (2000) con M. rosenbergii, Villafuerte-Mojica et al. (2016) y Hernández-Abad et al. (2018), con M. acanthurus, y García-Guerrero et al. (2021) y el presente estudio con M. tenellum. Por su parte, García-Ulloa et al. (2004) probaron dietas con distintos niveles de proteínas y lípidos en hembras de M. tenellum con un peso mayor; los resultados de VH fueron similares, pero el PSH fue menor. Por otro lado, el VH de hembras silvestres en estadio II de desarrollo embrionario es de 0.059 mm3 (Vargas-Ceballos et al. 2018a). Tal parece que el VH no varía en hembras silvestres o confinadas de M. tenellum y aparentemente no está ligado al alimento consumido, no obstante, el PSH si pudiera ser un indicador inicial de su calidad, pero son necesarios más estudios para corroborar dicha información.
La TE de hembras de M. tenellum fue mayor a lo reportado por Das et al. (1996) y Cavalli et al. (2000) en hembras de M. rosenbergii, pero tales diferencias en el último estudio no se pueden atribuir completamente al tipo de dieta, si no que pueden deberse a que las muestras de huevos se incubaron in vitro durante 11 días y en el actual estudio se evaluó la tasa de eclosión con huevos en estadio III a unas 24 - 36 horas antes de su eclosión. Por su parte, Cavalli et al. (2001) reportan para hembras de esta última especie alimentadas con dietas P44L9 un porcentaje de 82.4 - 97.7%, similar a lo encontrado en el presente estudio.
Calidad de las larvas
El termino calidad, en acuicultura, suele utilizarse para definir aspectos reproductivos y condiciones fisiológicas de huevos y larvas de crustáceos (García-Ulloa et al. 2004). Dentro de lo relacionado con el desarrollo embrionario, este término se usa para establecer criterios de longitud, peso, diámetro del huevo, eclosión, sobrevivencia, entre otros; ya que estos son indicadores biológicos esenciales en las primeras etapas del ciclo de vida (Lavens y Sorgeloos 1991). La LTL de larvas recién eclosionadas no vario en función de los diferentes niveles de proteínas y lípidos usados en las dietas de las hembras. Al respecto, Cavalli et al. (2003) y Kangpanich et al. (2016) obtuvieron resultados similares al probar dietas con diferentes fuentes de lípidos, e inclusiones de P45L9 y P42L9, respectivamente. En función de estos resultados se puede inferir que, los niveles de proteínas y lípidos probados en ambos estudios no influyeron en la LTL.
Las pruebas de estrés se basan en el supuesto de que la condición fisiológica de los organismos acuáticos determina su capacidad para sobrevivir a condiciones ambientales adversas (MacNiven y Little 2001). Distintos autores han propuesto métodos para estimar la calidad de las larvas, principalmente en camarones peneidos; estos consisten esencialmente en exponer a las larvas a un estrés ambiental breve pero extremo, como son: bajas o altas salinidades y temperaturas, altas concentraciones de amoniaco, periodos de inanición, entre otras (Racotta et al. 2003). Al respecto, Anger (2001) , menciona que la salinidad es uno de los parámetros ambientales con mayor influencia en los animales acuáticos que viven en estuarios, como es el caso de M. tenellum, debido a la gran variación de la salinidad que ahí se presenta. A pesar de que este langostino es eurihalino, Vargas-Ceballos et al. (2018b) reportan que en concentraciones salinas mayores a los 30 ups los embriones no eclosionan y las larvas mantenidas en agua dulce (0 ups) mueren en menos de 96 horas. Los promedios más bajos de SL45 (20 min) se encontraron en dietas con L4, sin embargo, esta tendencia no fue significativa. En este sentido, las reservas energéticas que los progenitores transfieren a sus larvas podrían ayudarles a hacer frente a condiciones extremas de salinidad, pero, se requieren estudios más puntuales para esclarecerlo.
Durante la fase inicial del desarrollo larval, las larvas de M. amazonicum usan sus reservas de grasa en ausencia de alimento, y a 10 ups sobreviven hasta 14 días sin consumir alimento externo (Anger y Hayd 2009). También existe evidencia de que las larvas de M. rosenbergii pueden permanecer al menos dos días sin alimentarse exógenamente después de la eclosión, ya que toma su energía de su saco vitelino (Barros y Valenti 2003, Araujo y Valenti 2007). Para el caso de M. tenellum, Vargas-
Ceballos et al. (2018b) reportan que a 10 ups la supervivencia de las larvas es del 98% a 7 días (168 h) post eclosión, en larvas sin ser alimentadas. Mientras que Vargas-Ceballos et al. (2020) reportan que la larva (zoea I) de esta misma especie tiene algunas reservas lipídicas en la región cefalotorácica que le permiten crecer a la siguiente etapa sin alimentación exógena. Dado que los nutrientes de las hembras se transfieren a los huevos en la ovogénesis a través del hepatopáncreas, un alimento que provea más nutrientes asimilables a la hembra puede dar mayores reservas energéticas a las larvas, y, por ende, una resistencia mayor a la inanición. En el presente estudiose observaron diferencias estadísticas en la SLI, los valores más altos se encontraron en el grupo de dietas con L12, lo que podría indicar que los nutrientes que las madres transfieren a los embriones están afectando su respuesta ante la falta de alimento.
Indice gonadosomatico (IGS) y hepatosomatico (IHS)
Los IGS e IHS son indicadores de movilización de reservas energéticas del hepatopáncreas hacia las gónadas para la maduración de estas, en crustáceos decápodos (Rodríguez-González et al. 2006, Zara et al. 2012, Revathi et al. 2012). Diversos estudios en especies del genero Macrobrachium evidenciaron el uso de reservas nutricionales del hepatopáncreas para la maduracion ovarica, ya que se han observado relaciones inversas entre IGS e IHS (Cavalli et al. 2001, Revathi et al. 2012, Magalhaes et al. 2012). Los resultados evidenciaron una tendencia inversa (no significativa) en hembras con la gónada madura respecto al IGS-IHS y el nivel de lípidos en las dietas evaluadas, ya que se encontraron los porcentajes más altos de IHS en las dietas con L12 y de igual manera los valores de IGS más bajos en las mismas dietas. En relación con esto, Cavalli et al. (2003) reportan lo contrario en hembras de M. rosenbergii maduras, valores más altos para el IGS y más bajos para el IHS, lo mismo ocurre con Cavalli et al. (2000), aunque estos últimos autores encontraron valores más altos que en el presente estudio para el IGS y similares para IHS; cabe resaltar que tanto Cavalli et al. (2003) como Cavalli et al. (2000), utilizaron un porcentaje de proteínas del 45% en las dietas suministradas a las hembras, igual al porcentaje de proteínas mayor evaluado en las dietas del presente estudio, en el que el incremento del nivel de proteínas no tuvo ningún efecto para el IGS e IHS. No obstante, el enriquecimiento con ácido araquidónico en distintas proporciones en dietas suministradas a hembras de M. rosenbergii tuvo un efecto significativo en el porcentaje de IGS e IHS (Kangpanich et al. 2016), lo que sugiere que estos índices pueden ser afectados por los nutrientes de los alimentos que consumen los reproductores.
Conclusiones
Se detectó una tendencia a que dietas con mayor porcentaje de lípidos representan mejor calidad de huevos, pero no significativa, por lo que se sugiere probar niveles de lípidos intermedios (6 y 8%) y más altos (14%) a los que se evaluaron en el presente estudio, para determinar si su interacción con los niveles de proteínas mejora los parámetros y/o acentúan las diferencias. Se encontraron evidencias que sugieren una relación entre el índice gonadosomático-hepatosomático y los niveles de lípidos consumidos, ya que, conforme aumenta la disponibilidad de lípidos en las dietas mayor cantidad son almacenados en el hepatopáncreas, pero no se transfiere mayor cantidad a la gónada, dicha relación podría esclarecerse con análisis bioquímicos de proteínas solubles y lípidos totales en los mencionados tejidos. Los niveles de lípidos y proteínas probados, y su interacción, tienen diferentes efectos en los parámetros de calidad de huevo y en las pruebas de supervivencia de larvas. La dieta P30L4 tuvo los promedios más bajos en la mayoría de los parámetros evaluados, por lo que, estos niveles de proteína y lípidos se pueden descartar en la formulación dietaría para reproductores. Se sugiere utilizar la dieta P35L4 en la alimentación de reproductoras de M. tenellum ya que garantiza una calidad de huevos y larvas similar a la mayoría de las dietas evaluadas e implica un menor gasto monetario en la inclusión de proteínas y lípidos.











 nueva página del texto (beta)
nueva página del texto (beta)



