Introducción
La restauración de bosques degradados y tierras agrícolas se ha convertido en un aspecto principal de la conservación global (Christin et al., 2016). Varios países desarrollan métodos de preservación de semillas de especies forestales con la finalidad de mejorar su adaptación, crecimiento y calidad (Skrøppa y Fjellstad, 2017). Pinus montezumae Lamb. y Pinus greggii Engelm. ex Parl. son especies prioritarias de los bosques de coníferas en México pues revisten gran importancia económica, ecológica y social (Conafor-FAO, 2011). Además, la segunda es endémica de Norte América y está catalogada en estatus de vulnerabilidad según la International Union for the Conservation of Nature (Conabio, 2018).
Para la familia Pinaceae, la semilla es el principal recurso de propagación. Sin embargo, durante su almacenamiento diversos factores causan su deterioro: su contenido de humedad, la humedad relativa y la temperatura del ambiente (Wang y Beardmore, 2004). Otros agentes que favorecen el daño a dichas estructuras son los organismos vivos (Arguedas, 1997) como: hongos, bacterias, virus, nematodos y artrópodos; de ellos, los hongos son el grupo de patógenos de mayor transmisión, se desarrollan en la superficie, en su interior o en ambas partes y se propagan por medio de diferentes formas, como esporas y esclerocios (Neegaard, 1977).
La información sobre los patógenos asociados a las semillas forestales almacenadas es escasa, y los hongos resultan de interés porque los daños que ocasionan repercuten en su posterior establecimiento. Con base en lo anterior, se plantearon como objetivos identificar y cuantificar los géneros de hongos asociados a las semillas almacenadas de Pinus montezumae y Pinus greggii bajo dos condiciones de humedad relativa.
Materiales y Métodos
La investigación se realizó en el Centro de Capacitación y Desarrollo en Tecnología de Semillas de la Universidad Autónoma Agraria Antonio Narro, en Saltillo, Coahuila, en junio de 2018. Las semillas de pino prieto (Pinus greggii) y pino real (Pinus montezumae) recolectadas en los municipios de Metepec y Calimaya respectivamente, en el Estado de México fueron proporcionadas por la Comisión Nacional Forestal (Conafor).
Se tomó una muestra representativa de un kilogramo en cada lote; por especie se utilizaron cuatro repeticiones de 50 semillas por humedad relativa (60 y 80 %) y para cada muestreo, los que se llevaron a cabo a los 0, 30, 60, 90, 120, 150 y 180 días. Las semillas se colocaron en bolsa de malla y se suspendieron sobre una tarima dentro de recipientes de plástico, para que durante el tiempo de almacenamiento las semillas no tocaran directamente las soluciones. Las humedades relativas (HR) se obtuvieron con sales según Winston y Bates (1960); para 60 % de HR, se colocó 1.5 kg de sal de grano para los muestreos dos (30 días) y tres (60 días); mientras que, para los muestreos del cuatro al siete (90 a 180 días) se usaron 2.0 kg. Para 80 % HR, se agregó 0.5 kg de sal más 1 L de agua para los primeros dos muestreos y 1.1 kg más 2 L de agua para los muestreos del cuatro al siete.
El material así tratado, se almacenó en una cámara de enfriamiento marca Torrey modelo CV-32 a temperatura constante de 5 °C. Las variables evaluadas fueron: contenido de humedad de la semilla (HS), que se calculó con base en ISTA (2004) con 15 semillas en promedio por cada repetición; las semillas se pusieron en cajas de aluminio con tapa, previamente pesadas; enseguida se pesaron las cajas con la semilla húmeda y se colocaron dentro de una estufa de secado SHEL-LAB modelo FX14-2, a 103 °C por 16 ±1 horas; posteriormente, se pesaron las cajas después del secado. Para todas las mediciones se utilizó una balanza analítica marca OHAUS modelo AV264. La HS se calculó por diferencia de peso y se expresó en porcentaje.
La identificación y cuantificación de géneros de hongos (GH) y semillas libres de hongos (SLH), se realizó mediante la técnica de crecimiento en medio de cultivo Malta Sal Agar (Moreno, 1988). Se utilizaron 10 semillas con cuatro repeticiones por muestreo, mismas que se desinfestaron con NaClO al 0.5 % para P. greggii y al 1.0 % para P. montezumae, durante 1 minuto para ambas especies; las diferencias en la concentración de NaClO se debe a que el tegumento de P. greggii es más delgado y sensible al hipoclorito de sodio, con respecto a P. montezumae. A continuación se hizo la siembra dentro de una campana de flujo laminar marca ALDER, con 10 semillas por caja Petri; posteriormente, se les depositó en una cámara de incubación marca SHEL-LAB modelo FX14-2 a temperatura de 28 - 30 °C, por 7 días. Los GH se identificaron por la morfología de sus colonias con las claves taxonómicas de Barnett y Hunter (1998) y Moreno (1988). Para SLH se cuantificaron las semillas que no desarrollaron micelio y se registraron en porcentaje. La incidencia (I) de GH para los dos taxones de pino, se calculó mediante la siguiente fórmula (Abdullah y Al-Mosawi, 2010):
Se aplicó un diseño experimental completamente al azar para humedad de semilla y semillas libres; se llevó a cabo una comparación de medias de Tukey (P <0.05), con el paquete estadístico SAS (2002).
Resultados
El análisis de varianza mostró que para las fuentes de variación analizadas: especie, humedad relativa y tiempo hubo significancia de 0.01. Para HS por especie, P. montezumae registró una media de 12.37 %, lo que fue estadísticamente diferente a P. greggii con 9.59 %; en SLH, P. montezumae obtuvo los mayores valores, con 69.28 %, en comparación con P. greggii (64.52 %). La menor HS se determinó bajo la condición de 60 HR, P. montezumae presentó 10.21 % y P. greggii 7.97 %; para 80 HR, se incrementó para la primera especie (14.53 %) y para la segunda, 11.21 % de humedad de la semilla. En cuanto las semillas libres de hongos, en la condición de 60 HR P. montezumae registró 71.42 % y P. greggii 62.85 % y para el ambiente de 80 HR, el primer taxón, 67.14 % y el segundo, 66.19 %.
Durante el tiempo de almacenamiento, la HS fue similar para ambas especies. En P. montezumae bajo la condición de humedad relativa al 60 %, se observó la menor HS a los 0 días (8.72 %); al 80 HR la mayor HS fue a los 180 días (16.42 %). Con respecto a SLH, el porcentaje más alto se identificó a los 30 días en condiciones de 60 HR y, en 80 HR, a los 60 y 90 días (76.66 y 73.33 %). El comportamiento de P. greggii fue similar, ya que a los cero días bajo 60 HR se obtuvo el valor de HS más bajo (7.58 %); para SLH fue a los 120 días a 80 HR con el valor más alto (75.6 %), mientras que a 60 HR los valores más destacados se observaron a los 150 y 180 días con 73.72 %. Para ambas especies, la mayor HS se alcanzó a los 180 días en las dos condiciones de humedad relativa: P. greggii 9.08 y P. montezumae 13.06 %; finalmente, para SLH no hubo diferencias significativas entre las dos condiciones de humedad relativa (Figura 1).

Figura 1 Respuesta de Pinus montezumae Lamb. y Pinus greggii Engelm. ex Parl., la humedad de la semilla (HS) y semillas libres de hongos (SLH) durante 180 días de almacenamiento a 60 y 80% de humedad relativa (HR).
Los géneros de hongos presentes en ambas especies y humedades durante el almacenamiento fueron Fusarium sp., Penicillium sp., Alternaria sp., Rizhopus sp. y Aspergillus sp.; sin embargo, este último no se manifestó en P. greggii al 60 % de HR. Al inicio del almacenamiento, la cantidad y variabilidad de géneros fue mayor, pero, al finalizar los muestreos Penicillium sp. fue predominante.
En P. montezumae al 60 % de HR, Penicillium sp. presentó incidencias de 30 % a los 180 días; y la máxima de Fusarium sp. fue a los 90 días (16.7 %). Alternaria sp. y Aspergillus sp. disminuyeron hasta 0 %, en cambio Rizhopus sp. se mantuvo hasta los 180 días (Figura 2a). Al 80 % de HR, Penicillium sp. dominó con una incidencia de 8.33 a 43.3 %, en cambio Fusarium sp. se verificó hasta el último muestreo; mientras que Aspergillus sp. al día 0 se mostró con 10 % y Rizhopus sp con 2.33 % (Figura 2).
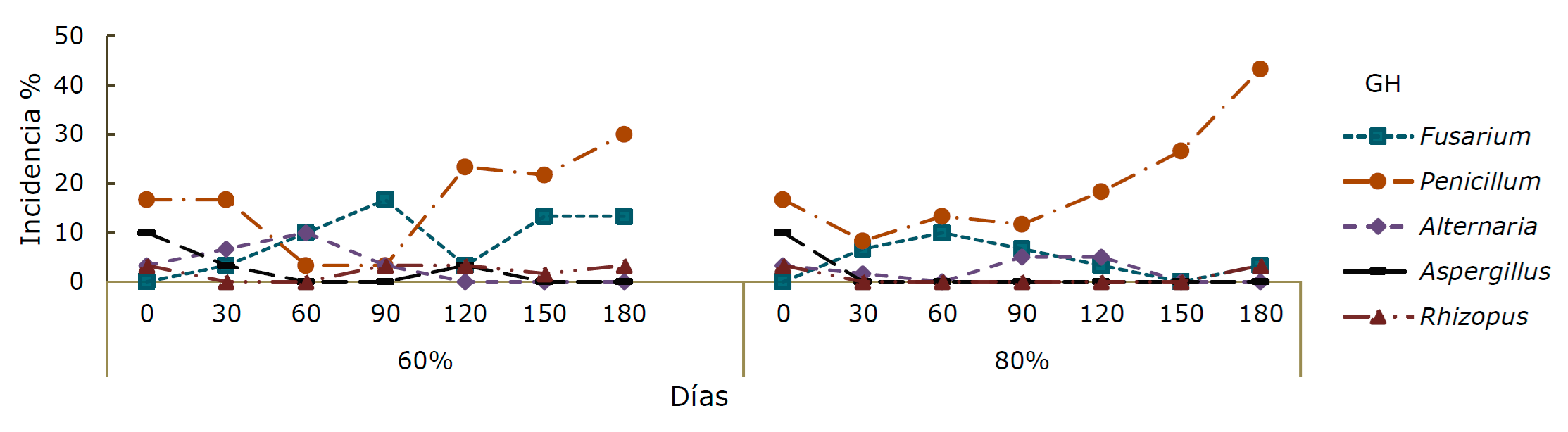
Figura 2 Porcentaje de incidencia de diferentes géneros de hongos (GH) en semillas de Pinus montezumae Lamb. durante 180 días de almacenamiento a 60 y 80 % de humedad relativa.
La incidencia de hongos en P. greggii fue similar a la de P. montezumae, a los 0 días Alternaria sp. dominó con 27 % (Figura 3), pero disminuyó con el paso del tiempo. Fusarium sp. estuvo presente durante todo el almacenamiento. A la humedad relativa de 60 %, su máxima incidencia fue a los 60 días (23.3 %) y a la HR de 80 % a los 30 días fue de 16.7 %; Rizhopus sp. solo se presentó al inicio del experimento En el ambiente de 60 % de HR no se detectó Aspergillus sp., y la incidencia de Penicillium sp., fue mayor a 120 días con 33 %. En el ambiente de 80 % de HR el mayor incremento de Penicillium sp. fue de 30 % a 60 y 180 días, mientras que Aspergillus sp. solo se observó a los 150 días con 3.33 %.
Discusión
La HS está en función directa de la humedad relativa y la temperatura del ambiente. Al tener la capacidad de perder o ganar humedad de acuerdo a las condiciones ambientales (Delouche, 1972), P. montezuma y P. greggii alcanzaron la humedad de equilibrio a los 30 días y valores máximos de 16.42 y 13.06 %, respectivamente; sin embargo, Conafor (2017a,b) recomienda que la humedad más apropiada para el almacenamiento en P. montezumae es de 8-10 % y para P. greggii del 6-7 %. La HS durante el almacenamiento de estas especies resultó ser un factor determinante para mantener la calidad de la semillas (SNICS, 2018). Estos porcentajes de humedad de la semilla favorecen la presencia de hongos y con ello, el proceso de deterioro por factores bióticos (Engels y Visser, 2007).
En referencia a la HR, Ortiz-Catón et al. (2011) establecieron que la actividad biológica de diversas cepas de hongos se incrementa cuando están en un intervalo de 81 - 92 %. En Brassica sp., Suma et al. (2013) concluyeron que la viabilidad de las semillas y los parámetros de vigor de las plántulas se redujeron cuando se les sometió a una HR alta (75 %), lo que coinciden con los resultados obtenidos en el presente estudio, en el que se observó que a 80 % HR la incidencia de hongos fue mayor que a 60 % HR, en las dos especies de interés.
Ceballos-Freire y López-Ríos (2007) señalaron que en Alnus acuminata Kunth (aliso), Guarea guidonia (L.) Sleumer (cedrillo), Juglans neotropica Diels (cedro negro), Retrophyllum rospigliosii (Pilg.) C. N. Page (chaquiro) y Cordia gerascanthus L. (solera) la alta humedad relativa (90 %) provocó un aumento de la humedad de la semilla almacenada y, como consecuencia, se presentó un ataque severo de hongos de los géneros Penicillium y Aspergillus, los cuales afectaron 50 y 70 % del material en conservación, respectivamente.
La tendencia de SLH para P. montezuma disminuyó drásticamente en las dos HR a partir de los 90 días; en P. greggii al 80 %, la tendencia bajó a los 120 días, lo que coincide con investigaciones sobre semillas de Pinus spp. que indican la pérdida de viabilidad por el aumento de daños fisiológicos (Hilli et al., 2003; Du Hyun y Sim, 2018) durante el almacenamiento a largo plazo.
Los géneros determinados en ambas especies de pino sometidas a ambientes de 60 y 80 % de HR durante los 180 días coinciden con la información aportada por Guerra et al. (2004) y Campo-Aranda et al. (2014) sobre la micobiota en semillas de Pinus spp. De acuerdo con Moreno (1988), los hongos de campo como Alternaria sp. y Fusarium sp., se desarrollan en humedades entre 90 y 100 %. De esta forma, Alternaria sp. estuvo presente en las semillas al inicio de los muestreos y disminuyó su incidencia conforme trascurrió el tiempo. Fusarium sp. se comportó de igual forma, fue mayor a 60 % de HR que a 80 % enlos dos taxones de pino evaluados. Al desarrollarse este género en la semilla, ocasiona que la calidad de la planta sea inferior, ya que daña al embrión antes de germinar y causa necrosis del hipocótilo y los cotiledones (Peterson, 2008; Solano-Bonilla y Brenes-Chacón, 2012).
En este estudio se presentaron hongos del género Penicillium sp., Aspergillus sp. y Rhizopus sp., catalogados como hongos de almacén con crecimiento en un intervalo entre 65 y 90 % de HR. Penicillium sp. incrementó su incidencia en todos los ambientes y en ambas especies a partir de los 120 días, además Aspergillus sp. se identificó con mayor frecuencia en P. montezumae, pero en P. greggii solo se le identificó al 80 % de HR. Rhizopus sp. se observó de forma esporádica en P. montezumae. Estos géneros disminuyen la calidad fitosanitaria de las plántulas, ya que causan pudriciones, reducción de crecimiento y muerte de plántulas (Borges y Urdaneta, 2010; Arguedas, 2011; Lee, 2011).
Gran parte de estos géneros de hongos son considerados saprofitos, algunos no siempre provocan daños directos en la semilla, pero se reconoce que cuando la incidencia es muy alta, el vigor y la viabilidad de las semillas tienden a disminuir (Mittal et al., 1990).
Conclusiones
Las condiciones de almacenamiento de semillas de P. montezuma y P. greggii con alta humedad relativa aumentan la incidencia fúngica de géneros como: Fusarium sp., Aspergillus sp., Alternaria sp., Rhizopus sp. y Penicillium sp., los cuales se han identificado como causantes de deterioro.
Los ambientes fríos (5 °C) y secos (60 % HR) pueden ser seguros para el almacenamiento de semillas de P. montezumae y P. greggii, ya que son las condiciones en las que menor porcentaje de humedad de la semilla se registra y en consecuencia hay menos incidencia de hongos causantes del deterioro.











 texto en
texto en 



