Introducción
Los neonicotinoides son una familia de insecticidas que se caracterizan por su alta efectividad en el uso contra plagas en diversos cultivos, y su baja toxicidad en mamíferos (Jeschke y Nauen, 2008, 1084; Kagabu, 2011, 2887; Tomizawa y Casida, 2003, 339). Dentro de esta familia, se encuentran, por mencionar algunos; el Imidacloprid, Acetamiprid, Tiacloprid y Tiametoxam. Estos compuestos tienen un mecanismo de acción a nivel del sistema nervioso central como agonistas de los receptores nicotínicos de acetilcolina (nAChR’s, por sus siglas en inglés) responsables de una rápida neurotransmisión excitatoria, debido a la apertura de los canales de iones sodio (Tomizawa y Casida, 2009, 260; Iwasa et al., 2004, 371; Tomizawa y Casida 2005, 259).
A pesar de su baja toxicidad en animales superiores, la exposición a altas dosis de imidacloprid se ha asociado a cambios degenerativos en el timo, médula ósea, páncreas (Department of Agriculture, 2005) y afectaciones en el desarrollo cerebral (Kimura-Kuroda et al., 2012, 1). Recientemente, se ha evaluado el impacto ambiental que tienen estos componentes debido a su extenso uso en actividades agrícolas, ya que estudios sugieren que son altamente dañinos, debido a su permanencia en agua y suelos, así como su interferencia en el ciclo de polinización, afectando a organismos polinizadores (Whitehorn et al., 2012, 351; Lu et al., 2012, 103; Iwasa et al., 2004, 371; Chagnon et al., 2013, 126; Goulson, 2013, 983).
Los neonicotinoides exhiben una vida media-larga, siendo resistentes a la hidrólisis a pH neutro y ácido (< pH 9) a condiciones anaerobias, además de que son altamente solubles en agua generando su uso idóneo como insecticida sistémico (Morrissey et al., 2015, 293). Como una consecuencia de su alta solubilidad y persistencia en suelos, estos compuestos poseen un riesgo de contaminación acuífera, particularmente después de eventos de lluvia, ya que son arrastrados por dichas precipitaciones hasta mantos acuíferos superficiales y subterráneos (Haith, 2010, 6499; Thuyet et al., 2012, 515; Gupta et al., 2002, 502, Canadian Council of Ministers of the Environment, 2002).
Existen procesos por los cuales los neonicotinoides pueden ser removidos de muestras de agua contaminada; los más comunes son los de oxidación (Turabik et al., 2014, 8387; Dell’Arciprete et al., 2011, 678; Dell’Arciprete et al., 2012, 3479). Éstos, basados en la química de los radicales hidroxilo (•OH), son actualmente usados para la destrucción de contaminantes orgánicos persistentes y/o tóxicos. Los radicales hidroxilo, son agentes altamente oxidantes y reaccionan de una manera no selectiva sobre compuestos orgánicos llegando a la mineralización final de tales productos.
Recientemente han sido propuestos nuevos procesos de oxidación mediante electroquímica debido a su adecuación ambiental, alta efectividad, rapidez y seguridad (Turabik et al., 2014, 8387; Brillas et al., 2009, 6586; Nidheesh et al., 2012, 2). Sin embargo, estos métodos de extracción son sumamente costosos y como consecuencia la remoción de estos compuestos en grandes volúmenes de agua es una tarea difícil.
Por otro lado, tenemos al carbón activado (CA). Éste es un compuesto estructurado por secciones de nanoporos adsorbentes, el cual es ampliamente utilizado en el tratamiento de aguas residuales y el acondicionamiento de agua potable mediante la adsorción de contaminantes orgánicos e inorgánicos, (Gun’ko et al., 2013, 140; Putra et al., 2009, 2429; Baccar et al., 2012, 310) tales como plaguicidas, fármacos entre otros. Estudios experimentales han dado evidencia de que el carbón activado contiene en su estructura arreglos hexagonales y pentagonales de átomos de carbono en fragmentos agrupados tipo fullereno, (Harris et al., 2008, 5; Terzyk et al., 2007, 5920; Smith et al., 2004, 2046) por lo que teóricamente han sido propuestos como modelos en el estudio y simulación del carbón activado. (Cam et al., 2009, 4395; Guerra et al., 2015, 1023)
De nuestro conocimiento, no existen trabajos teóricos donde se estudie la adsorción de neonicotinoides con modelos de carbón activado, por tal motivo, en el presente reporte se muestra un estudio computacional de la adsorción de 3 neonicotinoides ampliamente usados en la actividad agrícola con CA dentro del marco de la Teoría de Funcionales de la Densidad (DFT). Los modelos propuestos fueron estructuras de tipo fullereno para simular las curvaturas del carbón activado.
Método
Un breve bosquejo a la Teoría de Funcionales de la Densidad
La posibilidad de obtener resultados confiables de comportamientos fisicoquímicos, biológicos, y demás, mediante cálculos computacionales es fascinante, sin embargo, esto no hubiera sido posible sin el desarrollo de teorías que nos ayudan a la resolución de estos problemas.
En 1926 Schrödinger (1926, 361) propone una ecuación de valores propios la cual determina la estructura electrónica de un sistema:
Donde debemos encontrar la función de onda (ψ) correspondiente a dicho sistema. La solución exacta de esta ecuación para sistemas de varios electrones es compleja. Por ello se han desarrollado métodos para resolverla. De aquí surge la Teoría de Funcionales de la Densidad (DFT por sus siglas en inglés). Esta última, tiene sus antecedentes en los trabajos de Thomas (1927, 542) y Fermi, (1927, 602) donde utilizan a la densidad electrónica como variable básica.
En 1964 Hohenberg y Kohn (1964, B864) mediante sus teoremas mostraron que para el estado fundamental, el modelo de Thomas-Fermi puede ser considerado como una aproximación a una teoría exacta, la Teoría de Funcionales de la Densidad. Posteriormente, con las aportaciones de Kohn y Sham, (1965, 1134) la DFT adquirió la forma de un método práctico para el estudio de la estructura electrónica. Ellos hicieron una propuesta para obtener la densidad del estado basal de un sistema electrónico, la cual podemos resumir en los siguientes puntos:
1. Sistema de referencia donde se conoce la función de onda exacta. Este sistema corresponde a un sistema donde los electrones no interactúan entre sí y por lo tanto un determinante de Slater da la descripción de este sistema. Precisamente, por ser un determinante de Slater se sabe que la energía cinética es igual a:
Y la densidad electrónica
Donde la suma corre desde i = 1 hasta el número de electrones totales (N), ψ es la función de onda y las integrales van sobre la parte espacial (r) y de espín (s) respectivamente.
2. Potencial efectivo que genere la densidad del estado basal. Una parte clave de la propuesta de Kohn y Sham es que los orbitales con los que se construye el determinante de Slater deben de satisfacer el problema de valores propios
Donde se ha usado la relación entre orbitales de espín y orbitales libre de espín ψi (r, s) = ϕi (r)σ(s), con σ = α,β. De manera que el potencial νKS (r) debe ser tal que la densidad generada en la ecuación 3 debe ser igual a la densidad del estado basal.
3. Partición de la energía. Kohn y Sham proponen que la contribución a la energía entre los electrones sea de la forma
Donde J[ρ] representa la interacción coulómbica entre la distribución de carga, mientras que Exc es el llamado funcional de intercambio y correlación. Por otro lado, reconocemos que la energía cinética del estado de referencia no es igual a la energía cinética exacta, por lo tanto, el funcional de Hohenberg y Kohn puede ser escrito como:
Donde es claro que el funcional de intercambio y correlación, Exc [ρ] se define como:
Tomando en cuenta lo anterior, la ecuación de la energía total del sistema se puede escribir como:
Con estas contribuciones a la energía se puede reconocer que el νKS (r), potencial efectivo de Kohn−Sham, puede escribirse como:
Donde
Es el potencial de intercambio y correlación.
Aun cuando el formalismo de Kohn−Sham es exacto, dentro de sus ecuaciones el cómo representar al funcional de intercambio y correlación sigue siendo un reto. Mientras se incorpora de manera exacta la energía cinética Ts [ρ], la forma del funcional de intercambio y correlación Exc [ρ] debe ser aproximado ya que hasta el momento no se ha elucidado el funcional de intercambio y correlación exacto. La búsqueda del Exc [ρ] exacto sigue siendo el objetivo de muchos investigadores. La aproximación más simple, es la aproximación de densidad local (LDA por sus siglas en inglés), la cual hace referencia al funcional de Dirac (1930, 376) para la energía de intercambio y se introduce una contribución a la energía de correlación, en ambos casos a través del gas de electrones. También tenemos a los GGA (Aproximación de Gradientes Generalizados, por sus siglas en inglés), los cuales además de tomar en cuenta la densidad electrónica ρ(r), toman también el gradiente de la densidad ∇ρ(r), lo que ayuda a obtener mejores energías de enlace con respecto a LDA. Un funcional muy representativo de esta familia es el desarrollado por Perdew, Burke y Ernzerhof (PBE), (Perdew et al., 1996, 3866) el cual es utilizado en este reporte. Posteriormente, surgen los funcionales llamados híbridos, donde el más representativo es el B3LYP. (Becke, 1993, 5649)
Detalles computacionales
En este estudio se analizaron teóricamente tres insecticidas neonicotinoides; Acetamiprid (act), Tiacloprid (tcl) y Tiametoxam (tmt), frente a un adsorbente tipo fullereno formado por 15 anillos hexagonales y 1 pentagonal, C45H15 (mdl) (ver Figura 1). Se llevó a cabo una optimización de geometría de los insecticidas y del modelo a estudiar con el funcional de intercambio y correlación PBE (Perdew et al., 1996, 3866), el cual ha sido utilizado en trabajos previos (García-Hernández et al., 2017, 967) y que además es de bajo costo computacional y tiene buen desempeño para interacciones no covalentes de adsorbatos sobre grafeno (Cortés-Arriagada et al., 2013, 3570), acoplado a una función de base doble zeta con funciones de polarización (DZVP). (Godbout et al., 1992, 560) Se generaron 8 modos de interacción neonicotinoide - adsorbente, los cuales fueron optimizados inicialmente utilizando el método semiempírico PM7 en el código MOPAC2012. (Stewart, 2012) Dado el tamaño de los sistemas analizados, era importante hacer una búsqueda de conformaciones que se encontraran en un mínimo de energía (mínimos locales) usando métodos de bajo costo computacional, como es el caso de los semiempíricos. Las configuraciones obtenidas se reoptimizaron sin restricción de geometría con el nivel de teoría PBE/3-21G para evaluar la energía de adsorción resultante en primera instancia. Finalmente, se aplicó un conjunto de base DZVP a los modelos más estables de cada uno. Se realizó un análisis de frecuencias vibracionales para verificar que las estructuras estudiadas estuvieran en un mínimo de energía. Todas las frecuencias encontradas fueron positivas. Dada la naturaleza electrónica de los compuestos y el adsorbente, se evaluó la energía asociada a las interacciones de dispersión, mediante el esquema de Grimme D3. (Grimme et al., 2010, 3)
La Energía de Adsorción en kcal/mol (EA) fue calculada mediante la ecuación:
Donde EADS-NEO corresponde a la energía total del sistema adsorbente - neonicotinoide y EADS y ENEO a las energías totales del adsorbente (C45H15) y del neonicotinoide (Acetamiprid, Tiacloprid y Tiametoxam) respectivamente. Para la energía de adsorción asociada a la dispersión, se utilizó el mismo contexto presentado en la ecuación 11, pero tomando solamente la energía de dispersión obtenida de la expresión:
Aquí la primera suma va sobre todos los pares en el sistema,
Todos los cálculos de estructura electrónica fueron realizados en el paquete computacional NWChem v6.6. (Valiev et al., 2010, 1477)
Resultados y Discusión
Utilizando el método semiempírico PM7, se hizo una búsqueda aleatoria de posibles modos de interacción entre los neonicotinoides y la estructura tipo fullereno (mdl) propuesta. Se generaron 8 configuraciones para cada uno de los modelos; C45 H15 ··Acetamiprid, C45 H15 ··Tiacloprid y C45 H15 ··Tiametoxam. Debido a que mdl consta de una sección convexa y cóncava, se tomaron en cuenta configuraciones donde interaccionaran los insecticidas con cada una de estas secciones. En la Figura 2, se muestran las estructuras optimizadas obtenidas después de aplicar el funcional PBE-D3 acoplado a la función de base 3-21G, (Ditchfield et al., 1971, 725) el cual nos puede dar un primer acercamiento de las energías de interacción.
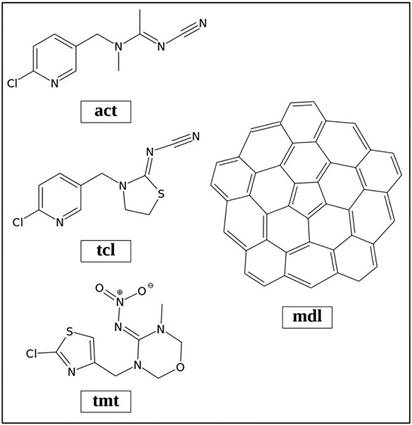
Figura 1 Estructuras del Acetamiprid (act), Tiacloprid (tcl), Tiametoxam (tmt) y C45H15 (mdl), estudiadas en este trabajo.
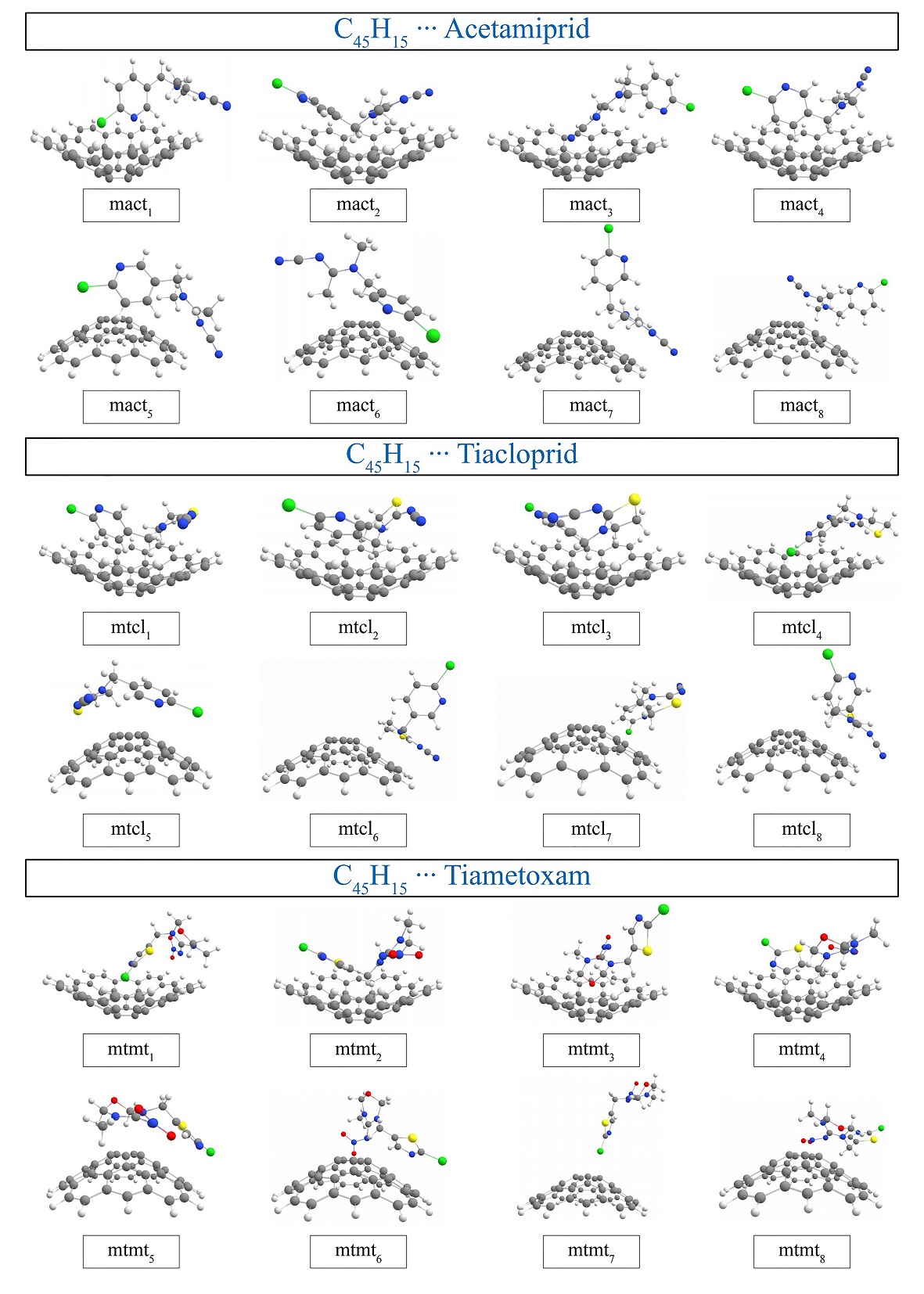
Figura 2 Modos de interacción para el Acetamiprid, Tiacloprid y Tiametoxam con C45H15. Código de color: gris, carbono; rojo, oxígeno; azul, nitrógeno; blanco, hidrógeno; verde, cloro; amarillo, azufre.
De la Figura 2, se puede resaltar que para los tres modelos, las primeras 4 configuraciones corresponden al adsorbato dentro de la concavidad de mdl, y 4 más al adsorbato en la parte convexa.
De las estructuras químicas de los insecticidas mostrados en la Figura 1, es claro que las tres comparten dos fracciones unidas por un metileno, que pueden considerarse importantes al momento de la interacción con mdl. Para el Acetamiprid y Tiacloprid, la primera fracción es la del anillo de cloropiridina, mientras que para el Tiametoxam es el anillo de clorotiazol. La disposición o modos de estos anillos sobre la superficie del C45H15 es importante a tomar en cuenta al momento de generar los modelos. Así mismo sucede con los denotados farmacóforos, los cuales son los responsables de su actividad insecticida. (Jeschke y Nauen, 2008, 1086)
Para los primeros dos (ace y tcl), se trata de un grupo funcional ciano unido a una imina, y en el caso de tmt es una nitroimina.
Para todos los casos se modelaron éstos orientando su posición hacia C45H15 (mdl) con todas las configuraciones posibles para tener certeza que los modos encontrados fueran los más estables.
Se obtuvo la energía relativa para evaluar la configuración más estable de cada modelo. Estos valores están reportados en la Tabla 1.
Tabla 1 Energías Relativas (ER) de las diferentes configuraciones obtenidas con PBE-D3/3-21G. Todos los valores están en kcal/mol.
| Modelo | ER | Modelo | ER | Modelo | ER |
|---|---|---|---|---|---|
| mact1 | 18.17 | mtcl1 | 2.35 | mtmt1 | 13.12 |
| mact2 | 0.00 | mtcl2 | 0.00 | mtmt2 | 0.00 |
| mact3 | 17.40 | mtcl3 | 0.04 | mtmt3 | 8.41 |
| mact4 | 7.03 | mtcl4 | 15.64 | mtmt4 | 2.76 |
| mact5 | 19.03 | mtcl5 | 23.64 | mtmt5 | 23.09 |
| mact6 | 20.17 | mtcl6 | 22.35 | mtmt6 | 27.27 |
| mact7 | 19.50 | mtcl7 | 24.48 | mtmt7 | 39.87 |
| mact8 | 23.62 | mtcl8 | 22.08 | mtmt8 | 24.60 |
De acuerdo con los valores de ER, en los tres casos la forma más estable es la etiquetada como “2”, siendo mact2, mtcl2 y mtmt2, las más estables de las 8 configuraciones. Los 3 modelos se reoptimizaron utilizando una función de base DZVP (Godbout et al., 1992, 560) para una buena descripción de los sistemas y del análisis de adsorción de los mismos. Esta base es suficientemente buena respecto a otros métodos correlacionados, (Godbout et al., 1992, 570) el porqué de la elección de ésta para el presente estudio. Evidentemente, para corroborar que las estructuras a trabajar estuvieran en un mínimo de energía se llevó a cabo un análisis de frecuencias vibracionales, obteniendo frecuencias positivas en todos los casos.
Interacción C45H15···Acetamiprid
Para C45 H15 ··Acetamiprid, la geometría más estable obtenida con PBE-D3/DZVP, es donde el Acetamiprid está orientado dentro de la cavidad cóncava (Figura 3).

Figura 3 Modo de interacción de Acetamiprid con mdl. EA corresponde a la energía de interacción obtenida de la ecuación 11, y EA (dispersión) hace referencia a la EA proveniente de las interacciones de dispersión (ecuación 12).
Debido a que el Acetamiprid consta de una fracción cloropiridina en el cual los electrones π están conjugados en dicho sistema, se observa que la disposición espacial del act estuviera orientado hacia la sección de mdl donde se encuentran los anillos de seis miembros, acoplándose mediante una interacción π - π. En la Figura 3, se muestran tres sitios donde hay contacto del Acetamiprid y el modelo C45H15 propuesto. Evidentemente, se puede observar que la interacción más cercana es la etiquetada con 2.71 Å de distancia y se forma con un grupo metilo y mdl. La energía de adsorción para esta configuración es de -20.18 kcal/mol. Los cálculos realizados, revelan que la contribución principal en la adsorción está dada en su totalidad por la energía de dispersión.
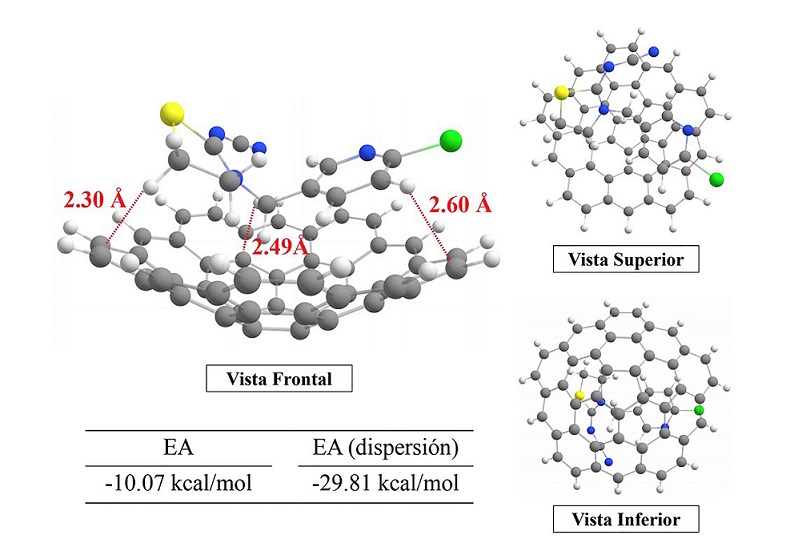
Interacción C45H15·· Tiacloprid
Para el segundo modelo, la disposición del Tiacloprid es similar a la del Acetamiprid, observando también tres posibles interacciones entre adsorbente y adsorbato. Analizando la Figura 4, podemos ver que las distancias de interacción son ligeramente más pequeñas en el conjunto C45 H15 · Tiacloprid respecto a C45 H15 · Acetamiprid en 0.42 Å en promedio. A pesar de que la interacción entre el metileno contiguo al átomo de azufre es más cercana en 0.41 Å en relación con el metilo ··· mdl del modelo anterior, la energía de adsorción se ve disminuida en ~10 kcal/mol. Evidentemente, esta disminución en la energía de adsorción indica que el Tiacloprid no va a tener tanta afinidad frente al carbón activado, como lo tendría el Acetamiprid. Para esta configuración, la energía de dispersión tiene un impacto importante ya que esta reporta -29.81 kcal/mol, lo que implica que al igual que en el modelo descrito anteriormente, la adsorción está mediada por fuerzas de dispersión.
Interacción C45H15 ··Tiametoxam
Finalmente, para el modelo C45 H15 ··· Tiametoxam se dibujan las posibles interacciones presentes en el acoplamiento (Figura 5). Para este caso, la distancia más cercana corresponde a la etiquetada con 2.70 Å, donde se distingue al grupo metileno que une a los anillos tipo oxadiazina (sin dobles enlaces) y clorotiazol, interaccionando con la superficie parcialmente plana de mdl. Al igual que en los modelos anteriores, el adsorbato se encuentra en el lado cóncavo del adsorbente.
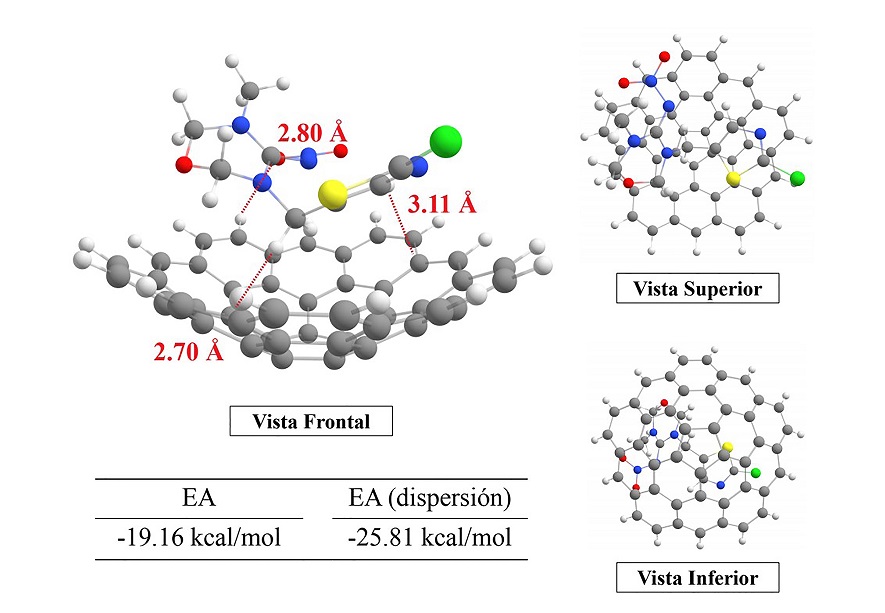
Figura 5 Modo de interacción de Tiametoxam con mdl. EA corresponde a la energía de interacción obtenida de la ecuación 11, y EA (dispersión) hace referencia a la EA proveniente de las interacciones de dispersión (ecuación 12).
Claramente en los modelos planteados en este trabajo, la conformación más estable adoptada por los tres insecticidas es en posición “acostada” sobre el lado cóncavo del modelo tipo fullereno, con una energía por debajo de ~19 kcal/mol y hasta ~40 kcal/mol respecto a las configuraciones orientadas en la sección convexa. Un trabajo realizado por Cam y colaboradores (2009, 4395) donde llevaron a cabo un estudio similar al mostrado en este reporte, pero usando como adsorbato al fenol, encontraron que para el modelo pristino, la interacción está mediada por la dispersión solamente, lo que está relacionado a lo encontrado este trabajo. Así, podemos sugerir que los neonicotinoides al acoplarse al carbón activado podrían unirse mediante interacciones asociadas a la dispersión.
Evidentemente, el tomar en cuenta efectos de solvente así como modelos con grupos funcionales, es deseable para una descripción mucho más completa del proceso que se quiere evaluar, sin embargo así como algunos trabajos realizados en fase gas, (Cortés-Arriagada et al., 2013, 3578; Tolmachev et al., 2009, 164) los datos presentados en este escrito dan una buena descripción de las posibles interacciones entre adsorbato - adsorbente.
Conclusiones
En el presente artículo se evaluó la adsorción sobre carbón activado de tres neonicotinoides importantes en la industria de pesticidas; Acetamiprid, Tiacloprid y Tiametoxam. Ocho conformaciones fueron evaluadas, de las cuales 4 están dispuestas en la sección cóncava del modelo tipo fullereno y 4 en la región convexa. Las energías de adsorción para los modelos siguen el siguiente orden C45H15··Acetamiprid > C45 H15·· Tiametoxam > C45H15 Tiacloprid. De los resultados obtenidos en este reporte, se rescata que el Acetamiprid es el insecticida que más afinidad tiene sobre el carbón activado, por lo que éste puede ser usado para su remoción en muestras de aguas contaminadas. El Tiacloprid, es el compuesto que muestra la energía de adsorción más baja con 10.07 kcal/mol. Evidentemente, en todos los casos la energía de interacción está mediada por fuerzas de dispersión, las cuales le dan la estabilidad a los modelos planteados en este estudio.











 nueva página del texto (beta)
nueva página del texto (beta)