Introducción
Lisianthus [Eustoma grandiflorum (Raf.) Shin.] es un cultivo relativamente nuevo en el mercado internacional, que se ha ubicado rápidamente entre las principales flores de corte (Fernández-Pavía y Trejo-Téllez, 2018), debido a su belleza y gran variedad de colores (Castillo-González et al., 2017). Esta importancia contrasta con la baja producción en México, de donde es originario (López-Guerrero et al., 2020), ya que sólo se cultivan cerca de 4 ha a nivel nacional en lugares como Arteaga, Coahuila, Zacatepec, Morelos, Villa Guerrero, Estado de México, Tecamachalco, Puebla y Guadalajara, Jalisco (Castillo-González et al., 2017).
En México, después del corte, las inflorescencias de lisianthus se transfieren al área de empaque, donde se eliminan las hojas basales y se seleccionan los tallos con base en su calidad, para luego colocarse en bouquets o arreglos florales y finalmente en agua, para su posterior transporte y venta (Pérez-Arias et al., 2014). En estas condiciones, la vida poscosecha promedio de las flores varía entre 9.8 y 16.2 días (Clark et al., 2010).
Algunas sales como las de aluminio, boro, cobalto, calcio, cobre, níquel, plata o zinc, aplicadas en solución en concentraciones apropiadas, se han utilizado para mejorar la vida y la calidad postcosecha de varias flores de corte (Arief et al., 2016). El calcio funciona como mejorador del estado hídrico de las flores, mantiene la integridad de la membrana, la estructura de la pared celular y actúa como segundo mensajero en la célula (Arief et al., 2016; Marschner, 2012); aplicado en solución pulso, aumenta la vida y calidad poscosecha de crisantemo (Souri et al. 2018). El cobalto favorece el consumo de agua, mantiene el balance hídrico, retrasa la pérdida de peso fresco y reduce la producción y la sensibilidad al etileno (Arief et al., 2016); su aplicación mejora la vida poscosecha de lilium y gladiola (Mandujano-Piña et al., 2012; Trejo-Téllez et al., 2014). El catión Al3+, por su parte, inhibe la transpiración en las hojas y muestra actividad antimicrobiana al acidificar la solución de florero (Damunupola y Joyce, 2008). El boro, aplicado en solución pulso a crisantemo inhibe la producción de etileno, disminuye la tasa de respiración y mejora su vida poscosecha (Serrano et al., 2001). Finalmente, el níquel incrementa la conductancia de agua en el tallo de Phalaenopsis (Arief et al., 2016) y actúa como germicida e inhibidor de la biosíntesis de etileno (Halevy y Mayak, 1981).
De acuerdo con Shimizu-Yumoto e Ichimura (2010), la producción de etileno y la aplicación de soluciones pulso son aspectos importantes a considerar en el manejo poscosecha de esta especie. Con la finalidad de incrementar su vida poscosecha, se han aplicado soluciones pulso o de florero conteniendo benciladenina y sacarosa (Huang y Chen, 2002), ácido peroxiacético (de la Riva et al., 2009), ácido naftalenacético y aminoetoxivinil glicina (Shimizu-Yumoto e Ichimura, 2010), glucosa y fructosa (Chuang y Chang, 2013), calcio quelatado con aminoácidos (Saeedi et al., 2015), nanopartículas de óxido de zinc y óxido de zinc/grafeno (Soriano-Melgar et al., 2018) y oligosacarinas (López-Guerrero et al., 2020); sin embargo, no se ha evaluado todavía el efecto de soluciones minerales en las relaciones hídricas y fisiología de estas flores. El objetivo del presente estudio fue determinar el efecto de algunos minerales en el consumo de agua, el peso fresco relativo y la respiración de dos variedades de lisianthus, con el fin de contribuir al desarrollo de nuevas tecnologías de manejo poscosecha para esta especie.
Materiales y métodos
El estudio se realizó en el Laboratorio de Producción Agrícola, Campo Experimental de la Facultad de Ciencias Agropecuarias, Universidad Autónoma del Estado de Morelos. Se utilizaron inflorescencias de lisianthus ABC Blue Rim y Mariachi Carmine germinadas de la empresa Plántulas de Tetela S. A. de C. V. Estos cultivares producen tallos de 76 a 114 cm de longitud, flores dobles, de color uniforme, poco propensas al arrosetamiento, de gran vigor y un periodo de crecimiento de 13 a 16 semanas. Las inflorescencias, cultivadas en suelo con cubierta plástica (Pérez-Arias et al., 2014), se cosecharon entre las 7:00 y 8:00 a.m., con un 100 % de apertura en las dos primeras flores basales y se trasladaron en agua destilada al laboratorio. Los tallos se recortaron a una altura de 45 cm, se eliminaron las hojas basales de los primeros 20 cm, se seleccionaron por ausencia de daños y se colocaron por 12 h en las soluciones de los minerales a evaluar o agua destilada en el caso del control (Cuadro 1). Se contó con ocho repeticiones por tratamiento, dos tallos florales por repetición y el diseño experimental fue completamente al azar.
Cuadro 1 Soluciones de minerales evaluadas en dos variedades de lisianthus.
| Solución mineral | Concentración |
| Nitrato de Calcio | 0.1 % |
| Cloruro de Cobalto | 0.2 mM |
| Sulfato de Aluminio | 100 mg L-1 |
| Ácido Bórico | 100 mg L-1 |
| Cloruro de Níquel | 0.5 mM |
| Agua | Control |
Las flores se mantuvieron en agua destilada en una cámara de crecimiento a 20 °C, humedad relativa del 80 % e intensidad luminosa de 120 μm m-2 s-1, simulando la vida en florero con 12 h de oscuridad y 12 h de luz de día.
El volumen de agua consumido se cuantificó colocando cada inflorescencia en 250 mL de agua destilada y midiendo al tercer día el volumen de agua remanente, después de lo cual se renovó el agua completamente. El peso fresco relativo se obtuvo pesando cada inflorescencia al inicio y cada tercer día durante su vida útil, con una balanza digital (Ohaus®, Parsippany, New Jersey, EUA); el resultado se expresó como el porcentaje de cambio en peso con respecto al peso inicial.
La velocidad de respiración en mL de CO2 kg-1 h-1 se determinó colocando las flores pesadas dentro de un recipiente hermético de volumen conocido durante 1 h; posteriormente, se extrajo del espacio de cabeza 1 mL del gas con ayuda de una jeringa y se inyectó en un cromatógrafo de gases Agilent (Agilent Technologies®, Santa Clara, California, EUA). Las temperaturas del inyector, horno y detector de conductividad térmica fueron 150, 80 y 170 °C, respectivamente; el nitrógeno fue utilizado como gas de arrastre. Para la cuantificación del CO2 en las muestras se usó el método de calibración absoluta utilizando un estándar Praxair® a 460 mg L-1 de CO2. Los datos se sometieron a análisis de varianza y comparación de medias por la prueba de Tukey (P ≤ 0.05).
Resultados y discusión
El consumo de agua de las flores de lisianthus ABC Blue Rim y Mariachi Carmine disminuyó constantemente durante el periodo de evaluación en todos los tratamientos (Figuras 1 A y B). De acuerdo con Arief (2016), esta disminución se debe a una reducción de la conductividad del tallo ocasionada por oclusión, cavitación, lignificación o por la presencia de algunas macromoléculas en la solución. En las flores de ABC Blue Rim el consumo de agua fluctuó de 28 a 42, 12 a 21 y 5 a 10 mL por tallo a los 3, 5 y 11 días, respectivamente, sin que se detectaran diferencias significativas (P > 0.05) entre tratamientos (Figura 1 A). En Mariachi Carmine, las flores tratadas con cloruro de níquel mostraron el mayor consumo de agua (57 mL por tallo) en el día 3, mientras que las sometidas a los tratamientos restantes consumieron sólo entre 27 y 38 mL por tallo (Figura 1 B). En el día 5, el consumo de agua en las flores tratadas con nitrato de calcio, sulfato de aluminio y cloruro de níquel varió entre 25 y 31 mL por tallo, en tanto que las flores de los demás tratamientos absorbieron sólo entre 13 y 22 mL por tallo (Figura 1 B). En los días posteriores, el consumo de agua promedio de las flores sometidas a estos tres tratamientos fue significativamente mayor (P ≤ 0.05) al resto de los tratamientos, siendo este aumento más evidente con el nitrato de calcio (Figura 1 B).

Figura 1 Consumo de agua de flores de lisianthus ABC Blue Rim (A) y Mariachi Carmine (B) tratadas con diferentes minerales. Cada punto representa la media de ocho observaciones y su error estándar. Medias con letras iguales no son estadísticamente diferentes (Tukey, P ≤ 0.05). DSH: 7.62 (A) y 7.37 (B).
Similarmente, Liao et al. (2001) reportaron un mayor consumo de agua en flores de lisianthus HeiHou tratadas con sulfato de aluminio (150 mg L-1), consumo que se mantuvo elevado hasta por 15 días. Este efecto positivo se adjudicó a la capacidad germicida del sulfato de aluminio, que evitó el bloqueo por bacterias de los haces vasculares. Por otra parte, Souri et al. (2018) encontraron que el nitrato de calcio (100 y 500 mg L-1), aplicado como solución pulso, incrementó el consumo de agua. En este caso, el efecto se atribuye al catión calcio que retrasa la pérdida de permeabilidad de la membrana plasmática, manteniendo por más tiempo su integridad y funcionalidad; además, Van Doorn (2012) indicó que el calcio favorece el consumo de agua en flores de corte, debido a la mayor facilidad de expansión y contracción de las pectinas y de los compuestos polihidroxilados de la pared celular como la lignina. En cuanto al cloruro de níquel, su efecto positivo probablemente obedece a su acción germicida; de hecho, se le utiliza para evitar el taponamiento del xilema de los tallos florales por crecimiento bacteriano (Khuraijam et al., 2017).
En general, el peso fresco relativo (PFR) de los tallos florales de ABC Blue Rim fue significativamente mayor (P ≤ 0.05) con sulfato de aluminio y cloruro de níquel que con agua (control) (Figura 2 A). Al cabo de 3 días, el PFR aumentó en promedio 105 % en todos los tratamientos, y de los 5 a los 9 días sólo en las flores tratadas con sulfato de aluminio y en el caso de los tratamientos con cloruro de níquel, ácido bórico y nitrato de calcio éste se mantuvo constante (102 % en promedio), mientras que en las tratadas con cloruro de cobalto se redujo (Figura 2 A). En cuanto a las flores control, su PFR se redujo después del día 3, mostrando valores promedio menores a 100 % y cercanos a 80 % a los 5 y 9 días de evaluación, respectivamente (Figura 2 A).
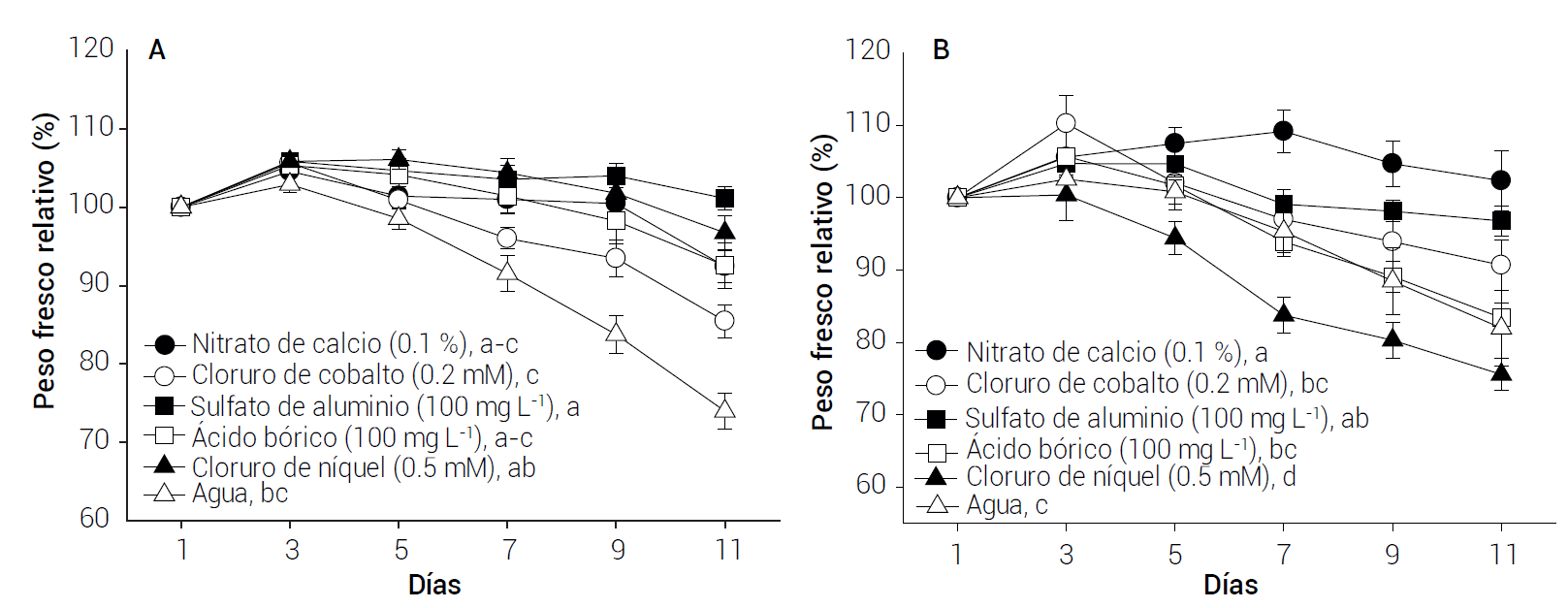
Figura 2 Peso fresco relativo de flores de lisianthus ABC Blue Rim (A) y Mariachi Carmine (B) tratadas con diferentes minerales. Medias con letras iguales no son estadísticamente diferentes (Tukey, P ≤ 0.05). Cada punto representa la media de ocho observaciones y su error estándar. DSH: 3.84 (A) y 5.63 (B).
En Mariachi Carmine el PFR promedio fue significativamente mayor en las flores tratadas con nitrato de calcio, sulfato de aluminio y cloruro de cobalto (P ≤ 0.05), manteniéndose de 97 a 110 % y 91 a 102 % al cabo de 7 y 11 días, respectivamente (Figura 2 B). Las flores control y las tratadas con ácido bórico mostraron valores menores de PFR (90 y 81-83 % después de 7 y 11 días, respectivamente) y las tratadas con cloruro de níquel presentaron los valores más bajos (83 y 76 % después de 7 y 11 días, respectivamente).
La vida poscosecha de lisianthus se puede alargar con tratamientos que incrementen el contenido de agua en los tallos florales (Alves et al., 2015), por lo que la evaluación del peso fresco en postcosecha es un buen indicador de la duración de las flores (Kamiab et al., 2017). La aplicación de sulfato de aluminio ayudó a mantener el PFR en ambas variedades de lisianthus, debido a su acción genérica como germicida, en tanto que el cloruro de níquel y el nitrato de calcio parecen tener actividades más específicas, pues favorecieron un mayor PFR sólo en los cultivares ABC Blue Rim y Mariachi Carmine, respectivamente. En cualquiera de estos casos, la mayor duración de las flores está asociada con valores de PFR más altos.
En cuanto a la respiración, la velocidad inicial promedio de las flores ABC Blue Rim en todos los tratamientos fue de 109 mL CO2 kg-1 h-1, pero después de 3 días disminuyó significativamente a 21-33 mL CO2 kg-1 h-1 en las flores tratadas con cloruro de cobalto, nitrato de calcio y sulfato de aluminio y a sólo 58-67 mL CO2 kg-1 h-1 en las control y en las tratadas con cloruro de níquel y ácido bórico (Figura 3 A). Posteriormente, la respiración se incrementó significativamente en las flores de estos tres últimos tratamientos, con máximos de entre 121 y 244 mL CO2 kg-1 h-1 a los 9 días, en tanto que en las flores tratadas con nitrato de calcio, sulfato de aluminio y cloruro de cobalto también se incrementó la respiración, pero el máximo fue significativamente menor, de sólo 64-79 mL CO2 kg-1 h-1 (Figura 3 A).
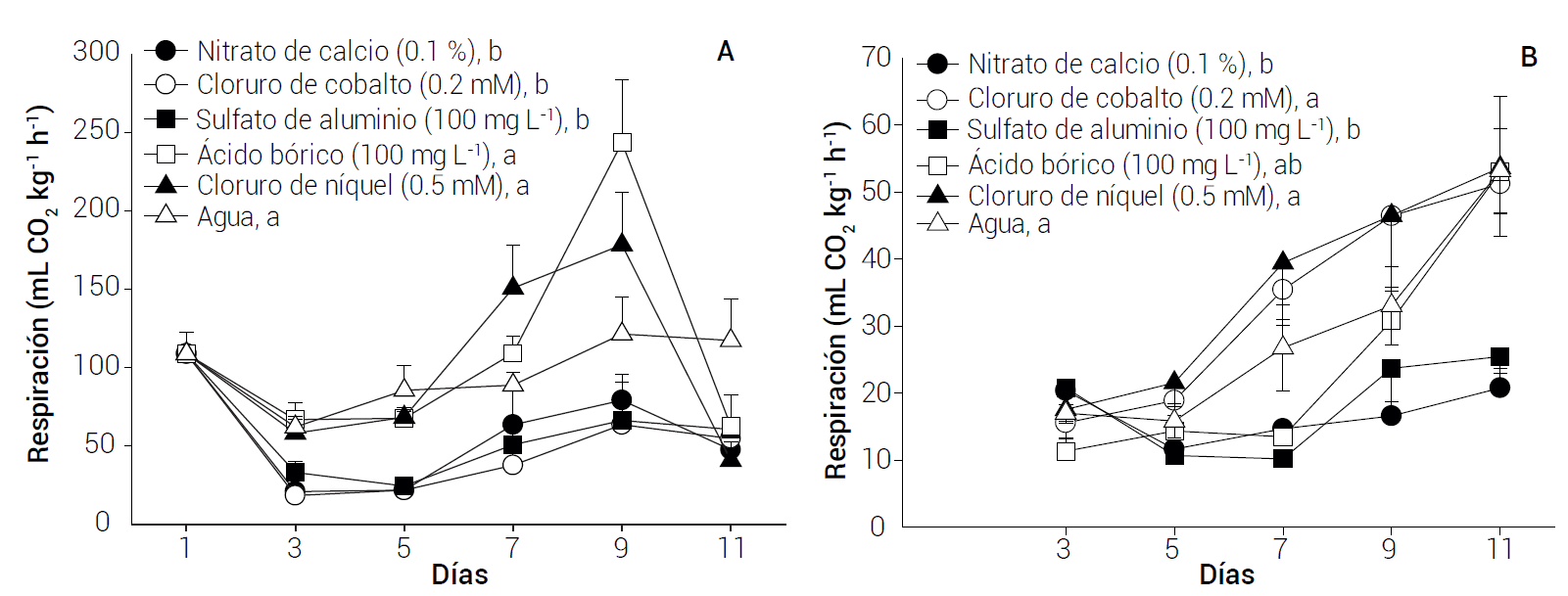
Figura 3 Velocidad de respiración de flores de lisianthus ABC Blue Rim (A) y Mariachi Carmine (B) tratadas con diferentes minerales. Medias con letras iguales no son estadísticamente diferentes (Tukey, P ≤ 0.05). Cada punto representa la media de ocho observaciones y su error estándar. DSH: 36.44 (A) y 34.25 (B).
En las flores Mariachi Carmine la respiración al tercer día de evaluación fluctuó entre 11 y 20 mL CO2 kg-1 h-1 (Figura 3 B). Posteriormente, de manera similar a lo ocurrido en el cultivar ABC Blue Rim, la respiración de las flores control y de las tratadas con cloruro de níquel y ácido bórico se incrementó constantemente hasta alcanzar un máximo de 51-52 mL CO2 kg-1 h-1 a los 11 días. Finalmente, en las flores tratadas con nitrato de calcio y sulfato de aluminio, el máximo también ocurrió a los 11 días, pero los valores fueron significativamente (P ≤ 0.05) menores (21 y 26 mL CO2 kg-1 h-1; Figura 3 B).
Los datos anteriores indican que el sulfato de aluminio y el nitrato de calcio redujeron la velocidad de respiración en las flores de los dos cultivares. La respiración, al igual que el PFR, es un buen indicador de la vida útil de las flores, pero en este caso una velocidad alta ocasiona una rápida disminución de la calidad y vida poscosecha del producto, debido a que los sustratos disponibles para generar energía se consumen más rápidamente (Saltveit, 2016). El efecto reportado para el sulfato de aluminio en el incremento de la vida poscosecha de flores de corte se debe parcialmente a su efecto como germicida y en mayor proporción como inhibidor de la transpiración (Damunupola y Joyce, 2008). El efecto del nitrato de calcio se atribuye al calcio que libera en la solución y que es absorbido por los tallos florales, retrasando el deterioro de las membranas y paredes celulares (Sairam et al., 2011); sin embargo, es necesario realizar más estudios para esclarecer el efecto o la participación de este catión en el proceso respiratorio.
En conclusión, la aplicación de sulfato de aluminio y nitrato de calcio mejoraron el consumo de agua y mantuvieron el peso fresco relativo de los tallos florales; además, redujeron la tasa de respiración. Por lo tanto, estas sales pueden usarse en formulaciones para extender la vida en florero de lisianthus, contribuyendo así al desarrollo de nuevas técnicas de manejo para la conservación de esta especie.











 nueva página del texto (beta)
nueva página del texto (beta)


