INTRODUCCIÓN
Las preparaciones de inmunoglobulina G humana disponibles com8ercialmente se obtienen de muestras de plasma de más de 1000 donadores de sangre. Esas preparaciones contienen entre 95 y 98% de moléculas de IgG monoméricas y elementos traza de IgA, IgM, entre otras proteínas plasmáticas.1
La IgG fue administrada por primera vez con fines terapéuticos por vía subcutánea en un paciente con agammaglobulinemia e infecciones de repetición, en quien se demostró su efectividad como tratamiento de reemplazo.2 Años después, con los adelantos en los métodos para fraccionar el plasma y purificar la IgG, se obtuvieron las primeras preparaciones disponibles para administración por vía intravenosa.1 En 1981 se publicó un estudio de 7 pacientes con púrpura trombocitopénica crónica y 6 con púrpura trombocitopénica idiopática aguda, en quienes se incrementaron sus concentraciones de plaquetas después del tratamiento con dosis altas de IgG por vía intravenosa y de esta forma se abrió la posibilidad de prescribirla para el tratamiento de afecciones autoinmunitarias e inflamatorias.3
Después del desarrollo inicial del método de fraccionamiento de plasma humano, por el profesor Edwin Cohn a principios del decenio de 1940, además de los avances científicos y tecnológicos, se han incorporado múltiples mejoras en el proceso industrial de la IgG y de esta forma han permitido obtener productos con mayor eficacia clínica, cada vez más puros, estables y seguros.4 La Figura 1 muestra los acontecimientos iniciales en la indicación de la IgG y la evolución de las formulaciones comercialmente disponibles.

Figura 1 Acontecimientos iniciales en la indicación de IgG y evolución de las formulaciones comercialmente disponibles. IGIV: IgG por vía intravenosa; IGSC: IgG por vía subcutánea.
El Consejo de Salubridad General, dependiente de la Secretaría de Salud de México, en su cuadro básico de medicamentos ha otorgado diversas claves para el registro de preparaciones de IgG para su administración por vía intravenosa (5 y 10%) y subcutánea (16.5 y 20%), en el tratamiento de reemplazo de pacientes con inmunodeficiencias primarias y secundarias. Además, el Consejo de Salubridad General tiene aprobada la prescripción de IgG por vía intravenosa como tratamiento de inmunomodulación en pacientes con púrpura trombocitopénica, enfermedad de Kawasaki, síndrome de Guillain-Barré y polineuropatía desmielinizante inflamatoria crónica.5
La Agencia Reguladora de Medicamentos y Alimentos de Estados Unidos (Food and Drug Administration [FDA]) aprobó la prescripción de IgG por vía intravenosa para el tratamiento de inmunodeficiencias primarias, púrpura trombocitopénica autoinmunitaria, enfermedad de Kawasaki, trasplante de células progenitoras hematopoyéticas, leucemia linfocítica crónica de células B, enfermedad por virus de inmunodeficiencia humana en niños, neuropatía motora multifocal y polineuropatía inflamatoria desmielinizante crónica. Incluso aprobó la indicación de IgG por vía subcutánea en el tratamiento de inmunodeficiencias primarias humorales en niños y adultos y desde el año 2014 certificó la administración por vía subcutánea con hialuronidasa humana recombinante (rhH) para el tratamiento de inmunodeficiencias primarias humorales en adultos.6
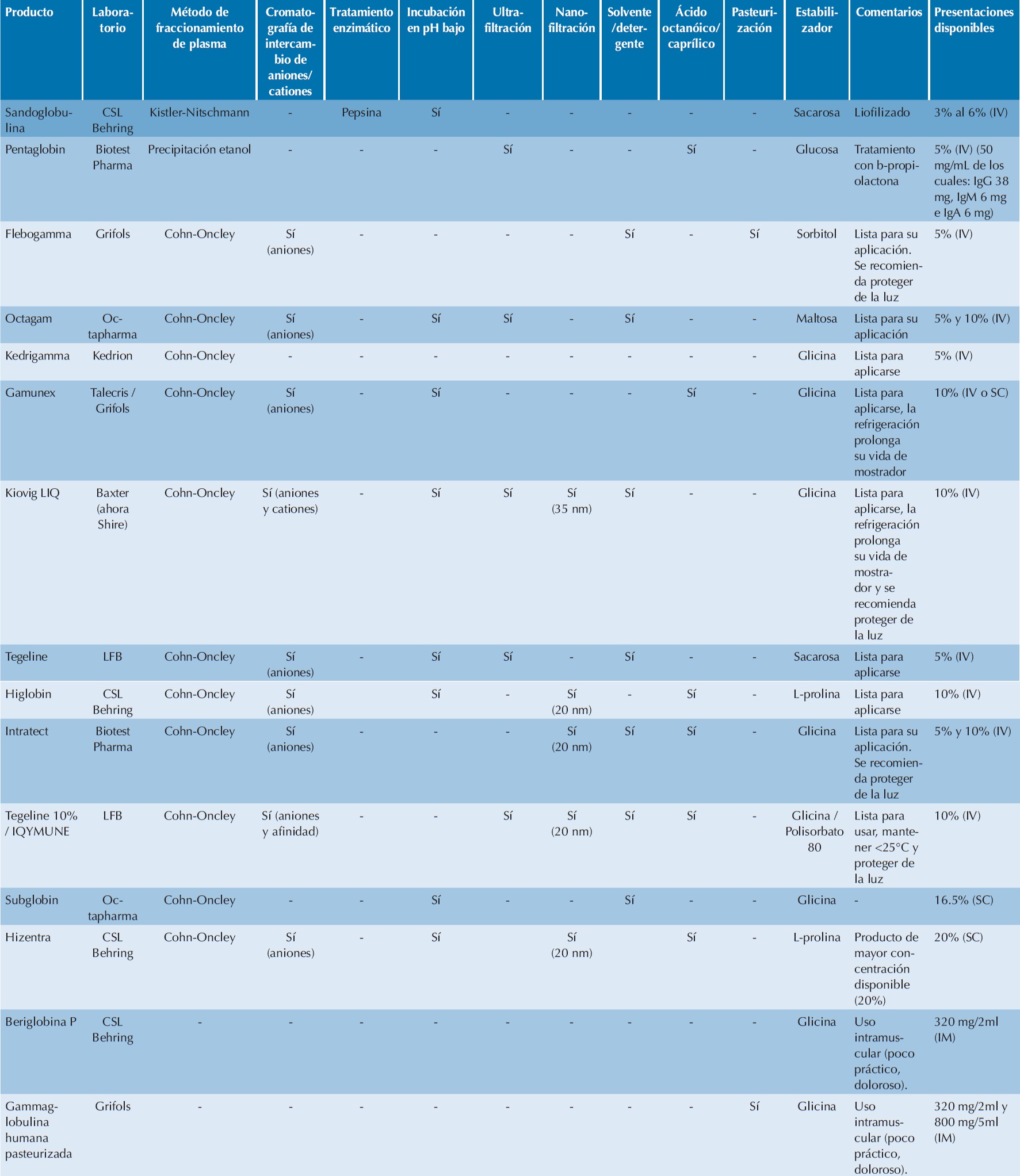
En el Cuadro 1 se muestran los productos de IgG aprobados por la COFEPRIS y sus características más importantes.
Aunque en la actualidad la IgG se prescribe para el tratamiento de diversos padecimientos inflamatorios y autoinmunitarios, en prácticamente todas las especialidades de la medicina no existe evidencia sólida que respalde de su eficacia. Por lo general, su indicación se establece con base en el conocimiento de inmunología básica y fisiopatología de las enfermedades autoinmunitarias, además de las dosis altas de IgG en diferentes receptores y células que generan un efecto “regulador”, evaluadas en series o reportes de casos clínicos relacionados con sus beneficio. Esto obedece a que representan padecimientos de muy baja prevalencia, lo que hace sumamente difícil contar con ensayos clínicos controlados.
El objetivo de este estudio fue elaborar o emitir un consenso mexicano para la prescripción de inmunoglobulina G humana como tratamiento de reemplazo e inmunomodulación, con un enfoque de medicina basada en evidencias. Este documento pretende guiar al clínico en la toma de decisiones y orientar a las autoridades sanitarias para entender mejor la función de las preparaciones de IgG en el contexto actual de las instituciones de salud.
MATERIALES Y MÉTODOS
Se integró un grupo multidisciplinario de especialistas en diversos campos de la medicina en México (hematología, infectología, inmunología clínica, neonatología, neurología y reumatología), con la finalidad de emitir un consenso en la prescripción de inmunoglobulina G humana. Se realizó la búsqueda de revisiones sistemáticas en las bases de datos: MEDLINE, EMBASE, BVS-LILACS, NGS, NICE, CENETEC, Imbiomed, TripDatabase y Medigraphic. Para el análisis de los datos se utilizaron algoritmos de búsqueda con términos (Medical Subject Headings, MeSH) o Descriptores en Ciencias de la Salud (DeCS) específicos para cada enfermedad clínica, con la intención de identificar guías de práctica clínica y otros tipos de guías, artículos de revisión sistemáticos, metanálisis, ensayos clínicos aleatorizados, casos clínicos, estudios descriptivos u observacionales y evaluaciones de costo-beneficio. Solo se incluyeron publicaciones en idioma español e inglés, de 1980 a la fecha. Para el estudio de la evidencia se organizaron ocho grupos de trabajo, según el campo de conocimiento y experiencia de los especialistas (inmunodeficiencias primarias y secundarias; enfermedades hematológicas, neurológicas e infecciosas; alteraciones neonatales, indicaciones relacionadas con trasplante e indicaciones misceláneas) y de esta manera formularon preguntas clínicas con el constructo PICO, por su acrónimo en inglés: Patients (pacientes o población), Intervention (intervención de interés), Comparison (comparación con otra intervención) y Outcome (desenlace de interés).7 Cada grupo de trabajo realizó un análisis crítico y sistematizado de la calidad de la evidencia clínica disponible para las diferentes indicaciones de la IgG. Después de discutir las evidencias correspondientes y responder las preguntas formuladas, se redactó un documento con declaraciones específicas por indicación y calidad de su evidencia, de acuerdo con el sistema GRADE (Grading of Recommendations Assessment, Development, and Evaluation),8 que evalúa la calidad de la evidencia y la define como “alta” cuando es poco probable que investigaciones futuras cambien la estimación del efecto; “moderadamente alta” cuando al realizar investigaciones adicionales repercuta en un cambio relacionado con algún efecto estimado; “baja” cuando es probable que cambie la percepción del efecto al realizar más investigaciones y “muy baja” cuando cualquier estimación del efecto es incierta. El sistema GRADE también califica el nivel de evidencia en A, B, C y D para calidad alta, moderada, baja y muy baja, respectivamente. La fuerza o grado de recomendación se califica de manera binaria como: 1 para recomendación fuerte a favor de la intervención y 2 para débil a favor de la intervención; 2 para débil en contra de la intervención y 1 para fuerte en contra de la intervención (Cuadro 2).9
Cuadro 2 Niveles de evidencia y fuerza de recomendación
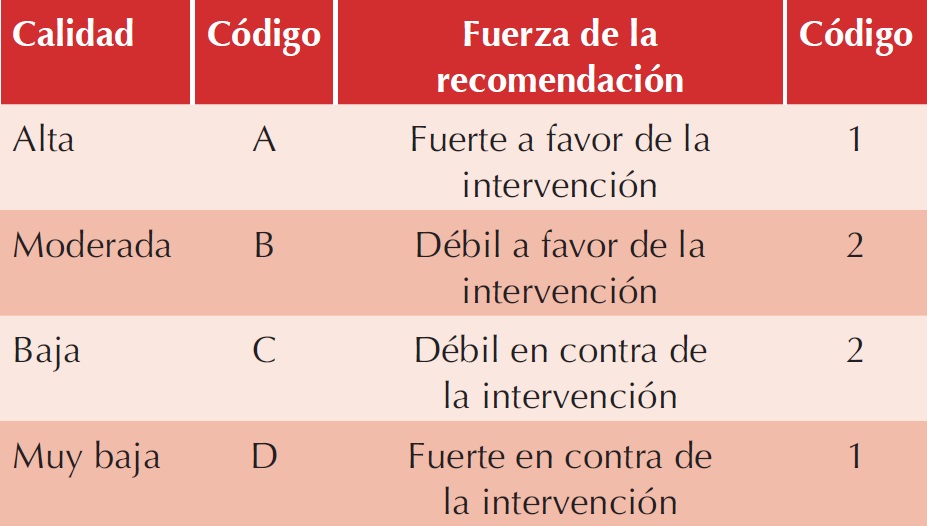
Adaptado de Oñate-Ocaña LF, Ochoa-Carrillo FJ. Sistema GRADE para clasificar nivel de evidencia y grado de las recomendaciones para la elaboración de guías de buena práctica clínica. Cir Ciruj 2009;77:417-419.
En la reunión presencial final y de manera plenaria se discutieron temas de controversia y se conformaron las recomendaciones finales en dos formatos: un documento que explica las recomendaciones y un cuadro de síntesis de las mismas (Cuadro 3). Las guías se sometieron a validación externa por los principales representantes de las academias y los colegios de las áreas de conocimiento incluidas.
Cuadro 3 Nivel de evidencia y fuerza de recomendación por afección y condición clínica (continúa en la siguiente página)

WHIM: Verrugas, hipogammaglobulinemia, infecciones de repetición y mielocatexis por sus siglas en inglés. EBV: virus Epstein-Barr; TCPH: trasplante de células progenitoras hematopoyéticas; LLC: leucemia linfocítica crónica. TOS: trasplante de órgano sólido. PB19: Parvovirus B19
TRATAMIENTO DE REEMPLAZO
El tratamiento de reemplazo con IgG proporciona anticuerpos como moléculas monoméricas policlonales, poliespecíficas con un perfil fisiológico de subclases (IgG1-4) y con actividad biológica completa de sus regiones Fab (fracción de unión al antígeno o antigen-binding fraction) y Fc (fracción cristalizable), para permitir la unión con el antígeno, neutralización de toxinas, opsonización, facilitación de fagocitosis, activación de inmunorreceptores en neutrófilos y macrófagos, y activación del complemento. El tratamiento de reemplazo tiene como objetivo bioquímico normalizar las concentraciones séricas de IgG y clínico de disminuir la frecuencia y gravedad de los procesos infecciosos. La FDA define como “eficaz” al producto capaz disminuir el número de infecciones bacterianas graves a menos de 1 evento por año-paciente.10
R. La administración de IgG como tratamiento de reemplazo en pacientes con inmunodeficiencias primarias puede administrase por vía intravenosa o subcutánea, pues su eficacia es comparable/similar (GRADE B1).11-17
R. La administración de IgG como tratamiento de reemplazo consiste en dosis de 400-600 mg/kg por vía intravenosa cada 3 a 4 semanas (GRADE B1) o 100-150 mg/kg por vía subcutánea por semana, incluso de 200-300 mg/kg cada 2 semanas (GRADE B1).11-17
R. No existen diferencias significativas en la eficacia de diversas formulaciones de IgG disponibles comercialmente para su aplicación intravenosa o subcutánea (GRADE B1).18
El tratamiento de reemplazo puede ser una estrategia permanente o temporal, según su indicación en cada paciente.
R. El tratamiento de reemplazo con IgG de manera temporal está indicado por un período de 12 a 24 meses. Posteriormente se suspende su aplicación y se lleva a cabo la reevaluación del estado clínico del paciente y de la respuesta inmunitaria contra antígenos proteínicos, polisacáridos, o ambos, después de tres meses de la última dosis de IgG (GRADE D2).11,19-21
R. Antes de iniciar la administración de IgG debe establecerse el diagnóstico de inmunodeficiencia primaria, con la finalidad de justificar su indicación, además de la evaluación adicional por estudios de laboratorio como: biometría hemática completa, determinación de creatinina y pruebas de función hepática (GRADE D1).20,22-24
R. Los pacientes con inmunodeficiencia primaria en tratamiento de reemplazo con IgG deben evaluarse cada 3 a 6 meses, con énfasis en la frecuencia, tipo de infecciones y concentraciones séricas de IgG preinfusión. Los estudios adicionales deben individualizarse (GRADE D2).20,23,24
R. Los principales objetivos del tratamiento de reemplazo con IgG consisten en reducir la frecuencia y gravedad de las infecciones, prevenir el daño en órganos afectados y normalizar las concentraciones de IgG sérica conforme a la edad del paciente (GRADE D2).20,22,25
INMUNODEFICIENCIAS PRIMARIAS Y SECUNDARIAS
Inmunodeficiencias primarias
Las inmunodeficiencias primarias incluyen más de 350 enfermedades hereditarias, principalmente causadas por defectos monogénicos que afectan el desarrollo, la función del sistema inmunológico, o ambos, y confirieren susceptibilidad a infecciones, inflamación, autoinmunidad y cáncer.26 Aproximadamente 85% de las inmunodeficiencias afectan el sistema inmunitario adaptativo humoral sin o con producción deficiente de anticuerpos.27 El tratamiento de reemplazo con IgG por vía intravenosa o subcutánea ha demostrado eficacia y seguridad, por lo que representa el protocolo de primera línea para diversas inmunodeficiencias primarias.28
Los principales tipos de inmunodeficiencias primarias relacionados con la prescripción de IgG incluyen:
a) Inmunodeficiencia con defecto primario de linfocitos B: agammaglobulinemia ligada al cromosoma X, agammaglobulinemias autosómicas recesivas, inmunodeficiencia común variable, defectos en el cambio de isotipo o de hipermutación somática, e hipogammaglobulinemia transitoria de la infancia. En este tipo de inmunodeficiencias existe nula o deficiente producción de anticuerpos, lo que provoca hipogammaglobulinemia (valor sérico ≤ 500 mg/dL en adultos o dos desviaciones estándar por debajo de los valores normales para la edad en niños y adultos) o agammaglobulinemia (ausencia de inmunoglobulinas séricas).26
La Academia Americana de Alergia, Asma e Inmunología (AAAAI) y la Sociedad Europea de Inmunodeficiencias (ESID, por sus siglas en inglés) consideran que la IgG beneficia, definitivamente, a este tipo de pacientes, por lo que el tratamiento debe iniciar al momento de establecer el diagnóstico.29-33 El tratamiento de reemplazo con IgG disminuye la frecuencia y gravedad de las infecciones.34 Existe una correlación positiva entre la dosis de IgG administrada y la concentración de IgG sérica en los pacientes tratados por vía intravenosa y subcutánea.14 También se ha demostrado una correlación inversamente proporcional entre las concentraciones séricas de IgG y la frecuencia y gravedad de procesos infecciosos en estos pacientes.25
El tratamiento de reemplazo con IgG no muestra beneficio en la incidencia de malignidad o autoinmunidad.
R. Los pacientes con agammaglobulinemia deben recibir tratamiento de reemplazo con IgG de forma regular y no interrumpirlo desde el momento en que se establece el diagnóstico (GRADE B1).25,28
R. Las inmunodeficiencias con defectos primarios de células B deben tratarse con dosis de 400-600 mg/kg de IgG por vía intravenosa cada 3 a 4 semanas (GRADE B1)22,35-37o con dosis de 100 a 150 mg/kg por vía subcutánea por semana, incluso 200 a 300 mg/kg cada 2 semanas (GRADE B1).14,16,38,39
R. La misma dosis mensual de IgG administrada por vía intravenosa puede aplicarse por vía subcutánea (GRADE B1).40
R. Las dosis de IgG por vía intravenosa o subcutánea deben ajustarse de acuerdo con el grado de hipogammaglobulinemia, gravedad de las infecciones y daño a órganos afectados (GRADE B1).22,35-37
R. La primera infusión de IgG intravenosa en pacientes con agamma-hipogammaglobulinemia que no han recibido tratamiento debe administrarse a una velocidad de 0.5 a 1 mg/kg por minuto. Después de 15 minutos se incrementará la velocidad de 1.5 a 2.5 mg/kg por minuto. El aumento debe ser continuo, según la tolerancia, hasta alcanzar 4 mg/kg por minuto (GRADE B1).22,38,41
R. El tratamiento de reemplazo con IgG por vía subcutánea debe iniciar a una velocidad de infusión de 1-2 mL/min (60-120 mL/h), con volumen máximo por sitio de 20-30 mL. Incluso pueden utilizarse, al mismo tiempo, múltiples sitios de infusión (GRADE C2).14,6,38
R. Los pacientes con inmunodeficiencia común variable deben recibir tratamiento de reemplazo con IgG desde el momento del diagnóstico, independientemente del antecedente de infecciones graves, recurrentes, o ambas. Es importante comprobar la producción deficiente de anticuerpos específicos antes iniciar el tratamiento con IgG (GRADE B1).11,22,42-48
R. Los pacientes con defectos en el cambio de isotipo o con defectos en la hipermutación somática deben recibir tratamiento de reemplazo con IgG (GRADE C1).22
R. En los pacientes con hipogammaglobulinemia transitoria de la infancia, con infecciones graves o procesos infecciosos febriles de difícil control (algunos autores consideran más de seis episodios al año), debe administrarse IgG. En estos pacientes debe reevaluarse su estado inmunológico luego de 6 y 12 meses postratamiento (GRADE C2).19,22,28,49-51
b) Inmunodeficiencias primarias con concentraciones normales de IgG total, pero con alteración significativa de la producción de anticuerpos específicos: inmunodeficiencia selectiva de anticuerpos contra antígenos polisacáridos, inmunodeficiencia por defecto de subclases de IgG, deficiencia de IgA relacionada con deficiencia de IgG2/IgG3 o con deficiencia selectiva de anticuerpos. Los pacientes con este tipo de inmunodeficiencias reportan concentraciones normales de IgG total; sin embargo, se encuentra disminuida la concentración sérica de algunas subclases de IgG, de IgA o IgG contra antígenos polisacáridos incluidos en la vacuna contra neumococo (conjugada hepta-, deca- o tridecavalente o no conjugada de 23 serotipos), lo que representa un factor de riesgo para infecciones frecuentes y graves.
R. Los pacientes con inmunodeficiencia selectiva de anticuerpos, con evidencia de infecciones recurrentes como: sinusitis, otitis media con alto riesgo de pérdida auditiva, neumonías, bronquiectasias, requerimiento de antibióticos por vía intravenosa o hipersensibilidad múltiple a los antibióticos que interfiere con los tratamientos deben recibir tratamiento de reemplazo con IgG (GRADE C2).11,20,22,50-52
R. Los pacientes con inmunodeficiencia específica de subclases IgG3, IgG4 e IgG2 deben recibir tratamiento de reemplazo con IgG solamente cuando la deficiencia se asocia con algún defecto específico de anticuerpos contra polisacáridos y quienes manifiestan infecciones recurrentes, graves, o ambas, como las que se refieren en el defecto específico de producción de anticuerpos contra polisacáridos (GRADE C2).11,20
R. La deficiencia selectiva de IgA no supone indicación de tratamiento de reemplazo con IgG; sin embargo, cuando se asocia con inmunodeficiencia selectiva de anticuerpos, con o sin deficiencia de IgG2, puede considerarse la administración de IgG (GRADE D2).50,53,54
c) Inmunodeficiencia con alteración significativa de la producción de anticuerpos: inmunodeficiencia combinada grave (SCID, por sus siglas en inglés), síndrome de hiper-IgE (defectos de STAT3 y de DOCK8), síndrome de Wiskott-Aldrich, síndromes linfoproliferativos con hipo- o disgammaglobulinemia, defectos en la vía del factor nuclear NF-KB, síndrome WHIM (verrugas, hipogammaglobulinemia, infecciones y mielocatexis, por sus siglas en inglés) y síndromes de hiper-IgM.
R. Los pacientes con sospecha o diagnóstico confirmado de inmunodeficiencia combinada grave, con o sin linfocitos B, deben recibir tratamiento de reemplazo con IgG de forma inmediata, y mantenerlo durante y después del trasplante de células hematopoyéticas, hasta asegurarse la reconstitución de linfocitos T y normalizar la función de los linfocitos B (GRADE B1).11,22,55),(56
R. En los pacientes con síndrome de hiper-IgE, en quienes se confirma la deficiencia de producción de anticuerpos específicos contra antígenos T-independientes, está indicado el tratamiento de reemplazo con IgG (GRADE B1).11,22,57-60
R. En los pacientes con síndrome Wiskott-Aldrich está indicado el tratamiento de reemplazo con IgG, pues supone una inmunodeficiencia típicamente asociada con producción inadecuada de anticuerpos específicos (se considera una inmunodeficiencia combinada). El tratamiento debe mantenerse hasta que el paciente reciba un trasplante de células hematopoyéticas y se compruebe la reconstitución de la función de las células T y B. En estos pacientes, la prescripción de IgG ha disminuido la incidencia de infecciones (GRADE B1).11,22,61,62
R. En los pacientes con síndrome linfoproliferativo autoinmunitario con hipogammaglobulinemia, disgammaglobulinemia, o ambas, e infecciones, está indicado el tratamiento con IgG (GRADE B1).11,63,64
R. Los pacientes con defectos en la vía del factor de transcripción NF-_B con inmunodeficiencia deben recibir tratamiento de reemplazo con IgG (GRADE B2). Los pacientes con este tipo de inmunodeficiencia muestran elevada susceptibilidad para infecciones por neumococo y deficiente respuesta contra antígenos de polisacáridos.11,65,66
R. En los pacientes con síndrome WHIM (verrugas, hipogammaglobulinemia, infecciones y mielocatexis) está indicado el tratamiento de reemplazo con IgG (GRADE B1).11,22,67
R. Los pacientes con síndrome de hiper-IgM deben recibir tratamiento de reemplazo con IgG (GRADE C1).22
Recomendaciones adicionales para el tratamiento de inmunodeficiencias primarias
R. Los pacientes que reciben tratamiento de reemplazo con IgG por inmunodeficiencias primarias deben someterse al ajuste de dosis en caso de persistir con infecciones (más de tres infecciones moderadas al año), falla de medro o elevada pérdida de proteínas. En los pacientes con daño pulmonar grave (por ejemplo, bronquiectasias) debe incrementarse la dosis de IgG, con la finalidad de mantener las concentraciones séricas ≥ 800 mg/dL. Es importante ajustar la dosis en pacientes con infecciones agudas o complicaciones autoinmunitarias (GRADE C1).11,20,22,24,25,68
R. Los eventos adversos provocados por la administración de IgG por vía intravenosa suelen relacionarse con la velocidad de infusión: por lo tanto, deben ajustarse y optimizar individualmente. Se recomienda reducir la velocidad de infusión y efectuar la adecuada reconstitución del producto cuando es liofilizado, con el propósito de disminuir la formación de agregados y reducir la posibilidad de eventos adversos. Los eventos adversos sistémicos son más frecuentes en pacientes que reciben IgG por vía intravenosa y los locales en sujetos que reciben IgG por vía subcutánea (GRADE D1).12,22,36,69-71
Inmunodeficiencias secundarias
Los principales tipos de inmunodeficiencia secundaria en que se encuentra justificada la indicación de IgG son: mieloma múltiple, leucemia linfocítica crónica, enfermedades con pérdida de proteínas, hipogammaglobulinemia secundaria a medicamentos (antiepilépticos, rituximab) e infección por VIH en pacientes pediátricos.
Mieloma múltiple
R. En pacientes con mieloma múltiple, hipogammaglobulinemia (concentración de IgG menor de 500 mg/dL) e infecciones bacterianas recurrentes o graves, o deficiencia de respuesta de anticuerpos a polisacáridos comprobada, el tratamiento de reemplazo con IgG disminuye significativamente la tasa de infecciones graves (RR 0.45; IC95% 0.27-0.75) e infecciones clínicamente documentadas (RR 0.49; IC95% 0.39-0.61) sin mostrar efectos significativos en la supervivencia (RR 1.36; IC95% 0.58-3.19) (GRADE A2).20,37,72-76
Leucemia linfocítica crónica
R. Los pacientes con leucemia linfocítica crónica con hipogammaglobulinemia (IgG < 500 mg/dL) e infecciones bacterianas graves o recurrentes, aún con la prescripción profiláctica de antibióticos, se benefician del tratamiento de reemplazo con IgG y disminuye la tasa de infecciones graves (RR 0.45; IC95% 0.27-0.75) (GRADE A1), sin efecto significativo en la supervivencia (GRADE A2).74,77,78
Enfermedades con pérdida de proteínas
Se ha documentado hipogammaglobulinemia e infecciones secundarias asociadas con diversas afecciones que incrementan la pérdida de proteínas en la zona intestinal (enteropatía con pérdida de proteínas, linfangiectasias), renal (síndrome nefrótico, nefritis asociada con enfermedades autoinmunitarias), torácica (quilotórax) y la piel (quemaduras). Sin embargo, no existen estudios controlados que evalúen la eficacia de la IgG por vía intravenosa o subcutánea en estos pacientes.
R. La evidencia es contradictoria con algunos reportes de casos clínicos o estudios abiertos no controlados que reportan disminución de la tasa de infecciones con la administración de IgG por vía intravenosa o subcutánea en dosis de reemplazo y otros que no documentan beneficios. No existe suficiente evidencia que respalde la indicación de IgG en estos pacientes, por lo que se sugiere individualizar cada caso (GRADE D2).79-94
Inmunodeficiencias secundarias provocadas por la prescripción de medicamentos
Se ha descrito hipogammaglobulinemia en individuos que reciben tratamiento con antiepilépticos (valproato, carbamazepina, fenitoína, lamotrigina, entre otros).
R. El tratamiento de reemplazo con IgG está indicado en pacientes con hipogammaglobulinemia (concentración de IgG menor de 500 mg/dL) e infecciones graves o recurrentes asociadas con la prescripción de valproato, carbamazepina, fenitoína, lamotrigina, entre otros, cuando éstos no pueden sustituirse por otros fármacos o cuando la hipogammaglobulinemia persiste después de suspenderlos (GRADE D1).79,95-99
Hipogammaglobulinemia secundaria al consumo de rituximab
La prescripción cada vez más amplia de rituximab en el tratamiento de diversas afecciones neoplásicas y autoinmunitarias se relaciona con hipogammaglobulinemia grave o prolongada, especialmente cuando se indica con otros fármacos inmunosupresores.
R. El tratamiento de reemplazo con IgG está indicado en pacientes con hipogammaglobulinemia (concentración de IgG menor de 500 mg/dL) e infecciones recurrentes (GRADE C1).99-106
Infección pediátrica por virus de la inmunodeficiencia humana
R. El tratamiento de reemplazo con IgG por vía intravenosa previene infecciones bacterianas graves en pacientes con VIH e hipogammaglobulinemia (IgG < 500 mg/dL). Sin embargo, no ha demostrado disminución de la estancia hospitalaria ni de mortalidad en pacientes con infecciones bacterianas (GRADE A2).107,108
R. Debe prescribirse tratamiento de reemplazo con IgG en pacientes con VIH que cursen con infecciones bacterianas recurrentes graves sin hipogammaglobulinemia, pero con disfunción de anticuerpos comprobada mediante pruebas funcionales (GRADE 2C).109
R. En pacientes pediátricos con VIH y trombocitopenia relacionada con sangrado activo o cuenta plaquetaria menor de 10 x 109/L se recomienda la administración de IgG por vía intravenosa en dosis de 1 g/kg durante dos días (2 g/kg dosis total) (GRADE C1).110
TRATAMIENTO DE INMUNOMODULACIÓN
El efecto del tratamiento de inmunomodulación con altas dosis de IgG es poco entendido y depende, en gran parte, de la integridad de la molécula de IgG y de las interacciones de la porción Fc con diversos inmunorreceptores y otros mecanismos que permanecen como hipótesis111,112
Unión con componentes del complemento activado solubilizan complejos inmunológicos e inhiben su fusión con blancos celulares.
Bloqueo de receptores Fc e inhibición de las interacciones entre las células opsonizadas con autoanticuerpos y fagocitos.
Coexistencia de anticuerpos antiidiotipo, antirreceptores αβ de células T, anticomplejos principales de histocompatibilidad clase I, anti-CD45 (Fas) y otros autodeterminantes.
Unión de anticuerpos antiidiotipo con sus blancos que generan dimerización de inmunoglobulinas e interacciones con receptores Fc.
Incremento del catabolismo de autoanticuerpos por saturación del receptor FcRn.
Regulación a la baja en la activación de linfocitos B e interacciones entre linfocitos T y B.
Anticuerpos anticitocinas y con funciones antagonistas en receptores de citocinas.
Inducción de receptores inhibitorios FcgRIIb en macrófagos efectores (IgG sialilada).
Expansión, activación de células T reguladoras, o ambas.
Inhibición de la diferenciación y maduración de células dendríticas.
Inhibición de la activación de células endoteliales y leucocitos.
La evidencia clínica de la prescripción de IgG como tratamiento inmunomodulador se ha incrementado gradualmente y, en términos generales, los beneficios se han estudiado, observado y aceptado para su aplicación por vía intravenosa. Sin embargo, cada vez se acumula evidencia en favor de altas dosis de IgG por vía subcutánea como alternativa de inmunomodulación, principalmente en pacientes con trastornos inmunitarios como: polineuropatía inflamatoria desmielinizante crónica, neuropatía motora multifocal, síndrome de Guillain-Barré, entre otras neuropatías autoinmunitarias desmielinizantes y miopatías inflamatorias.112
ENFERMEDADES AUTOINMUNITARIAS
Púrpura trombocitopénica inmunitaria
Han pasado más de 30 años desde que se informó el primer caso de prescripción de IgG en un paciente con púrpura trombocitopénica inmunitaria. Diferentes metanálisis concluyen que la IgG es tan efectiva como los corticosteroides, con una tasa de éxito de alrededor de 80% para aumentar la concentración de plaquetas a 50,000/mm3 luego del quinto día de tratamiento.113
R. El tratamiento inmunomodulador de IgG por vía intravenosa está indicado como protocolo de primera o segunda línea en pacientes con púrpura trombocitopénica inmunitaria (GRADE A1).113,114
R. En pacientes con púrpura trombocitopénica inmunitaria recurrente la infusión repetida de IgG por vía intravenosa representa una alternativa a la esplenectomía (GRADE C2).115
R. En pacientes pediátricos con púrpura trombocitopénica inmunitaria el tratamiento inmunomodulador con IgG por vía intravenosa, en dosis de 0.8-1 g/kg, puede considerarse como protocolo de primera línea. Este tratamiento, comparado con la administración de ciclo corto de corticosteroides, incrementa rápidamente las cifras plaquetaria (GRADE B1).116,117
R. En adultos con púrpura trombocitopénica inmunitaria y con concentraciones menores de 30,000 plaquetas/mm 3 se recomienda iniciar el tratamiento inmunomodulador con IgG por vía intravenosa, en conjunto con corticosteroides sistémicos en ciclos largos. En pacientes con contraindicación para corticosteroides o efectos adversos graves puede indicarse IgG por vía intravenosa o anti-D como tratamiento de primera línea (GRADE B2).116,117
R. En pacientes con púrpura trombocitopénica inmunitaria el tratamiento inmunomodulador con IgG por vía intravenosa se administra en dosis única de 1 g/kg; en sujetos con resistencia al tratamiento o eventos recurrentes puede repetirse el mismo protocolo. La dosis de 0.8 g/kg ha demostrado la misma eficacia en la mayoría de los casos; por lo tanto, disminuye los costos y posibles efectos adversos (GRADE B1).116,117
R. En pacientes con púrpura trombocitopénica inmunitaria crónica es efectiva la inmunomodulación con IgG por vía intravenosa, pues incrementa rápidamente la concentración plaquetaria y pospone o evita la esplenectomía. La dosis recomendada es la misma que reciben los pacientes con púrpura trombocitopénica inmunitaria aguda (GRADE C2).116,117
R. Los efectos adversos relacionados con la administración de IgG por vía intravenosa en pacientes con púrpura trombocitopénica inmunitaria muestra una prevalencia de 5-75%, generalmente leves. Los más comunes son: cefalea, dolor de espalda, escalofríos y fiebre. Algunos estudios han reportado anafilaxia, meningitis aséptica o hemólisis autoinmunitaria. No se ha reportado trasmisión de hepatitis C u otro agente infeccioso en productos que utilizan pasos de inactivación de los virus durante su fabricación (GRADE C2).116,117
Púrpura postransfusional
R. La IgG por vía intravenosa puede ser un tratamiento eficaz en el tratamiento de la púrpura transfusional resistente a la prescripción de metilprednisolona (GRADE C2).117,118
Neutropenia autoinmunitaria
Las infecciones en pacientes con neutropenia autoinmunitaria suelen ser menores, habitualmente en el sistema respiratorio. Incluso 80% de los pacientes pediátricos se recupera espontáneamente. El tratamiento suele ser conservador, con filgrastim (G-CSF), en sujetos con infecciones graves o prescribirse antes de la cirugía.
R. En la población pediátrica con neutropenia autoinmunitaria se recomienda vigilancia expectante. En caso de requerir tratamiento, filgrastim (G-CSF) representa el protocolo de primera línea. En adultos suele haber una enfermedad subyacente (lupus, linfoproliferación), por lo que el tratamiento debe dirigirse a la enfermedad de base.118,119
R. No se recomienda prescribir de manera rutinaria la IgG por vía intravenosa en el tratamiento de la neutropenia autoinmunitaria. Se sugiere indicar IgG intravenosa cuando han fallado (dosis 1 g/kg/en un día) otro tipo de medicamentos (antibióticos y G-CSF) (GRADE D2).109,118-127
Anemia hemolítica autoinmunitaria
R. La evidencia de la prescripción de IgG por vía intravenosa en pacientes con anemia hemolítica autoinmunitaria es escasa. Los reportes disponibles no distinguen entre las distintas clases de anemia hemolítica autoinmunitaria (idiopática o secundaria, tibia o fría). La reacción del tratamiento es menor que la reportada con corticosteroides o esplenectomía; por tanto, la eficacia de la inmunomodulación con IgG por vía intravenosa es limitada y no se recomienda de manera rutinaria. Puede considerarse la prescripción de IgG por vía intravenosa, a dosis de 2 g/kg en dos días, en conjunto con otros fármacos en casos graves de anemia hemolítica autoinmunitaria que amenacen la vida del paciente (GRADE D2).118,128
Síndrome de Evans (anemia y trombocitopenia autoinmunitarias)
R. La reacción de cualquier tratamiento en pacientes con síndrome de Evans (esteroide o danazol) es deficiente. En cuanto a la prescripción de IgG por vía intravenosa, la evidencia es escasa y la reacción es igualmente deficiente y transitoria, con recaídas frecuentes y tasa de respuesta mala. En estos casos, el tratamiento debe dirigirse a los síntomas primarios y descartar las causas subyacentes de las citopenias autoinmunitarias (dosis: 1 g/kg en 1 día) (GRADE D2).118,125,126,128
Dermatomiositis y polimiositis
R. Por tratarse de enfermedades raras, no existe suficiente evidencia de calidad; sin embargo, los estudios disponibles han demostrado incremento de la fuerza muscular con la prescripción de IgG por vía intravenosa, sin provocar efectos adversos asociados con inmunosupresores, plasmaféresis y leucoféresis. Se considera un tratamiento efectivo y con buena tolerancia (GRADE B1); por tanto, puede recomendarse como tratamiento de primera línea.129,130
R. La IgG por vía intravenosa representa una buena opción en pacientes con polimiositis- dermatomiositis resistente al tratamiento en exacerbación, rápidamente progresiva o grave y sujetos con alguna contraindicación para recibir corticosteroides u otro tipo de inmunodepresores (GRADE C1). La dosis sugerida es de 2 g/kg, con dosis total entre 2 y 5 días, cada mes por 3 a 6 meses.129,131,132
Miositis por cuerpos de inclusión (IBM)
R. No existe suficiente evidencia para emitir una recomendación. Se requieren estudios adicionales de largo plazo (GRADE C2). El esquema tradicional, al igual que en varias enfermedades autoinmunitarias, es de 2 g/kg entre 2 y 5 días, cada mes por 3 a 6 meses (GRADE D2).133-135
Hemofilia adquirida
R. No existe suficiente evidencia para emitir una recomendación. Se requieren estudios adicionales. Cada caso debe individualizarse. Puede considerarse (dosis: 2 g/kg en dos días) como tratamiento adyuvante en casos graves o situaciones urgentes (GRADE C2).118,136,137
Síndrome hemofagocítico asociado con virus
R. De acuerdo con la evidencia disponible, no puede indicarse la IgG por vía intravenosa como tratamiento único en pacientes con linfohistiocistosis hemofagocítica familiar o relacionada con virus. Con base en un consenso de expertos, puede recomendarse como tratamiento coadyuvante en casos graves o con rápido deterioro de la salud. El tratamiento con IgG por vía intravenosa (dosis: 2 g/kg a lo largo de 2 días) no se considera inmunodepresor; por tanto, representa una opción segura y con función coadyuvante, particularmente en pacientes inmunodeficientes o graves. Se requieren más estudios controlados (GRADE 2D).118,138-145
ENFERMEDADES INFLAMATORIAS
Enfermedad de Kawasaki
La enfermedad de Kawasaki debe su nombre a la descripción de 50 pacientes pediátricos afectados con síndrome linfomucocutáneo febril agudo infantil por el doctor Tomisaku Kawasaki, y que se consideraba un proceso peculiar, que tiende a curarse de forma espontánea y con pronóstico favorable.146 Sin embargo, a principios del decenio de 1970 se reportaron 10 casos compatibles con enfermedad de Kawasaki que terminaron en muerte súbita; en las únicas 4 autopsias realizadas se identificaron aneurismas y trombosis en las arterias coronarias, por lo que tuvieron lugar nuevos acercamientos diagnósticos y terapéuticos.147 En 1984 el doctor Furusho realizó el primer ensayo clínico multicéntrico que demostró la eficacia y seguridad de la IgG por vía intravenosa, en dosis altas, para disminuir las anormalidades en las arterias coronarias de pacientes con enfermedad de Kawasaki;148 posteriormente, en 1991, los ambos estudios realizados por el grupo de Fred S. Rosen establecieron el esquema que hoy se considera el tratamiento de primera línea para esta enfermedad.149
R. La prescripción de IgG por vía intravenosa en conjunto con ácido acetilsalicílico en pacientes con enfermedad de Kawasaki disminuye de forma significativa la frecuencia de aneurismas coronarias. La dosis recomendada es de 2 g/kg (GRADE A1).148,150-153
R. Los pacientes que continúan con fiebre (enfermedad de Kawasaki resistente al tratamiento) después de la primera infusión de IgG tienen mayor riesgo de aneurismas y deben recibir una segunda dosis de (2 g/kg) (GRADE A1).150-155
ALTERACIONES NEUROLÓGICAS
Neuropatías periféricas desmielinizantes
Síndrome de Guillain-Barré
R. La IgG por vía intravenosa es efectiva en pacientes con síndrome de Guillain-Barré -que con escala funcional de Hughes mayor a 3 requieren apoyo para caminar- en los primeros 15 días de iniciar los síntomas o hasta 4 semanas a partir del comienzo del padecimiento (GRADE A1).156-159
R. La población pediátrica con síndrome de Guillain-Barré debe recibir IgG intravenosa como tratamiento de primera línea (GRADE C1).156-159
R. Los efectos adversos de la IgG por vía intravenosa en pacientes con síndrome de Guillain-Barré son excepcionales, comparados con la plasmaféresis. Las reacciones adversas más frecuentes son escalofríos, náuseas, cefalea, mialgias, fatiga, fiebre, entre otros, pero ceden satisfactoriamente con el tratamiento sintomático. Son raros los reportes de efectos adversos graves (GRADE B1).159-162
R. La dosis recomendada de IgG intravenosa en pacientes con síndrome de Guillain-Barré es de 2 g/kg, como dosis total fraccionada, de 3 a 5 días (GRADE A2).159-162
R. Los pacientes con reacción inicial y que posteriormente recaen deben recibir, nuevamente, un segundo curso de IgG por vía intravenosa, sobre todo quienes sufren recidiva en las primeras ocho semanas (fluctuación relacionada con el tratamiento). Cuando las recidivas ocurren en más de tres ocasiones, en un período superior a ocho semanas, se establece el diagnóstico de polirradiculopatía desmielinizante inflamatoria crónica de inicio agudo (GRADE D2).159-162
R. No existe suficiente información para emitir la prescripción de IgG por vía intravenosa en pacientes con las variantes clínicas del síndrome de Guillain-Barré (síndrome de Miller Fisher y síndrome faringocervicobraquial).159-162
Polirradiculoneuropatía desmielinizante inflamatoria crónica
R. La IgG por vía intravenosa se considera el tratamiento de primera línea en pacientes con polirradiculoneuropatía desmielinizante inflamatoria crónica (PDIC), de moderada a grave. Es un tratamiento eficaz y seguro, mejora la calidad de vida y no provoca efectos adversos graves (GRADE A1).163-167
R. Los pacientes con síntomas leves de PDIC pueden mantenerse en vigilancia y sin tratamiento. Los pacientes con discapacidad moderada o grave pueden recibir tratamiento combinado con IgG intravenosa y corticosteroides antes de considerar la plasmaféresis (GRADE B2).163-167
R. Los pacientes con PDIC pueden recibir dosis de 1 g/kg de IgG intravenosa cada tres semanas para sostener la mejoría. Aunque el beneficio puede considerarse breve, aumenta la calidad de vida. Se recomienda individualizar el tratamiento de cada paciente (0.4-1.2 g/kg cada 2-6 semanas). Cuando el paciente permanece estable con el régimen intermitente, se recomienda reducir la dosis. Aproximadamente 15% de los pacientes no reaccionan con ningún tratamiento (GRADE D2).165-167
R. En los últimos años se ha acumulado la evidencia en favor del tratamiento de inmunomodulación con IgG por vía subcutánea a largo plazo en los pacientes con PDIC. Consideramos que se trata de un área de interés y con buenas expectativas; sin embargo, se requieren estudios adicionales para ofrecer una recomendación específica. (GRADE B2).112
Neuropatía multifocal motora con bloqueo de la conducción
R. La inmunomodulación con IgG por vía intravenosa representa la única opción eficaz en pacientes con neuropatía multifocal motora con bloqueo de la conducción (NMM); se ha demostrado que los corticosteroides y la plasmaféresis no producen resultados satisfactorios, incluso pueden empeorar el estado de salud. Los pacientes con NMM requieren terapia de mantenimiento a largo plazo, por lo que debe individualizarse cada caso, de acuerdo con la reacción al tratamiento (GRADE A1).167-170
R. La IgG intravenosa es el tratamiento de elección en pacientes con NMM moderada a grave, con dosis total de 2 g/kg (0.4 g/kg/d por 5 días) (GRADE A1).167-170
R. En pacientes con recurrencia, cuyo tratamiento inicial con IgG intravenosa fue efectivo, debe repetirse la misma dosis. La administración repetida debe establecerse con base en la reacción del tratamiento. El esquema de mantenimiento consiste en 1 g/kg cada 2-4 semanas o 2 g/kg cada 1-2 meses. La mayoría de los pacientes requiere tratamiento repetido con IgG por vía intravenosa y aunque se mantienen estables por varios años, puede afectarse lentamente su salud por daño axonal progresivo, aún con la administración de dosis altas del tratamiento (GRADE D2).167-170
R. En los últimos años se ha incrementado la evidencia a favor del tratamiento de inmunomodulación con IgG por vía subcutánea a largo plazo en pacientes con NMM. Sin embargo, por tratarse de un área de interés y con buenas expectativas, deben realizarse más estudios para emitir una recomendación específica (GRADE B2).112
Neuropatía periférica
R. No existe suficiente evidencia para emitir una recomendación. Es importante considerar el tratamiento inmunomodulador con IgG intravenosa en pacientes con neuropatías periféricas paraneoplásicas sin reacción satisfactoria con otros medicamentos (dosis: 2 g/kg entre 2 y 5 días) (GRADE D2).144,160
Neuropatía desmielinizante paraproteinémica (gammapatía monoclonal)
R. El tratamiento inmunomodulador con IgG intravenosa representa el protocolo inicial en pacientes con discapacidad importante o con deterioro rápido. Se requieren estudios con mayor cantidad de pacientes, mejor diseñados y con seguimiento a largo plazo (de 6 a 12 meses como periodo mínimo) para obtener una mejor calidad de evidencia. La dosis recomendada es de 2 g/kg, dividida en 2 a 5 días consecutivos (GRADE C1).171-175
Otras enfermedades desmielinizantes (agudas y progresivas)
Encefalomielitis aguda diseminada
R. No existe suficiente evidencia para emitir una recomendación. La prescripción de IgG por vía intravenosa en pacientes con encefalomielitis aguda diseminada (EMDA) puede ser eficaz como tratamiento de segunda línea, cuando no los corticosteroides no ofrecen reacción satisfactoria. Hasta la fecha no existen estudios que comparen la efectividad entre IgG intravenosa, plasmaféresis y corticosteroides (GRADE 2D). 176- 180
Síndrome opsoclono-mioclono o encefalopatía mioclónica infantil
R. El tratamiento de inmunomodulación con IgG intravenosa ha demostrado eficacia en monoterapia o como coadyuvante en sujetos con síndrome opsoclono-mioclono o encefalopatía mioclónica infantil (SOM), independientemente de su etiología (GRADE D2).169-172),(183-186
Síndrome de persona rígida
R. La IgG por vía intravenosa representa el tratamiento de primera línea en pacientes con síndrome de persona rígida, quienes reportan anticuerpos anti-GAD positivos. Se desconoce su efecto en pacientes con anticuerpos anti-GAD negativos (GRADE B1).144,173-175,187-189
Encefalitis límbica autoinmunitaria
R. Los pacientes pediátricos y adultos con alto índice de sospecha de encefalitis límbica autoinmunitaria deben recibir tratamiento inmunomodulador con IgG intravenosa (en dosis de 400 mg/kg/d por 5 días) y corticosteroides, plasmaféresis, o ambos. El 50% de los casos reacciona satisfactoriamente con la inmunoterapia de primera línea (IgG intravenosa, corticosteroides o plasmaféresis) y el 50% restante requiere tratamiento de segunda línea, con rituximab o la combinación de rituximab y ciclofosfamida. Entre 12 y 20% de los casos reporta recidivas; sin embargo, muestran buena reaccionan con inmunoterapia. Los pacientes sin reacción con la inmunoterapia de primera línea deben recibir terapias de segunda línea aisladas o en combinación (GRADE C2).176-178,190-192
Miastenia grave
R. La inmunomodulación con IgG por vía intravenosa, con dosis de 2 g/kg, representa el tratamiento de elección, eficaz a corto plazo, en sujetos con exacerbaciones agudas o casos graves de miastenia grave (MG) (GRADE A1).193-196
R. El tratamiento de inmunomodulación con IgG por vía intravenosa también es una buena opción en mujeres embarazadas con miastenia grave, debido a su eficacia y perfil de seguridad (GRADE A1).193-196
R. Los efectos adversos de la IgG intravenosa en pacientes con miastenia grave son raros, leves y de curación espontánea. Entre los principales se incluyen: fiebre, cefalea, transaminasemia y elevación de creatinina (GRADE B1).193-196
R. No existe suficiente evidencia para emitir una recomendación en cuanto a la inmunomodulación con IgG intravenosa como tratamiento de mantenimiento en pacientes con miastenia grave (GRADE D2). 193-196
R. Está indicada la administración de IgG por vía intravenosa en pacientes con miastenia grave neonatal (GRADE D2).193-196
R. La dosis recomendada de IgG intravenosa en pacientes con exacerbación aguda de miastenia grave es de 2 g/kg en 2 días o, bien, 1 g/kg en aplicación única. No existe diferencia en cuanto a la aplicación de dosis mayores de 2 g/kg (GRADE A2).193-196
Síndrome miasténico Lambert-Eaton
R. La inmunomodulación con IgG por vía intravenosa, en dosis de 2 g/kg en 2 días consecutivos, ha demostrado efectos mínimos y transitorios (hasta 8 semanas) en pacientes con síndrome miasténico de Lambert-Eaton (LEMS) para reducir la debilidad (GRADE B2).144,162,183,184,197,198
Epilepsia infantil intratable y síndromes epilépticos
R. No existen suficientes estudios para emitir una recomendación de la prescripción rutinaria de IgG intravenosa en pacientes con epilepsia infantil intratable. La dosis de 2 g/kg entre 2 y 5 días consecutivos ha reportado resultados variables (GRADE D2).185-192,199-206
Esclerosis múltiple
R. La indicación de IgG por vía intravenosa en pacientes con esclerosis múltiple se considerada un tratamiento de segunda línea en algunos países; sin embargo, en general no se encuentra indicada. No obstante, es el único inmunomodulador disponible durante el embarazo (GRADE C2).193-195,207-213
R. El tratamiento de pacientes con esclerosis múltiple por recidiva no ha demostrado efectos adicionales cuando se prescribe la combinación de IgG y corticosteroides. No se recomienda la administración de IgG intravenosa en monoterapia o en combinación con metilprednisolona en pacientes con algún brote/proceso/evento discapacitante (GRADE A1).193,195,214,215
R. Debe considerarse la prescripción de IgG por vía intravenosa en el tratamiento crónico de pacientes con esclerosis múltiple remitente-recurrente, en dosis de 2 g/kg por 2 días, pues ha demostrado disminución de la discapacidad a un año y reducción de la tasa de recidivas a 3 años (GRADE C1).207-213
ENFERMEDADES AUTOINMUNITARIAS EN PACIENTES PEDIÁTRICOS
Prescripción de IgG intravenosa en reumatología pediátrica
Artritis idiopática juvenil
R. No está indicada la administración de IgG intravenosa en pacientes con artritis idiopática juvenil (GRADE C2).
En reportes de casos se ha señalado la aplicación de IgG intravenosa en pacientes con artritis idiopática juvenil, pero no se ha comprobado su eficacia en el control de la actividad de la enfermedad. 216-220
R. De acuerdo con los reportes de casos clínicos, puede indicarse en pacientes con falla al tratamiento o con alergia a los fármacos modificadores de la enfermedad (FARMES), ya sean biológicos o no biológicos (GRADE C2).216-220
Lupus eritematoso sistémico
R. No se recomienda la prescripción de IgG intravenosa como tratamiento de primera línea en pacientes con lupus eritematoso sistémico (GRADE C2).
R. La prescripción del tratamiento debe establecerse en situaciones precisas (GRADE C2)221-225
En caso de falla al tratamiento de primera línea:
alveolitis intersticial
miocarditis lúpica
trombocitopenia lúpica resistente al tratamiento
vasculitis del sistema nervioso central
mononeuritis
neurolupus resistente al tratamiento (especialmente en sujetos con manifestaciones neuropsiquiátricas)
nefropatía lúpica resistente al tratamiento
Síndrome antifosfolípidos catastrófico
R. La prescripción de IgG por vía intravenosa en pacientes pediátricos con síndrome antifosfolípido catastrófico representa una opción efectiva, al igual que la plasmaféresis. En algunos casos se ha descrito su indicación después de la plasmaféresis y en combinación con corticosteroides, anticoagulantes e inmunodepresores (GRADE C2).226,227
Vasculitis sistémicas y vasculitis asociadas con anticuerpos contra citoplasma de neutrófilos
R. La administración de IgG intravenosa en pacientes con vasculitis sistémicas y vasculitis asociadas con anticuerpos contra citoplasma de neutrófilos es un tratamiento que requiere evaluarse e individualizarse en cada paciente. No se recomienda su administración intravenosa ni subcutánea como tratamiento de primera línea (GRADE C2).
R. La IgG intravenosa puede indicarse únicamente en pacientes con vasculitis en los siguientes escenarios clínicos (GRADE C2):228,229
Síndrome de activación de macrófagos
La prescripción de IgG intravenosa en pacientes con síndrome de activación de macrófagos, asociado con artritis idiopática juvenil sistémica, lupus eritematoso sistémico e infección en pacientes pediátricos con enfermedad reumática es una opción segura que puede indicarse en conjunto con corticosteroides, inmunodepresores e inmunomoduladores (etopósido, ciclosporina, etcétera).
R. Se recomienda la administración de IgG intravenosa en conjunto con inmunodepresores e inmunomoduladores (GRADE C2), principalmente en pacientes con:218-221,230-232
TRASPLANTES
R. Los pacientes que recibirán trasplante de órgano sólido y quienes muestran sensibilización contra antígenos de histocompatibilidad (HLA) del donador pueden recibir IgG intravenosa, en dosis de 2 g/kg por mes durante 4 meses antes del trasplante. La evidencia disponible proviene, principalmente, de trasplantes renales. Existe poca evidencia para emitir una recomendación del tratamiento en sujetos con trasplantes cardiacos, pulmonares o hepáticos (GRADE B1).233-238
R. Las diferentes presentaciones de IgG intravenosa disponibles se consideran seguras. En pacientes con insuficiencia renal y factores de riesgo para trombosis debe tenerse cautela e infundirse lentamente el tratamiento (GRADE B2).237
R. Se recomienda la administración de IgG por vía intravenosa (2 g/kg total) luego de la plasmaféresis en receptores de trasplante de riñón, que cursen por un rechazo agudo mediado por anticuerpos, para prolongar la supervivencia del injerto (GRADE B2).237,238
R. Se sugiere vigilar las concentraciones séricas de IgG y administrar IgG por vía intravenosa en pacientes con enfermedad injerto contra huésped (EICH) crónica sistémica, moderada a grave, con hipogammaglobulinemia, con la finalidad de prevenir infecciones agregadas, y en sujetos con EICH pulmonar para limitar la inflamación, que puede resultar en bronquiolitis obstructiva. La dosis recomendada es de 400 mg/kg/mensual, para mantener concentraciones séricas de IgG mayores de 500 mg/dL durante 10 meses después del trasplante (GRADE C1).227-229,239,240
Trasplante e infecciones
R. La prescripción de IgG intravenosa en combinación con ganciclovir, o foscarnet, está indicada en el tratamiento de la infección de novo por citomegalovirus de pacientes que recibieron trasplante de células progenitoras hematopoyéticas o de órgano sólido (GRADE B1).241,242
R. La IgG por vía intravenosa está contraindicada como profilaxis con infección por citomegalovirus, quienes recibieron trasplante de células progenitoras hematopoyéticas o de órgano sólido (GRADE B1).241,242
R. La IgG por vía intravenosa es el tratamiento de elección en pacientes postrasplantados con neumonitis causada por citomegalovirus, incluso ha demostrado mejor pronóstico y evolución cuando se prescribe en conjunto con ganciclovir (GRADE A1).241,242
R. La dosis de IgG intravenosa de 2 g/kg ha demostrado eficacia para prevenir la pérdida de injerto en pacientes con trasplante renal asociada con nefropatía por virus BK (GRADE C2).241,242
R. La prescripción de IgG por vía intravenosa es eficaz en pacientes con enfermedad linfoproliferativa postrasplante por virus Epstein-Barr en conjunto con rituximab y ganciclovir (GRADE D2).243,244
R. No se recomienda la administración rutinaria de IgG intravenosa para prevenir las infecciones postrasplante. La administración rutinaria no muestra disminución del riesgo de infección viral, bacteriana o micótica (GRADE A1).245-247
R. El tratamiento de reemplazo con IgG intravenosa (400-600 mg/kg/mes) está indicado en pacientes con inmunodeficiencia primaria que recibirán trasplante de células progenitoras hematopoyéticas, en sujetos trasplantados con diagnóstico de mieloma múltiple, leucemia linfocítica crónica y en quienes padecen enfermedad injerto contra huésped con hipogammaglobulinemia, hasta que la concentración de IgG se encuentre en sus límites normales luego de 10 meses de recibir el trasplante (GRADE A1).248,249
R. En los pacientes sin hipogammaglobulinemia (IgG < 500 mg/dL) no se ha demostrado que la administración mensual de IgG intravenosa sea capaz de reducir las complicaciones tardías luego del trasplante de células progenitoras hematopoyéticas (GRADE B2).233-238,250
ENFERMEDADES RELACIONADAS CON INFECCIONES
R. Existe evidencia que la IgG por vía intravenosa es capaz de reducir la tasa de mortalidad en niños y adultos con sepsis y choque séptico. La dosis recomendada es de 1-2 g/kg (GRADE 1A).251,252
R. La IgG por vía intravenosa incrementa la supervivencia de pacientes con síndrome de choque tóxico (dosis de 0.5 a 1 g/kg/d por 1-6 días), a partir del diagnóstico de la enfermedad (GRADE 2 C2).253-255
R. Los pacientes con colitis grave o multirrecurrente por Clostridium difficile pueden recibir IgG por vía intravenosa, en dosis de 400 mg/kg durante 1 a 4 días, pues ha demostrado disminución de la morbilidad y mortalidad una semana después de iniciar el tratamiento convencional (GRADE C2).255-259
R. Está indicado el tratamiento de IgG por vía intravenosa en pacientes con anemia de serie roja por parvovirus B19 (GRADE C2).260
Sepsis neonatal
R. No existe evidencia que respalde la eficacia de la IgG intravenosa de forma rutinaria para disminuir la mortalidad de pacientes con sepsis neonatal.261,262
No existe evidencia que respalde la prescripción profiláctica (sepsis) rutinaria de IgG intravenosa en recién nacidos prematuros o con bajo peso (GRADE A1).251-253,263
USOS MISCELÁNEOS
Trombocitopenia aloinmunitaria neonatal
R. La dosis de IgG intravenosa de 2 g/kg en 2 días puede ser eficaz en neonatos con trombocitopenia aloinmunitaria para evitar la destrucción de plaquetas trasfundidas.264,265
R. En pacientes con embarazos subsecuentes puede administrase la IgG por vía intravenosa, en dosis de 0.5-1 g/kg/semanal en combinación con corticosteroides, luego de comprobar el fenómeno-proceso autoinmunitario, para prevenir la trombocitopenia en el recién nacido (GRADE C2).266-271
Enfermedad hemolítica neonatal
R. La IgG por vía intravenosa, en dosis de 500 mg/kg, puede reducir el requerimiento de exsanguinotransfusión en neonatos con enfermedad hemolítica neonatal. Se ha observado que el tratamiento con IgG intravenosa durante el embarazo, en monoterapia o combinada con corticosteroides, es eficaz para prevenir la enfermedad hemolítica del recién nacido (GRADE C2).232,238,254-256,272-274
Enfermedades dermatológicas
R. La IgG por vía intravenosa, en dosis ≥ 2 g/kg, está indicada en pacientes con necrólisis epidérmica tóxica y síndrome de Stevens-Johnson (GRADE B2).275-277
R. La administración de IgG por vía intravenosa puede indicarse como tratamiento coadyuvante en pacientes con pénfigo buloso grave, quienes requieren control rápido, con falla al tratamiento o en quienes tienen contraindicación para otro tipo de fármacos. La dosis recomendada es de 2 g/kg (GRADE C2).278-279
R. La administración de IgG por vía intravenosa en dosis altas (1-2 g/kg) es eficaz en pacientes con psoriasis resistente y grave, y en quienes padecen artritis psoriásica (GRADE C2).279-282
R. No está indicado el tratamiento rutinario de IgG por vía intravenosa en pacientes con dermatitis atópica. Puede administrarse para el control, a corto plazo, de formas graves y resistentes a otros tratamientos (GRADE D2).283-286
R. No está indicado el tratamiento rutinario de IgG por vía intravenosa en pacientes con urticaria; sólo puede prescribirse como último recurso en casos graves de urticaria autoinmunitaria (GRADE D2).282
Enfermedades neurocognitivas
R. No se recomienda la administración de IgG por vía intravenosa en pacientes con autismo (GRADE B1).287-291
R: Está indicada la prescripción de IgG intravenosa, en dosis de 2 g/kg, en pacientes pediátricos con formas graves y resistentes al tratamiento con antibióticos por trastornos neuropsiquiátricos autoinmunitarios asociados con infecciones por estreptococos (PANDAS) (GRADE C2).291,292
R. La IgG por vía intravenosa está contraindicada en el tratamiento del síndrome de fatiga crónica (GRADE A1).293-296
Fibrosis quística
R. La IgG por vía intravenosa es un tratamiento eficaz en pacientes con fibrosis quística asociada con hipogammaglobulinemia (GRADE C2).297
Miocarditis viral aguda
R. No existe suficiente evidencia para recomendar la administración rutinaria de IgG intravenosa en pacientes con miocarditis viral aguda (GRADE D2).298-299
Aborto involuntario recurrente
R. La administración de IgG por vía intravenosa en el tratamiento del aborto involuntario recurrente no se justifica fuera del contexto de ensayos controlados aleatorizados bien diseñados. Hasta la fecha se desconoce algún mecanismo de acción comprobado, incluso no existen algoritmos diagnósticos para identificar a los pacientes capaces de beneficiarse con dicho tratamiento (GRADE A1).300,301











 nueva página del texto (beta)
nueva página del texto (beta)