Introducción
La retinopatía del prematuro (ROP, por sus siglas en inglés), anteriormente llamada fibroplasia retrolental, fue descrita por Terry en 1942. Se trata de un trastorno retiniano vasoproliferativo, considerado como la principal causa de ceguera infantil, pero que es prevenible.1,2 La menor edad gestacional y el peso bajo al nacimiento son los principales factores de riesgo para el desarrollo de ROP.3 En la actualidad su detección se lleva a cabo mediante el tamizaje oftalmológico, el cual se realiza considerando la edad gestacional (EG) y el peso al nacimiento de cada recién nacido (RN).
Cuando este tamizaje oftalmológico se lleva a cabo apropiadamente, tanto por la selección oportuna de los prematuros en riesgo, como porque se realiza con oftalmólogos capacitados, permite identificar y clasificar a todos los pacientes con ROP, 4 lo cual es trascendental, ya que se pueden alcanzar tasas de curación de hasta 98% cuando se brinda el tratamiento de manera oportuna; sin embargo, la realización del tamizaje oftalmológico no es inocua, ya que puede producir desaturación de oxígeno, aumento de la frecuencia cardiaca y de los episodios de apnea durante la exploración.
Se han desarrollado modelos de predicción clínica para identificar a pacientes con alto riesgo de ROP, lo cual es de suma utilidad para determinar con mayor precisión qué prematuros requieren ser evaluados por tamizaje oftalmológico. Lo anterior resulta importante en unidades médicas sin personal capacitado, ya que puede ayudar a seleccionar a los pacientes que tienen mayor probabilidad de requerir tratamiento para ROP en centros especializados, o bien puede reducir el número de exámenes para la detección de ROP.5
En 2009, en Suecia, Hellström y colaboradores publicaron un estudio retrospectivo sobre el desarrollo de un algoritmo que denominaron WINROP (Weight, IGF-1 [insulinlike growth factor 1], Neonatal, ROP), el cual utiliza el peso al nacimiento (< 1,500 g), la edad gestacional y el aumento del peso semanal para predecir la presencia de ROP en pacientes prematuros ≤ 32 semanas de gestación (SDG). Al utilizar este algoritmo, los pacientes que se clasifican con y sin riesgo de ROP; así, los pacientes con riesgo tienen mayor probabilidad de requerir tratamiento para revertir esta complicación, en comparación con quienes el algoritmo los clasifica sin riesgo de ROP.6
El objetivo de este estudio fue determinar la capacidad diagnóstica, de acuerdo con la sensibilidad y especificidad del algoritmo WINROP para predecir ROP, en un hospital de la ciudad de Monterrey, Nuevo León, México.
Material y métodos
Éste es un estudio de prueba diagnóstica, transversal y retrospectivo. Se tomó en cuenta la población de RN ingresados a la unidad de cuidados intensivos neonatales (UCIN) de los hospitales Christus Muguerza Alta Especialidad y Christus Muguerza Hospital General Conchita, en el periodo de enero de 2016 a agosto de 2021. Los criterios de inclusión fueron: pacientes con peso al nacimiento < 1,500 g, ≤ 32 SDG, que requirieron administración de FiO2 > 0.21 por al menos 24 horas consecutivas, y a quienes se les realizó exploración oftalmológica durante la cuarta y sexta semana de edad postnatal. Se excluyó a pacientes con alguna malformación congénita que hubiera condicionado deterioro cardiorrespiratorio, cardiopatía congénita, catarata congénita o que tuvieran hidrocefalia que condicionara aumento excesivo de peso del RN.
Del expediente clínico se registró: diagnóstico de ingreso, sexo, edad gestacional, peso al nacimiento, ganancia de peso por semana durante su estancia en la UCIN, requerimiento de surfactante, administración de cafeína, necesidad de ventilación mecánica invasiva y días de duración, días de uso de oxígeno suplementario, persistencia de conducto arterioso (PCA), transfusión de sangre y desarrollo de displasia broncopulmonar.
Después de la realización del tamizaje oftalmológico mediante oftalmoscopía indirecta, se diagnosticó a los pacientes sin y con ROP; en estos últimos además se registró el grado de ROP, presencia de enfermedad plus y el tratamiento recibido. La oftalmoscopía indirecta fue el estándar de oro para el diagnóstico de ROP.
Por otro lado, para clasificar a los pacientes según el algoritmo WINROP, se utilizó la plataforma https://www.winrop.com/, que es un sistema de vigilancia en línea. En esta plataforma se introducen datos de cada RN, que incluyen peso al nacimiento, edad gestacional y la ganancia semanal de peso. De acuerdo con los datos incorporados, cuando se detecta desaceleración en el crecimiento, entonces se activa una alarma, lo que identifica a los prematuros en riesgo de ROP; mientras que cuando el crecimiento es normal, entonces son considerados sin ROP.
Análisis estadístico
Para determinar el tipo de distribución de las variables cuantitativas se utilizó Kolgomorov-Smirnov; cuando hubo distribución normal, los datos se presentan con promedio y desviación estándar; en caso contrario, se presentan con mediana y rango intercuartil (RIQ). Las variables cualitativas se describen en frecuencia y porcentajes.
Para determinar la capacitad diagnostica de WINROP, se calculó la sensibilidad y especificidad, valor predictivo positivo (VPP) y valor predictivo negativo (VPN), utilizando Tablas de 2 × 2 al comparar su resultado (en riesgo o no de ROP) con el obtenido por oftalmoscopía indirecta (presencia o ausencia de ROP). También se calcularon la razón de verosimilitud positiva (RVP) y la razón de verosimilitud negativa (RVN), con intervalos de confianza a 95% (IC95%).
Además, se realizó comparación entre grupos con las pruebas t de Student, U de Mann-Whitney y χ2. Valores de p < 0.05 se consideraron estadísticamente significativos.
Los análisis fueron realizados con el programa SPSS versión 21.0.
Resultados
En la Tabla 1 se presentan las características generales de los 77 pacientes que se incluyeron en este estudio; como se observa, 42 fueron hombres (54.5%,), con un peso promedio al nacimiento de 1,040.3 ± 205.7 g, y con una mediana de edad gestacional de 29 SDG (RIQ 27.8-31).
Tabla 1: Características clínicas de la población.
| Variables | Todos (N = 77) | ROP (N = 52) | Sin ROP (N = 25) | p |
|---|---|---|---|---|
| n (%) | n (%) | n (%) | ||
| Peso nacimiento [g], promedio* | 1,040.3 ± 205.7 | 954.9 ± 162 | 1,218 ± 171.6 | 0.01§ |
| Edad gestacional, mediana‡ | 29 (27.8-31) | 28.8 (27-30.1) | 31 (29.6-31.4) | < 0.01¶ |
| Apgar 1 min, mediana‡ | 7 (5-8) | 7 (5-8) | 7 (6-8) | 0.74¶ |
| Apgar 5 min, mediana‡ | 9 (8-9) | 9 (8-9) | 9 (8-9) | 0.64¶ |
| Edad tamizaje, mediana‡ | 34 (32.2-35) | 33.6 (32-34) | 34.6 (34-35.1) | < 0.01¶ |
| Semanas alarma, mediana‡ | 31 (30-32) | 31 (30-32) | 31.5 (31-32) | 0.07¶ |
| Sexo | 0.50** | |||
| Mujer | 35 (45.5) | 25 (49.1) | 10 (40) | |
| Hombre | 42 (54.5) | 27 (51.9) | 15 (60) | |
| Peso bajo para la edad | 5 (6.5) | 3 (5.8) | 2 (8) | 0.71** |
| Restricción del crecimiento intrauterino | 6 (7.8) | 4 (7.7) | 2 (8) | 0.96** |
| Surfactante | 43 (55.8) | 36 (69.2) | 7 (28) | < 0.01** |
| Cafeína | 77 (100) | 52 (100) | 25 (100) | 1.0 |
| Días de oxígeno, promedio* | – | 50.4 ± 19 | 10.7 ± 7.5 | < 0.01§ |
| Ventilación mecánica | 37 (48.1) | 33 (63.5) | 4 (16) | < 0.01** |
| Persistencia del conducto arterioso | 22 (28.6) | 21 (40.4) | 1 (4) | < 0.01** |
| Transfusión de sangre | 42 (54.5) | 37 (71.2) | 5 (20) | < 0.01** |
| Fototerapia | 56 (72.7) | 39 (75) | 17 (68) | 0.51** |
| Displasia broncopulmonar | 30 (39) | 30 (57.7) | 0 (0) | < 0.01** |
| Días de estancia, mediana‡ | – | 69 (57-79.8) | 42 (34.5-52.5) | < 0.01¶ |
* DE = desviación estándar,
‡ RIQ = rango intercuartil.
§ Prueba t-Student.
¶ U Mann-Whitney,
** prueba χ2.
Diagnóstico de ROP
De los 77 pacientes, 52 se diagnosticaron en alguno de los estadios de ROP mediante oftalmoscopía indirecta, lo cual resultó en una prevalencia de 67.5%. De éstos, la ROP estadio 1 ocurrió en 48.1% (n = 25), estadio 2 en 50.0% (n = 26) y el estadio 3 solamente se identificó en un paciente (1.9%). Ninguno se encontró con enfermedad plus.
Análisis de WINROP como prueba diagnóstica
En 54 de 77 pacientes (70.1%) se activó la alarma de acuerdo con el algoritmo WINROP, con lo cual se clasificaron en riesgo de ROP; mientras que en 23 pacientes (29.9%) no se dio ninguna alarma, por lo que se consideraron sin riesgo de ROP.
En la Tabla 2 se muestran los resultados del desempeño de WINROP como prueba diagnóstica; se observa que, para la detección de pacientes prematuros con ROP, su sensibilidad fue de 96% y la especificidad de 84%; mientras que los VPN y VPP fueron de 91 y 92.5%, respectivamente.
Tabla 2: Comparación de WINROP con la oftalmoscopía indirecta (estándar de oro) para la detección de retinopatía del prematuro (ROP).
| ROP presente | ROP ausente | Total | |
|---|---|---|---|
| WINROP positivo: alarma | 50 | 4 | 54 |
| WINROP negativo:sin alarma | 2 | 21 | 23 |
| Total | 52 | 25 | 77 |
WINROP = Weight, IGF-1 (insulinlike growth factor 1), Neonatal, ROP.
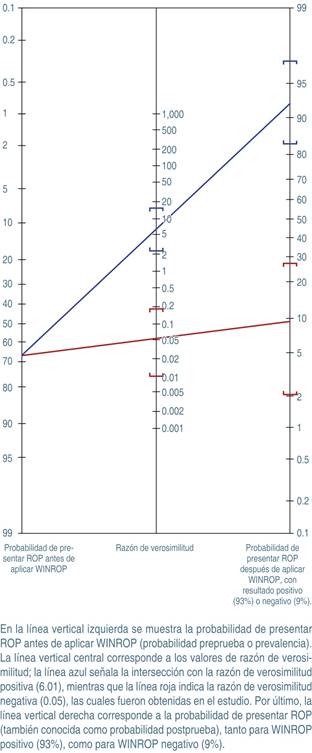
La RVP fue de 6.01 (IC95% 2.44-15) y la RVN de 0.05 (IC95% 0.01-0.18). Estos dos datos se extrapolaron a un nomograma de Fagan que se presenta en la Figura 1. Como se observa, a partir de una prevalencia (o valor preprueba) de 67.5%, en casos de WINROP positivo la probabilidad de ROP será de 93%. Por el contrario, ante WINROP negativo sólo 9% tendrá ROP.
Comparación de factores en pacientes con y sin ROP
Como también se muestra en la Tabla 1, varios factores fueron diferentes entre pacientes con ROP y sin ROP. Tanto el peso (954.9 ± 162 g versus 1,218 ± 171.6 g, p = 0.01) como la edad gestacional fueron menores en el grupo de ROP (mediana 28.8 SDG [RIQ 27-30.1] versus 31 SDG [RIQ 29.6-31.4], p < 0.01). Además, el uso de ventilación mecánica fue mayor en el grupo con ROP (63.5% versus 16%, p < 0.01), así como la presencia de PCA (40.4 versus 4%, p < 0.01).
Discusión
El algoritmo WINROP es una herramienta inocua que toma en cuenta la edad gestacional, el peso al nacimiento y la ganancia de peso para predecir qué pacientes < 32 SDG desarrollarán algún grado de ROP. En estudios previos se ha investigado la capacidad diagnóstica del algoritmo WINROP; los resultados de algunos de esos estudios y de éste se muestran en la Tabla 3.6-21 Como se observa, los datos que encontramos de sensibilidad de 96% son similares a 13 de los 16 estudios en los que se reporta una variación entre 84 y 100%; sin embargo, la especificidad que obtuvimos (84%) es alta en comparación con la mayoría de los estudios, ya que solamente en tres se reportó que fuera mayor a 80%.6,7,11
Tabla 3: Comparación con otros estudios de validación de WINROP.
| Autor | Año | País | No. de pacientes | Sensibilidad (%) | Especificidad (%) | VPP (%) | VPN (%) |
|---|---|---|---|---|---|---|---|
| Hellstrom et al.(6) | 2009 | Suecia | 353 | 100 | 85 | 41 | NR |
| Wu et al.(7) | 2010 | EE. UU. | 318 | 100 | 82 | 34.6 | 100 |
| Hård et al.(8) | 2010 | Brasil | 366 | 91 | 55 | 10 | 99 |
| Wu et al.(9) | 2012 | EE. UU., Canadá | 1,706 | 99 | 36 | 13.1 | 99.7 |
| Zepeda-Romero et al.(10) | 2012 | México | 352 | 55 | 27 | NR | NR |
| Sun et al.(11) | 2013 | China | 590 | 89 | 89 | 45.9 | 98.8 |
| Choi et al.(12) | 2013 | Corea del Sur | 314 | 90 | 53 | 21.7 | 97.3 |
| Lundgren et al.(13) | 2013 | Suecia | 407 | 96 | 24 | 14.1 | 97.7 |
| Piyasena et al. (14) | 2014 | Reino Unido | 410 | 88 | 63 | 8.8 | 99.2 |
| Eriksson et al. (15) | 2014 | Suecia | 104 | 100 | 59 | 10.8 | 100 |
| Ko et al.(16) | 2015 | Taiwán | 148 | 65 | 55 | 15.7 | 92.3 |
| Koçak et al.(17) | 2016 | Turquía | 223 | 84 | 53 | 23 | 95.2 |
| Piermarocchi et al. (18) | 2017 | Italia | 377 | 84 | 55 | NR | NR |
| Jagla et al.(19) | 2017 | Polonia | 79 | 82 | 71 | 59.5 | 88.1 |
| Sanghi et al.(20) | 2018 | India | 70 | 90 | 38 | 53.8 | 83.3 |
| Di Lim et al.(21) | 2020 | Malasia | 92 | 95 | 38 | 29.9 | 96.0 |
| Estudio actual | 2022 | México | 77 | 96 | 84 | 92.5 | 91.0 |
VPP = valor predictivo positivo. VPN = valor predictivo negativo. NR = no se reporta.
Parece importante destacar que los resultados de este estudio difieren de los hallazgos de otro estudio realizado en México, en la ciudad de Guadalajara, por Zepeda-Romero y colaboradores, en el cual se señala que la sensibilidad fue de 55% y la especificidad de 27%.10
Los resultados de este estudio, en conjunto con lo ya ampliamente reportado en otras partes del mundo, sugieren que el análisis de la ganancia de peso semanal en prematuros mediante el algoritmo WINROP predice con alto grado de precisión el desarrollo de ROP. Por lo anterior, el uso de esta herramienta podría ayudar a reducir la carga de trabajo para oftalmólogos pediatras, particularmente en hospitales con gran volumen de pacientes en la UCIN, como los hospitales públicos.5 Sin embargo, su implementación en la práctica clínica habitual requiere un papel más activo de los neonatólogos, a fin de obtener buenos resultados, pero debemos dejar claro que su uso no debe sustituir la realización de oftalmoscopía indirecta para establecer el diagnóstico de ROP.
Los resultados de este estudio deben ser contextualizados con respecto a sus limitaciones, las cuales incluyen un tamaño de muestra que es pequeño, una alta prevalencia de ROP y que se trata de un estudio retrospectivo.











 nueva página del texto (beta)
nueva página del texto (beta)