Introducción
Las enfermedades reumáticas autoinmunes sistémicas (ERAS) son trastornos complejos en los que factores como la luz ultravioleta, las infecciones, las hormonas y los adyuvantes actúan como desencadenantes para iniciar mecanismos inmunitarios aberrantes en individuos genéticamente susceptibles.1 Las ERAS se caracterizan por la pérdida de los puntos de control inmunitario y la activación descontrolada de células efectoras. Este funcionamiento inmunitario aberrante se traduce en anomalías en los circuitos de citocinas y en la producción de autoanticuerpos, que forman el sustrato fisiopatológico del daño tisular y orgánico que define a dichas enfermedades.1
La molécula TRIM21 es una proteína de 52 kDa (Ro52) reconocida por los anticuerpos anti-Ro52/TRIM21, marcadores serológicos encontrados frecuentemente en pacientes con ERAS.2 Como miembro de la familia de proteínas con motivo tripartito, TRIM21 se compone de un dominio RING, una secuencia de caja B de tipo 2 y una región helicoidal. TRIM21 es la enzima ubiquitina ligasa E3, que participa en las modificaciones postraduccionales que conducen a la proteólisis en el proteasoma.3 Después de su activación por una enzima activadora (E1), la ubiquitina se transfiere a una enzima de conjugación (E2), desde donde se transfiere a la proteína diana por la ligasa E3. Este proceso da como resultado la poliubiquitinación de la proteína diana, con la consiguiente captura y degradación por parte del proteasoma (Figura 1).4 TRIM21 media la ubiquitinación de múltiples proteínas, incluidos los factores reguladores de interferón (IRF) y el factor nuclear kappa B (NF-κB).3,5 Por lo tanto, TRIM21 es un potente regulador de la producción de citocinas y su interrupción funcional conduce a mayor producción de interleucinas e interferones.4,6,7
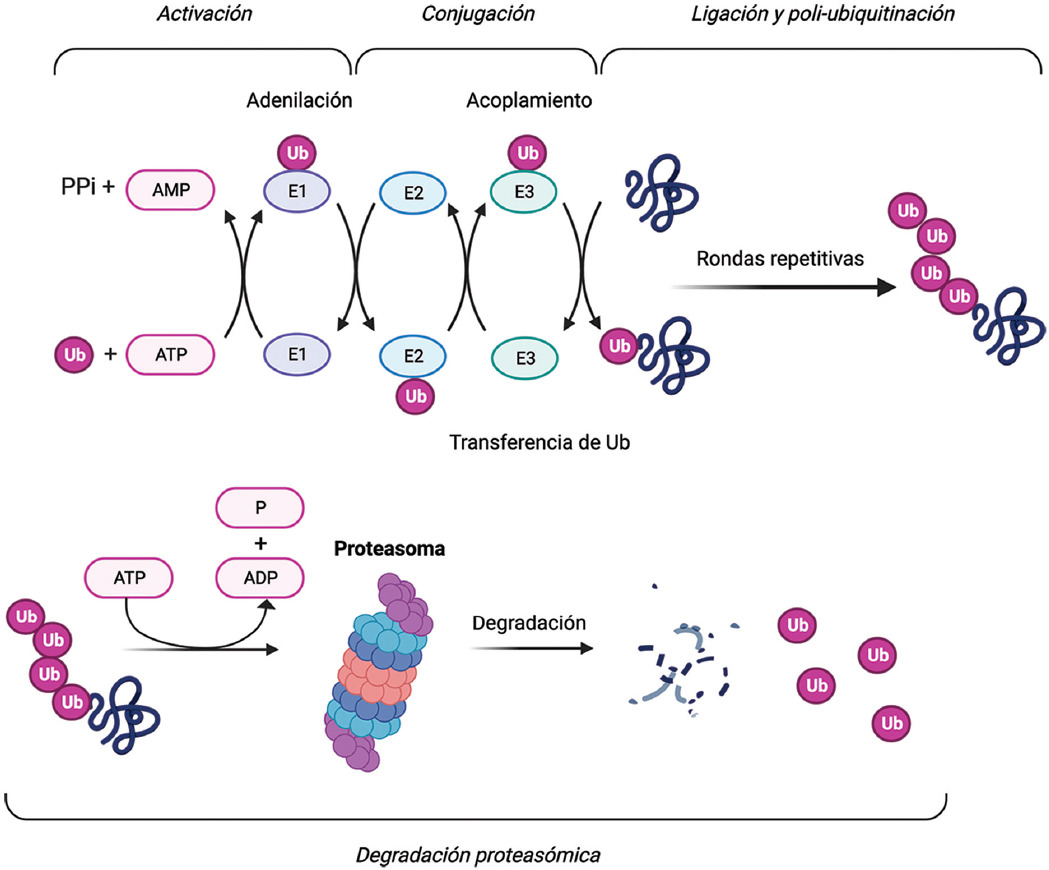
Figura 1 Sistema de ubiquitinación de proteínas para la degradación proteosomal. Primero, la enzima activadora E1 activa a la ubiquitina usando ATP y la transfiere a la enzima conjugadora E2. Por su parte, la enzima ligasa E3 reconoce un sustrato proteico y recluta a la enzima E2 para catalizar la transferencia de ubiquitina desde E2 al sustrato proteico. Después de repetidas rondas de ligación y ubiquitinación, el sustrato proteico poliubiquitinado se transfiere a un complejo de proteasa dependiente de ATP, llamado proteasoma, que degrada a las proteínas dañadas o mal plegadas en polipéptidos más pequeños. Creado con BioRender.com.
Se ha demostrado la interacción de los anticuerpos anti-Ro52/TRIM21 con su blanco antigénico dentro de células vivas (líneas celulares e hibridomas).2,8 Esta interacción conduce a la pérdida de la función reguladora de TRIM21, con el consiguiente aumento de la producción de inmunoglobulinas y mediadores inflamatorios solubles.7 Sin embargo, aún no se han identificado los circuitos de citocinas predominantemente afectados por la presencia de anticuerpos circulantes anti-Ro52/TRIM21 en pacientes con ERAS, ni si estos anticuerpos pueden influir en los niveles séricos de otras moléculas inflamatorias como las quimiocinas y las pentraxinas.
Métodos
El estudio se realizó en el Instituto Nacional de Cardiología "Ignacio Chávez", un hospital de tercer nivel dedicado a la docencia universitaria. Se incluyeron pacientes adultos con diagnóstico de lupus eritematoso sistémico (LES),9 síndrome de Sjögren primario (SSp)10 o esclerosis sistémica (ES).11 Se excluyeron pacientes con superposición autoinmune y conectivopatía indiferenciada o enfermedad mixta del tejido conectivo, aunque se permitió la superposición con el síndrome de anticuerpos antifosfolípidos. Ningún paciente tenía una infección clínicamente aparente. No se incluyeron mujeres embarazadas o puérperas e individuos con antecedente de neoplasia, insuficiencia renal crónica o infección por virus de la hepatitis B o C, o virus de la inmunodeficiencia humana.
El estudio siguió las directrices de la Declaración de Helsinki y el protocolo (No. 16-960) fue aprobado por los comités de investigación y ética del Instituto Nacional de Cardiología "Ignacio Chávez". Los pacientes firmaron el consentimiento informado y autorizaron el uso de datos clínicos y muestras biológicas con fines de investigación.
En el reclutamiento, los pacientes fueron examinados por el mismo reumatólogo y se evaluaron estudios radiográficos y de laboratorio. En pacientes con LES, la actividad de la enfermedad se determinó mediante el índice SLEDAI-2K.12 La afectación específica de órganos se evaluó conforme a las definiciones preestablecidas.13
Los sueros se obtuvieron de sangre venosa por centrifugación (600 g, 15 minutos, 4 oC) y se almacenaron a −70 oC hasta su uso. Cada alícuota se descongeló en condiciones estándar para medir los diferentes mediadores en procesos independientes. Los anticuerpos anti-Ro52/TRIM21 (Orgentec Diagnostika, Alemania; corte para positividad en 25 U/mL) y la proteína amiloide A sérica (ThermoFisher Scientific, Estados Unidos; rango 9.4-600 ng/mL) se cuantificaron mediante ensayo inmunoabsorbente ligado a enzimas. Las citocinas se midieron con un panel 18-Plex Human ProcartaPlex y las quimiocinas con un panel 9-Plex Human ProcartaPlex (ThermoFisher) en una plataforma de lectura Luminex (MagPix, Luminex Corp., Estados Unidos). La proteína C reactiva de alta sensibilidad (hs-CRP) y las proteínas del complemento C3 y C4 se midieron mediante nefelometría (Beckman Coulter, Estados Unidos).
La distribución de datos se evaluó mediante la prueba de D'Agostino-Pearson. De acuerdo con la distribución observada, las medianas (y los valores mínimos y máximos) se utilizaron como descriptores para las variables continuas; para las discretas se utilizaron proporciones y porcentajes. Las diferencias entre grupos (muestras independientes) se analizaron mediante la prueba U de Mann-Whitney; las diferencias entre más de dos grupos se evaluaron con la prueba de Kruskal-Wallis (posprueba de Dunn). Las diferencias entre proporciones se evaluaron mediante la prueba exacta de Fisher o la prueba de chi cuadrada, según correspondiera. Las asociaciones se analizaron mediante el coeficiente r de Spearman, con intervalos de confianza de 95 % (IC 95 %). Los análisis fueron de dos colas con una p < 0.05 como indicativa de significación estadística. Para los cálculos se utilizó GraphPad Prism versión 9.3.1 (GraphPad Inc., Estados Unidos).
Se crearon redes de interacción proteína-proteína con análisis de enriquecimiento funcional para los mediadores solubles identificados como diferentes en función de los anticuerpos anti-Ro52/TRIM21 mediante el programa STRING versión 11.5, de libre acceso online en https://string-db.org14 (accesos registrados entre enero y marzo de 2022).
Resultados
Se reclutaron 167 pacientes con ERAS, cuyo diagnóstico primario fue LES en 143 (85 %), SSp en 16 (9 %) y ES en ocho (4 %). La mediana de edad fue de 41 años (18-81) y 149 fueron mujeres (89 %). La Tabla 1 resume los datos clínicos y de laboratorio.
Tabla 1 Principales datos clínicos y de laboratorio de pacientes con enfermedades reumáticas autoinmunes sistémicas
| Datos clínicos y de laboratorio | Total (n = 167) | Anticuerpos anti-Ro52/TRIM21 | p | ||||
|---|---|---|---|---|---|---|---|
| Positivos (n = 41) | Negativos (n = 126) | ||||||
| Mediana | Mín-máx. | Mediana | Mín-máx. | Mediana | Mín-máx. | ||
| Edad en años | 41 | 18-81 | 45 | 19-79 | 39 | 18-81 | 0.100 |
| Años de evolución | 6 | 3-12 | 4 | 1-18 | 6 | 1-41 | 0.028 |
| Índice de masa corporal (kg/m2) | 24.7 | 15.2-40.4 | 24.9 | 17.9-40.4 | 24.4 | 15.2-37.3 | 0.816 |
| Estudios de laboratorio | |||||||
| Leucocitos (× 103/mm3) | 5.7 | 2.6-14.8 | 4.9 | 2.6-14.8 | 5.8 | 2.7-13.0 | 0.090 |
| Neutrófilos (× 103/mm3) | 3.3 | 1.3-13.3 | 2.7 | 1.3-13.3 | 3.3 | 1.3-9.8 | 0.201 |
| Plaquetas (× 103/mm3) | 227 | 32-595 | 227 | 87-595 | 226 | 32-400 | 0.878 |
| Hemoglobina (g/dL) | 13.6 | 6.0-20.3 | 13.5 | 7.6-20.3 | 13.7 | 6.0-19.1 | 0.324 |
| Creatinina (mg/dL) | 0.7 | 0.3-13.9 | 0.7 | 0.3-6.9 | 0.7 | 0.3-13.9 | 0.564 |
| Nitrógeno ureico (mg/dL) | 14.3 | 4.8-81.9 | 12.9 | 4.8-75.8 | 14.5 | 6.6-81.9 | 0.423 |
| VSG (mm/h) | 10 | 1-140 | 14 | 4-119 | 10 | 1-140 | 0.166 |
| Complemento C3 (mg/L) | 94.4 | 11.9-150.1 | 92.7 | 11.9-135.9 | 94.9 | 23.1-150.1 | 0.062 |
| Complemento C4 (mg/L) | 15.7 | 1.5-43.8 | 13.4 | 1.7-29.0 | 17.0 | 1.5-43.8 | 0.003 |
| n | % | n | % | n | % | ||
| Sexo femenino | 149 | 89 | 38 | 92 | 111 | 88 | 0.566 |
| Enfermedad autoinmune | |||||||
| Lupus eritematoso sistémico | 143 | 85 | 28 | 68 | 115 | 91 | 0.001 |
| Síndrome de Sjögren primario | 16 | 9 | 8 | 19 | 8 | 6 | |
| Esclerosis sistémica | 8 | 4 | 5 | 12 | 3 | 2 | |
| Hipertensión arterial sistémica | 59 | 35 | 13 | 31 | 46 | 36 | 0.707 |
| Diabetes | 12 | 7 | 2 | 4 | 10 | 7 | 0.732 |
| SAF | 31 | 18 | 4 | 9 | 27 | 21 | 0.109 |
| Tratamiento | |||||||
| Glucocorticoides | 80 | 119 | 18 | 43 | 62 | 49 | 0.592 |
| Hidroxicloroquina | 121 | 72 | 23 | 56 | 98 | 77 | 0.009 |
| Ciclofosfamida | 42 | 25 | 9 | 21 | 33 | 26 | 0.681 |
| Micofenolato de mofetilo | 47 | 28 | 14 | 34 | 33 | 26 | 0.325 |
| Azatioprina | 37 | 22 | 5 | 12 | 32 | 25 | 0.086 |
| Metotrexato | 35 | 20 | 10 | 24 | 25 | 19 | 0.516 |
| Anticuerpos | |||||||
| Anticuerpos antinucleares | 167 | 100 | 41 | 100 | 126 | 100 | 1.0 |
| Anti-dsDNA | 112 | 67 | 28 | 68 | 84 | 66 | 1.0 |
| Anti-Ro/SS-A | 70 | 41 | 41 | 100 | 29 | 23 | < 0.0001 |
| Anti-La/SS-B | 28 | 16 | 17 | 41 | 11 | 8 | < 0.0001 |
| Anti-Sm | 23 | 13 | 6 | 14 | 17 | 13 | 0.800 |
| Anti-RNP | 55 | 32 | 11 | 26 | 44 | 34 | 0.444 |
| Antinucleosomas | 80 | 47 | 19 | 46 | 61 | 48 | 0.858 |
SAF: síndrome de anticuerpos antifosfolípidos; VSG: velocidad de sedimentación globular.
En cuanto a los anticuerpos anti-Ro52/TRIM21, 41 pacientes (24 %) fueron positivos. La seropositividad fue mayor en ES (62 %) y SSp (50 %) en comparación con LES (19 %) (p = 0.028. Posprueba: ES versus LES, p = 0.012; SSp versus LES, p = 0.010; ES versus SSp, p = 0.679). Además, los pacientes con anticuerpos anti-Ro52/TRIM21 tenían niveles más bajos de complemento C4 (13.4, 1.7-29.0 mg/L versus 17.0, 1.5-43.8 mg/L, p = 0.003) y una mayor seropositividad para anti-Ro/SSA (100 % versus 23 %, p < 0.0001) y anti-La/SSB (41 % versus 8 %, p <0.0001). Otras variables se presentan en la Tabla 1. La titulación de anticuerpos anti-Ro52/TRIM21 (Figura 2) fue mayor en pacientes con ES (57, 0-105 U/mL), intermedia en SSp (30, 0-94 U/mL) y menor en LES (0, 0-123 U/mL, p = 0.016 para comparaciones múltiples; p no significativa en análisis posprueba).
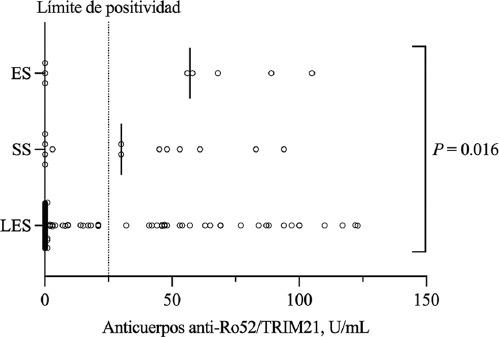
Figura 2 Niveles séricos de anticuerpos anti-Ro52/TRIM21. Los niveles de anticuerpos anti-Ro52/TRIM21 fueron más altos en pacientes con esclerosis sistémica (ES) que en aquellos con síndrome de Sjögren (SS) o lupus eritematoso sistémico (LES). Mediana: 57 U/mL versus 30 U/mL versus 0 U/mL, respectivamente; p = 0.016 para comparaciones múltiples y p no significativa en análisis posprueba. Las líneas verticales indican valores medianos. Punto de corte para positividad = 25 U/mL.
La Tabla 2 muestra los niveles de mediadores solubles según la presencia de anticuerpos anti-Ro52/TRIM21. Hubo diferencias significativas en los niveles de interleucina (IL)-2, IL-4, IL-6, factor estimulante de colonias de granulocitos y monocitos (GM-CSF), IL-21 e IL-22 entre pacientes con anticuerpos anti-Ro52/TRIM21 positivos y negativos. Mientras que varias citocinas fueron indetectables, las quimiocinas analizadas se detectaron consistentemente en casi todas las muestras. En este sentido, los niveles más altos de las quimiocinas CCL4, CXCL8, CXCL10 y CXCL12 se encontraron en pacientes con anticuerpos anti-Ro52/TRIM21. Finalmente, la concentración de hs-CRP fue mayor en pacientes con anticuerpos anti-TRIM21 positivos, mientras que no hubo diferencia en los niveles de proteína amiloide A sérico.
Tabla 2 Niveles séricos de los marcadores inflamatorios en suero
| Marcador | Anticuerpos anti-Ro52/TRIM21 | p | |||
|---|---|---|---|---|---|
| Positivos (n = 41) | Negativos (n = 126) | ||||
| Mediana | Mín.-máx. | Mediana | Mín.-máx. | ||
| Citocinas (pg/mL) | |||||
| Interleucina-27 | 5 | 5-1393 | 5 | 5-487 | 0.176 |
| Interleucina-1β | 0 | 0-46 | 0 | 0-27 | 0.064 |
| Interleucina-2 | 0 | 0-147 | 0 | 0-55 | 0.035 |
| Interleucina-4 | 1 | 1-289 | 1 | 1-218 | 0.009 |
| Interleucina-5 | 0 | 0-282 | 0 | 0-74 | 0.228 |
| Interleucina-6 | 0 | 0-179 | 0 | 0-416 | 0.040 |
| Interleucina-10 | 0 | 0-22 | 0 | 0-58 | 0.069 |
| Interleucina-12p70 | 0 | 0-27 | 0 | 0-137 | 0.268 |
| Interleucina-13 | 0 | 0-19 | 0 | 0-28 | 0.176 |
| Interleucina-17A | 0 | 0-32 | 0 | 0-92 | 0.547 |
| Interferón-gama | 63 | 0-463 | 42 | 0-433 | 0.100 |
| GM-CSF | 1 | 1-273 | 1 | 1-160 | 0.035 |
| Factor de necrosis tumoral | 7 | 0-149 | 0 | 0-137 | 0.066 |
| Interleucina-9 | 0 | 0-17 | 0 | 0-21 | 0.418 |
| Interleucina-23 | 0 | 0-275 | 0 | 0-82 | 0.106 |
| Interleucina-18 | 71 | 0-379 | 56 | 0-1063 | 0.326 |
| Interleucina-21 | 0 | 0-2389 | 0 | 0-874 | 0.001 |
| Interleucina-22 | 8 | 8-187 | 8 | 8-189 | 0.007 |
| Quimiocinas (pg/mL) | |||||
| CCL2 (MCP-1) | 214 | 41-1210 | 187 | 14-3943 | 0.301 |
| CCL3 (MIP-1α) | 72 | 13-423 | 49 | 4-560 | 0.263 |
| CCL4 (MIP-1β) | 326 | 170-739 | 263 | 130-716 | 0.034 |
| CCL5 (RANTES) | 248 | 75-1645 | 173 | 43-8870 | 0.168 |
| CCL11 (eotaxina) | 67 | 13-487 | 59 | 6-435 | 0.394 |
| CXCL1 (GRO-α) | 58 | 13-167 | 41 | 5-357 | 0.066 |
| CXCL8 (interleucina-8) | 16 | 3-88 | 12 | 0-179 | 0.032 |
| CXCL10 (IP-10) | 135 | 31-741 | 91 | 15-992 | 0.007 |
| CXCL12 (SDF-1) | 864 | 374-2727 | 718 | 0-3754 | 0.039 |
| Pentraxinas | |||||
| hs-CRP (mg/L) | 2.9 | 0.5-14.6 | 1.7 | 0-131.0 | 0.007 |
| Proteína amiloide A (ng/mL) | 63 | 0-146 | 66 | 0-147 | 0.719 |
GM-CSF: factor estimulante de colonias de granulocitos y macrófagos; hs-CRP; proteína C reactiva de alta sensibilidad.
Se evaluó la asociación entre los títulos de anticuerpos anti-Ro52/TRIM21 y los mediadores solubles (Tabla 3). Como se observa en la Figura 3, anti-Ro52/TRIM21 mostró una asociación directa con los niveles de IL-2 (r = 0.21), IL-4 (r = 0.18), IL-6 (r = 0.18), IL-10 (r = 0.18), IL-21 (r = 0.30), IL-22 (r = 0.23), CXCL10 (r = 0.22) y hs-CRP (r = 0.22), así como asociación inversa con C3 (r = −0.17) y C4 (r = −0.20).
Tabla 3 Análisis de correlación entre los títulos de anticuerpos anti-Ro52/TRIM21 y los niveles séricos de marcadores inflamatorios
| Marcador | Coeficiente ρ de Spearman | IC 95 % | p |
|---|---|---|---|
| Interleucina-27 | 0.09 | −0.08 a 0.25 | 0.288 |
| Interleucina-1β | 0.10 | −0.06 a 0.26 | 0.208 |
| Interleucina-2 | 0.21 | 0.04 a 0.36 | 0.012 |
| Interleucina-4 | 0.18 | 0.01 a 0.34 | 0.026 |
| Interleucina-5 | 0.12 | −0.04 a 0.28 | 0.153 |
| Interleucina-6 | 0.18 | 0.02 a 0.34 | 0.025 |
| Interleucina-10 | 0.18 | 0.02 a 0.34 | 0.027 |
| Interleucina-12p70 | 0.08 | −0.08 a 0.24 | 0.351 |
| Interleucina-13 | 0.09 | −0.07 a 0.25 | 0.291 |
| Interleucina-17A | 0.03 | −0.14 a 0.20 | 0.709 |
| Interferón-gama | 0.09 | −0.08 a 0.25 | 0.292 |
| GM-CSF | 0.15 | −0.02 a 0.30 | 0.077 |
| Factor de necrosis tumoral | 0.11 | −0.05 a 0.27 | 0.170 |
| Interleucina-9 | 0.06 | −0.10 a 0.23 | 0.433 |
| Interleucina-23 | 0.14 | −0.03 a 0.30 | 0.092 |
| Interleucina-18 | 0.06 | −0.11 a 0.22 | 0.504 |
| Interleucina-21 | 0.30 | 0.14 a 0.44 | 0.0002 |
| Interleucina-22 | 0.23 | 0.07 a 0.38 | 0.004 |
| CCL3 (MIP-1α) | 0.09 | −0.08 a 0.26 | 0.287 |
| CXCL12 (SDF-1) | 0.12 | −0.06 a 0.28 | 0.175 |
| CXCL10 (IP-10) | 0.22 | 0.05 a 0.38 | 0.008 |
| CXCL8 (interleucina-8) | 0.16 | −0.01 a 0.32 | 0.059 |
| CCL11 (eotaxina) | 0.05 | −0.13 a 0.22 | 0.583 |
| CCL5 (RANTES) | 0.05 | −0.15 a 0.25 | 0.616 |
| CCL4 (MIP-1β) | 0.10 | −0.07 a 0.26 | 0.241 |
| CCL2 (MCP-1) | 0.03 | −0.14 a 0.20 | 0.733 |
| CXCL1 (GRO-α) | 0.12 | −0.06 a 0.28 | 0.172 |
| hs-CRP | 0.22 | 0.05 a 0.38 | 0.008 |
| Proteína amiloide A | 0 | −0.17 a 0.17 | 0.978 |
| VSG | 0.14 | −0.04 a 0.31 | 0.117 |
| Complemento C3 | −0.17 | −0.32 a 0 | 0.048 |
| Complemento C4 | −0.20 | −0.35 a -0.03 | 0.016 |
GM-CSF: factor estimulante de colonias de granulocitos y macrófagos; hs-CRP: proteína C reactiva de alta sensibilidad; IC 95 %: intervalo de confianza de 95 %; VSG: velocidad de sedimentación globular.

Figura 3 Asociación entre el título de anticuerpos anti-Ro52/TRIM21 y marcadores inflamatorios. Gráficos con los análisis de correlación que mostraron una asociación significativa entre los niveles de anticuerpos anti-Ro52/TRIM21 y diferentes mediadores inflamatorios solubles. Los valores de los coeficientes ρ de Spearman se presentan en el texto. La línea de regresión se traza en cada gráfico.
La asociación potencial entre los niveles de anticuerpos anti-Ro52/TRIM21 y la actividad de la enfermedad fue evaluada en los pacientes con LES, ya que constituían la población más numerosa. Como se puede apreciar en la Figura 4A, la actividad de la enfermedad no mostró correlación con los niveles de anticuerpos anti-Ro52/TRIM21 (r = −0.003, p = 0.971). Del mismo modo, no encontramos diferencias según la afectación neuropsiquiátrica, vasculítica, articular, renal, hematológica, mucocutánea o serosa (Figura 4B).
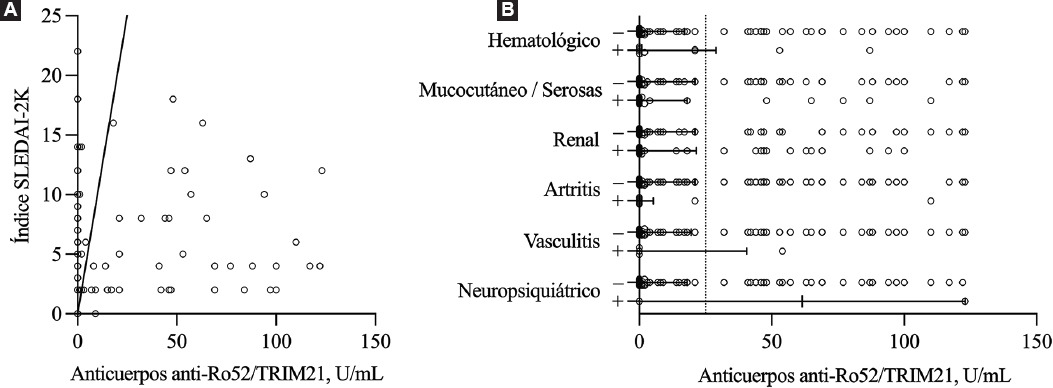
Figura 4 Anticuerpos anti-Ro52/TRIM21 y actividad de la enfermedad en pacientes con lupus eritematoso sistémico. A: el análisis de correlación de Spearman no mostró una asociación lineal entre los niveles de anticuerpos anti-Ro52/TRIM21 y la actividad de la enfermedad evaluada mediante el índice SLEDAI-2K (ρ −0.003, IC 95 % = −0.181 a 0.175, p = 0.971). B: no se encontraron diferencias significativas en los niveles de anticuerpos anti-Ro52/TRIM21 según la presencia de daño órgano-específico en pacientes con LES. Las líneas horizontales denotan valores medianos con rango intercuartílico.
Finalmente, las redes de interacción proteína-proteína mostraron interacciones entre la molécula TRIM21 y diferentes mediadores inflamatorios, principalmente a través de los factores de transcripción IRF3, IRF5, IRF7 y NF-κB (vía su sistema inhibitorio). Estas interacciones se observaron más allá de las esperadas por casualidad y se basaron en relaciones determinadas tanto experimentalmente como por minería de texto (Figura 5).
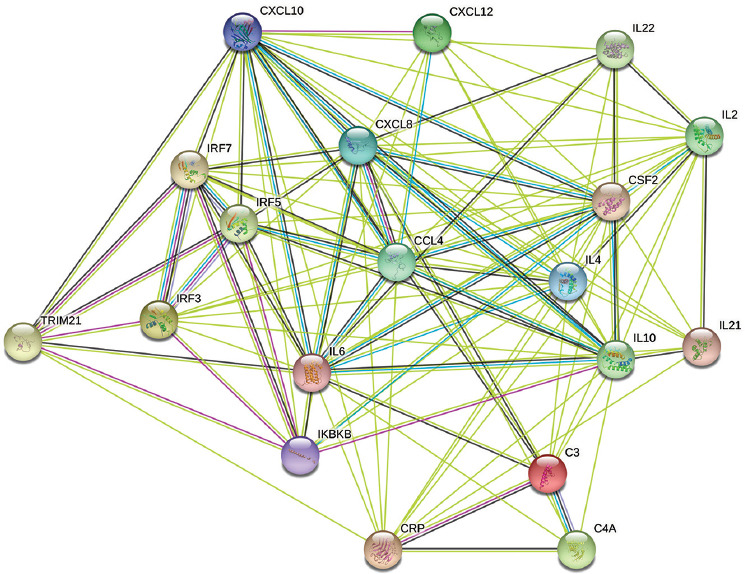
Figura 5 Redes de interacción proteína-proteína con análisis de enriquecimiento funcional. Interacciones entre la molécula TRIM21 y citocinas, quimiocinas y pentraxinas, utilizando como intermediarios los factores de transcripción IRF3, IRF5, IRF7 y NF-κB (a través de su sistema inhibitorio, IKBKB). Se encontraron interacciones más allá de las esperadas por casualidad, tanto en relaciones demostradas experimentalmente (líneas rosas) como en relaciones identificadas mediante minería de texto (líneas verdes). Creado con STRING: Functional Protein Association Networks.
Discusión
En este estudio encontramos que los anticuerpos anti-Ro52/TRIM21 están asociados a una respuesta aberrante del circuito de citocinas del fenotipo Th17 y elevados niveles de moléculas angiogénicas y quimioatrayentes para neutrófilos y monocitos. Esta respuesta anormal se produce independientemente de la actividad de la enfermedad o de la afectación de un órgano específico.
Los autoanticuerpos circulantes se consideran el sello distintivo de las ERAS y la forma como pueden unirse a los antígenos intracelulares para producir alteraciones funcionales ha sido objeto de una intensa investigación.15 Alarcón Segovia et al. demostraron por primera vez la capacidad de algunos anticuerpos anti-ribonucleoproteína para penetrar en las células a través de los receptores Fc-gamma.16 Posteriormente, se ha mostrado la capacidad de otros autoanticuerpos para internarse en células vivas y producir alteraciones funcionales, incluso mediante mecanismos independientes a los de los receptores Fc-gamma.17-20
En cuanto a los anticuerpos anti-TRIM21, se ha observado que los obtenidos de pacientes con LES o SSp se dirigen característicamente al dominio RING funcionalmente activo de la molécula TRIM21 (dominio con actividad de ligasa E3), por lo que pueden inhibir la actividad de ligasa bloqueando estéricamente la interacción E3/E2.2,8 La degradación de proteínas mediada por ubiquitinación regula múltiples procesos celulares, incluido el control del ciclo celular, la transducción de señales, la reparación del ADN, la autofagia y la apoptosis.4,21
Algunos factores de transcripción responsables de la producción de interferones tipo I, como IRF3, son reconocidos por la molécula TRIM21 para la degradación mediada por ubiquitina, lo que da como resultado una regulación a la baja de la producción de interferones tipo I.4 Paralelamente, NF-κB es un factor de transcripción crítico en una amplia variedad de eventos celulares. En las células en reposo, el NF-κB está secuestrado en el citoplasma por la proteína inhibidora IkappaB (IκB). El NF-κB puede activarse transitoriamente a través de receptores de la superficie celular, como el receptor del factor de necrosis tumoral (TNF), el receptor tipo Toll 4 o el receptor de lipopolisacáridos.3 Estos inductores conducen a la activación del complejo IκB quinasa (IKK), que a su vez fosforila IκB, haciéndolo susceptible a la ubiquitinación mediada por TRIM21 con la subsiguiente degradación proteasómica. La degradación de IκB permite que el NF-κB libre se traslade al núcleo, donde promueve la transcripción de múltiples genes implicados en la inflamación, la oncogénesis y la apoptosis. Curiosamente, TRIM21 también puede ubiquitinar IKK, lo que facilita su degradación; por lo tanto, el efecto neto de TRIM21 es como un potente regulador negativo de la señalización de NF-κB al prevenir la fosforilación de IκB a través de IKK.3
Dada la relevancia de TRIM21 como regulador de la respuesta de citocinas, es intuitivo que los anticuerpos anti-Ro52/TRIM21 ejerzan un efecto facilitador en la producción de mediadores inflamatorios. Un estudio reciente demostró que los anticuerpos anti-Ro52/TRIM21 están asociados a la sobreproducción de interferones tipos I y II, así como a la hiperactivación de los linfocitos B, con el consiguiente aumento de la producción de inmunoglobulinas.7 Este estudio también mostró diferencias en la concentración sérica de IL-6, IL-10 y de las quimiocinas de respuesta a interferón CXCL8 y CXCL10.7 Además, se ha observado que las células mononucleares con expresión deficiente de TRIM21 de pacientes con miopatías inflamatorias muestran un fenotipo inflamatorio caracterizado por una mayor producción de IL-6, interferón-a y TNF.6 Asimismo, las células CD4+ deficientes en TRIM21 se caracterizan por sobreproducción de IL-17, una citocina prototípica del fenotipo Th17.6 Este hallazgo es relevante para los resultados de nuestro estudio, ya que la diferenciación de los linfocitos efectores hacia Th17 tiene la función de activar los neutrófilos para mantener la homeostasis epitelial en barreras físicas como piel y mucosas. Además, los linfocitos Th17 son potentes inductores de la inflamación tisular y la autoinmunidad.22
La diferenciación hacia el fenotipo Th17 está mediada por el factor RORγt, que a su vez es inducido por citocinas producidas por células dendríticas como IL-6 e IL-21. Una vez polarizadas, las células Th17 ejercen sus acciones produciendo citocinas de la familia IL-17, incluidas IL-17A e IL-22.22 Es de destacar que los pacientes de nuestro estudio con anticuerpos anti-Ro52/TRIM21 también tenían los niveles más altos de todas las citocinas pertenecientes al fenotipo Th17, así como del factor de proliferación común a todos los linfocitos, IL-2.
En paralelo con un fenotipo Th17 está la activación de los neutrófilos como células efectoras finales de la respuesta inmune. En nuestro estudio, los pacientes con anticuerpos anti-Ro52/TRIM21 tuvieron los niveles más altos de CCL4 y CXCL8, que constituyen las principales moléculas de quimioatracción y desgranulación de neutrófilos, lo que facilita la inflamación neutrofílica aguda.23,24 CXCL10 y CXCL12 inducen poderosas respuestas de quimioatracción para los monocitos y otros leucocitos mientras reclutan células progenitoras endoteliales, regulando así la angiogénesis.25,26
Finalmente, en el análisis de redes de interacción proteína-proteína proponemos cómo los anticuerpos anti-Ro52/TRIM21 podrían bloquear el funcionamiento in vivo de TRIM21 al inhibir su acción como ubiquitina ligasa E3. Una vez perdida esta función, los factores IRF3, IRF5 e IRF7, así como la vía del NF-κB, permanecerían intactos para regular la transcripción de los genes que impulsan la polarización de las células T hacia el fenotipo Th17, al tiempo que facilitan la producción de factores quimioatrayentes de neutrófilos, monocitos e inductores de angiogénesis, completando el círculo patogénico de circuitos aberrantes de citocinas y quimiocinas asociados a la presencia de anticuerpos anti-Ro52/TRIM21.
A pesar de tener sustento biológico, no podemos omitir la falta de asociación entre los anticuerpos anti-Ro52/TRIM21 y la actividad de la enfermedad, al menos en LES. Aunque otros tampoco lograron encontrar asociaciones clínicas,7 se han descrito anticuerpos anti-Ro52/TRIM21 en bloqueo cardiaco congénito, lupus neonatal, enfermedad valvular, miopatía inflamatoria y enfermedad pulmonar intersticial, lo que sugiere que los anticuerpos anti-Ro52/TRIM21 sí están asociados a reacciones autoinmunes.27-31 Además, queda por definir si la asociación entre anticuerpos anti-Ro52/TRIM21 y la respuesta inmune anormal es un proceso estático en el que la mera presencia de anticuerpos condiciona una producción aberrante de citocinas o, por el contrario, si es un fenómeno dinámico donde estos últimos fluctúan continuamente en relación con la actividad de la enfermedad, el funcionamiento de otros anticuerpos, el sustrato genético y otros factores no directamente relacionados con la autorreactividad contra la molécula TRIM21.
Conclusiones
Los anticuerpos anti-Ro52/TRIM21 se detectan frecuentemente en pacientes con ERAS y su presencia se asocia a circuitos aberrantes de citocinas pertenecientes al fenotipo Th17, así como a niveles elevados de moléculas quimioatrayentes de neutrófilos y monocitos y de moléculas angiogénicas, lo que sugiere una participación activa de estos anticuerpos en la regulación de los mecanismos de daño tisular que se producen en las ERAS.











 nueva página del texto (beta)
nueva página del texto (beta)


