Introducción
La fibromatosis desmoide (FD) es una neoplasia benigna rara de origen monoclonal que surge de estructuras muscoloaponeuróticas. La incidencia estimada es de 5 a 6 casos por 1,000,000 de habitantes por año y es más prevalente en pacientes de 30 a 40 años. El curso clínico es impredecible y las recurrencias locales son frecuentes1.
La FD suele ocurrir de forma esporádica, pero aproximadamente el 5% surge en asociación con la poliposis adenomatosa familiar2. El FD de ubicación retroperitoneal es más rara y representa menos del 1% de las masas retroperitoneales3. Las opciones de tratamiento activo incluyen: cirugía, radioterapia, terapia hormonal, quimioterapia y agentes antiinflamatorios4. El curso de la enfermedad es variable e impredecible, incluido el crecimiento, la progresión, la estabilización e incluso la regresión espontánea. A pesar de la tendencia a la recidiva local, los tumores desmoides no metastatizan, pero pueden presentarse lesiones multifocales en la misma extremidad o región5.
Se presenta el caso de una fibromatosis retroperitoneal con un comportamiento agresivo, documentado con imágenes y propuesta terapéutica multidisciplinaria.
Reporte de caso
Se presenta el caso de un paciente varón de 48 años natural de la selva central del Perú. Como antecedente patológico, haber tenido tuberculosis pulmonar con tratamiento completo hace 10 años, hipertensión arterial desde hace cinco años en tratamiento y no ha presentado intervenciones quirúrgicas. Acude al establecimiento oncológico con tiempo de enfermedad de 11 meses caracterizado por dolor abdominal tipo presión, agregándose una marcha claudicante de la extremidad inferior derecha. Al examen clínico, presenta un ECOG (Eastern Cooperative Oncology Group) 2, se palpa una masa en flanco derecho de consistencia dura. Por lo que se realiza tomografía espiral multicorte (TEM) de tórax, que no muestra metástasis pulmonar o de partes blandas, y TEM de abdomen y pelvis, con evidencia de tumoración retroperitoneal de 17 x 12 cm de aspecto sarcomatoso con signos de infiltración vertebral de L2 y músculo psoas (Fig. 1). Una resonancia magnética (RM) de columna lumbar, que revela que la masa presenta extensión vertebral de L2 y transforaminal a nivel de L2-L3 sin estenosis de canal medular (Fig. 2). Se realiza biopsia percutánea de la lesión, con resultado de neoplasia fusocelular con estroma hialinizado, siendo positivo a β-catenina y negativo a S-100 (Fig. 3), compatible este resultado con fibromatosis retroperitoneal. Se realiza endoscopia digestiva alta y baja, no encontrándose pólipos en el tracto gastrointestinal. Se plantea la resección de la lesión tumoral con posibilidad de irradiación postoperatoria. Sin embargo, el paciente se pierde de vista y reingresa al establecimiento a los cinco meses por aumento de la intensidad del dolor, con una nueva TEM de abdomen y pelvis, en donde se evidencia incremento significativo de sus dimensiones, con infiltración de la vena cava inferior, y mayor infiltración del músculo psoas (Fig. 4). Con este resultado se difiere cualquier medida curativa y pasa a manejo sintomático. Debido a que el paciente no aceptó estudios posteriores, no se realizaron estudios genómicos ni imagenológicos. Durante el seguimiento, el estado funcional del paciente fue deteriorándose, limitando la movilidad de miembros inferiores, presentando constipación, permaneciendo en cama todo el día y falleciendo a los 12 meses del diagnóstico por muerte súbita.
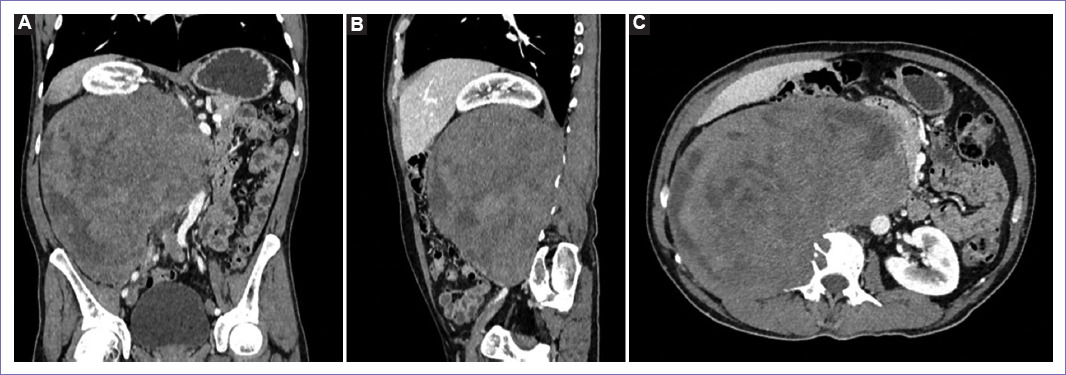
Figura 1 Tomografía espiral multicorte de abdomen y pelvis al ingreso. A: en vista coronal se observa una tumoración de aspecto neoproliferativo a nivel retroperitoneal derecho, de densidad heterogénea con áreas hipodensas (sugiere necrosis), mide 17 x 17 x 12 cm y presenta captación heterogénea del contraste. B: en vista sagital se observa el desplazamiento craneal del riñón derecho, por la masa retroperitoneal anterior a la vena cava inferior. C: en vista sagital se observa el efecto lítico a nivel de cuerpo vertebral de L2 y mala interfase con músculo psoas.
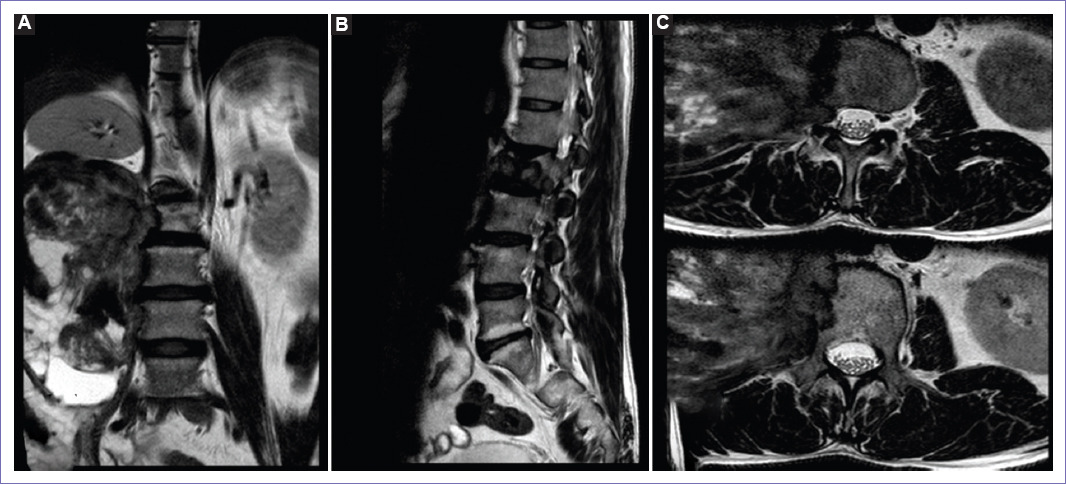
Figura 2 Resonancia magnética de columna lumbar al ingreso. A: en vista coronal se observa en secuencia T2 una masa hipointensa paravertebral derecha. B: en vista sagital se observa la destrucción del cuerpo vertebral L2. C: en vista axial, el cuerpo vertebral de L2 muestra reemplazo medular a nivel de su aspecto lateral derecho por masa retroperitoneal derecha, la cual muestra extensión a nivel foraminal entre L2 y L3 con compresión radicular y contacto del saco dural.
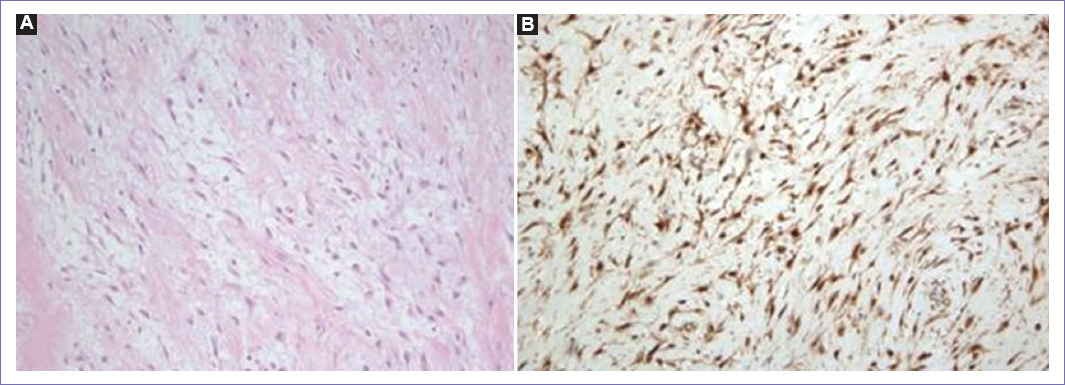
Figura 3 Imágenes de patología. A: microscópicamente, el tumor está compuesto por células fusiformes alargadas y uniformes dentro de un estroma de colágeno. Las células fusiformes muestran un pleomorfismo nuclear (tinción con hematoxilina y eosina a un aumento por 100). B: el estudio de inmunohistoquímica muestra una fuerte positividad nuclear y citoplasmática para la β-catenina (aumentado por 100).
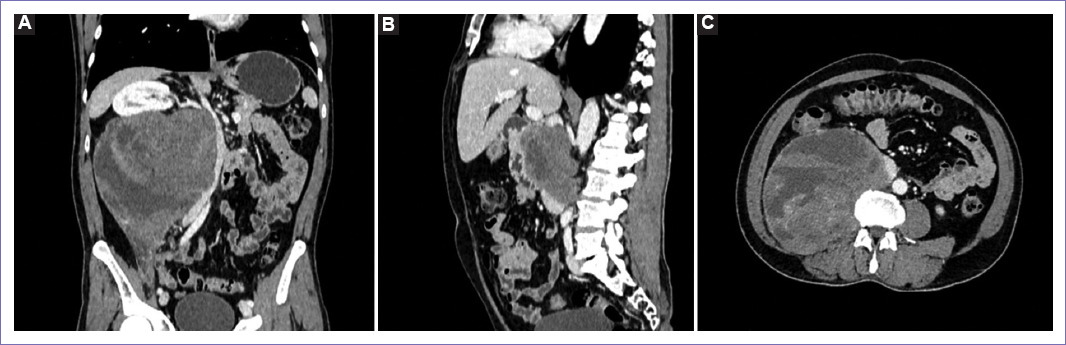
Figura 4 Tomografía espiral multicorte de abdomen y pelvis a los cinco meses. A: masa sólida en el lado derecho del retroperitoneo, muestra captación heterogénea de la sustancia de contraste, mide 21 x 22 x 15 cm, ejerce efecto de masa desplazando hacia cefálico el hilio y riñón derecho, sin evidencia de infiltrarlo, así mismo desplaza el uréter hacia ventral en todo su trayecto; desplaza hacia contralateral la aorta abdominal, páncreas y asas delgadas, contacta la unión de la venas ilíacas. B: el trayecto de la vena cava inferior no se logra representar adecuadamente, por la infiltración de la masa retroperitoneal. C: masa que infiltra el músculo psoas, así como el cuerpo vertebral L2, condicionando lesiones líticas, además se extiende hacia el neuroforamen L2-L3 derecho.
Discusión
La FD, también llamada tumor desmoide o fibromatosis profunda, es una neoplasia mesenquimatosa poco común compuesta por proliferación fibrosa de tejidos blandos. El tumor se caracteriza por un crecimiento localmente agresivo y recurrencia frecuente, aunque nunca hace metástasis6. Puede clasificarse en función de su ubicación anatómica, como pared abdominal, intraabdominal o extraabdominal. En varios estudios, del 28 al 69% de los FD eran intraabdominales (mesentéricos o pélvicos) o localizados en la pared abdominal7. Pero la ubicación de origen retroperitoneal es de incidencia escasa.
Son ampliamente conocidos múltiples factores de riesgo de FD, incluidas mutaciones genéticas del gen de la poliposis adenomatosa coli, como en la poliposis adenomatosa familiar o el gen de la β-catenina, cirugía previa, traumatismo, embarazo y uso de anticonceptivos orales1. Sin embargo, la patogenia de la FD no se comprende completamente. El paciente carecía de algún antecedente de traumatismo abdominal, su único antecedente de drogas era el tratamiento antituberculoso y el antagonista de receptor de angiotensina II. Así mismo se descartó enfermedad polipósica gastrointestinal mediante los estudios endoscópicos.
La FD es más común en mujeres jóvenes, desde la pubertad hasta los 40 años. Sin embargo, la FD intraabdominal no muestra diferencias de sexo ni predilección por edad. La mayoría de los pacientes se presentan como masa abdominal asintomática, pero algunos tienen dolor abdominal leve8. Esto es compatible con nuestro paciente adulto maduro, por presentar una masa que generaba dolor por efecto, al desplazar las vísceras y comprometer paquetes nerviosos. Y al no presentar hemorragia gastrointestinal o perforación de víscera al inicio, alejaba el diagnóstico de una FD mesentérica7.
Ante la presencia de una masa retroperitoneal es necesario obtener una biopsia, para saber a qué nos estamos enfrentando, nos ayudamos por la histología y los marcadores de inmunohistoquímica9. La FD se compone de células fusiformes uniformes y alargadas dentro de un estroma de colágeno. Aunque parece estar bien delimitado en el análisis macroscópico y en las imágenes transversales, a nivel microscópico sus márgenes parecen infiltrar las estructuras adyacentes. Inmunohistoquímicamente, las células tumorales son negativas para las proteínas CD34, CD117 y S-100. Estos hallazgos excluyen los tumores del estroma gastrointestinal y los tumores neurogénicos. La inmunorreactividad para la β-catenina apoya el diagnóstico de FD, pero no es patognomónica de esta enfermedad porque otras entidades, como la fibromatosis superficial, los sarcomas miofibroblásticos de bajo grado y los tumores fibrosos solitarios, también pueden presentar tinción nuclear para la β-catenina10. En nuestro caso, la presentación fusiforme, la negatividad para S-100 y el positivo para β-catenina nos confirmaron que se trataba de una FD retroperitoneal.
En las evaluaciones imagenológicas no es necesario repetir estudios de extensión distantes a la región comprometida, ya que su comportamiento es local progresivo (invadiendo órganos adyacentes y comprometiendo vasos sanguíneos), o recurrente, sin presencia de metástasis10. En la FD intrabdominal, si está ubicado en el mesenterio o intestinos, tiene ventaja la TEM por el movimiento respiratorio. Pero si la ubicación es retroperitoneal, tanto la TEM como la RM van a complementarse10,11. En la TEM, la FD aparece como una masa de tejido blando de atenuación y realce variables, que depende de los componentes del tejido. Con un estroma predominante de colágeno, suele mostrar una atenuación homogénea de los tejidos blandos. Mientras, con una matriz mixoide aparece como una lesión hipodensa. Algunas lesiones pueden aparecer estriadas o en espiral debido a la alternancia del área colágena y mixoide. Puede observarse una atenuación heterogénea debido a necrosis o degeneración. El componente de tejido blando es una característica tan dominante que a menudo parece similar a los tumores sólidos, como el tumor del estroma gastrointestinal, el linfoma o el sarcoma de tejido blando10. En la RM existe una correlación entre la señal de lesión de los tumores desmoides y su composición histológica. El tumor parece tener una señal heterogénea, isointensiva en la ponderación T1 en comparación con el músculo, y una señal variable en T2, de acuerdo con la proporción entre celularidad tumoral y colágeno: en caso de que la celularidad sea significativa, la lesión aparece hiperintensa en T2. Si predomina el colágeno, la señal aparece hipointensa con respecto al músculo12. La utilidad de la tomografía por emisión de positrones aún no está bien establecida debido a su baja actividad metabólica y su incapacidad para hacer metástasis4. En el caso, las imágenes iniciales ayudaron a preplanificar la posibilidad del acto quirúrgico. En las secuencias de las tomografías se observa la evolución natural del compromiso de la vena cava inferior y la destrucción del cuerpo vertebral, y la RM al inicio nos ayudó a explicar la causa de su marcha claudicante por dolor de la extremidad inferior, al estar comprometido el agujero foraminal.
La estrategia de tratamiento inicial actual para FD de cualquier ubicación aboga por un periodo de vigilancia activa, ya que existe la regresión espontánea en un 20%13. En los últimos años, como consecuencia de los resultados insatisfactorios obtenidos con la cirugía, el abordaje inicial se ha orientado hacia una estrategia conservadora, no operatoria, que ahora es la estrategia de elección14. Sin embargo, los pacientes que tienen tumores en lugares potencialmente mortales o limitantes como el retroperitoneo, así como aquellos con dolor intenso, pueden evitar el periodo de vigilancia. La cirugía debe considerarse en los casos de progresión a terapias médicas o de irradiación, siempre considerando la ubicación y la edad. Cuando se realiza una cirugía, se debe tratar de preservar la función, después de considerar todas las alternativas para ello. Los casos de tumores mesentéricos o retroperitoneales no asociados a poliposis familiar pueden tratarse inicialmente con cirugía debido a la morbilidad y síntomas que provocan1. Shen et al, en su serie retrospectiva de 26 casos de FD retroperitoneal, lograron una resección R0 en el 80.77% mediante cirugía multivisceral, observándose progresión tumoral a los cuatro años en el 40 y 28% en el grupo de resección incompleta y completa, respectivamente15.
Respecto a la terapia sistémica, comprende terapia hormonal, fármacos antiinflamatorios no esteroideos, quimioterapia e inhibidores de la tirosina cinasa15. Existe controversia sobre el uso de quimioterapia sistémica en una enfermedad que no conlleva un potencial metastásico; sin embargo, debe considerarse como el tratamiento de primera línea en pacientes con tumores sintomáticos rápidamente progresivos o irresecables. Los fármacos incluyen doxorubicina (sola o en combinación con dacarbazina), vinorelbina, vinblastina y metotrexato. El régimen basado en antraciclinas es similar al que se usa en los sarcomas y se asocia con altas tasas de respuesta. Se administra durante 6-8 ciclos e, independientemente de la combinación utilizada, se consigue una respuesta objetiva o estabilización de la enfermedad en el 80% de los casos, con una respuesta duradera en el 45% de los pacientes16.
Las indicaciones de irradiación en FD son debatidas debido a su toxicidad, especialmente en la población joven. Se recomienda en enfermedad progresiva o en ausencia de otras alternativas terapéuticas17. La tasa de control local es del 75% cuando se utilizó radioterapia más cirugía, del 78% para radioterapia y del 61% para cirugía, incluidos los pacientes con márgenes positivos y negativos1; por tanto, sugieren su uso en sitios anatómicos donde la cirugía puede generar una morbilidad considerable, o riesgo de enfermedad residual (R1 o R2), como en el retroperitoneo.
La dosis recomendada es de 50 a 56 Gy en fracciones de 2 Gy. Janssen et al. publicaron un metaanálisis, concluyendo que la radioterapia adyuvante debe considerarse especialmente en aquellos pacientes con resecciones R1 o R2, ya que tienen mayor riesgo de recurrencia18. Se recomienda que el volumen clínico objetivo (CTV) deber ser una expansión de 1 a 4 cm del volumen tumoral macroscópico (GTV) si fuera posible, según la anatomía limitante como intestino delgado; y el volumen tumoral de planificación (PTV) se recomienda una expansión de 3 a 10 mm del CTV, según los accesorios de inmovilización5,19.
En nuestro caso se había optado por realizar una resección parcial del tumor, dejando una mínima enfermedad adherida al cuerpo vertebral, seguido de adyuvancia con irradiación a dosis de 5,600 cGy en 28 sesiones al lecho quirúrgico en técnica especial de arco volumétrico de intensidad modulada (VMAT). Y si el paciente rechazaba la opción quirúrgica inicial, se hubiera abierto la posibilidad de irradiación en técnica especial VMAT con un PTV de 3,728 ml, a dosis de 5,000 cGy, consiguiendo valores de dosis de irradiación a órganos de riesgos, dentro de los parámetros permitidos en la mayoría, a excepción del riñón ipsilateral que se encuentra confinado por la tumoración (Fig. 5). Sin embargo, el paciente no regresó al establecimiento, por lo que se perdió la posibilidad de manejo activo, por el compromiso de la vena cava inferior, empeorando la limitación funcional, solo quedándole la opción de manejo de dolor.
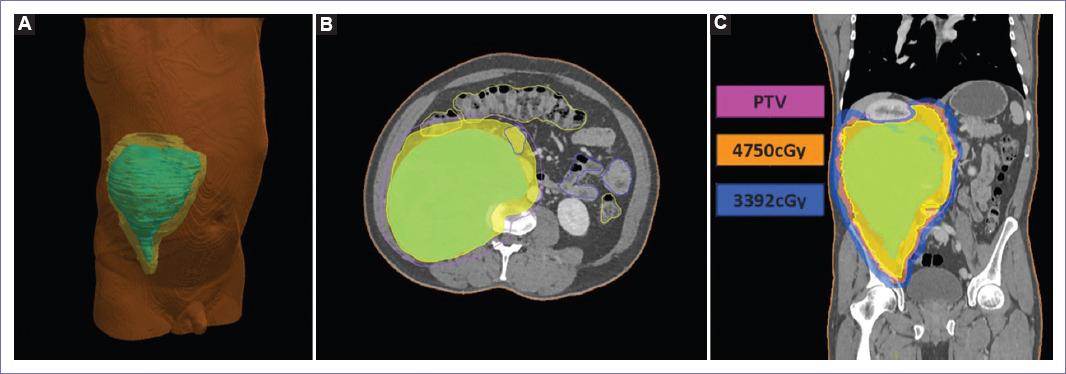
Figura 5 Tratamiento de irradiación. A: reconstrucción tridimensional, localizándose el volumen tumoral macroscópico (GTV) (de color verde) y el volumen clínico objetivo (CTV) (de color amarillo), en hemiabdomen derecho. B: delimitación de los volúmenes de tratamiento, GTV (tumoración grosera, de color verde), CTV (expansión de 10 mm del GTV, de color amarillo) y PTV (expansión de 3 mm del CTV, de color fucsia). C: planificación de irradiación en técnica especial VMAT, con un volumen de CTV y PTV de 3,261 ml y 3,728 ml, con dosis máxima en intestino delgado, y médula espinal de 49 y 44 Gy, con dosis media en hígado, riñón izquierdo y derecho de 20, 12 y 22 Gy.
En el seguimiento, se recomienda monitorizar a los pacientes de forma ambulatoria, realizar un examen físico y una imagen cada tres a cuatro meses, durante los primeros dos años, luego de un tratamiento activo. Posteriormente, los intervalos pueden ser más largos. Cuando se opta por la vigilancia activa, se debe realizar con RM y con TEM para tumores intraabdominales cada mes los primeros dos meses, luego cada tres meses durante un año seguido, cada seis meses durante cinco años y anualmente a partir de entonces1. La calidad de vida en FD retroperitoneal que progresan empeorará por el dolor, el compromiso de vísceras, como uréteres, el compromiso nervioso y muscular, limitando su movilidad, y por lo tanto el paciente se vuelve una persona totalmente dependiente20, como ocurrió con el nuestro al empeorar su estado funcional.
La FD retroperitoneal es rara, y a menudo causa limitaciones funcionales importantes, dolor e incluso discapacidades importantes. Afecta a pacientes jóvenes, por lo que su calidad de vida en una edad productiva y activa se ve gravemente afectada, a pesar de que no provocan metástasis a distancia. El curso impredecible, la escasa incidencia por la localización y el desconocimiento han sido factores limitantes para un avance rápido del manejo de esta compleja patología. Por lo que se debe fomentar la derivación temprana a un equipo multidisciplinario, para que reciba un manejo óptimo y a tiempo, evitando que comprometa estructuras vasculonerviosas imprescindibles. Si es posible, la escisión quirúrgica sería de elección, ya sea completa seguida de observación o incompleta seguida de radioterapia.











 nueva página del texto (beta)
nueva página del texto (beta)


