INTRODUCCIÓN
La ehrlichiosis y anaplasmosis son enfermedades de gran importancia tanto para la salud veterinaria como pública, ya que son responsables de enfermedades como la Ehrlichiosis Monocítica y Anaplasmosis Granulocítica Humana (Vieira et al., 2013; Farhan 2015; Rodríguez-Vivas et al., 2019). Son provocadas por bacterias intracelulares obligadas Gram negativas conocidas como Ehrlichia spp. y Anaplasma spp. respectivamente (Harrus y Waner 2011; Stuen et al., 2013). A nivel mundial, los casos se han incrementado considerablemente en los últimos años principalmente en zonas tropicales y subtropicales donde proliferan las garrapatas vectoras (Rhipicephalus sanguineus e Ixodes spp) (Beugnet y Chalvet-Monfray 2013; Irwin 2014; Little et al., 2014; Battilani et al., 2017). Debido a la cercanía cada vez mayor de las personas con sus mascotas, la probabilidad de picaduras por estos ectoparásitos aumenta considerablemente propiciando a que estas infecciones se están convirtiendo en zoonosis reemergentes (Bhadesiya y Modi 2015; Ismail y McBride 2017).
En México, la Ehrlichiosis canina se reportó por primera vez en 1996, desde entonces el número de casos se ha incrementado considerablemente (Maggi y Krämer 2019); no obstante, el diagnóstico, en muchas ocasiones se basa en signos clínicos sin realizar pruebas de laboratorio que corroboren directa o indirectamente su presencia. El diagnóstico definitivo se centra en técnicas microscópicas; sin embargo, estos métodos tienen baja sensibilidad y especificidad en pacientes con una baja bacteremia, lo cual evita establecer la terapéutica adecuada (Harrus y Waner 2011; Allison y Little 2013). En respuesta a esto, la Reacción en Cadena de la Polimerasa (PCR) surge como una importante herramienta de apoyo a los métodos de diagnóstico convencionales (Almazan et al., 2016; Cetinkaya et al., 2016; de la Fuente et al., 2017).
El estado de Tamaulipas por su ubicación geográfica cuenta con características idóneas que favorecen el desarrollo de garrapatas vectoras de estas enfermedades (Tinoco-Gracia et al., 2009); sin embargo, se desconoce la verdadera magnitud de este problema. Por lo tanto, el principal objetivo de esta investigación fue determinar la presencia de E. canis y A. phagocytophilum, a través de PCR, en perros naturalmente infectados en la zona centro de Tamaulipas; así como evaluar algunos factores asociados a la presencia de estas enfermedades.
MATERIAL Y MÉTODOS
Área de estudio
El presente trabajo se realizó con muestras sanguíneas de perros remitidas (durante el periodo marzo de 2020 a marzo de 2021) al Laboratorio de Parasitología y Análisis Clínicos de la Facultad de Medicina Veterinaria y Zootecnia “Dr. Norberto Treviño Zapata”, perteneciente a la Universidad Autónoma de Tamaulipas. Asimismo, con muestras provenientes de varias clínicas veterinaria particulares de la capital de Tamaulipas y algunos municipios aledaños.
Población de estudio
Se utilizó un muestreo no probabilístico, en el cual se analizaron las muestras de pacientes que se remitieron con los siguientes criterios de inclusión: 1) ser del estado de Tamaulipas (zona centro), 2) presentar signos clínicos relacionados con hemoparásitos (fiebre, diarrea, uveítis, petequias, epistaxis, trastornos osteoarticulares, respiratorios, reproductivos y neurológicos), 3) presentar o haber estado en contacto con garrapatas y 4) tener el consentimiento del propietario de la mascota. El tamaño de muestra fue de 384 animales, que es el tamaño de muestra mínima que se obtiene de la fórmula de (n) para proporciones de poblaciones infinitas, ya que no existe un padrón de población canina en la zona a evaluar (Wayne y Chad 2013). Todos los perros fueron manejados de acuerdo con las normas oficiales de bienestar animal establecido por el Comité de Bioética de la Facultad de Medicina Veterinaria y Zootecnia de la Universidad Autónoma de Tamaulipas.
Colección de muestras
Se obtuvo un mínimo de 3 ml de sangre por punción venosa (vena cefálica), los cuales fueron transferidos rápidamente a un tubo (BD Vacutainer®) con anticoagulante EDTA K2 (ácido etilendiaminotetraacético potásico). Las muestras se mantuvieron en refrigeración (8°C) por no más de 24 horas antes de ser procesada para su evaluación hematológica. Se guardó una alícuota de sangre en viales de 1.5 ml y se almacenó a -20 °C para su posterior extracción de ADN y prueba de PCR. En todos los casos se registró la edad, sexo, raza y estación del año en que se tomó la muestra de los individuos estudiados.
Análisis hematológico
La determinación de los parámetros hematológicos se realizó de forma inmediata, sin que pasaran más de 4 horas de haber obtenido la sangre para evitar alteraciones morfológicas de las células. Las muestras fueron analizadas en un equipo automatizado (Auto Hematology Analyzer, MINDRAY, BC-2800 Vet; Shenzhen, China). Para la determinación de las proteínas plasmáticas se utilizó el método del microhematocrito, utilizando tubos capilares sin heparina; los cuales se llenaron con – partes con sangre, se sellaron y centrifugados (centrífuga KHT-410E Kendal Import S.A.C Gemmy Taiwan) a 11,500 rpm durante 5 min. El plasma obtenido fue colocado en un refractómetro (American Optical) y se obtuvo el total de proteínas. Se realizó el conteo de diferencial leucocitario de manera manual. El primero consistió en valorar y contar en un frotis sanguíneo (teñido con Diff-Quik™) 100 células nucleadas y así obtener el recuento porcentual de los diferentes leucocitos: neutrófilos, eosinófilos, linfocitos, monocitos y basófilos. Para determinar si existía la presencia de anemia se tomó en cuenta el valor del hematocrito, el cual fue categorizado en 2 grupos, con y sin presencia de anemia. El conteo de plaquetas y proteínas totales fueron divididos en 2 grupos, animales con y sin trombocitopenia y con y sin presencia de hiperproteinemia respectivamente. El total de leucocitos, así como sus distintas poblaciones fueron agrupadas como conteos normales, altos y disminuidos.
Identificación de hemoparásitos por microscopía
Para la búsqueda de hemoparásitos por microscopía se elaboraron frotis sanguíneos, los cuales fueron fijados con metanol durante 5 minutos y teñidos con solución Giemsa al 10% durante 15 min. Posteriormente se evaluaron al microscopio con el objetivo de inmersión (100x) múltiples áreas aleatorias de la monocapa y cola del frotis; aquí se buscó la presencia de mórulas (agregados citoplasmáticos de color basofílico) o cualquier otro cuerpo de inclusión compatible con hemoparásitos (Dulmer et al., 2001).
ANÁLISIS MOLECULAR
Obtención de ácidos nucleicos
De las alícuotas de sangre con EDTA almacenadas se realizaron extracciones de ADN mediante el kit comercial de extracción y purificación de ADN (Wizard® Genomic DNA Purification-Promega), de acuerdo con los protocolos establecidos por la compañía. El ADN total extraído fue cuantificado, utilizando un espectrofotómetro (NanoDrop2000®, Thermo Scientific, Waltham, MA, Estados Unidos) y conservado a -20 °C hasta su posterior uso en las pruebas de PCR.
Reacción en Cadena de la Polimerasa
Para el análisis molecular se amplificó una región del gen GltA (utilizado para la identificación de rickettsias que codifica para la enzima citrato sintasa) para E. canis y una región del gen MSP4 (complejo principal de superficie) para A. phagocytophilum. Se utilizó el kit GoTaq® Green Master Mix (Promega, Madison, WI USA. Cat. Num: M7122) de acuerdo a los protocolos establecidos por la empresa. Para esto se utilizó 21 µl de solución del kit, 1 µl del cebador sentido, 1 µl del cebador antisentido y 2 µl del ADN de cada muestra para alcanzar un volumen final de 25 µl. Posteriormente las muestras fueron amplificadas en el termociclador (Applied Biosystems™ Num:2720) con el protocolo de amplificación que se muestra en la tabla 1. Los productos amplificados se analizaron mediante electroforesis en gel de agarosa al 2% en 600 ml de TAE Buffer, 1X (Promega, Madison, WI USA. Cat. Num: V4271) a 120 V por 40 minutos utilizando el colorante de ácidos nucleicos Diamond Nucleic Acid Dye (Promega, Madison, WI USA. Cat.Num: H1181) y posteriormente visualizando bajo luz UV del transiluminador UVP (Productos Ultravioleta, Inc., California, USA. Cat. Num: TFM-30). Se utilizó como control positivo fragmentos de ADN de longitudes conocidas (E. canis, 200 pb; A. phagocytophilum: 980 pb) y un marcador de peso molecular de 100 bp DNA Ladder (Promega, Madison, WI USA. Cat. Num: G210A) como referencia.
Tabla 1 Secuencia de los oligonucleótidos utilizados para cada patógeno, protocolo de amplificación y tamaño del amplificado
| Organismo y gen diana | Secuencia de oligonucleótidos (5'-3') | Programa de amplificación | Tamaño del amplificado (pb) | Referencia |
|---|---|---|---|---|
| 95°C por 5 min | ||||
| E. canis | E. canis Fw ATAAACACGCTGACTTTACTGTTCC | 94°C por 30 s | 200 | Stich et al., 2002 |
| 60 °C por 30 s | ||||
| (GltA) | E canis Rev GTGATGAGATAGAGCGCAGTACC | 72 °C por 1 min | ||
| 72 °C por 7 min | ||||
| 35 ciclos | ||||
| 94°C por 5 min | ||||
| A. phagocytophilum | MSP4AP5 ATGAATTACAGAGAATTGCTTGTAGG | 94°C por 30 s | ||
| 50 °C por 30 s | 849 | Yousefi et al.,2019 | ||
| MSP4AP3 | 72 °C por 30 s | |||
| (Msp4) | TTAATTGAAAGCAAATCTTGCTCCTATG | 72 °C por 7 min | ||
| 35 ciclos |
Análisis estadísticos
Se representaron las frecuencias absolutas y porcentajes de casos positivos y hallazgos hematológicos. El grado de asociación entre la presencia de patógenos y las variables evaluadas (sexo, edad, raza, época del año y parámetros hematológicos); se analizaron mediante la prueba de independencia de Chi cuadrada con un nivel de significancia de 0.05; utilizando el programa estadístico MedCalc. V. 7.0.
RESULTADOS
Presencia de E. canis y A. phagocytophilum
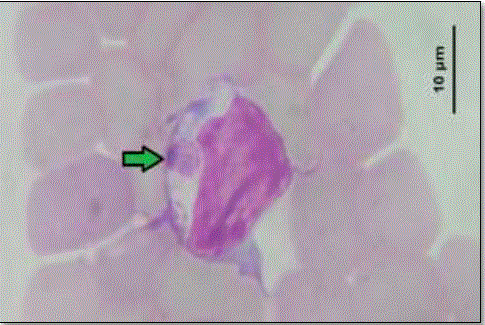
Del número total de muestras analizadas (384) durante el periodo de estudio, 103 resultaron positivos a E. canis (frecuencia de 26.8 %) mediante la técnica de PCR, donde se amplificó el gen GltA con un tamaño molecular esperado de 200 pb, como se puede observar en la figura 1. De los frotis sanguíneos evaluados se logró identificar E. canis en sólo 41 de las muestras evaluadas (10.7%). Las mórulas se observaron en el citoplasma de linfocitos y monocitos como estructuras redondas, con un tamaño entre 4 a 6 µm de diámetro que se tiñeron fuertemente de un color basofílico; como se muestra en la figura 2. Por otro lado, ninguno de los perros evaluados por PCR o evaluación de frotis resultó positivo para A. phagocytophilum (figura 3).

(M) Marcador de peso molecular, (C+) control positivo con peso molecular de 200 pb, (115, 117,118, 119, 120, 121, 126) muestras positivas, (C-) control negativo con agua bidestilada. Gel de agarosa al 2%, teñido con Diamond.
Figura 1 Amplificación por PCR de E. canis en muestras de sangre tomada de caninos
Características de la población canina
Se evaluaron 192 hembras (50%) y 192 machos (50%), con edades comprendidas entre 3 meses hasta 20 años. Los resultados observados nos muestran que E. canis no distingue entre género; ya que dentro del grupo de infectados los porcentajes de hembras (29.7) y machos (24.0) no fueron estadísticamente significativos (p>0.05). Al evaluar la relación entre la edad del perro (cachorros, adultos o seniors) y el porcentaje de positivos a E. canis, se determinó que existe relación significativa entre ambas variables, donde la condición de adulto (1 a 7 años) está relacionada con la presencia de la enfermedad (p<0.05) (tabla 2).
Tabla 2 Frecuencias y porcentajes de positivos y negativos a E. canis agrupados por característica del animal y época del año
| Presencia de E. canis | Valor de p | ||||
|---|---|---|---|---|---|
| Variable | Positivo Frecuencia | % | Negativo Frecuencia | % | |
| Sexo | 0.205 | ||||
| Macho | 42 | 24.0 | 146 | 76.0 | |
| Hembra | 57 | 29.7 | 135 | 70.3 | |
| Edad | 0.016 | ||||
| Cachorro (0-12 meses) | 16 | 22.2 | 56 | 77.8 | |
| Adulto (1 a 7 años) | 69 | 32.5 | 143 | 67.5 | |
| Senior (>7 años) | 18 | 18.0 | 82 | 82.0 | |
| Raza | 0.981 | ||||
| Mestizo | 19 | 26.0 | 54 | 74.0 | |
| De raza | 84 | 27.0 | 227 | 73.0 | |
| Época del año | 0.816 | ||||
| Primavera-Verano | 71 | 26.3 | 199 | 73.7 | |
| Otoño-Invierno | 32 | 28.1 | 82 | 71.9 | |
Los perros de raza representaron el 81% (311/384) de la población de estudio y los mestizos constituyeron el 19% (73/384); sin embargo, la prueba de independencia de chi cuadrada no encontró diferencias estadísticas significativas entre el resultado positivo a E. canis, en relación con los grupos raciales definidos y los mestizos (p>0.05) (tabla 2). De la misma manera, no se encontraron diferencias significativas entre la presencia de Ehrlichiosis con la época del año (tabla 2).
Variables hematológicas
En relación con los hallazgos de laboratorio para los perros positivos a E. canis no existió diferencias significativas en aquellos que presentaban anemia, trombocitopenia o hiperproteinemia comparado con los animales negativos quienes muchos de ellos presentaban porcentajes parecidos al grupo de infectado (p>0.05). Por otro lado, sí se encontraron diferencias significativas para algunos parámetros de la serie blanca, como el recuento total de leucocitos y neutrófilos (p<0.05). Sin embargo, para estos analitos, la mayor cantidad de perros infectados con Ehrlichia fueron los que resultaron con valores dentro de los rangos de referencia, en comparación con los animales que resultaron negativos en donde se muestra una gran cantidad de perros con leucocitosis o neutrofilia. Para el resto de los parámetros hematológicos evaluados la prueba estadística no encontró diferencias significativas (p>0.05), como se observa en la tabla 3.
Tabla 3 Frecuencias y porcentajes de positivos y negativos a E. canis agrupados en serie roja y plaquetas
| Presencia de E. canis | Valor de p | ||||
|---|---|---|---|---|---|
| Variable | Presencia de E. canis Positivo Frecuencia | % | Negativo Frecuencia | % | |
| Hematocrito | 0.280 | ||||
| Anemia (< 0.37 L/L) | 49 | 24.3 | 153 | 75.7 | |
| Sin anemia (≥0.37 L/L) | 54 | 29.7 | 128 | 70.3 | |
| Proteínas Plasmáticas | 0.739 | ||||
| Sin hiperproteinemia (<75 g/L) | 45 | 25.7 | 130 | 74.3 | |
| Con hiperproteinemia (>75 g/L) | 58 | 27.8 | 209 | 72.2 | |
| Plaquetas | 0.946 | ||||
| Trombocitopenia(<180X109/L) | 6 | 28.6 | 15 | 71.4 | |
| Sin trombocitopenia (≥180X109/L) | 97 | 26.7 | 266 | 73.3 | |
| Leucocitos | 0.005 | ||||
| Leucopenia (<6x109/L) | 3 | 15.8 | 16 | 84.2 | |
| Normal (6-17x 109/L) | 71 | 33.3 | 142 | 66.7 | |
| Leucocitosis(>17x109/L) | 29 | 19.1 | 123 | 80.9 | |
| Monocitos | 0.060 | ||||
| Sin Monocitosis (≤1.4x109/L) | 31 | 21. | 116 | 78.9 | |
| Monocitosis(>1.4x109/L) | 72 | 30.4 | 165 | 69.6 | |
| Linfocitos | 0.235 | ||||
| Linfocitosis(>4.8x109/L) | 12 | 18.5 | 53 | 81.5 | |
| Normal (1.0-4.8x109/L) | 72 | 28.1 | 184 | 71.9 | |
| Linfopenia(<1.0x109/L) | 19 | 30.2 | 44 | 69.8 | |
| Neutrófilos Segmentado | 0.004 | ||||
| Neutropenia (<3.0 x109/L) | 30 | 18.4 | 133 | 81.6 | |
| Normal (3.0-11.5x109/L) | 70 | 33.8 | 137 | 66.2 | |
| Neutrofilia(>11.5x109/L) | 3 | 21.4 | 11 | 78.6 | |
| Eosinófilos | 0.575 | ||||
| Sin eosinofilia (<0.9x109/L) | 90 | 26.2 | 253 | 73.8 | |
| Con Eosinofilia (>0.9x109/L) | 13 | 31.7 | 28 | 68.3 | |
DISCUSIÓN
Hoy en día, la ehrlichiosis y anaplasmosis canina han ganado mayor importancia a nivel mundial, lo cual se atribuye principalmente a que su vector (Rhipicephalus sanguineus) es considerado como la especie de garrapata con mayor distribución geográfica (Aguiar et al., 2007; Parola et al., 2013; Cabezas-Cruz et al., 2019). En este trabajo de investigación se encontró que del número total de perros evaluados (384), 103 resultaron positivos a E. canis (26.8 %) mediante la técnica de PCR y solamente 41 (10.7%) a través de la evaluación del frotis sanguíneo. Esta discrepancia de los 2 métodos utilizados es similar a lo reportado por Happi et al., (2018), quienes de un total de116 muestras de perros sólo 10.3% resultaron positivas por microscopía, comparada con la técnica de PCR donde se obtuvo 42 resultados positivos (36.2%). Estos resultados eran de esperarse, ya que aunque el diagnóstico por visualización microscópica de las típicas inclusiones intracelulares o mórulas dentro del citoplasma de los monocitos o linfocitos en extendidos de sangre periférica (figura 3), ha sido de gran importancia; esta técnica presenta ciertas desventajas, como la falta de sensibilidad durante la fase temprana de la infección, cuando existe una baja bacteremia; o bien, cuando la bacteria se multiplica en microcolonias intracitoplasmáticas en órganos linfoides donde adquirirá mecanismos que aseguren la evasión de la respuesta inmune dentro de la célula del hospedero (Bai et al., 2017; Manasa et al. 2017; McClure et al., 2017; Tominello et al., 2019;Franco-Zetina et al., 2019). Además, se han reportado falsos negativos en casos crónicos o transitorios, debido a que las mórulas suelen desaparecer cinco a ocho días después de la infección, como se ha revelado en estudios experimentales en perros y ganado (Gal et al., 2008; Stuen et al., 2013).
En México, estas enfermedades frecuentemente son subdiagnosticadas, contando con pocos estudios que determinen su prevalencia. En el 2009 en Yucatán se registró una seroprevalencia de ehrlichiosis canina del 45% (Jiménez-Coello et al., 2009) y en otra investigación donde participaron 28 estados de la República Mexicana, donde se determinó la presencia de anticuerpos contra Anaplasma spp., Borrelia burgdorferi y E. canis; registrándose una alta prevalencia para E. canis (55%) y moderada para Anaplasma spp (16,4%), para algunos estados del noreste como Coahuila y Nuevo León (Movilla et al., 2016). Geográficamente los animales que participaron en este estudio pertenecen a la zona noreste de México; sin embargo, si comparamos la prevalencia obtenida en la zona centro de Tamaulipas para E. canis (26.8%) con estos dos estados, sería mucho menor. No obstante, es importante mencionar que en ese estudio se utilizaron pruebas serológicas, las cuales pueden tener el inconveniente de presentar reacción cruzada con otros microrganismos estrechamente relacionados; sobrestimando los resultados de prevalencia y planteando la necesidad de realizar estudios con técnicas moleculares que permitan evidenciar con mayor exactitud el tipo de patógeno implicado (Cetinkaya et al., 2016).
En el 2019, se realizó un estudio de detección molecular de E. canis en zonas rurales de Yucatán, encontrando un 29.26% de prevalencia (Ojeda-Chi et al., 2019), lo cual es cercano a lo reportado en este trabajo (26.8%); pero mucho mayor comparada con la prevalencia encontrada en perros evaluados en la Comarca Lagunera (4%) (Almazán et al., 2016).
En cuanto a las infecciones por A. phagocytophilum, se han diagnosticado cada vez más en animales de compañía y de granja a nivel mundial (McMahan et al., 2016). En México, A. phagocytophilum, se ha detectado en zarigüeyas y perros del estado de Campeche, con una prevalencia de 3 y 27%, respectivamente (Rojero et al., 2017); sin embargo, en este trabajo ninguno de los perros evaluados resultó positivo por PCR o frotis sanguíneo. Esto no es sorprendente, ya que Ixodes spp. y Dermacentor spp., garrapatas poco frecuentes en la zona de estudio, han sido reconocidas como los vectores de mayor importancia en el ciclo de transmisión de esta bacteria, lo cual pudo contribuir a su nula presencia (Tinoco-García et al., 2009; Guzmán-Cornejo et al., 2016; Rodríguez-Vivas et al. 2019).
Los resultados observados en esta investigación muestran que E. canis no tiene predilección entre género, ya que dentro del grupo de los infectados los porcentajes de hembras (29.7) y machos (24.0) no fueron estadísticamente significativos (p>0.005). Esta misma variable ha sido estudiada por varios autores (Nuñez, 2003; Rodríguez-Vivas et al., 2005), encontrando resultados similares. No obstante, esto discrepa de lo registrado por otros investigadores, donde sostienen que las hembras, especialmente durante el celo preñez o parto, favorecen el riesgo de contraer infecciones por E. canis (Salazar et al., 2014; Abdelfattah et al., 2021).
En relación con los hallazgos hematológicos asociados a la presencia de ehrlichiosis y anaplasmosis canina, se ha registrado que dichas alteraciones dependerán en qué fase de la enfermedad se encuentran (Afusat et al., 2020). Durante la etapa aguda es común la presencia de anemia, la cual suele ser leve a moderada (usualmente normocítica, normocrómica, no regenerativa) (Eberts et al., 2011).
En este trabajo, la presencia de anemia no se relacionó significativamente con ninguna de las enfermedades. La trombocitopenia ha sido un hallazgo hematológico que tradicionalmente ha sido asociado a la ehrlichiosis canina (Piratae et al., 2019). Sin embargo, en este estudio la presencia de trombocitopenia (<200,000) no tuvo asociación con los animales positivos a E. canis. Diversos estudios han reportado una asociación entre el número de plaquetas y la presencia de E. canis, particularmente en animales con recuento celular plaquetario inferior a 100 X109/L (Bulla et al., 2004; Tngsahuan et al.,2020). Aunque en este estudio se reportaron muchos animales con presencia de anemia e hiperproteinemia, no existe asociación estadística significativa al compararlos con animales que resultaron negativos; lo anterior puede deberse a la posible presencia de otros hemoparásitos como Ehrlichia ewingii o Anaplasma platys, los cuales pueden producir grados de anemia e hiperproteinemia similares a los reportados en perros infectados con E. canis (Piratae et al., 2019).
Por otro lado, es posible que muchos de los individuos positivos a E. canis con resultados hematológicos sin alteraciones, hubieran estado en la fase subclínica de la enfermedad; esto último sería de gran importancia ya que si la enfermedad no se detecta durante esta fase podría progresar a una etapa crónica, produciendo graves daños irreversibles como trombocitopenia, leucopenia y anemia severa no regenerativa producto de una supresión de la médula ósea (Little et al., 2014).
En cuanto a la evaluación de la serie blanca, se observa que a pesar de la existencia de diferencias significativas entre los casos negativos y positivos a E. canis para el conteo total de leucocitos, neutrófilos y monocitos; los resultados no eran lo esperado, ya que los perros negativos resultaron con más alteraciones en estas células (ya sea que estuvieran aumentadas o disminuidas), comparados con los positivos. Estos hallazgos concuerdan con los resultados obtenidos por Asgarali y colaboradores (2012), quienes reportaron que perros con Ehrlichiosis manifestaron niveles de neutrófilos y monocitos dentro de rangos de referencia; a diferencia de los animales negativos, los cuales tuvieron un aumento significativo en dichas células. Una posible explicación de por qué muchos de los perros positivos resultaran sin alteraciones en la serie blanca, es porque tal vez estos animales pudieron encontrarse en la fase subclínica de la enfermedad, donde la mayoría son asintomáticos y no presentan alteraciones hematológicas de consideración (de Castro et al., 2004).
CONCLUSIONES
El presente estudio evidenció que las alteraciones hematológicas evaluadas en perros con signología sospechosa a Ehrlichia canis resultaron no ser específicas, ya que una gran cantidad de estos animales no se encontraban infectados. Por otro lado, muchos de los perros que sí resultaron positivos, permanecieron sin cambios aparentes en sus hemogramas, lo cual es de gran relevancia, ya que estos individuos si no se diagnostican a tiempo podrían ser reservorios para otros hospedadores incluyendo el ser humano. Además, el clínico veterinario debería considerar que estas enfermedades pueden cursar por un cuadro subclínico sin signología o con la presencia de co-infecciones que produzcan signos similares, lo cual dificultarían su diagnóstico y por ende el tratamiento adecuado. Se sugieren realizar más investigaciones que incluyan la detección de otras especies de hemoparásitos en la región, debido a su importancia como agentes potencialmente zoonóticos.











 texto en
texto en