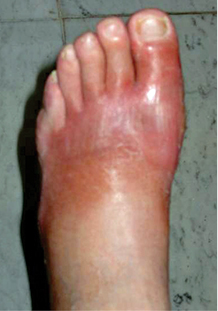
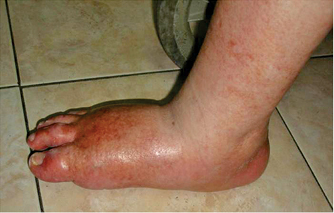
Introducción
La artropatía neuropática es uno de los trastornos degenerativos de las articulaciones de mayor interés, cada vez más comunes dentro de la patología ortopédica. (1)
Se define como una artropatía degenerativa crónica progresiva que afecta a una o más articulaciones periféricas que se desarrolla como resultado de una falla en la percepción sensorial normal (dolor y propiocepción) en la inervación de las articulaciones. Sin embargo, el diagnóstico de artropatía neuropática puede hacerse solamente con la presencia de un desorden neurológico subyacente. (2)
Musgrave en 1703 describió por vez primera la artropatía neuropática en su libro Arthritide symptomatica. Describió la inflamación de las articulaciones en un paciente que presentaba "parálisis fláccida". Mitchell documentó en 1831 cambios "extraños" en las articulaciones de un paciente con parálisis de la médula espinal secundaria a tuberculosis. (3) En 1868 Jean-Marie Charcot(4),(5) dio la primera descripción detallada de la rápida evolución, deterioro e inestabilidad de las articulaciones en pacientes con tabes dorsal. Sokoloff reveló en 1892 la asociación de las articulaciones neuropáticas de la extremidad superior con siringomielia. En 1936 Jordan(6) asoció la diabetes mellitus con cambios neuropáticos en el pie y el tobillo.
Chandler y Wright en 1958(7) documentaron cambios neuropáticos asociados a aplicaciones intraarticulares de esteroides. La diabetes, la sífilis y la siringomielia son las entidades clínicas más comúnmente asociadas a la artropatía neuropática. La lepra, espina bífida, la insensibilidad congénita al dolor y muchos otros trastornos también se asocian a esta condición, aunque de forma menos frecuente. Se han referido hasta la fecha más de 24 enfermedades como causantes de la "articulación de Charcot". Hoy en día la diabetes mellitus es la principal etiología. La neuroartropatía de Charcot es una enfermedad degenerativa progresiva que afecta las articulaciones del pie. Fue observada por primera vez en pacientes con lepra y en alcohólicos. Cualquier condición que ocasione una neuropatía sensorial o autonómica puede conducir a una deformidad de Charcot.(2),(8),(9),(10),(11)
A menudo se asocia a daño nervioso relacionado con la neuropatía diabética que disminuye la capacidad de percibir los estímulos sensoriales, principalmente el dolor y disminuye los reflejos musculares que controlan el movimiento. Como resultado, las articulaciones de los pies son sometidas a traumatismos y lesiones repetitivas, ocasionando un efecto "neurotraumático", dañando progresivamente los ligamentos, cartílagos y huesos. El pie de Charcot con frecuencia afecta las articulaciones del mediopié, retropié y antepié. (12),(13),(14),(15),(16),(17) A menudo se confunde con osteomielitis e infección masiva del pie, por lo que debe identificarse de forma precoz. Iniciar el tratamiento en las primeras fases es primordial para evitar la amputación de la extremidad.
Con el surgimiento de las técnicas quirúrgicas avanzadas y una mejor comprensión de la enfermedad, se recurre con menor frecuencia a la amputación como tratamiento estándar. Al entender a fondo los factores etiológicos y las condiciones que ocasionan la deformidad, puede planificarse el tratamiento para cada paciente en particular. La etiología de la artropatía de Charcot ha sido estudiada por varios autores. Johnson(18) documentó 118 pacientes con artropatía de Charcot en distintas articulaciones, además de realizar estudios en animales, describió tres etapas consistentes en el desarrollo de una articulación de Charcot, independientemente de la ubicación, que se producen después de la denervación de la articulación.
Una de las teorías que tratan de explicar los cambios que ocurren en la artropatía de Charcot es la teoría neurovascular, ésta se refiere al aumento en el flujo de sangre periférica de los huesos del pie siendo el responsable de la reabsorción ósea, desmineralización y osteopenia que se encuentran en este padecimiento.(19),(20),(21)
El aumento de la perfusión se debe a la pérdida del tono simpático vascular asociada a la neuropatía autonómica.(22),(23),(24)
La patología neuropática del pie diabético no sólo afecta los nervios sensoriales de forma selectiva, también se ven afectadas las fibras autonómicas de los nervios motores, por lo que la neuropatía es mixta, la inervación parasimpática es responsable de la inervación de los vasos sanguíneos menores, glándulas sudoríparas y los músculos piloerectores del pie. Cuando se pierde el tono de las fibras simpáticas, se produce vasodilatación y aumento de la perfusión periférica de la piel del pie, ésta se torna caliente, seca, anhidrótica con pérdida de los folículos pilosos, por lo que se presenta el edema neuropático. Archer(25) demostró que la temperatura promedio de la piel aumenta aproximadamente 7 grados centígrados en el pie neuropático, en comparación con el pie normal, en el estudio Doppler el flujo sanguíneo en el pie neuropático es cinco veces mayor que en el paciente control. Boulton(26) publicó que la pO2 de la sangre venosa en los pacientes con pie neuropático es significativamente más alta que en los sujetos control. La disminución de la perfusión distal de O2 en las células se atribuye a la pérdida de la función simpática,(27),(28),(29) así como a la calcificación vascular que revelan las radiografías aplicadas a estos pacientes,(30) ya que el músculo existente en la túnica media arterial se atrofia y se calcifica,(31) lo cual no está relacionado con la edad, gravedad o duración de la diabetes, sino con el grado de neuropatía presente. Las presiones elevadas anormales en los huesos dañados del pie son los factores que condicionan las úlceras cutáneas en el pie de Charcot.(32) Duncan(33) estudió la inervación simpática ósea demostrando que la pérdida de estas fibras ocasiona aumento en el flujo sanguíneo e hiperemia ósea.
Las contribuciones de todos estos autores han demostrado que una circulación periférica normal no condiciona el desarrollo de la artropatía de Charcot.
El pie de Charcot se presenta con mayor frecuencia en pacientes con diabetes mellitus, pero también puede atribuirse a otras condiciones sistémicas.(34) En la diabetes mellitus los niveles de glucosa en sangre se encuentran elevados y la mayoría de los problemas de los pies se originan de dos complicaciones graves de la enfermedad: daño a los nervios y circulación arterial anormal.(35),(36),(37),(38),(39),(40)
Esta neuroartropatía es una de las complicaciones más graves de la diabetes mellitus, pues ocasiona importantes deformidades en el tobillo y pie con gran discapacidad en el paciente.(41)
Incidencia y prevalencia
De acuerdo con la Asociación Americana de la Diabetes, más de 25 millones de personas en Estados Unidos tienen esta enfermedad, alrededor de 8% de la población también la padece y no está diagnosticada. De 60-70% de las personas con diabetes desarrollan daño en los nervios periféricos y hasta 29% de estos pacientes pueden presentar artropatía de Charcot. En la mayoría de los casos esta complicación es tardía, por lo general aparece después de que el paciente ha padecido diabetes durante un largo período.(42) El paciente típico se presenta con obesidad mórbida, con tiempo de evolución de 10 o más años y sufre de neuropatía caracterizada por insensibilidad en las pruebas clínicas.(43) El daño a los nervios, o neuropatía, conduce a la pérdida de sensibilidad en los pies.
Los pacientes ya no pueden sentir cuando algo ha irritado o incluso perforado la piel, la lesión inicial puede ser tan pequeña como una ampolla y progresar a una infección grave en cuestión de días.(44) La neuropatía motora en la extremidad inferior diabética tiende a precipitar una debilidad de los grupos musculares de la extremidad inferior, la presencia del desequilibrio dinámico y funcional ocasiona las deformidades complejas del pie. Los grupos musculares más afectados son los de la cara anterior de la pierna y los músculos intrínsecos del pie. La pérdida de los músculos intrínsecos del pie provoca contractura de las articulaciones metatarso falángicas, dedos en garra y en martillo, el roce de los dedos con el calzado y la insensibilidad de los mismos puede provocar úlceras sobre las hiperqueratosis dorsales y las cabezas de los metatarsianos.
La pérdida de fuerza de los músculos anteriores de la pierna provoca un desequilibrio muscular y una deformidad en equino del pie con estrés patológico en las articulaciones tarso metatarsianas. Conforme la debilidad progresa, se presenta contractura de los músculos isquiotibiales con la consiguiente contractura en flexión de la rodilla, lo que ocasiona aumento de la presión en la parte anterior del pie.
La teoría neurotraumática del pie de Charcot se basa en que la presión excesiva (trauma repetitivo) en un pie que no tiene sensibilidad puede provocar fracturas microscópicas o macroscópicas e iniciar un proceso de consolidación con un callo exuberante.
La debilidad muscular y el aumento de la movilidad ligamentaria dan como resultado inestabilidad de la articulación y la posterior subluxación y/o luxación. La falta de congruencia articular inicia el proceso de la enfermedad degenerativa de las articulaciones (artropatía). Ocasiona el cizallamiento de los extremos óseos y los fragmentos de hueso y cartílago se introducen en la articulación produciendo crepitación que puede llegar a ser audible al producirse el movimiento.(45),(46)
Como se ha mencionado, la diabetes afecta a la circulación periférica, debilita los huesos y causa desintegración y fracturas en el pie y el tobillo. Cuando una persona con diabetes sufre fractura de uno o varios huesos en el pie o en el tobillo, ésta puede ser imperceptible debido a la insensibilidad, por lo que el paciente continúa caminando sobre el pie lesionado provocando fracturas más graves y luxaciones articulares. Los bordes afilados del hueso fracturado aumentan el riesgo de úlceras crónicas debido a la presión anormal sobre la piel.(45),(46)
Factores de riesgo y causas
La diabetes mellitus y la neuropatía periférica son los principales factores de riesgo de la neuroartropatía en el pie y el tobillo. Los niveles elevados de glucosa en sangre de forma crónica (hiperglucemia) están asociados a eventos de desintegración ósea y al trauma que la precede.(47) El control de los niveles de glucosa es crítico en el manejo de una persona diabética y en el seguimiento de una dieta adecuada y ejercicio. Mantener un control estricto de los pacientes de alto riesgo y saber reconocer los primeros signos de artropatía de Charcot en personas con diabetes implica enseñarles a tener un cuidado adecuado e inspección diaria de los pies y el control cuidadoso de la glicemia.(48)
Signos y síntomas
La progresión del pie de Charcot puede ocurrir en cuestión de semanas o meses. Un trauma menor como la torsión o esguince del pie y tobillo, aunado a la pérdida de la percepción del dolor y posición del pie puede dar lugar a lesiones repetitivas en una o más articulaciones ocasionando la fragmentación y destrucción de las mismas (Figuras 1, 2 y 3).

Colección personal Dr. López Gavito.
Figura 1: úlcera plantar por sobrecarga en el segundo metatarsiano.
Cuadro agudo
La apariencia clásica del pie de Charcot en la etapa aguda es un pie con edema considerable, piel caliente, brillosa eritematosa,(49) deformidad con retropié en valgo y el antepié relativamente indoloro y si el edema lo permite los pulsos son palpables, se observa hipermovilidad de las articulaciones fracturadas y es posible que se presenten úlceras que pueden complicarse con una infección superficial o profunda.(50)
Las radiografías pueden mostrar una zona de colapso óseo, aunque el episodio inicial consiste solamente en microfracturas y el único dato clínico es el derrame articular.
El hueso presenta esclerosis y osteopenia y puede estar fragmentado, por lo que debe hacerse el diagnóstico diferencial con una osteomielitis.(51),(52),(53)
En la fase aguda es de suma importancia descartar una infección (Figura 4).
Artropatía neuropática (1) , (39)
Eichenholtz describió en 1966 las etapas de la artropatía neuropática:(54)
Etapa I. Desarrollo y fragmentación
Se caracteriza por destrucción y fragmentación ósea, con hiperemia y cambios tróficos en la piel y la duración es de 3 a 4 meses.
El pie se encuentra tumefacto rojo y caliente, simulando una celulitis o un proceso infeccioso.
En esta etapa los rayos X pueden ser normales o se observarán los huesos escleróticos o fragmentados con luxaciones periarticulares, por lo que es posible que se confundan con un proceso infeccioso. Es importante revisar la piel del miembro afectado en búsqueda de lesiones cutáneas que puedan ser la puerta de entrada de un proceso infeccioso, ante la ausencia de heridas visibles debemos pensar que el problema corresponde a la fase inicial de una neuroartropatía, la maniobra clínica que nos orienta al diagnóstico diferencial es elevar el miembro afectado durante cinco minutos, si el rubor cede, lo más probable es que se trate de un problema neuropático, en el caso contrario debe descartarse un proceso infeccioso.
Exámenes de laboratorio: la velocidad de sedimentación globular y la proteína C reactiva estará elevada en ambos casos; sin embargo, el paciente con artropatía no presentará la descompensación metabólica que es característica en pacientes diabéticos con una infección activa.
Cuando las articulaciones se encuentran en la etapa inflamatoria pueden ser indicativas de punción para obtener un cultivo, para hacer el diagnóstico diferencial, debe siempre tenerse en cuenta el riesgo que implica la punción como posible factor que propicia una infección, sobre todo si se trata de una neuroartropatía, debido a que podemos empeorar el pronóstico.
La gammagrafía es positiva en ambos procesos, los leucocitos marcados con Indio son indicativos de la artropatía.
Etapa II. Coalescencia
Se caracteriza por ser la etapa de inicio de la reparación ósea, su duración es de 8 a 12 meses. Clínicamente encontramos la desaparición progresiva del rubor, edema y calor local.
Los rayos X demuestran: neoformación ósea, reacción perióstica con coalescencia, puentes óseos y consolidación interfragmentaria.(55),(56)
Etapa III. Consolidación
Se caracteriza por la consolidación ósea, generalmente con deformidad residual. Clínicamente desaparece el aumento de temperatura comparado con el miembro ipsilateral y puede persistir la tumefacción. Desde el punto de vista radiológico se observa remodelación ósea, extremos redondeados de los fragmentos óseos y disminución de la esclerosis.
El pie presenta marcado descenso de la bóveda plantar, ensanchamiento con prominencias óseas en la región plantar y en los bordes interno y externo que pueden dar lugar a la aparición de úlceras plantares. El diagnóstico y tratamiento oportuno de un pie inestable disminuirá el riesgo de formación de exostosis que provoquen úlceras que lleven a infección ósea y que al complicarse terminen en la pérdida de la extremidad.(12),(57)
Clasificación anatómica
Pinzur en 1999 propuso la siguiente clasificación anatómica de la artropatía de Charcot:(58),(59),(60)
Tipo 1: Articulaciones tarso metatarsianas La localización más común es la articulación de Lisfranc (60%) con luxación cuneometatarsiana que ocasiona prominencias óseas plantares o en la barra medial o lateral, al producirse el descenso del mediopié la deformidad se presentará en forma de "mecedora" con equino del calcáneo y acortamiento del tendón de Aquiles.(61)
Tipo 2: Articulaciones subastragalina y medio-tarsianas Se ven afectadas en 30%. Puede producirse luxación astrágalo escafoidea, calcáneo cuboidea y de articulaciones subastragalina. Es posible que haya fragmentación ósea extensa y desplazamiento completo de estas articulaciones, lo que determina gran inestabilidad del pie que a menudo se compara con una "bolsa de huesos", que lo hace proclive a largos períodos de inmovilización que pueden llevar de 1 a 2 años. Las prominencias óseas son menos frecuentes que en el Tipo1.
Tipo 3a: Articulaciones del tobillo Esta artropatía es a menudo secundaria a eventos traumáticos que por tener Rx normales en su inicio no se inmovilizan, determinando así que el paciente que no experimenta dolor continúa apoyando el pie lesionado con las consecuentes luxaciones y fracturas.
Tipo 3b: Calcáneo Es una lesión rara que puede llevar al colapso del arco interno. Se caracteriza por fractura avulsión de la extremidad posterior de calcáneo, pudiendo producir lesiones de piel e infección en el talón por la presencia de una prominencia ósea.
Tipo 4: Múltiples articulaciones Es una lesión muy grave en la que pueden observarse fracturas de más de una región anatómica y es muy común la periastragalina, es decir, una combinación de los tipos 2 y 3.
Tipo 5: Antepié Son poco frecuentes y se localizan fundamentalmente en las articulaciones metatarso falángicas, pueden confundirse con osteomielitis u osteoartritis de dichas articulaciones. Deben ser tratadas con inmovilización inmediata y descargando el apoyo porque pueden extenderse rápidamente a la articulación de Lisfranc. Por lo que es de suma importancia que se efectúe el diagnóstico temprano y se aplique el tratamiento precoz.
Clasificación por su ubicación
Brodsky y Rouse propusieron en 1993(62),(63) la siguiente clasificación, según la ubicación de la neuroartropatía (Figuras 5 y 6).

Tomado de: Brodsky JW: Charcot joints. En: Mann RA, Coughlin MJ, eds. Surgery of the foot and ankle. St. Louis: Mosby; 1993: 925-53.
Figura 5: Clasificación de Brodsky.

Tomado de: Brodsky JW: Charcot joints. En: Mann RA, Coughlin MJ, eds. Surgery of the foot and ankle. St. Louis: Mosby; 1993: 925-53.
Figura 6: Clasificación de Brodsky.
Tipo 1: Mediopié.
Tipo 2: Retropié.
Tipo 3a: Tobillo.
Tipo 3b: Fractura por avulsión del calcáneo por el tendón de Aquiles.
Tipo 4: Enfermedad en múltiples sitios.
Tipo 5: Antepié.
Sammarco y Conti,(64) así como Schon y cols.(65) describieron en 1998 sistemas similares de clasificación radiográfica en las deformidades asociadas a neuroartropatía en el mediopié (Figura 7).

Tomado de: Sammarco GJ, Conti SF: Surgical treatment of neuroarthropathic foot deformity. Foot Ankle Int. 1998; 19: 102-9.
Figura 7: Clasificación de Sammarco y Conti.
Patrón 1: diástasis del primer y segundo metatarsianos, fragmentación y el colapso que se extiende a través de la articulación tarso metatarsiana.
Patrón 2: destrucción metatarso cuneiforme medial sin diástasis de primer y segundo metatarsianos.
Patrón 3: artropatía en el escafoides, cuneiforme medial, fragmentación de la cuña media y afección de las articulaciones tarso metatarsianas laterales.
Patrón 4: artropatía medial del primer metatarsiano y cuneiforme diástasis entre el primer y segundo metatarsiano y proximal, la extensión a las articulaciones intercuneanas que terminan en la articulación calcáneo cuboidea.
Patrón 5: afección en el escafoides y periescafoidea con extensión al tarso distal.
Schon y cols. en 2002(66),(67) presentaron una clasificación radiográfica y clínica. Esta clasificación se basa en la zona anatómica de la deformidad (Figura 8):

Tomado de: Schon LC, Easley ME, Cohen I, et al: The acquired midtarsus deformity classification system interobserver reliability and intraobserver reproducibility. Foot Ankle Int. 2002; 23: 30-6.
Figura 8: Clasificación de Schon.
Tipo I: articulación de Lisfranc.
Tipo II: escafocuneiforme
Tipo III: periescafoidea (Chopart).
Tipo IV: patrón transversal.
Clasificación clínica basada en el grado de deformidad con carga de peso (Figura 9).
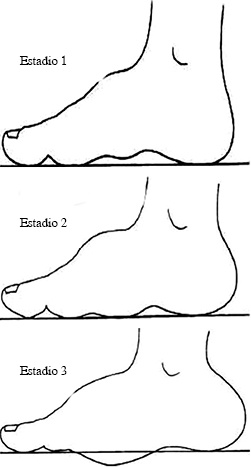
Tomado de: Schon LC, Easley ME, Cohen I, et al: The acquired midtarsus deformity classification system interobserver reliability and intraobserver reproducibility. Foot Ankle Int. 2002; 23: 30-6.
Figura 9: Clasificación clínica de Schon.
Síntomas
Inflamación y aumento de volumen significativo que pueden ocurrir sin una lesión aparente debido a la acumulación de líquido en las articulaciones de los huesos subyacentes.
Enrojecimiento al inicio.
Aumento de la temperatura local, calor, particularmente en las primeras etapas.
Deformidades de los dedos, pie plano, pie en mecedora, etc.
Úlceras crónicas abiertas a través de la piel.
Inestabilidad articular.
Alteraciones en los rayos X: pérdida de la alineación ósea, ya sea por fractura o luxación. Colapso de los huesos del tarso, se manifiesta como un pie en "mecedora", estas exostosis pueden ocasionar callos y úlceras debido a la irritación crónica de la piel. Los cambios radiológicos que ocurren en el hueso pueden confundirse con una infección ósea u osteomielitis.(68)
Historia clínica y exploración
El médico general y el especialista deben hablar con el paciente sobre su padecimiento, realizar una historia clínica completa y preguntar sobre los medicamentos que el paciente toma de forma habitual,(33) así como la sintomatología relacionada. Los eventos traumáticos específicos, independientemente de qué tan insignificantes parezcan, son imprescindibles para realizar el diagnóstico, la exploración minuciosa del pie y el tobillo será de mucha utilidad para el diagnóstico adecuado.(6),(69)
Diagnóstico por imágenes
El estudio que se utiliza con más frecuencia es la radiografía simple: pie en proyección anteroposterior y lateral con apoyo.
Los rayos X proporcionan imágenes detalladas de los huesos y son útiles para detectar derrames articulares, osteofitos, fracturas, fragmentos óseos y falta de alineación articular y/o luxación. En los inicios del padecimiento las radiografías pueden ser normales, conforme la condición avanza a las etapas intermedias y tardías los Rx muestran múltiples fracturas y luxaciones de las articulaciones del pie.(8),(70),(71),(72)
Imágenes por resonancia magnética (IRM) y ecografía
La resonancia magnética (RM) y el ultrasonido proporcionan mejores imágenes de las estructuras de los tejidos blandos del pie y el tobillo.
Una de las indicaciones de la RM es la presencia de infección subyacente para delimitar su extensión antes de realizar una cirugía.
Gammagrafía
La gammagrafía es un examen de medicina nuclear muy útil en la detección de la infección del hueso y consiste en la inyección de una pequeña cantidad de medio de contraste radiactivo,(73),(74),(75),(76),(77) por lo general en una vena en el brazo o la mano, de vez en cuando en el pie. El Indio es un medio de contraste que se fija a los leucocitos, indicando si existe o no infección ósea, en la artropatía de Charcot la gammagrafía será positiva, ya que existe un gran aumento de actividad celular, por lo que en la interpretación puede confundirse con infección activa, la diferencia con un proceso infeccioso es que cuando hay infección la actividad captada por el medio de contraste es marcadamente mayor.(78) Existen diversas pruebas de laboratorio para diagnosticar en forma adecuada la pérdida de hueso y la infección. También es útil la artrocentesis que consiste en extraer líquido de una articulación en la que se sospecha infección y enviarla a examen citoquímico, así como obtener fragmentos óseos y de cartílago articular. Si se observa infección activa deberán tomarse cultivos y antibiograma, suministrar antibióticos por vía intravenosa y realizar un desbridamiento quirúrgico. La biopsia de hueso es la prueba definitiva para descartar una infección, mientras que hallar fragmentos de hueso en el análisis de tejido sinovial es diagnóstico de una articulación de Charcot. Ante este cuadro se indicará inmovilización inmediata y diferir el apoyo de la extremidad afectada, puesto que si ésta no se indica, continuará la fragmentación del hueso y la resorción ósea. Puede ser necesaria una silla de ruedas como protección para prevenir la afección en el otro pie.
Diagnóstico
El diagnóstico se basa en la interpretación adecuada de la historia clínica, exploración física, exámenes de laboratorio como biometría hemática completa con diferencial, química sanguínea y rayos X simples de la extremidad afectada. Si se detecta infección activa el paciente puede necesitar hospitalización. La fase aguda termina cuando se cumplan las siguientes condiciones: el pie recupera la temperatura normal, resolución del edema y no se observa hipermovilidad en las articulaciones.
Tratamiento conservador
Varios autores han propuesto el tratamiento farmacológico con medicamentos antirresortivos; sin embargo, existe poca evidencia para apoyar su uso. Se han estudiado los bifosfonatos orales e intravenosos(7),(79),(80) en el tratamiento de la artropatía de Charcot en pequeños ensayos aleatorizados, doble ciego y controlados(81),(82) o en estudios controlados retrospectivos.(83) Algunos pacientes no toleran los bifosfonatos orales, pero pueden beneficiarse de la terapia intravenosa utilizando pamidronato o ácido zoledrónico.(84),(85) La calcitonina intranasal es otro agente antirresortivo que se ha estudiado en la artropatía, este tratamiento se asoció a una reducción significativamente mayor en los enlaces cruzados del telopéptido carboxiterminal del colágeno tipo I y la fosfatasa alcalina específica de los huesos comparado con el tratamiento estándar en el grupo de control que recibió sólo el suplemento de calcio y descarga de peso. La calcitonina tiene un perfil más seguro en la insuficiencia renal en comparación con la terapia con bisfosfonatos.(84),(86),(87),(88) Sin embargo, una sola dosis de bifosfonato por vía intravenosa ante un problema renal generalmente no requiere ajuste. No existen pruebas concluyentes para el uso de los bifosfonatos en la fase activa del pie de Charcot, nuestro conocimiento está evolucionando a medida que se van realizando más estudios.(42)
Tratamiento médico
El tratamiento médico se basa en la prevención de complicaciones,(89) en primer lugar la extremidad lesionada debe ponerse en reposo, quitándole peso, lo que evitará la aparición de nuevas fracturas y úlceras en la piel.(90) Descargar el peso del miembro lesionado en la fase aguda de la enfermedad es el principal factor preventivo para detener la progresión de la deformidad. Lo ideal es que el pie debe ser inmovilizado en un aparato de yeso de contacto total que se revisará y reemplazará inicialmente cada semana, la reducción del edema es notable durante las primeras semanas, el aparato deberá cambiarse con la frecuencia necesaria para que ajuste correctamente, ya que al disminuir el edema éste se aflojará, ocasionando roce con la piel y aparición de úlceras, el paciente deberá, de ser posible, utilizar muletas o silla de ruedas para evitar la sobrecarga en el lado sano.(18),(43),(91),(92)
La inmovilización se continúa hasta que haya desaparecido la inflamación y la temperatura del pie afectado se encuentre a 2 oC de la del pie contralateral.(25),(93)
Puede entonces indicarse una bota premoldeada o de tipo comercial para que el paciente pueda caminar con la misma.(94),(95),(96),(97) Debe revisarse periódicamente tanto el pie afectado como la bota o molde escogido para evitar lesiones y úlceras en la piel que pudieran ocasionar estos dispositivos, también debe alertarse al paciente sobre el riesgo de caídas y fracturas debidas a la inestabilidad como resultado de múltiples comorbilidades, incluyendo la pérdida de la propiocepción y la hipotensión postural.
No obstante, debe tenerse en cuenta que la inmovilidad total puede presentar desventajas como la pérdida de tono muscular, reducción de la densidad ósea y la pérdida de la fuerza de la extremidad.
La duración y la descarga de peso deben evaluarse en forma periódica con base en el edema, el eritema de la piel y los cambios de temperatura.(90),(98),(99)
La fase aguda termina cuando se cumplan las siguientes condiciones: el pie recupera la temperatura normal, resolución del edema y no se observa hipermovilidad en las articulaciones. Durante esta fase de reconstrucción comienza la consolidación de los fragmentos óseos que progresan hacia la unión ósea. Este proceso puede variar de tres meses a más de un año. Utilizar en esta etapa campos electromagnéticos pulsados puede ser útil para acelerar el proceso de consolidación,(100),(101) se ha demostrado que las áreas de hueso bajo compresión revelaron potenciales eléctricos negativos, mientras que las áreas bajo tensión mostraron potenciales positivos. Basset(102) publicó que se requiere una tensión inducida de 1.0 a 1.5 voltios/cm de hueso para activar la calcificación del fibrocartílago, lo que permite la fase final de la curación de las fracturas, este proceso es similar en muchos aspectos a la osificación endocondral. La evidencia de la curación comprobada con rayos X o resonancia magnética es decisiva en la toma de decisiones clínicas para la transición del paciente del aparato de inmovilización al calzado. Deberá de revisarse continuamente al paciente para reconocer y neutralizar las fuerzas de deformación en el pie y la pierna. La fisioterapia es a menudo útil en la corrección de los desequilibrios musculares, pues aumenta la fuerza y disminuye la tasa de contracturas de los músculos específicos involucrados.(103) Cuando los desequilibrios musculares no ceden con la fisioterapia, deben tratarse mediante cirugía.
Calzado
Después de controlar la inflamación y detener la destrucción ósea para evitar la recurrencia o ulceración en deformidades posteriores,(104) debe utilizarse calzado especializado, hecho a la medida, botas o zapatos comerciales para pie diabético que están diseñados para disminuir el riesgo de la aparición de úlceras, debe tenerse en cuenta que para este tipo de pies no es adecuado el zapato normal.(14),(100)
Tratamiento quirúrgico
En el transcurso de la enfermedad puede requerirse una o varias intervenciones quirúrgicas para lograr un pie plantígrado y evitar que las exostosis provoquen presión en la piel y por lo tanto úlceras de difícil manejo.(105) Los injertos de piel pueden ser útiles para disminuir el tamaño de una herida abierta y la posibilidad resultante de la infección bacteriana, menos de 50% de reducción en el tamaño de la herida disminuye significativamente la posibilidad de contaminación o infección. La cirugía en los tendones se utiliza para eliminar la fuerza deformante y restaurar el equilibrio muscular en la articulación vecina. La reconstrucción electiva de las articulaciones dañadas tiene como objetivo dejar un pie funcional y prevenir la amputación. Es importante seleccionar cuidadosamente el procedimiento quirúrgico, cuando es posible deben realizarse artrodesis de las articulaciones vecinas,(106),(107) sobre todo en pacientes con artrosis, ya que los procedimientos artroplásticos, es decir los que quitan parte de la articulación, tienen como secuela un movimiento excesivo, dejando la extremidad con gran inestabilidad y están condenados al fracaso.
Cuando las úlceras plantares y la inestabilidad son resistentes a las medidas conservadoras,(9) el tratamiento consistirá en la resección agresiva de las úlceras plantares y exostectomía de las prominencias óseas causantes de éstas. El abordaje para realizar la exostectomía se realiza desde un sitio distante a la úlcera y es útil para el cierre de la misma cuando el fragmento de hueso la produce.
Una de las cirugías que se realizan con mayor frecuencia es la artrodesis de las articulaciones dañadas,(56),(98),(102) los objetivos de la artrodesis de pie y tobillo neuropático y el tobillo son mantener el eje de soporte del cuerpo, obtener un pie plantígrado y eliminar en lo posible el uso de órtesis o férulas.
La cirugía prolongada es aconsejable solamente durante la fase de coalescencia de la enfermedad. Puede utilizarse fijación interna o externa, o ambas.(108)
La inmovilización prolongada para proteger la osteosíntesis es necesaria para aumentar la probabilidad de éxito de la artrodesis.(109)
La carga temprana de peso, incluso en la presencia de formación de callo abundante, puede dar lugar a la resorción ósea en el sitio de la artrodesis y la subsiguiente falta de unión.
Cuando se fracasa al intentar realizar una artrodesis, pero el pie y tobillo se encuentran alineados, la deformidad puede ser tratada con éxito mediante un aparato ortopédico. No se ha reportado la necesidad de reemplazos articulares en el pie o en el tobillo neuropático. La amputación solamente se indica en casos de infección grave o cuando la inestabilidad sea incapacitante.
La cirugía está indicada para el tratamiento de las deformidades severas; tratar de reconstruir las estructuras dañadas con el fin de lograr un pie plantígrado sin exostosis que provoque úlceras de presión, cuando la deformidad ocasionada por la destrucción es significativa o extensa, el tratamiento se centra exclusivamente en retirar las prominencias óseas que pueden causar lesiones en la piel.(109) La cirugía también se indica en las fracturas inestables y luxaciones articulares para estabilizar el pie en forma adecuada. La técnica quirúrgica dependerá del tipo y grado del daño.(110)
La deformidad leve en equino se tratará con alargamiento del tendón de Aquiles,(60),(111) sobre todo cuando existan deformidades o úlceras en antepié y dedos ocasionadas por la misma deformidad en equino del pie que no respondan al tratamiento conservador con zapatos o plantillas, al alargar este tendón se reduce la presión en el antepié, lo que permite la curación de las úlceras.
Prominencias óseas en la región plantar.(45),(62) La mayoría de las veces el colapso de las articulaciones mediotarsianas provoca un pie en "mecedora" con una gran protuberancia ósea en la región media o lateral de la planta del pie, cuando esta exostosis no puede controlarse con plantillas o zapatos especiales, se requiere cirugía, de nuevo dependiendo de la estabilidad de los huesos y las articulaciones en esa área, por lo general se realiza la resección únicamente de la prominencia ósea por abordaje lateral evitando directamente el abordaje plantar.(63),(112)
Deformidad inestable
Cuando la deformidad es inestable y se presentan prominencias óseas o colapso de los huesos del tarso, se requiere la reconstrucción del arco longitudinal mediante la artrodesis para lograr la fusión ósea y alineación del pie, lo que puede realizarse con fijación interna, externa o combinada. Para esta cirugía es necesario utilizar una cantidad mayor de material de osteosíntesis (placas, tornillos, dispositivos de fijación externa) de los que se usan en un paciente sano, debido a que la calidad del hueso es menor y más frágil en esta población de pacientes. Posterior a la osteosíntesis o reconstrucción de la deformidad, el período de reposo sin carga de peso debe ser siempre más largo que el convencional, generalmente se recomienda un período de tres meses antes de iniciar el apoyo para permitir la cicatrización adecuada.
Deformidad del tobillo
La deformidad en el tobillo ocasionada por la artropatía de Charcot es en extremo difícil de tratar simplemente con un aparato ortopédico fijo o articulado, en general se requiere artrodesis para permitir una corrección estable de dicha deformidad, la fusión puede incluir la articulación tibio astragalina, astrágalo calcánea o la artrodesis tibio astrágalo calcánea. Debido la cantidad de hueso dañado y la mala calidad de los tejidos blandos, el riesgo de presentar una falla en la consolidación y el riesgo de infección son muy altos.(108),(113) La amputación puede ser necesaria si se presenta una infección severa que pueda comprometer la vida del paciente, o en caso de una úlcera crónica en la región plantar o maleolar de larga evolución secundaria a prominencias óseas ocasionadas por fracturas luxaciones con infección u osteomielitis agregadas. La cirugía que implica la escisión de la úlcera, la resección del hueso subyacente, erradicación de la infección, reconstrucción ósea y la inmovilización prolongada puede no ser la mejor opción para el paciente. Los procedimientos quirúrgicos en cualquiera de estos escenarios descritos son extremadamente difíciles de realizar y llevan a un mayor riesgo de complicaciones de la herida, infecciones y potencialmente amputación, en comparación con los pacientes sanos que necesitan cirugía posterior a una fractura de tobillo.(64),(108),(109),(112) A medida que progresa la gravedad de la deformidad, los procedimientos quirúrgicos también se vuelven más complejos, por lo que a mayor complejidad de la lesión será necesario un tratamiento más agresivo, con las complicaciones que esto conlleva, por lo que el diagnóstico temprano y el tratamiento oportuno se convierten en la mejor opción.
Prevención
Todavía no está muy claro por qué sólo algunos pacientes con diabetes desarrollan neuroartropatía y otros no, también sería interesante saber la causa por la que un paciente con artropatía la desarrolla sólo en una de las extremidades.
Los pacientes con artropatía de Charcot deben siempre ser evaluados en busca de un desequilibrio muscular, sobre todo cuando se trata de una deformidad en equino, que según Young se define como la limitación de la dorsiflexión del tobillo menor a 10o, con la rodilla extendida y la articulación subastragalina en posición neutra cuando el paciente utiliza zapato normal (compensando la altura del talón). En estos pacientes se recomienda realizar una tenotomía proximal del gastrocnemio medial para evitar las complicaciones de la artropatía de Charcot.
Pronóstico
El objetivo de todo tratamiento es lograr un pie plantígrado, estable y funcional; pese a lograr este fin, la mayoría de los pacientes con pie de Charcot no serán capaces de reanudar muchas de las actividades cotidianas.
Los pacientes con diabetes mellitus deben controlar estrictamente sus niveles de azúcar en la sangre y las lesiones en los pies, ya que de no seguir las indicaciones es probable que se presente la recurrencia de la enfermedad.
Conclusión
El objetivo ideal en el tratamiento de la artropatía de Charcot sería evitar las fracturas iniciales. Es labor del médico identificar los factores de riesgo en el paciente diabético, reconociendo en forma temprana cuando se presenta una neuropatía autonómica o motora e iniciar con el tratamiento conservador antes de la pérdida progresiva de la sensibilidad y la aparición de la deformidad.
Para evitar contracturas secundarias en el desbalance muscular deben tomarse en cuenta intervenciones quirúrgicas oportunas en las fases tempranas de la enfermedad a fin de prevenir la aparición de esta última, así como de grandes deformidades, infección de úlceras y amputación. Debe considerarse que la conducta expectante ante las primeras manifestaciones de una artropatía no es lo mejor para el paciente. Con el conocimiento de todas las facetas de la neuropatía diabética, muchos pacientes pueden conservar el pie con un buen funcionamiento. Para garantizar el mejor resultado es esencial que el paciente siga los cuidados e indicaciones del médico tratante con respecto al tratamiento estricto de la enfermedad de base y conocer sus limitaciones para detener el progreso de la misma. Es primordial tener siempre en mente que cuanto más temprano se diagnostique la artropatía de Charcot, podrá evitarse la mayoría de las complicaciones a mediano y largo plazo.











 nueva página del texto (beta)
nueva página del texto (beta)