Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Acta ortopédica mexicana
versión impresa ISSN 2306-4102
Acta ortop. mex vol.28 no.1 Ciudad de México ene./feb. 2014
Artículo original
Tratamiento y reconstrucción en tumores óseos del húmero con prótesis no convencional tipo RIMAG
Treatment and reconstruction of bone tumors of the with a rimag unconventional prosthesis
Linares-González LM,* Rico-Martínez G,** Domínguez-Hernández VM,*** Araujo-Monsalvo V,*** Delgado-Cedillo EA,**** León-Hernández SR*****
Instituto Nacional de Rehabilitación
Nivel de evidencia: IV
* Profesor Titular de Diplomado en Cirugía de Reconstrucción en Ortopedia Oncológica.
** Profesor Titular de Alta Especialidad en Ortopedia Oncológica.
*** Departamento de Biomecánica.
**** Profesor Adjunto al Servicio de Tumores Óseos.
***** Jefe de la Unidad de Apoyo a la Investigación.
Instituto Nacional de Rehabilitación.
Dirección para correspondencia:
Dr. Luis Miguel Linares González
Servicio de Tumores Óseos, Instituto Nacional de Rehabilitación
Av. México-Xochimilco Núm. 289,
Col. Arenal de Guadalupe, CP 14389, Tlalpan, México, D.F.
Teléfono: 59991000, ext. 12702
E-mail: dr_linares@yahoo.com.mx
RESUMEN. Introducción: La cirugía conservadora y de reconstrucción con prótesis no convencional en tumores del húmero sin compromiso neurovascular está indicada ayudando a conservar las funciones del hombro, del codo y la mano. El húmero es el tercer sitio más frecuentemente afectado por los tumores benignos, agresivos, malignos y metastásicos provocando limitación funcional o pérdida de la extremidad. Material: Pacientes con tumor óseo en el húmero sin invasión neurovascular, que cumplan con los criterios de selección. Prótesis no convencional tipo RIMAG, no cementada, con ajuste diafisario y bloqueo con pernos. Métodos: Entre Junio de 1995 y Diciembre de 2011, fueron tratados 39 pacientes con tumores intraarticulares tipo I según las clasificaciones de Malawer y Enneking, con resección tumoral y reconstrucción con prótesis no convencional y partes blandas. Resultados: Se estudiaron 18 mujeres y 21 hombres entre 12-72 años, con tumores como: tumores de células gigantes (14), osteosarcomas (7), metástasis (7), condrosarcomas (6), sarcomas de Ewing (2), condroblastoma (2), y quiste óseo aneurismático (1). Doce pacientes murieron por enfermedad sistémica, el resto de la serie sobreviven. Los márgenes quirúrgicos fueron amplios con resección humeral entre los 100 a 230 mm. Los resultados funcionales fueron evaluados de acuerdo a la Sociedad de Tumores Musculoesqueléticos; 13 excelentes, 16 buenos, 5 fallas, 5 pobres. Discusión: El nivel de la resección no restringe la colocación de esta prótesis que permite realizar revisiones a futuro. El resultado satisfactorio depende del tamaño de la resección y musculatura del hombro conservada y no es limitado por el tamaño de la resección mejorando la discapacidad del paciente.
Palabras clave: neoplasia, hueso, tibia, codo, prótesis, húmero, tumor óseo de células gigante, osteosarcoma, metástasis, condrosarcoma, condroblastoma, quistes óseos.
ABSTRACT. Introduction: Conservative surgery and reconstruction with an unconventional prosthesis are indicated for tumors of the humerus without neurovascular compromise, as they help preserve shoulder, elbow and hand function. The humerus is the third most frequent site of benign, aggressive, malignant and metastatic tumors that cause functional limitation or limb loss. Material: Patients with a bone tumor of the humerus without neurovascular involvement that met the inclusion criteria. Unconventional, uncemented RIMAG prosthesis with diaphyseal fit and locking bolts. Methods: 39 patients with intraarticular type I tumors according to the Malawer and Enneking classification were treated with tumor resection and reconstruction with an unconventional prosthesis and soft tissues. Results: Patients enrolled included 18 females and 21 males ages 12-72 years with tumors such as: giant cell tumors (14), osteosarcomas (7), metastasis (7), chondrosarcomas (6), Ewing's sarcomas (2), chondroblastoma (2) and aneurysmatic bone cyst (1). Twelve patients died due to systemic disease and the remaining patients survived. Surgical margins were broad, with humeral resection between 100 and 230 mm. Functional results were assessed according to the Muscoloskeletal Tumor Society score as 13 excellent, 16 good, 5 failures and 5 poor. Discussion: The resection level does not restrict the placement of this prosthesis, which permits future revisions. An appropriate result depends on the resection size and the preserved shoulder musculature and it is not limited by the size of resection, thus improving patients' disability.
Key words: neoplasms, bone, tibia, elbow, prosthesis, humerus, giant cell tumor of bone, osteosarcoma, metastasis, chondrosarcoma, chondroblastoma, bone cysts.
Introducción
El húmero es el tercer sitio más común de presentación de tumores óseos1,2,3,4,5 después de la rodilla y la cadera. La cirugía de salvamento y reconstrucción está indicada para tumores benignos, benignos agresivos, sarcomas de bajo y alto grado, así como para la metástasis en el hueso. Uno de los procedimientos iniciales de salvamento para los tumores de húmero fue la técnica de Tikhoff-Linberg, la cual se sigue utilizando hasta nuestra época con menor frecuencia para las resecciones agresivas del húmero proximal, incluyendo la fosa glenoidea y la clavícula distal.6 Sin embargo, este procedimiento, desde el punto de vista oncológico, deja una discapacidad funcional muy importante dependiendo de la extensión de la resección.
Dentro de las patologías benignas más comunes en el húmero se encuentran los quistes óseos y los osteocondromas. En las patologías benignas agresivas, las más comunes son: el quiste óseo aneurismático, el condroblastoma y el tumor de células gigantes; dentro de las malignos se encuentran, entre otros, los osteosarcomas, condrosarcomas y sarcoma de Ewing, así como los liposarcomas correspondientes a las partes blandas o el mieloma múltiple y para los metastásicos están los adenocarcinomas renales como los más frecuentes7 y las metástasis de mama.
La elección de una reconstrucción depende de la extensión del tumor en el hueso, ya sea IIA o IIB, de acuerdo con la clasificación de W. Enneking, la invasión a tejidos blandos y en especial del grado histológico, sin afección de la pared torácica o el paquete neurovascular. En los tumores malignos, la elección adecuada es por la buena respuesta a la quimioterapia, cambiando el pronóstico en aquellos pacientes ante un antecedente de fractura en una lesión maligna previamente establecida y no pasando por alto al paciente que le realizaron una biopsia mal planeada, de forma transversa, muy grande o lejana del abordaje para una cirugía definitiva, perdiendo así el concepto oncológico para el control local de la enfermedad. En el procedimiento de reconstrucción, el objetivo, en lo posible, es la conservación funcional del músculo deltoides y del nervio axilar sin afección de la arteria o vena.
En la actualidad existen varias técnicas de conservación del húmero para el tratamiento de los tumores como la de Tikhoff-Linberg, las artrodesis primarias, los aloinjertos solos o combinados con prótesis, la osteosíntesis combinada con metil-metacrilato y las prótesis de reconstrucción.2,5,8,9,10 Sin embargo, dentro de los antecedentes del uso de los aloinjertos se mencionan muchas fallas, como la reacción entre aloinjerto y huésped, fracturas o necrosis del injerto con incremento de infecciones, resultando incluso en amputaciones tardías.1
Las técnicas y sistemas antes mencionadas no son incluidas de manera comparativa en este trabajo, debido a que sólo se ha utilizado un sistema endoprotésico, apoyados en pruebas de laboratorio de biomecánica del mismo instituto.
Material y métodos
Entre Junio de 1995 y Diciembre de 2011 se estudiaron y trataron a 39 pacientes, a los que les fue implantado un sistema de prótesis no convencional con cuerpo ajustable y uso de pernos para realizar un bloqueo en su vástago. Se logró la sustitución del tercio proximal y del tercio medio con distal de húmero, utilizando la clasificación de la Sociedad de Tumores Musculoesqueléticos (MSTS, por sus siglas en inglés), así como la reconstrucción de tejidos blandos posterior a la resección en bloque del tumor.
Se realizó un estudio prospectivo y transversal, donde se incluyeron a pacientes de cualquier edad y sexo con expediente completo. Todos, portadores de tumores benignos agresivos, malignos de alto y bajo grado, tumores de origen medular y metastásicos en el húmero, tumores benignos agresivos etapa 3 de Enneking, tumores malignos intracompartimentales de bajo y alto grado (IIA, IIB) y metastásicos (III).11 Se excluyeron a los pacientes con sobrevida aproximada o menor a dos meses o pacientes con presencia de fractura. Para calcular las variables se utilizaron pruebas de χ2, análisis de la varianza y t de Student, con el paquete estadístico SPSS versión 17.
Los pacientes contaron con radiografías convencionales de húmero en posición anteroposterior (AP) y lateral, tomografía computada con reconstrucción tridimensional, angiotomografía, estudio de resonancia magnética y estudio de medicina nuclear con metoxi-isonitril-isobutrilo (MIBI). Para los pacientes que recibieron quimioterapia, se realizó laboratorio clínico con perfil prequirúrgico, química ósea, perfil hepático y depuración de creatinina en 24 horas. El diagnóstico se corroboró mediante biopsia incisional en todos los casos, removiendo la cicatriz durante la cirugía definitiva.
Se utilizó la clasificación quirúrgica de M. Malawer para identificar las lesiones intraarticulares tipo I.12 También se usó el sistema de estadiaje de Enneking13 y la aplicación de resultados de acuerdo con la Sociedad de Tumores Musculoesqueléticos.
A todos los pacientes incluidos se les pidió la firma de consentimiento informado de acuerdo con su diagnóstico ante la posibilidad de presentar limitaciones funcionales, debido a la alteración de la anatomía, derivadas del crecimiento o invasión tumoral. En algunos fue por encontrarse involucrado y tener que resecar el nervio axilar secundario a la resección amplia, así como los riesgos anestésicos y/o las posibles complicaciones transoperatorias y postoperatorias inmediatas y tardías. Se informó, a su vez, de la posibilidad de recidiva de la enfermedad posterior al procedimiento. Se realizó tratamiento y control por oncología médica en aquellos pacientes con diagnóstico de tumores malignos, esperando la respuesta favorable posterior al tercer ciclo de quimioterapia neoadyuvante para programar la cirugía.
El sistema de prótesis no convencional RIMAGMR para el húmero proximal cuenta como cuerpo fijo de 23 a 26 cm como vástago principal, con orificios en la cara externa de la curva proximal para la inserción músculo-tendinosa. La región distal del vástago tiene dos orificios para el bloqueo con pernos de diámetro 1/8 y con una pulgada de separación, un espaciador modular expandible mediante tornillo de ajuste hasta de 5 cm con una corona para rodear el hueso en el sitio de la osteotomía y con ventanas para dar más estabilidad entre el binomio hueso-implante donde posteriormente se espera el crecimiento del hueso a través de la ventana. En casos indispensable también se puede utilizar cemento (hasta el momento en nuestra serie no se ha utilizado).
Los implantes que utilizamos fueron los siguientes: acero 316 LVM grado médico en un grupo y titanio en otro, pudiendo combinar con cabeza de polietileno de alta densidad para el vástago de acero quirúrgico, cabeza de acero con vástago en acero o cabeza de titanio para el vástago de titanio. Todas las cabezas utilizadas en dichos materiales midieron 40 mm. El peso total aproximado osciló entre 350 y 550 g.
Resultados
Se trataron a 39 pacientes: 21 de ellos hombres y 18 mujeres, con una edad promedio de 32.1 ± 16.3 años (rango 12-72). El tumor más frecuente fue el tumor de células gigantes (TCG) con 14 casos (35.9%), seguido de siete osteosarcomas (OS) (17.9%) convencionales, siete metástasis (Mets) (17.9%): cinco de mama (12.8%) y dos renales (5.1%), seis condrosarcomas (15.4%), dos sarcomas de Ewing (SEw) (5.1%), dos condroblastomas (5.1%) y un quiste óseo aneurismático (QOA) (2.6%) (Tablas 1 y 2). En la tabla 1 se observa que los tumores malignos representaron 56.4% de los casos y los benignos 43.6%. Desglosados por tipo, los tumores de células gigantes ocuparon el primer lugar (35.9%) seguidos por los osteosarcomas (17.9%).

El lado afectado con más frecuencia fue el izquierdo con 24 casos (61.53%) y el derecho con 15 casos (38.46%). El género más afectado fue el masculino con 21 pacientes (53.8%), correspondiendo 18 casos (46.2%) al sexo femenino. El seguimiento mínimo fue de ocho meses y el máximo de 192 meses (16 años). Los tumores malignos fueron más frecuentes en el sexo femenino con un riesgo de 3.4 veces mayor que en el sexo masculino (IC 9% -13.3, p = 0.06). Como se muestra en la tabla 3, desglosados por tipo, las metástasis de mama y los osteosarcomas representaron la mayor carga del riesgo de malignidad en las mujeres (p = 0.02).
Los pacientes con osteosarcoma estadio IIA y IIB recibieron quimioterapia neoadyuvante y adyuvante con esquemas de cisplatino, adriamicina, metotrexato, doxorrubicina y rescates con ifosfamida. Del total de los pacientes con osteosarcoma, cuatro pacientes (15.6%) con estadio IIB inicial evolucionaron a estadio III, muriendo con actividad metastásica pulmonar (su sobrevida fue entre 24 y 60 meses). Uno de ellos presentó recidiva local a los cinco meses, siendo necesaria una desarticulación interescapulotorácica y teniendo 17 meses de sobrevida después de esta cirugía.
De los pacientes con metástasis uno sobrevivió con diagnóstico de cáncer renal y una con metástasis de mama; los otros cinco fallecieron por evolución propia de su enfermedad. De los pacientes con condrosarcoma de alto grado, dos murieron y uno presento recidiva. Un paciente de alto grado y tres de bajo grado siguen con vida, realizando su seguimiento en la consulta con apoyado de medicina nuclear, sin evidencia de actividad tumoral o metástasis a la fecha. El resto de los pacientes con los otros tumores diagnosticados siguen vivos. Los pacientes con tumores benignos agresivos han evolucionado favorablemente y sólo un TCG ha presentado recidiva (Tablas 4 y 5).
En todos los casos se realizaron resecciones intraarticulares tipo I con márgenes quirúrgicos adecuados, un caso de osteosarcoma ya mencionado recidivó en partes blandas. La longitud de resección desde la cabeza humeral hasta el sitio de osteotomía en la diáfisis del tercio proximal, medio y distal fue entre 100 y 230 mm, utilizando la clasificación de la MSTS con niveles S3, S4, S5 y E1, tal como se muestra en la tabla 6. En la figura 1 se puede apreciar para las medidas marginales la relación de tumores malignos y benignos de acuerdo con el sexo y la relación. Se encontró que la longitud de la resección es mayor para los tumores malignos en ambos sexos y en relación con la edad y longitud de la resección tuvieron una correlación moderada positiva (r = 0.256, p = 0.11) de manera que a mayor edad, mayor fue la longitud de la resección. Al mismo tiempo, los pacientes con tumores malignos tuvieron mayor edad y mayor longitud que la resección de los benignos.


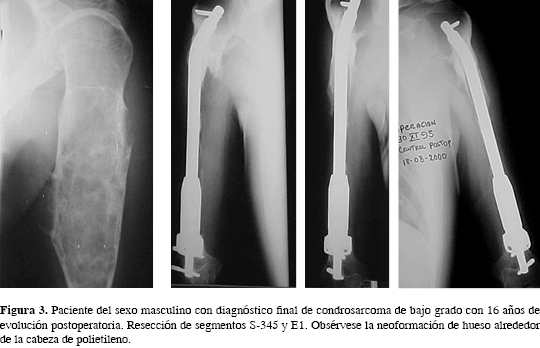
En 25 pacientes se eligió la colocación de prótesis y cabeza con material en titanio. En cinco pacientes (12.82%) se colocaron prótesis de acero 316 LVM y cabeza de polietileno de alta densidad (Figura 2), donde se observó, posterior a 18 meses, la formación de osificación periférica en la cabeza de polietileno (Figura 3) sin causar limitación de los movimientos obtenidos después de la cirugía. A nueve pacientes se les colocó prótesis y cabeza de acero quirúrgico.

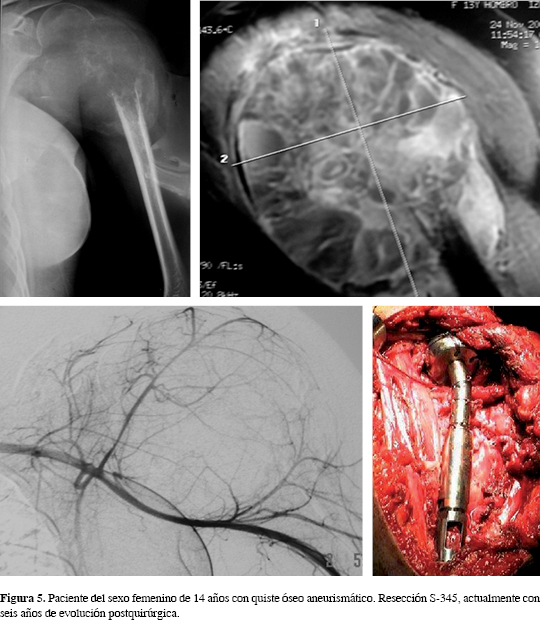
En este grupo donde se eligió la colocación de cabeza en acero quirúrgico 316 LVM, en dos pacientes (5.12%) se presentaron fístulas por metalosis con luxación anterior, por lo que se retiraron las prótesis, se desbridaron y se cambiaron a prótesis de titanio. Un caso en el grupo de colocación de cabeza en titanio (2.56%) también presentó luxación. En los tres casos la luxación anterior del hombro les fue atribuible al déficit del músculo deltoides que se indujo por el tipo de resección y el deficiente continente muscular postquirúrgico. A un caso (del grupo de cabeza en titanio) se le colocó malla de Mersilene, presentado nuevamente luxación y reacción inflamatoria a la malla. Por ello, se operó y se retiró la malla y el tejido inflamatorio, el cual se resolvió haciendo un anclaje con el músculo subescapular que controló la luxación. Se utilizaron suturas absorbibles y no absorbibles para el anclaje de tejidos blandos y de tendones, sin otra complicación a la ya mencionada hasta el momento. En 31 pacientes se observó crecimiento de hueso a través de las ventanas de la corona, logrando una mejor integración del binomio hueso implante. Ejemplos de los casos se presentan en las figuras 4 y 5.
La extremidad superior se inmovilizó por períodos de seis semanas, permitiendo una rehabilitación temprana del movimiento de flexoextensión del codo y la mano. En los resultados funcionales los movimientos de flexión y abducción del hombro en todos los casos se encontraron inicialmente limitados por dolor entre los 0o y 5o, debido al progreso secundario del tumor, por lo que no movilizaban el hombro, los cuales mejoraron posterior a la cirugía en 13 pacientes con abducción entre 10o a 20o comparada con los rangos previos a la cirugía, alcanzando hasta un rango de 25o para la abducción como máximo. En 21 pacientes de esta serie se obtuvieron de 0o a 5o grados para la extensión y de 10o a 15o para la flexión. La rotación interna alcanzó entre 15o a 30o y en la rotación externa entre 0o a 50o grados en la mayoría de los pacientes. Tres de los pacientes presentaron neuropraxia, los cuales mejoraron dos pacientes a las seis semanas y uno hasta la doceava semana. Todos con el apoyo de rehabilitación. En estos casos se prescribieron 900 mg al día de gabapentina sin resultados colaterales. El dolor que presentaron previo a la cirugía según la escala visual análoga (EVA) varió de inicio de entre siete a nueve, disminuyendo a tres y cero a las tres semanas del postoperatorio.
Se evaluaron el dolor, la función, la aceptación emocional, la movilidad de la mano, la destreza y la capacidad de levantar peso de acuerdo con la clasificación de la Sociedad de Tumores Musculoesqueléticos. De acuerdo con esta escala, se registró una calificación final de 83% de resultados, con un puntaje global de 25 sobre 30 como máximo, como se observa en la tabla 7. Con los resultados generales expresados como: 13 excelentes (33.33%), 16 buenos (41.02%), 5 fallas (12.82%) y 5 pobres (12.82%).

Para poder corroborar el brazo de palanca ejercida en este sistema se realizaron pruebas en el Departamento de Biomecánica del mismo Instituto,14 con la aplicación de cargas aplicadas a 90o y 120o grados de flexión de codo, debido que a 90o se obtiene la máxima eficacia de los músculos flexores y a 120o de flexión del codo, la mano puede llegar a la boca. Los casos analizados se realizaron variando la distancia a la cual la prótesis puede ser ajustada con el tornillo de acuerdo con el segmento de resección y necesidad de ajuste en el binomio hueso-implante, tomando en cuenta que esta región no es de carga como los sistemas para extremidad inferior.
Se le realizaron pruebas mediante el modelo de elemento finito, recabados a partir de información de la tomografía computarizada, datos almacenados y reproducidos en el software ANSYS versión 8.1. Para conocer los resultados de los casos críticos de las pruebas de ensamble prótesis-húmero mostraron que el nivel de esfuerzos a 90o de flexión de codo es constante cuando el espaciador ajustable no se desplaza tanto para el acero como para el titanio. Para los casos en que el espaciador ajustable tiene desplazamiento, los esfuerzos aumentan en 58% para el acero y 59% para el titanio, de manera considerable en relación con los pernos cuando el espaciador ajustable se desplaza a más de 10 mm de apertura. El esfuerzo en el perno distal aumenta de una manera significativa, tanto para el acero como para el titanio, mientras que a 20 mm o más éste disminuye. Se obtuvo también una mejor estabilidad en los cercanos al sitio de osteotomía con el implante de la corona.
Discusión
El tamaño de la resección y la función del sistema abductor del hombro dependen del estadiaje de acuerdo con las clasificaciones de Enneking y Malawer.12,13 El nivel de resección no restringe la colocación de la prótesis ni el uso de espaciador expandible asociado con el uso de pernos, dando un resultado satisfactorio que permite una revisión más accesible al futuro, atreviéndonos a comparar con una ventaja de versatilidad sobre los trabajos de Sharma15 y Witting,16 donde sólo utilizan sistemas cementados.
También debemos recordar que en la toma de la biopsia es indispensable evitar el surco deltopectoral y evitar en lo posible contaminar el manguito rotador o la articulación glenohumeral con un abordaje lateral o posterior. También cambia su pronóstico cuando no se tiene conocimiento adecuado de este sitio o bien ante un antecedente de fractura o bien si se presenta diseminación de un hematoma directo a la articulación o los compartimentos musculares y sinoviales.
La planeación de la resección en bloc del tercio proximal del húmero incluye el retiro de la biopsia previa, los elementos de partes blandas que sean necesarios sin infiltración tumoral al lecho vascular o neurológico, siendo esenciales éstos para la conservación de estabilidad y función del hombro, coincidiendo con Malawer en las técnicas de exposición y abordaje,17 la conservación del músculo deltoides, el nervio axilar y el plexo braquial, así como el manguito rotador son los más importantes. En algunos casos se recomienda embolización 24 horas previas a la cirugía para disminuir los sangrados.
Los resultados funcionales se limitan por la alteración secundaria de extensión y flexión de la mano y la capacidad de levantar peso. Debe recordarse de manera importante el estado del mecanismo abductor previo a la cirugía para su rehabilitación temprana. En la literatura consultada no se encontró un estudio comparativo con el modelo del elemento finito y su relación con el implante utilizado.18
Se ha evaluado el nivel de resección, el cual hasta el momento no afecta significativamente su resultado mecánico, siendo en la mayoría satisfactorio. El resultado final de una reconstrucción del húmero se centraliza en los siguientes puntos: control oncológico sistémico y/o local del tumor y preservar una extremidad que hasta hace menos de una década estaba anteriormente destinada a la desarticulación. El resultado funcional de aceptación emocional ante una desarticulación es muy aceptable.
El objetivo primordial en la cirugía de reconstrucción es dar estabilidad al hombro-húmero y acercarse a los movimientos del propio hombro, manteniendo la función primordial de las actividades del codo y de la mano, así como su aspecto cosmético, no olvidando el control de la lesión neoplásica.1 Se realizó una reconstrucción con los elementos anatómicos restantes para dar una estabilidad más estática y, en lo posible, dinámica, tratando la mejor cobertura muscular y/o de tejidos blandos posibles, evitando así una tendencia a la luxación anterior.
Todos los procedimientos de reconstrucción son discutibles, sin embargo, el desarrollo de una prótesis con un espaciador modular ajustable se desarrolla bajo la necesidad de crear un sistema que se adapte para poder substituir un segmento determinado, dando estabilidad hueso-implante, posterior a la resección del tumor en el húmero y no quedar con la limitación por la resección como aquéllos de sistema cementado, los cuales al requerir una revisión posterior los hace de mayor susceptibilidad a fracasos en el futuro o bien debido a módulos específicos que por segmento pueden quedar cortos o que la porción de reserva ósea no tenga un equilibrio entre longitud y la estabilidad.
Con relación a la sobrevida de este implante, aproximadamente el 70% de los pacientes han tenido buen resultado, dicho de otra forma, el tipo de resección y la reconstrucción de los tejidos blandos es probablemente más importante que el tipo de implante. Muchos centros han adoptado el uso de endoprótesis para la reconstrucción después de resecciones amplias, dando una relativa ventaja a éstas por la durabilidad del implante, el menor tiempo quirúrgico al colocarlas, los buenos resultados funcionales (valorables a corto plazo) y de manera importante la menor incidencia de complicaciones por infección que involucra a los aloinjertos.
En el presente trabajo se obtuvo la versatilidad de utilizar un sistema de ajuste expandible con uso del vástago distal bloqueado con pernos, pensado también en tener la posibilidad de usar metilmetacrilato en el paciente que así lo amerite. Se enfatiza que el crecimiento de hueso observado a través de las pequeñas ventanas logra una mejor integración hueso-implante alrededor de esta ventana, ayudando a una fijación biológica. Comparado con los sistemas tradicionales, refuerza con esto lo mencionado en la revisión por García19 donde se refiere a la ventaja de proveer la transferencia del estrés a través de un puente óseo extracortical. En este trabajo no se utilizó hasta la fecha ninguna prótesis cementada.
Los tumores en las extremidades superiores pueden causar discapacidad y pérdida de la independencia, debido a que ellos limitan la habilidad para realizar las actividades diarias de la vida. Habitualmente las lesiones de extremidad superior están libres de dolor hasta que ocurre un crecimiento rápido, lo que indica generalmente agresividad o malignidad o llegan a la fractura patológica.
Debido a que las metástasis esqueléticas ocurren en su mayoría en las extremidades inferiores, los cirujanos ortopedistas están poco familiarizados con las opciones de tratamiento de la enfermedad metastásica en la extremidad superior y su compleja reconstrucción que representa. Este trabajo refleja en especial el apoyo de un equipo interdisciplinario que conjunta las mejores opiniones en beneficio del paciente.
Declaración
No se han recibido beneficios económicos, en especie o remunerativos de ningún tipo, de alguna entidad comercial o relacionada en forma directa o indirecta con este artículo o alguno de sus autores.
REFERENCIAS
1. Wodajo F, Bickels J, Wittig J, Malawer M: Advances in reconstruction for bone sarcomas. Curr Opin Oncol. 2003; 15: 304-12. [ Links ]
2. Ross AC, Wilson JN, Scales JT: Endoprosthetic replacement of the proximal humerus. J Bone Joint Surg Br. 1987; 69-B(4): 656-61. [ Links ]
3. Johnston JO: Limb salvage procedures for primary sarcomas of the humerus. In: Yamamuro Takao, editor. New development in limb salvage. Tokio: Springer Verlag; 989: pp. 543-6. [ Links ]
4. Moreno H, Tecualt G, Morfín P, Padilla L, Amaya Z, Moreno W: Tumores del húmero. Acta Ortop Mex. 2002; 16(6): 296-306. [ Links ]
5. Toro F, Baar A, Paulos J, Calvo R: Cirugía reconstructiva en tumores del extremo proximal del húmero. Rev Chilena Ortop y Traum. 1999; 40: 171-8. [ Links ]
6. Malawer M, Meller I, Dunham: Shoulder girdle resection for bone and soft tissue tumors. In: Yamamuro Takao, editor. New development in limb salvage. Tokio: Springer Verlag; 1989. pp. 519-30. [ Links ]
7. Menéndez LR: Orthopaedic knowledge update. Musculoskeletal tumors. Am Acad Orthop Surg. Rosemont Illinois 2002. Cap. 7. [ Links ]
8. Gebhardt M, Roth Y, Mankin H: Osteoarticular allografts for reconstruction in the proximal part of the humerus after excision of a musculoskeletal tumor. J Bone Joint Surg Am. 1990; 72: 334-5. [ Links ]
9. Frassica F, Chao E, Shives T, Sim F: Resection of malignant bone tumors about the shoulder. A preliminary report of reconstruction with a new modular spacer. Clin Orthop. 1991; 267: 56-64. [ Links ]
10. Limberg BE: Interescapulothoracic resection for malignant tumors of the shoulder joint region. J Bone Joint Surg. 1928; 10A: 344-9. [ Links ]
11. Enneking WF: A system of staging musculoskeletal neoplasms. Clin Orthop Relat Res. 1986; 204: 9-24. [ Links ]
12. Malawer MM: Tumors of the shoulder girdle: technique of resection and description of the surgical classification system. Orthop Clin North Am. 1991; 22: 7-35. [ Links ]
13. Enneking WF, Dunham W, Gebhardt MC, Malawer M, Pitchard DJ: A system for the functional evaluation of reconstructive procedures after surgical treatment of tumors of the musculoskeletal system. Clin Orthop Relat Res.1993; 286: 241-6. [ Links ]
14. Valencia R: Análisis biomecánico de una prótesis tumoral no convencional de hombro mediante el método de elemento finito [Tesis de grado en Ingeniería]. México: Universidad Nacional Autónoma de México; 2006. [ Links ]
15. Sharma S, Turcotte RE, Isler MH, Wong C: Experience with cemented large segment endoprosthesis for tumors. Clin Orthop Relat Res. 2007; 459: 54-9. [ Links ]
16. Wittig J, Bickels J, Kellar-Graney K, Kim FH, Malawer M: Osteosarcoma of the proxima humerus: long-term results with limb-sparing surgery. Clin Orthop. 2002; 397: 156-76. [ Links ]
17. Wittig J, Kellar-Graney K, Bickels J, Meller I, Wodajo F, Malawer M: Utilitarian shoulder approach for malignant tumor resection; in tips and techniques. Orthopedics [Internet] 2002; (5): 479-84. Disponible en: http://www.orthobluejournal.com [ Links ]
18. Rödl RW, Gosheger G, Gebert C, Linder N, Ozaki T, Winkelmann W: Reconstrucción de la porción proximal del húmero tras la resección amplia de tumores. J Bone Joint Surg (Br). 2002; 84-B: 1004-8. [ Links ]
19. García R: Endoprosthetic reconstruction following bone sarcoma resection. Curr Opin Orthop. 2006; 17: 545-50. [ Links ]
Nota
Este artículo puede ser consultado en versión completa en: http://www.medigraphic.com/actaortopedica














