Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Chapingo serie ciencias forestales y del ambiente
versión On-line ISSN 2007-4018versión impresa ISSN 2007-3828
Rev. Chapingo ser. cienc. for. ambient vol.24 no.2 Chapingo may./ago. 2018
https://doi.org/10.5154/r.rchscfa.2017.03.023
Artículo científico
Aspergillus niger Tiegh., aislado en Sonora, México: evaluación de tolerancia a metales
1Universidad de Sonora, Departamento de Física. Bulevar Rosales s/n, col. Centro. C. P. 83000. Hermosillo, Sonora, México.
2Universidad Estatal de Sonora Ingeniería Ambiental. Ley Federal del Trabajo s/n, col. Apolo. C. P. 83100. Hermosillo, Sonora, México.
Introducción:
La contaminación por metales representa un riesgo significativo para los ecosistemas, por tanto, es necesario reducir la biodisponibilidad, movilidad y toxicidad de esos elementos.
Materiales y métodos:
El hongo se aisló a partir de suelo con actividad minera. El índice de tolerancia y la concentración mínima inhibitoria (CMI) del hongo se determinaron a 1, 5, 10, 15 y 20 mM de sales metálicas de Cd, Hg, Pb, Ag, Cu, Zn y Cr.
Resultados y discusión:
El hongo aislado fue Aspergillus niger. Este tuvo índices de tolerancia promedio de 0.89, 1.03, 1.05, 0.94, 0.88, 0.87 y 1.27 a 1 mM de las sales de Cd, Hg, Pb, Ag, Cu, Zn y Cr, respectivamente, después de siete días de crecimiento a 28 °C. La CMI de A. niger se encontró en un intervalo de 5 a 10 mM de las sales de Hg, Cu y Ag, y 15 a 20 mM de la sal de Cd. Las sales de Pb, Zn y Cr no inhibieron el crecimiento del hongo con la concentración más alta evaluada; es decir, la CMI es mayor de 20 mM.
Conclusión:
Aspergillus niger tiene potencial para la biorremediación de contaminantes, ya que mostró alta tolerancia a las sales de los metales.
Palabras clave: Hongo filamentoso; plomo; zinc; cromo; toxicidad de metales; actividad minera
Introduction:
Metal contamination represents a significant risk to ecosystems; it is therefore necessary to reduce the bioavailability, mobility and toxicity of these elements.
Materials and methods:
The fungus was isolated from soil with mining activity. The tolerance index and the minimum inhibitory concentration (MIC) of the fungus were determined at 1, 5, 10, 15 and 20 mM of the Cd, Hg, Pb, Ag, Cu, Zn and Cr metal salts.
Results and discussion:
The isolated fungus was Aspergillus niger. It had average tolerance indices of 0.89, 1.03, 1.05, 0.94, 0.88, 0.87 and 1.27 at 1 mM of the Cd, Hg, Pb, Ag, Cu, Zn and Cr salts, respectively, after seven days of growth at 28 °C. The MIC of A. niger was found in a range of 5 to 10 mM of the Hg, Cu and Ag salts, and 15 to 20 mM of the Cd salt. The Pb, Zn and Cr salts did not inhibit the growth of the fungus with the highest concentration evaluated; that is, the MIC is greater than 20 mM.
Conclusión:
Aspergillus niger has potential for the bioremediation of contaminants since it showed high tolerance to the metal salts.
Keywords: Filamentous fungus; lead; zinc; chromium; metal toxicity; mining activity
Introducción
La contaminación con metales en suelos, sedimentos y reservorios naturales de agua es uno de los mayores problemas ambientales a nivel mundial (Srivastava & Thakur, 2006). Los microcontaminantes inorgánicos son liberados por industrias dedicadas a la galvanoplastia, carrocería, minería, curtido, manufactura de baterías, entre otras (Ezzouhri, Castro, Moya, Espinola, & Lairini, 2009). Muchos de los metales son citotóxicos, carcinogénicos y mutagénicos, incluso en concentraciones muy bajas; por ejemplo, arsénico, cadmio, cromo, cobre, plomo, mercurio, níquel, selenio, plata y zinc (Nordberg, Fowler, & Nordberg, 2015).
La remoción de metales se hace comúnmente mediante precipitación química, intercambio iónico, extracción con solventes y reacciones de óxido-reducción; sin embargo, estos métodos son relativamente caros e ineficientes, especialmente cuando la concentración de los contaminantes está en el rango de 1 a 100 mg·L-1 (Krauter, Martinelli, Williams, & Martins, 1996). Una alternativa a estos métodos convencionales es la biorremediación, la cual se basa en la habilidad de ciertos organismos vivos, como las plantas, bacterias y hongos, para crecer en presencia de compuestos tóxicos (Rhodes, 2014). Particularmente, los hongos filamentosos son un grupo de microorganismos en los que se ha puesto atención especial por su alta relación superficie/volumen (Dixit et al., 2015) y su capacidad de desarrollo bajo condiciones extremas de pH, temperatura, nutrientes y concentración alta de metales (Anand, Isar, Saran, & Saxena, 2006).
La introducción de metales en los ecosistemas induce cambios morfológicos y fisiológicos en las comunidades microbianas (Verma et al., 2001). Lo anterior implica que los sitios contaminados se conviertan en una fuente de microorganismos tolerantes o resistentes a dichos microcontaminantes (Mohammadian, Babai, Arzanbu, Oustan, & Khazaei, 2017). Los mecanismos que los hongos filamentosos utilizan para tolerar o resistir metales incluyen biosorción, captación intracelular y transformación química, aunque pueden variar dependiendo de la especie (Danesh, Tajbakhsh, Goltapeh, & Varma, 2013).
Según el Servicio Geológico Mexicano (2017), Sonora es el estado de la república mexicana que ocupa el primer lugar en producción mineral; en 2016, la entidad aportó 33.3 % del total nacional. En este sentido, la minería ha sido y es sinónimo de crecimiento y desarrollo para el estado y el país; sin embargo, la intensa actividad minera ha provocado la contaminación de suelos y cuerpos de agua, debido a la liberación de metales. De ahí la necesidad de explorar nuevas estrategias para eliminar o reducir la presencia de tales compuestos en el ambiente. El objetivo de este trabajo fue identificar una especie de hongo tolerante a los metales y determinar si presenta potencial para la biorremediación de estos.
Materiales y métodos
Aislamiento e identificación del hongo
Se analizaron muestras de suelo de una mina activa ubicada en el estado de Sonora, México, las cuales fueron recolectadas en recipientes esterilizados. Las muestras (1 g) se depositaron en 100 mL de agua destilada esterilizada; la mezcla se agitó durante 20 min a temperatura ambiente y se hicieron diluciones seriadas (10-1 a 10-4). Después se tomaron alícuotas de 100 µL de cada dilución, se colocaron en placas Petri con medio de cultivo PDA (papa dextrosa agar) y se incubaron a 28 °C por cinco días. Las colonias desarrolladas se seleccionaron y se repitió el procedimiento de siembra en placas Petri con PDA, hasta lograr el aislamiento y purificación de la cepa fúngica. Esta se identificó con base en los principales rasgos morfológicos de las colonias, considerando características macroscópicas tales como color, forma y tipo de colonia, además de las estructuras microscópicas más importantes como esporas, cabeza conidial y conidióforo.
Preparación de la suspensión de esporas
El hongo aislado se inoculó en matraces Erlenmeyer de 250 mL, que contenían 50 mL de PDA, y se incubaron durante siete días a 28 °C. Posteriormente se agregaron 100 mL de agua destilada a temperatura ambiente y se agitaron cuidadosamente durante 5 min con un agitador magnético. El conteo de esporas se realizó con una cámara Neubauer. La suspensión de esporas se utilizó en la inoculación del medio de cultivo suplementado con las sales de los metales tóxicos a evaluar.
Índice de tolerancia
Las sales AgNO3, CdCl2, K2Cr2O7, CuSO4, HgCl2, (CH3COO)2Pbx3H2O y ZnSO4x7H2O se utilizaron como fuente de los metales Ag, Cd, Cr, Cu, Hg, Pb y Zn, respectivamente. El efecto de los metales sobre el crecimiento del hongo, también conocido como índice de tolerancia o resistencia, se determinó siguiendo la metodología descrita por Ezzouhri et al. (2009). Dicho método considera que el índice de tolerancia es igual a la relación entre el radio de las colonias del hongo tratadas con el metal y el radio de las colonias del hongo sin metal (control), es decir:
El hongo aislado se sembró en PDA suplementado con las sales metálicas, de manera individual, a una concentración de 1 mM. Previamente, se hizo un orificio en el centro del PDA solidificado en las placas Petri con el fin de obtener colonias de forma circular y, de este modo, hacer las mediciones del radio. En dicho orificio se depositó una suspensión de 108 esporas·mL-1; las cajas se incubaron a 28 °C. El crecimiento del hongo se determinó a los siete días después de la inoculación midiendo el radio de las colonias; todos los ensayos se realizaron por triplicado. Las esporas utilizadas se colectaron de un cultivo del hongo con siete días de crecimiento previo en PDA.
Concentración mínima inhibitoria
La concentración mínima inhibitoria (CMI) se define como aquella concentración más baja de metal que inhibe el crecimiento de un microorganismo (Ezzouhri et al., 2009). En este estudio, para determinar la CMI, el hongo se inoculó en el medio de cultivo PDA que contenía, individualmente, las sales metálicas AgNO3 (nitrato de plata), CdCl2 (cloruro de cadmio), K2Cr2O7 (dicromato de potasio), CuSO4 (sulfato de cobre), HgCl2 (cloruro de mercurio), (CH3COO)2Pbx3H2O (acetato de plomo trihidratado), y ZnSO4x7H2O (sulfato de zinc heptahidratado) como fuente de los metales Ag, Cd, Cr, Cu, Hg, Pb y Zn, respectivamente, en concentraciones de 5, 10, 15 y 20 mM. Se utilizaron inóculos de 108 esporas·mL-1 con siete días de crecimiento. Las placas inoculadas se incubaron a 28 °C por siete días. El crecimiento del radio de extensión (cm) de las colonias se midió cada 24 h, para determinar el índice de tolerancia a cada concentración. Todos los ensayos se realizaron por triplicado.
Resultados y discusión
Identificación del hongo aislado
De acuerdo con las características macroscópicas, las colonias del hongo en PDA, después de siete días de crecimiento, fueron blancas a amarillentas (entre las primeras 24 a 48 h de cultivo), volviéndose negras y granulosas, con reverso amarillo a verde (Figura 1). Entre las características microscópicas destacan cabezas conidiales globosas de tono negro a café; conidióforos lisos de color café claro y conidios o esporas globosas. Las características mencionadas coinciden para el hongo Aspergillus niger Tiegh. 1867 (Abarca, 2000; Sáez, Flórez, & Cadavid, 2002).
Índice de tolerancia del hongo
La exposición prolongada de los hongos del suelo a metales puede generar una adaptación fisiológica con modificaciones importantes reduciendo el número de poblaciones. Los cambios pueden estar asociados al incremento en la capacidad de biosorción, bioacumulación y transformación de metales (Ashraf & Ali, 2007). Iram, Zaman, Iqbal, y Shabbir (2013) encontraron que algunos hongos del género Aspergillus suelen predominar en suelo contaminado con metales.
En este estudio, el índice de tolerancia de A. niger, expuesto a una concentración 1 mM de cada sal metálica fue mayor de 0.80, después de siete días de crecimiento. El Cuadro 1 muestra el índice de tolerancia del hongo a cada una de las sales evaluadas. Un hongo filamentoso puede considerarse altamente tolerante cuando se expone a una concentración de al menos 1 mM de metal y el índice de tolerancia es igual o mayor que 0.80 (Ezzouhri et al., 2009). Con base en lo anterior, el hongo filamentoso aislado fue altamente tolerante a todos los metales evaluados.
Cuadro 1 Índice de tolerancia de Aspergillus niger expuesto a 1 mM de AgNO3, CdCl2, K2Cr2O7, CuSO4, HgCl2, (CH3COO)2Pbx3H2O y ZnSO4x7H2O como fuente de los metales Ag, Cd, Cr, Cu, Hg, Pb y Zn, respectivamente, después de siete días de incubación a 28 °C.
| Metal | Índice de tolerancia del hongo |
|---|---|
| Cd | 0.89 ± 0.12 |
| Hg | 1.03 ± 0.14 |
| Pb | 1.05 ± 0.18 |
| Ag | 0.94 ± 0.11 |
| Cu | 0.88 ± 0.04 |
| Zn | 0.87 ± 0.07 |
| Cr | 1.27 ± 0.07 |
± Desviación estándar de la media
Cuando A. niger se expuso a una concentración 1 mM de cloruro de cadmio se obtuvo un índice de tolerancia de 0.89 ± 0.12. Este resultado es ligeramente superior al descrito por Ezzouhri et al. (2009) para Penicillium sp. (S4S) y Penicillium sp. (S5S) con índices de 0.55 y 0.62, respectivamente, usando sulfato de cadmio como fuente de dicho elemento. Estos autores también determinaron que el índice de Alternaria alternata (Fr) Keissl. 1992 es solo de 0.13 y que varias especies de Fusarium sp. no crecieron en presencia de 1 mM de cadmio. Roane y Pepper (2000) mencionan que los niveles de tolerancia entre especies de hongos pueden ser diferentes, debido a la variación de los mecanismos de resistencia.
En el caso del mercurio (1 mM de cloruro de mercurio), A. niger tuvo un índice de tolerancia de 1.03 ± 0.14 por lo que resultó altamente tolerante al metal. Kurniati, Arfarita, e Imai (2014) reportaron que Aspergillus flavus Link 1809 tuvo un índice de tolerancia de 0.80 con 25 ppm de cloruro de mercurio.
El plomo es el metal que se encuentra mayormente como contaminante en suelo, agua y aire y es también altamente tóxico para las plantas, humanos, animales y microorganismos (Low, Lee, & Liew, 2000). De ahí la importancia de la búsqueda de alternativas para tratar sitios contaminados con este metal. En este sentido, se encontró que A. niger es altamente tolerante a 1 mM de acetato de plomo, ya que su índice fue 1.05 ± 0.18.
En este trabajo se observó que A. niger fue altamente tolerante a la plata, ya que el índice fue 0.94 ± 0.11 (usando nitrato de plata como fuente del elemento). En la actualidad no existen muchos estudios que demuestren la tolerancia o resistencia de los hongos filamentosos a dicho metal; sin embargo, Singh (2006) encontró que Fusarium oxysporum Link 1809 reduce iones de plata en solución, dando lugar a una suspensión estable.
Con respecto al cobre (1 mM de sulfato de cobre), A. niger mostró índices de tolerancia de 0.88 ± 0.04; es decir, el hongo es altamente tolerante. Ezzouhri et al. (2009) indicaron valores similares de tolerancia a 1 mM de cobre: 0.79, 0.98, 0.91 y 1.0 para los hongos Penicillium sp. (S2W), Penicillium sp. (S2S), Fusarium sp. (S1S) y Aspergillus niger (S5W), respectivamente.
El índice de tolerancia de A. niger a 1 mM de sulfato de zinc fue 0.81 ± 0.07, por lo tanto, el hongo fue altamente tolerante. Sintuprapa, Thiravetyan, y Tanticharoen (2000) sugirieron que ciertas especies de hongos filamentosos toleran al zinc gracias al mecanismo de captación a través del intercambio intra y extracelular en forma de precipitación de polifosfatos.
Finalmente, en el caso del cromo (1 mM de dicromato de potasio), A. niger tuvo un índice alto de tolerancia de 1.27 ( 0.06. Ezzouhri et al. (2009) reportaron índices similares en otros hongos; estos autores encontraron que A. alternata y Penicillium sp. fueron altamente tolerantes al cromo (dicromato de potasio como fuente) con índices de 1.02 y 1.23, respectivamente. También indicaron que Geotrichum candidum Link 1809 es poco tolerante al metal, ya que determinaron un índice de 0.19.
Concentración mínima inhibitoria
El Cuadro 2 indica la concentración mínima de los metales (en forma de sal metálica) que inhibieron el crecimiento de A. niger. El mercurio, el cobre y la plata fueron los más tóxicos para A. niger, ya que la CMI se encontró entre 5 y 10 mM de cada sal metálica, mientras que, para cloruro de cadmio, la CMI fue entre 15 y 20 mM. En presencia de las sales de plomo, zinc y cromo, el hongo creció incluso con la concentración más elevada de dichos metales; por lo tanto, la CMI fue mayor de 20 mM. En este sentido, otros estudios con concentraciones más altas de plomo, zinc y cromo son necesarios para encontrar aquellas que inhiban el crecimiento de A. niger.
Cuadro 2 Concentración mínima inhibitoria (CMI) de Aspergillus niger expuesto a AgNO3, CdCl2, K2Cr2O7, CuSO4, HgCl2, (CH3COO)2Pbx3H2O y ZnSO4x7H2O como fuente de los metales Ag, Cd, Cr, Cu, Hg, Pb y Zn, respectivamente.
| Metal | MIC (mM) / CMI (mM) |
|---|---|
| Cd | 15 < MIC < 20 / 15 < CMI < 20 |
| Hg | 5 < MIC <10 / 5 < CMI <10 |
| Pb | MIC > 20 / CMI > |
| Ag | 5 < MIC < 10 7 5 < CMI <10 |
| Cu | 5 < MIC <10 / 5 < CMI < 10 |
| Zn | MIC >20 / CMI > 20 |
| Cr | MIC > 20/v |
En las concentraciones más bajas de las sales metálicas (1 y 5 mM), el hongo fue muy tolerante y mostró un fuerte crecimiento, excediendo el control (sin metal) en el caso del plomo, zinc y cromo. El patrón de crecimiento sugiere el desarrollo de tolerancia o la adaptación de los hongos a la presencia de metales.
La Figura 2 muestra los índices de tolerancia de A. niger expuesto a 5 mM de cada sal metálica. A partir de dicha concentración, la fase de latencia se prolongó en comparación con el control, especialmente con Cd, Hg, Cu y Ag; el crecimiento del hongo se pudo observar y medir hasta los tres días después de la inoculación.

Figura 2 Índice de tolerancia de Aspergillus niger en presencia de 5 mM de AgNO3, CdCl2, CuSO4, HgCl2, (CH3COO)2Pbx3H2O, ZnSO4x7H2O y K2Cr2O7, como fuente de los metales Ag, Cd, Cu, Hg, Pb, Zn y Cr, respectivamente. Sobre las barras se representa la desviación estándar de la media.
Se observó que A. niger fue tolerante hasta 5 mM de nitrato de plata, ya que el hongo no tuvo capacidad de crecimiento a 10 mM. La plata es un metal usado ampliamente en las industrias fotográfica, eléctrica, electrónica y química; la forma soluble, al igual que en otros metales pesados, resulta muy peligrosa porque es transportada fácilmente quedando disponible para plantas y animales. Para los humanos, el envenenamiento con este tipo de metales puede provocar disfunción severa de los riñones, sistema reproductivo, hígado, cerebro y sistema nervioso central (Dixit et al., 2015). De ahí, la importancia de la búsqueda de posibles estrategias para tratar sitios contaminados con el metal.
En presencia de cobre (sulfato de cobre), la CMI de A. niger fue entre 5 y 10 mM. El hongo tuvo capacidad de crecimiento hasta 5 mM con un índice de tolerancia de 1.18 ± 0.38, después de siete días de incubación (Figura 2). Ezzouhri et al. (2009) encontraron valores similares de CMI para Penicillium sp. (S4W), Penicillium sp. (S5S), siendo 7.5 mM < CMI < 10 mM para ambos hongos, usando también sulfato de cobre como fuente del metal. Según Kermasha, Pellerin, Rovel, Goetghebeur, y Metche (1993), la tolerancia o resistencia de hongos al cobre, como A. niger, se debe a un proceso activo que involucra la síntesis de una metalotioneína (proteína dependiente del cobre).
El mercurio parece ser tóxico para Aspergillus; a pesar de ello, ciertas especies todavía son capaces de crecer a ciertas concentraciones del metal. En este trabajo, A. niger resultó altamente tolerante al mercurio (índice de tolerancia de 1.03 ± 0.14 a 1 mM de cloruro de mercurio). Al aumentar la concentración de la sal mercurial a 5 mM, el índice de tolerancia disminuyó a 0.82 ± 0.03. El hongo mostró capacidad de crecimiento significativo en presencia de hasta 5 mM de cloruro de mercurio, pero la inhibición fue completa a 10 mM. En otro estudio se encontró que A. flavus tolera hasta 100 ppm de mercurio (Kurniati et al., 2014). También se ha indicado que Phanerochaete chrysosporium Burds 1974 es tolerante y tiene la capacidad de acumular dicho metal (Dhawale, Lane, & Dhawale, 1996).
La Figura 3 muestra el índice de tolerancia de A. niger a 10 mM de sales de cadmio, plomo, zinc y cromo. Dicha concentración redujo el crecimiento y aumentó la fase de latencia en comparación con el control (sin metal). No obstante, en algunos casos, el hongo creció relativamente rápido, incluso después de una larga fase de latencia; por ejemplo, con sales de plomo y cromo a 15 y 20 mM. La reducción de la tasa de crecimiento es una respuesta típica de los hongos en presencia de tóxicos (Gadd, 1993), mientras que el alargamiento de la fase de latencia no siempre está presente (Ezzouhri et al., 2009).
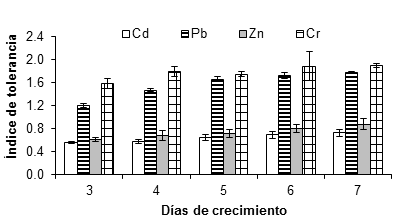
Figura 3 Índice de tolerancia de Aspergillus niger en presencia de 10 mM de CdCl2, (CH3COO)2Pbx3H2O y ZnSO4x7H2O, K2Cr2O7 como fuente de los metales Cd, Pb, Zn y Cr, respectivamente. Sobre las barras se representa la desviación estándar de la media.
La Figura 4 muestra que A. niger tuvo capacidad de crecimiento hasta 15 mM de cloruro de cadmio con un índice de tolerancia de 0.61 ± 0.09, después de siete días de incubación a 28 °C; sin embargo, a 20 mM ya no hubo crecimiento. Esto pudo deberse a un efecto de inhibición producto de la intoxicación del hongo, ya que el cadmio es considerado uno los metales más peligrosos por su alta estabilidad y toxicidad. Joo y Hussein (2012) observaron una fuerte inhibición del crecimiento de A. niger expuesto a 1 mM de cadmio. Jabbari, Faezi, Khosravan, Farahmad, y Shakibaie (2010) observaron que el cadmio ejerce efectos severos de inhibición en los procesos fisiológicos de los organismos, en algunos casos, incluso a concentraciones menores de 2 ppm. En contraste, Massaccesi, Romero, Cazau, y Bucsinszky (2002) indicaron que varias especies de hongos filamentosos, aislados de sedimentos industriales contaminados, pudieron remover de 63 a 70 % del cadmio durante 13 días de crecimiento. Además, Mohammadian et al. (2015) indicaron que Aspergillus versicolor Vuillemin 1903 y Aspergillus fumigatus Fresenius 1863 presentan CMI de 2 000 mg·L-1 y 1 000 mg·L-1, respectivamente. Lo anterior demuestra la capacidad de adaptación de los microorganismos, así como su potencial de uso en biorremediación.
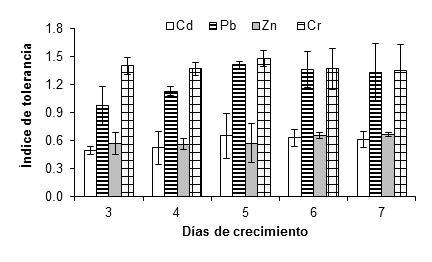
Figura 4 Índice de tolerancia de Aspergillus niger en presencia de 15 mM de CdCl2, (CH3COO)2Pbx3H2O, ZnSO4x7H2O y K2Cr2O7 como fuente de los metales Cd, Pb, Zn y Cr, respectivamente. Sobre las barras se representa la desviación estándar de la media.
La Figura 5 muestra que A. niger presentó mayor resistencia al plomo, zinc y cromo, ya que toleró una concentración de 20 mM de las sales utilizadas como fuente de estos metales. En el caso del plomo, el hongo tuvo un índice de tolerancia de 0.71 ± 0.12 después de siete días. Se observó un incremento en el crecimiento del hongo en todas las concentraciones evaluadas; Ezzouhri et al. (2009) observaron un comportamiento similar en A. alternata al incrementar 4 % su crecimiento en presencia de 1 mM de carbonato de plomo. Dichos autores también encontraron que la CMI (mM) de plomo para Penicillium sp. (S3S) Penicillium sp. (S4W), Penicillium sp. (S5S), Fusarium sp. (S5S), A. niger (S5W) y A. niger (S5S) fue de 12.5 < CMI < 15, 20 < CMI < 25, 7.5 < CMI < 10, 12.5 < CMI < 15, 20 < CMI < 25 y 25 < CMI < 30, respectivamente; todas las cepas fueron aisladas de suelo con actividad minera. Por otra parte, Sanyal, Rautaray, Bansal, Ahmad, y Sastry (2005) reportaron que el plomo no es tóxico para el hongo F. oxysporum, el cual crece fácilmente después de la exposición a este metal.
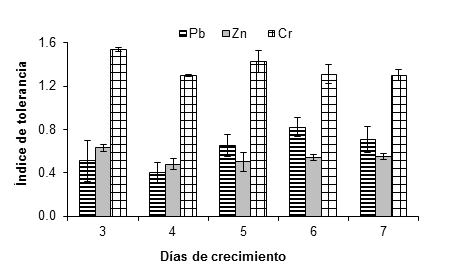
Figura 5 Índice de tolerancia de Aspergillus niger en presencia de 20 mM de (CH3COO)2Pbx3H2O, ZnSO4x7H2O y K2Cr2O7 como fuente de Pb, Zn y Cr, respectivamente. Sobre las barras se representa la desviación estándar de la media.
El hongo A. niger resultó moderadamente tolerante al zinc, ya que se obtuvieron índices de 0.87 ± 0.07, 0.55 ± 0.01, 0.88 ± 0.10, 0.66 ± 0.02 y 0.55 ± 0.01 a 1, 5, 10, 15 y 20 mM de sulfato de zinc, respectivamente, después de siete días de crecimiento. Dado que aún a 20 mM se observó crecimiento importante del micelio del hongo, la CMI es mayor que dicha concentración. Vadkertiova y Slavikova (2006) encontraron que Pichia anomala Hansen 1904, Candida krusei Berkhot 1923 y Cryptococcus laurentii (Kuff.) C. E. Skinner 1950 toleran el zinc a concentraciones superiores de 20 mM, resultado similar al de este trabajo con A. niger. Castro-Silva et al. (2003) también observaron tal similitud en cepas de levaduras aisladas de minas de carbón. Por otro lado, Levinskaite (2002) demostró que el índice de crecimiento de Penicillium atramentosum Pitt 1980 25SL disminuyó lentamente a partir de 40 mM de zinc, usando sulfato de zinc como fuente del metal. Por su parte, Sintuprapa et al. (2000) sugirieron que el mecanismo de captación de zinc, de ciertas especies de hongos filamentosos, es el intercambio intra y extracelular en forma de precipitación de polifosfatos. El zinc es esencial para todos los organismos, aunque a altas concentraciones puede volverse tóxico (Balsalobre et al., 2003).
La fuente de cromo promovió el crecimiento del hongo en todas las concentraciones evaluadas. Se encontraron índices de tolerancia de 1.27 ± 0.06, 1.49 ± 0.06, 1.90 ± 0.03, 1.35 ± 0.01 y 1.30 ± 0.05 para 1, 5, 10, 15 y 20 mM de dicromato de potasio, respectivamente; es decir, A. niger es altamente resistente y la CMI es mayor de 20 mM. En este sentido se requieren más estudios para encontrar la concentración de cromo que inhibe el crecimiento de A. niger. Al respecto, Ezzouhri et al. (2009) utilizaron dicromato de potasio, como fuente de cromo, y observaron valores similares de CMI (20 mM < CMI < 25 mM) para especies de hongos como Penicillium sp. (S3S) y Fusarium sp. (S5S); mientras que para Penicillium sp. (S4W), Penicillium sp. (S5S), A. niger (S5W) y A. niger (S5S), los CMI fueron menores: 12.5 < CMI < 15, 15 < CMI < 20, 12.5 < CMI < 15 y 10 < CMI < 12.5, respectivamente. La detoxificación del cromo por A. niger puede ser mediada por un sistema enzimático antioxidante como peroxidasa, catalasa y peróxido ascorbato (Srivastava & Thakur, 2006).
En general, el patrón de crecimiento del hongo sugiere el desarrollo de tolerancia y adaptación a la presencia de los metales evaluados. Con 1 mM de cada sal metálica, el crecimiento del hongo inició a las 24 h posteriores a la incubación, mientras que, a partir de 5 mM, el crecimiento del hongo inició a las 72 h, lo que implica un alargamiento de la fase de latencia. La Figura 6 ilustra los índices de tolerancia de A. niger a las distintas concentraciones evaluadas para cada metal, durante siete días de cultivo. Los metales más tóxicos para el hongo fueron plata, mercurio y cobre, ya que a partir de 10 mM de las sales metálicas no hubo crecimiento, seguidos por el Cd (15 mM). A 20 mM, el crecimiento del hongo solo se observó con las sales de plomo, zinc y cromo.
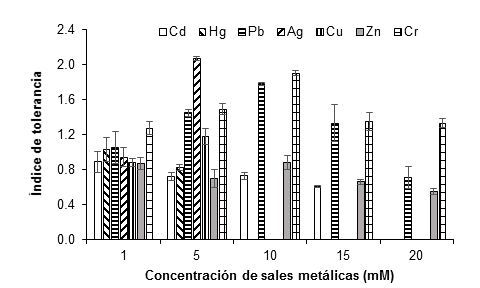
Figura 6 Índice de tolerancia de Aspergillus niger a 1, 5, 10, 15 y 20 mM de AgNO3, CdCl2, CuSO4, HgCl2, (CH3COO)2Pbx3H2O, ZnSO4x7H2O y K2Cr2O7, como fuente de los metales Ag, Cd, Cu, Hg, Pb, Zn y Cr, respectivamente, después de siete días de cultivo a 28 °C. Sobre las barras se representa la desviación estándar de la media.
En este y otros estudios se ha observado que los hongos filamentosos toleran la presencia de metales tóxicos. Por ello, estos microorganismos se consideran excelentes candidatos para acumular metales en sus micelios y esporas e incluso reducir la toxicidad (Bennet, Wunch, & Faison, 2002). La biosorción, captación intracelular y transferencia química son algunos de los mecanismos que los hongos utilizan para tolerar, acumular y transformar los metales tóxicos, aunque pueden variar según la especie (Chatterjee, Mukherjee, Sarkar, & Roy, 2012; Dixit et al., 2015). La biosorción se basa en las interacciones entre los metales y las células (biomasa) vivas o no vivas de los microorganismos (Izkandar, Zainudin, & Tan, 2011) e incluye intercambio iónico, quelación, adsorción, cristalización y precipitación, seguido por la difusión a través de la pared celular (Danesh et al., 2013). En los hongos filamentosos, la pared está formada por quitina, quitosano, glucanos, proteínas, lípidos y otros polisacáridos. Esta composición le confiere a la pared celular un gran número y variedad de grupos funcionales o sitios, como una resina de intercambio iónico. Por otro lado, los mecanismos de transferencia o transformación química son reducción, metilación y dealquilación (Danesh et al., 2013; Gadd, 1993). Con este último tipo de mecanismos, es importante considerar la posibilidad de que el producto resultante de la transformación, por acción de los microorganismos, resulte más tóxico que la forma inicial del metal; esto puede ocurrir con el plomo o el mercurio. En esta investigación no se revisó la producción de compuestos metilados de plomo y mercurio, pero se ha considerado hacerlo en estudios posteriores.
Conclusiones
Los resultados de esta investigación indican que el hongo filamentoso A. niger, aislado de un sitio con actividad industrial como la minería, tiene la capacidad de tolerar concentraciones altas de metales. El nivel de tolerancia dependió del metal, siendo el cadmio, mercurio, plata y cobre los más tóxicos, mientras que el plomo, zinc y cromo no afectaron el crecimiento del hongo a la concentración de sal metálica más alta evaluada (20 mM). Por lo anterior se sugiere que A. niger es un candidato prometedor para la eliminación de metales en ambientes contaminados. Se recomienda determinar la cantidad de metales que este hongo puede bioacumular y transformar, así como evaluar diferentes condiciones de cultivo (temperaturas, pH, tiempos de contacto y mezcla de metales).
Agradecimientos
A la Universidad Estatal de Sonora por el financiamiento otorgado para la realización de esta investigación a través del proyecto interno con clave UES-PII-14-UAH-IAI-04 (periodo 2014-2015). A Denisse Palma, Karen Vargas, Martín Quintero, Melissa Domínguez y Roxana Adriano, estudiantes del verano científico del “Programa Delfín 2015”, por el aislamiento de la cepa del hongo, y a Eber Addi Quintana Obregón por la asesoría técnica al inicio del estudio.
REFERENCIAS
Abarca, M. L. (2000). Taxonomía e identificación de especies implicadas en la aspergilosis nosocomial. Revista Iberoamericana de Micología, 17, S79-S84. Retrieved from http://www.fba.org.ar/panel-gestion/InformeResultado/MI/mi33.pdf [ Links ]
Anand, P., Isar, J., Saran, S., & Saxena, R. K. (2006). Bioaccumulation of copper by Trichoderma viride. Bioresource Technology, 97, 1018-1025. doi: 10.1016/j.biortech.2005.04.046 [ Links ]
Ashraf, R., & Ali, T. A. (2007). Effect of heavy metals on soil microbial community and Mung beans seed germination. Pakistan Journal of Botany, 39(2), 629-636. Retrieved from http://www.pakbs.org/pjbot/PDFs/39(2)/PJB39(2)629.pdf [ Links ]
Balsalobre, L., De Siloniz, M. I., Valderrama, M. J., Benito, T., Larrea, M. T., & Peinado, J. M. (2003). Occurrence of yeasts in municipal wastes and their behavior in presence of cadmium copper and zinc. Journal of Basic Microbiology, 43, 185-193. doi: 10.1002/jobm.200390021 [ Links ]
Bennet, J. W., Wunch, K. G., & Faison, B. D. (2002). Manual of environmental microbiology: Use of fungi biodegradation. Washington D.C., USA: ASM Press. [ Links ]
Castro-Silva, M. A., De Souza, L. A. O., Gerchenski, A. V., Jaques, D. B., Rodriques, A. L., De Souza, P. L., & Rorig, L. R. (2003). Heavy metal resistance of microorganisms isolated from coal mining environments of Santa Catarina. Brazilian Journal of Microbiology, 34, 45-47. doi: 10.1590/S1517-83822003000500015 [ Links ]
Chatterjee, S., Mukherjee, A., Sarkar, A., & Roy, P. (2012). Bioremediation of lead by-lead-resistant microorganisms, isolated from industrial sample. Advances in Bioscience and Biotechnology, 3(3), 290-295. doi: 10.4236/abb.2012.33041 [ Links ]
Danesh, Y. R., Tajbakhsh, M., Goltapeh, E. M., & Varma, A. (2013). Mycoremediation of heavy metals. In E. M. Goltapeh, Y.R. Danesh, & A. Varma (Eds.), Fungi as bioremediators. Soil Biology (vol. 32, pp. 245-267). Berlin Heidelberg: Springer-Verlag. doi: 10.1007/978-3-642-33811-3_11 [ Links ]
Dhawale, S. S., Lane, A. C., & Dhawale, W. (1996). Effects of mercury on the white rot fungus Phanerochaete chrysosporium. Bulletin of Environmental Contamination of Toxicology, 56(5), 825. doi: 10.1007/s001289900120 [ Links ]
Dixit, R., Malaviya, D., Pandiyan, K., Singh, U. B., Sahu, A., Shukla, R., Singh, B. P., …Paul, D. (2015). Bioremediation of heavy metals from soil and aquatic environment: An overview of principles and criteria of fundamental processes. Sustainability, 7, 2189. doi: 10.3390/su7022189 [ Links ]
Ezzouhri, L., Castro, E., Moya, M., Espinola, F., & Lairini, K. (2009). Heavy metal tolerance of filamentous fungi isolated from polluted sites in Tangier Morocco. African Journal of Microbiology Research, 3(2), 035-048. Retrieved from http://www.academicjournals.org/article/article1380177143_Ezzouhri%20et%20al.pdf [ Links ]
Gadd, G. M. (1993). Interactions of fungi with toxic metals. New Phytologist, 124(1), 25-60. doi: 10.1111/j.1469-8137.1993.tb03796.x [ Links ]
Iram, S., Zaman, A., Iqbal, Z., & Shabbir, R. (2013). Heavy metal tolerance of fungus isolated from soil contaminated with sewage and industrial wastewater. Polis Journal of Environmental Studies, 22(3), 691-697. Retrieved from https://pdfs.semanticscholar.org/8e80/0b9756b6b298a05c31668bfd2b820361b0b3.pdf [ Links ]
Izkandar, N. L., Zainudin, N. A., & Tan, S. G. (2011). Tolerance and biosorption of copper (Cu) and lead (Pb) by filamentous fungi isolated from a freshwater ecosystem. Journal of Environmental Sciences, 23(5), 824-830. doi: 10.1016/S1001-0742(10)60475-5 [ Links ]
Jabbari, N. K. A., Faezi, G. M., Khosravan, A., Farahmad, A., & Shakibaie, M. R. (2010). Cadmium bioremediation by metal resistant mutated bacteria isolated from active sludge of industrial effluent. Iranian Journal of Environmental Health Science & Engineering, 7(4), 279-286. Retrieved from http://www.bioline.org.br/pdf?se10032 [ Links ]
Joo, J. H., & Hussein, K. A. (2012). Heavy metal tolerance of fungi isolated from contaminated soil. Korean Journal of Soil Science Fertilized, 45(4), 565-571. doi: 10.7745/KJSSF.2012.45.4.565 [ Links ]
Kermasha, S., Pellerin, F., Rovel, B., Goetghebeur, M., & Metche, M. (1993). Purification and characterization of copper metallothioneins from Aspergillus niger. Bioscience, Biotechnology and Biochemistry, 57(9), 1420-1423. doi: 10.1271/bbb.57.1420 [ Links ]
Krauter, R., Martinelli, K., Williams, S., & Martins, S. (1996). Removal of Cr (VI) from ground water by Saccharomyces cerevisiae. Biodegradation, 7(4), 277-286. doi: 10.1007/BF00115741 [ Links ]
Kurniati, E., Arfarita, N., & Imai, T. (2014). Potential use of Aspergillus flavus strain KRP1 in utilization of mercury contaminant. Procedia Environmental Science, 20, 254-260. doi: 10.1016/j.proenv.2014.03.032 [ Links ]
Levinskaite, L. (2002). Response of soil fungi to chromium (VI). Ekologija, 1, 10-13. Retrieved from http://elibrary.lt/resursai/LMA/Ekologija /E-10.pdf [ Links ]
Low, K. S., Lee, C. K., & Liew, S. C. (2000). Sorption of cadmium and lead from aqueous solution by spent grain. Process Biochemistry, 36, 59-64. doi: 10.1016/S0032-9592(00)00177-1 [ Links ]
Massaccesi, G., Romero, M. C., Cazau, M. C., & Bucsinszky, A. M. (2002). Cadmium removal capacities of filamentous soil fungi isolated from industrially polluted sediments, in La Plata (Argentina). World Journal of Microbiology and Biotechnology, 18(9), 817-820. doi: 10.1023/A:1021282718440 [ Links ]
Mohammadian, E., Babai, A. A., Arzanbu, M., Oustan, S., & Khazaei, S. H. (2017). Tolerance to heavy metals in filamentous fungi isolated from contaminated mining soils in the Zanjan Providence, Iran. Chemosphere, 185, 290-296. doi: 10.1016/j.chemosphere.2017.07.022 [ Links ]
Mohammadian, F. M., Soleimani, N., Mehrasbi, M., Darabian, A., Mohammadi, J., & Ramazani, A. (2015). Highly cadmium tolerant fungi: their tolerance and removal potential. Journal of Environmental Health Science & Engineering, 13(19), 1-9. doi: 10.1186/s40201-015-0176-0 [ Links ]
Nordberg, G., Fowler, B., & Nordberg, M. (2015). Toxicology of metals: overview, definitions, concepts and trends. In G. Nordberg, B. Fowler, & M. Nordberg (Eds.), Handbook on the toxicology of metals (vol. 1, pp. 1-12). San Diego, USA: Elsevier. [ Links ]
Roane, T. M., & Pepper, L. L. (2000). Microbial responses to environmentally toxic cadmium. Microbial Ecology, 38, 358-364. doi: 10.1007/s002489901001 [ Links ]
Rhodes, Ch. (2014). Mycoremediation (bioremediation with fungi) - growing mushrooms to clean the earth. Chemical Speciation & Bioavailability, 26(3), 196-198. doi: 10.3184/095422914X14047407349335 [ Links ]
Sáez, V. A., Flórez, V. L., & Cadavid, R. A. (2002). Caracterización de una cepa nativa de Aspergillus niger y evaluación de la producción de ácido cítrico. Revista Universidad EAFIT, 128, 33-41. Retrieved from http://publicaciones.eafit.edu.co/index.php/revista-universidad-eafit/article/view/845/753 [ Links ]
Sanyal, A., Rautaray, D., Bansal, V., Ahmad, A., & Sastry, M. (2005). Heavy metal remediation by a fungus as a means of production of lead and cadmium carbonate crystals. Langmuir, 21, 7220-7224. doi: 10.1021/la047132g [ Links ]
Servicio Geológico Mexicano (SGM). (2017). Anuario estadístico de la minería mexicana 2016. Retrieved from http://www.sgm.gob.mx/productos/pdf/Anuario_2015_Edicion_2016.pdf [ Links ]
Singh, H. (2006). Mycoremediation. New York, USA: Ed. Wiley-Interscience. [ Links ]
Sintuprapa, W., Thiravetyan, P., & Tanticharoen, M. (2000). A possible mechanism of Zn2+ uptake by living cells of Penicillium sp. Biotechnology Letters, 22, 1709-1712. doi: 10.1023/A:1005688132205 [ Links ]
Srivastava, S., & Thakur, I. S. (2006). Biosorption potency of Aspergillus niger for removal of chromium (VI). Current Microbiology, 53, 232-237. doi: 10.1007/s00284-006-0103-9 [ Links ]
Vadkertiova, R., & Slavikova, E. (2006). Metal tolerance of yeasts isolated from water. Journal Basic of Microbiology, 46(2), 145-152. doi: 10.1002/jobm.200510609 [ Links ]
Verma, T., Srinath, T., Gadpayle, R. U., Ramteke, P. W., Hans, R. K., & Garg, S. K. (2001). Chromate tolerant bacteria isolated from tannery effluent. Bioresource Technology , 78, 31-35. doi: 10.1016/S0960-8524(00)00168-1 [ Links ]
Recibido: 23 de Marzo de 2017; Aprobado: 22 de Enero de 2018











 texto en
texto en 



