Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Chapingo serie ciencias forestales y del ambiente
versión On-line ISSN 2007-4018versión impresa ISSN 2007-3828
Rev. Chapingo ser. cienc. for. ambient vol.24 no.1 Chapingo ene./abr. 2018
https://doi.org/10.5154/r.rchscfa.2017.01.010
Artículo científico
La inoculación con un hongo ectomicorrízico comestible y bacterias incrementa el crecimiento y mejora la calidad fisiológica de Pinus montezumae Lamb.
1Colegio de Postgraduados, Campus Montecillo, Microbiología, Edafología. Carretera México-Texcoco km 36.5. C. P. 56230. Texcoco, Estado de México, México.
2Benemérita Universidad Autónoma de Puebla, Laboratorio de Microbiología de Suelos. Instituto de Ciencias. Edificio 103 J, Ciudad Universitaria. C. P. 72570. Puebla, México.
Introducción:
La ectomicorriza y las bacterias auxiliadoras de la micorrización son fundamentales en el reciclaje nutrimental de los ecosistemas forestales.
Objetivo:
El crecimiento, tasa fotosintética, clorofilas, carotenos, colonización de raíz y contenido de N, P y K se evaluaron en plantas de Pinus montezumae inoculadas con el hongo ectomicorrízico comestible Hebeloma mesophaeum (Hm), solo y en combinación con las bacterias Cohnella sp. (C) o Azospirillum brasilense (Ab).
Resultados y discusión:
Las plantas inoculadas solamente con el hongo o coinoculados con el hongo y las bacterias presentaron mejor calidad fisiológica que las plantas no inoculadas y las inoculadas exclusivamente con las bacterias, principalmente, en términos de crecimiento, fotosíntesis y contenido nutrimental. La inoculación con Hm, sola o combinada con las bacterias, incrementó la concentración de clorofilas a, b, y total. La inoculación bacteriana incrementó la concentración de carotenos, mientras que el hongo por sí solo no tuvo efecto. Existió sinergismo en las plantas inoculadas con Hm + Ab, el cual se reflejó en el contenido de N aéreo y total, en comparación con las plantas inoculadas con Hm o Ab por separado. La colonización ectomicorrízica varió de 69 a 76 % en los tratamientos inoculados.
Conclusión:
Existe potencial biotecnológico de la coinoculación con hongos comestibles ectomicorrízicos y bacterias auxiliadoras de la micorrización en P. montezumae.
Palabras clave: Micorriza; tasa fotosintética; clorofila; Hebeloma mesophaeum; Cohnella; Azospirillum brasilense
Introduction:
Ectomycorrhiza and mycorrhiza helper bacteria are essential to the nutritional recycling of forest ecosystems.
Objective:
Growth, photosynthetic rate, chlorophylls, carotenes, root colonization and N, P and K contents were evaluated in Pinus montezumae plants inoculated with the edible ectomycorrhizal fungus Hebeloma mesophaeum (Hm), alone and in combination with the bacteria Cohnella sp. (C) or Azospirillum brasilense (Ab).
Results and discussion:
Plants inoculated only with the fungus or coinoculated with the fungus and the bacteria showed better physiological quality than the uninoculated plants and those inoculated exclusively with the bacteria, mainly in terms of growth, photosynthesis and nutrient content. Hm inoculation, alone or in combination with the bacteria, increased the chlorophyll a, b, and total concentrations. Bacterial inoculation increased the carotene concentration, while the fungus alone had no effect. There was synergism in the plants inoculated with Hm + Ab, which was reflected in shoot and total N contents, compared to plants inoculated with Hm or Ab separately. Ectomycorrhizal colonization ranged from 69 to 76 % in inoculated treatments.
Conclusion:
There is biotechnological potential for coinoculation with edible ectomycorrhizal fungi and mycorrhiza helper bacteria in P. montezumae.
Keywords: Mycorrhiza; photosynthetic rate; chlorophyll; Hebeloma mesophaeum; Cohnella; Azospirillum brasilense
Introducción
La ectomicorriza es una simbiosis mutualista de gran importancia ecológica que se establece entre más de 20 000 especies de hongos y las raíces de más de 5 000 especies de plantas angiospermas y gimnospermas (Pérez-Moreno, Lorenzana, Carrasco, & Yescas-Pérez, 2010; Rinaldi, Comandini, & Kuyper, 2008). El principal beneficio de la simbiosis ectomicorrízica para las plantas es el abastecimiento nutrimental y la protección a los factores de estrés, mientras que para los hongos es la provisión de carbono por las plantas hospederas (Smith & Read, 2008). Además de acceder a los nutrientes del suelo, los hongos ectomicorrízicos y la micorrizosfera proporcionan un nicho único para otros microorganismos, incluyendo una vasta comunidad de bacterias. Dadas sus propiedades benéficas, diversos grupos de bacterias rizosféricas se conocen como bacterias auxiliadoras de la micorrización (BAM), las cuales se caracterizan por estimular el desarrollo y establecimiento de la micorriza (Cumming, Zawaski, Desai, & Collart, 2015).
En la actualidad, a nivel internacional, uno de los criterios de selección de los hongos ectomicorrízicos es su comestibilidad, lo cual los convierte en otro recurso aprovechable de los ambientes boscosos. Si bien existe potencial de coinoculación con hongos ectomicorrízicos comestibles y bacterias (Sousa, Franco, Ramos, Oliveira, & Castro, 2015), la información sobre su efecto en la fisiología, nutrición y crecimiento de las plantas de importancia forestal es escasa. Por otro lado, en México, la deforestación es una problemática de gran relevancia; de 2005 al 2010 se perdieron 775 000 ha de bosques y selvas en el país (Food and Agriculture Organization of the United Nations [FAO], 2010). Aunado a este problema, la supervivencia de pinos trasplantados de invernadero a campo es muy variable y en algunos sitios puede ser de 0 % (Cetina, 2004).
En los programas de reforestación se usan diversas especies de Pinus; sin embargo, su establecimiento ha fallado porque en este proceso y durante su crecimiento son dependientes de la ectomicorriza, la cual no se incorpora tradicionalmente en la producción de planta en México (Pérez-Moreno, 2016; Valdés, Ambriz, Camacho, & Fierros, 2010). En el presente trabajo se evaluó el efecto de la inoculación de un hongo ectomicorrízico comestible y dos bacterias auxiliadoras de la micorrización sobre el crecimiento, fisiología y contenido nutrimental de Pinus montezumae Lamb.
Materiales y métodos
El germoplasma utilizado de P. montezumae proviene de San Rafael, municipio de Tlalmanalco, Estado de México. Las semillas se esterilizaron con H2O2 al 30 % durante 20 min. El inóculo se preparó con esporomas provenientes de un bosque de pinos del municipio de Ozumba, Estado de México. El inóculo se obtuvo a partir de píleos de Hebeloma mesophaeum (Pers.) Quél., los cuales se cortaron de los estípites y se deshidrataron a 35 °C (deshidratador tipo charola Jersa®, México). Posteriormente, los píleos se molieron en un molino eléctrico (Thomas Scientific®, Model 4 Wiley Mill, EUA), a través de un tamiz de 1 mm de apertura, para obtener un tamaño de partícula homogéneo. El inóculo se almacenó a 5 °C.
Preparación del sustrato e inoculación
El sustrato consistió en una mezcla de arena, corteza y suelo forestal en una proporción 2:2:1, el cual se esterilizó en tres ocasiones con vapor de agua a una presión de 1.3 kg · cm-2 a 125 °C durante 5 h. Las semillas se sembraron en tubetes de plástico negro de 125 cm3 que contenían el sustrato descrito. Cada planta se inoculó con una concentración de 107 a 108 esporas de H. mesophaeum, determinada con un hematocitómetro. Se hicieron dos inoculaciones esporales del hongo: la primera simultáneamente con la siembra y la segunda 90 días después.
Cultivo de cepas bacterianas
La cepa bacteriana Cohnella sp., aislada de la raíz de P. montezumae, fue proporcionada por el Laboratorio de Microbiología del Colegio de Postgraduados, y Azospirillum brasilense Terrand Krieg et Dobereiner fue proporcionada por el Laboratorio de Microbiología de Suelos del Centro de Investigación en Ciencias Microbiológicas del Instituto de Ciencias de la Benemérita Universidad Autónoma de Puebla. Ambas especies fueron identificadas con técnicas moleculares de manera previa en dichos laboratorios. Las cepas se cultivaron en caldo nutritivo Merck® y se mantuvieron en movimiento constante a 28 °C hasta alcanzar una concentración de 108 ufc·mL-1. El cultivo bacteriano se centrifugó a 7 000 rpm y se eliminó el sobrenadante; el concentrado se lavó con agua destilada estéril, para eliminar los restos del medio de cultivo, y se resuspendió en agua destilada estéril para dejarlo a la misma concentración de 108 ufc·mL-1. Posteriormente, a los 10 días después de la segunda inoculación con el hongo ectomicorrízico, se efectuó una sola aplicación de 3 mL de la suspensión bacteriana a cada planta en las primeras horas del día. El experimento se mantuvo durante 420 días en un invernadero cerrado sin filtración de aire, control de temperatura ni fertilización adicional. Las condiciones ambientales durante el transcurso del experimento fueron: temperatura media anual 20 °C (9 y 31 °C, mínima y máxima, respectivamente), humedad media anual 47 % (23 y 81 % mínima y máxima, respectivamente) y fotoperiodo promedio anual de 11.9 h (10.9 y 13.1 h, mínimo y máximo, respectivamente).
Variables evaluadas
Diámetro y peso seco
El diámetro del tallo de siete plantas por tratamiento, seleccionadas al azar, se midió con un vernier digital a los 30, 120 y 420 días después de la inoculación bacteriana (ddib). La biomasa también se evaluó en siete plantas por tratamiento, seleccionadas al azar, para determinar el peso seco de la raíz, parte aérea y total, deshidratando cada componente por separado, durante tres días a 70 °C hasta lograr peso constante.
Tasa fotosintética y contenido de clorofilas y carotenos
La tasa fotosintética se evaluó 240, 300 y 360 ddib en tres plantas por tratamiento con un analizador de gases infrarrojo (IRGA, PP-Systems® modelo Ciras-3, EUA) y una cámara de asimilación de gases (PP-Systems®, accesorio original de Ciras-3 CPY-4, EUA) en invernadero. La razón por la cual no se efectuó una evaluación al final del experimento fue por limitantes prácticas relacionadas con las condiciones climatológicas. El contenido de clorofila a, b, total y carotenos se determinó 420 ddib por el método de acetona (Zhang, 1986) y la concentración de clorofilas y carotenos se obtuvo mediante las ecuaciones de Lichtenthaler (1987).
Análisis nutrimental
Los nutrimentos se analizaron en cuatro plantas de cada tratamiento; el nitrógeno (N) se determinó por el método de semimicro-Kjeldahl (Bremner, 1965); el fósforo total (P), según el método de Allen, Grimshaw, Parkinson, y Quarmbym (1997); y el potasio (K), mediante extracción con acetato de amonio por fotometría de llama. La colonización micorrízica se evaluó mediante las técnicas propuestas por Agerer (1994) y Martínez-Reyes et al. (2012). La confirmación de las raíces micorrizadas se efectuó con técnicas de microfotografía de las estructuras características de la ectomicorriza: manto, red de Hartig y micelio externo en un microscopio óptico (Leica®, DM1000, EUA).
Diseño experimental y análisis estadístico
El experimento se diseñó en bloques al azar con seis tratamientos: 1) Plantas sin inocular; y plantas inoculadas con: 2) H. mesophaeum (Hm), 3) Cohnella sp. (C), 4) A. brasilense (Ab), 5) Hm + C, y 6) Hm + Ab. Cada tratamiento tuvo 21 réplicas, por lo que en total se tuvieron 126 unidades experimentales, cada una constituida por una planta. Los datos de las variables evaluadas se sometieron a un análisis de varianza y prueba de comparación de medias de Tukey (P = 0.05) con el paquete estadístico (Statistical Analysis System [SAS Institute Inc.], 2009). Los valores de colonización micorrízica, expresados como porcentajes, se transformaron y se utilizó el logaritmo natural en los análisis de varianza.
Resultados y discusión
Peso seco y diámetro del tallo de P. montezumae
El Cuadro 1 contiene la información del peso seco de las plantas de P. montezumae bajo los distintos tratamientos de inoculación. El peso seco de la raíz, parte aérea y total fue mayor en las plantas inoculadas con el hongo ectomicorrízico, solo o coinoculado con cualquiera de las dos bacterias, en comparación con el de las plantas sin inocular. Cuando se inoculó exclusivamente con cualquiera de las dos bacterias se tuvieron pesos secos estadísticamente similares (P = 0.05) a los pesos de las plantas no inoculadas. En el caso del peso seco de la raíz existió un efecto sinérgico cuando se inoculó Hm + Ab; en este tratamiento, el peso fue hasta 6.4 veces mayor en comparación con las plantas sin inocular.
Cuadro 1 Peso seco de las plantas de Pinus montezumae bajo distintos tratamientos de inoculación con un hongo ectomicorrízico comestible y dos bacterias promotoras del crecimiento vegetal. Resultados a los 420 días después de la inoculación bacteriana*.
| Tratamientos | Peso seco (g) | ||
|---|---|---|---|
| Raíz | Parte aérea | Total | |
| Plantas sin inocular | 0.22 ± 0.02 c | 0.26 ± 0.02 c | 0.48 ± 0.04 c |
| Hebeloma mesophaeum (Hm) | 1.10 ± 0.07 b | 1.15 ± 0.12 ba | 2.25 ± 0.19 ba |
| Cohnella sp. (C) | 0.38 ± 0.05 c | 0.34 ± 0.02 c | 0.70 ± 0.07 c |
| Azospirillum brasilense (Ab) | 0.50 ± 0.06 c | 0.42 ± 0.04 c | 0.92 ± 0.10 c |
| Hm + C | 1.08 ± 0.05 b | 0.96 ± 0.08 b | 2.04 ± 0.12 b |
| Hm + Ab | 1.41 ± 0.12 a | 1.33 ± 0.08 a | 2.75 ± 0.18 a |
*La inoculación bacteriana se hizo a los 100 días después de la siembra de P. montezumae. Valores con la misma letra en la misma columna son iguales según la prueba de Tukey (P = 0.05). ± Error estándar de la media (n = 7).
Con respecto al diámetro del tallo, en la Figura 1 se observa que dicha variable incrementó en mayor medida en las plantas inoculadas tanto con Hm como en las plantas con Hm + C y Hm + Ab a los 30, 120 y 420 ddib. La inoculación con cualquiera de las dos bacterias no originó diferencias del diámetro del tallo en comparación con las plantas sin inocular.
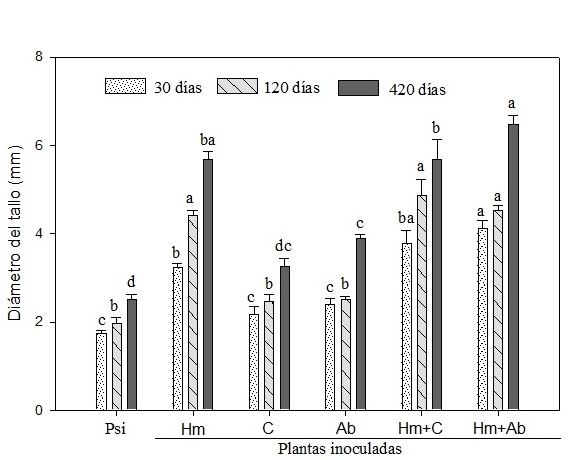
Figura 1 Diámetro del tallo de plantas de Pinus montezumae bajo distintos tratamientos de inoculación con un hongo ectomicorrízico comestible y dos bacterias promotoras del crecimiento vegetal. Psi = plantas sin inocular; Hm = Hebeloma mesophaeum, C = Cohnella sp., Ab = Azospirillum brasilense. Sobre las barras se representa el error estándar de la media (n = 7). Valores con la misma letra para cada fecha son iguales según la prueba de Tukey (P = 0.05).
El estímulo en el crecimiento, atribuible a la inoculación con hongos ectomicorrízicos, ha sido ampliamente reportado para el género Pinus. Gómez-Romero, Lindig-Cisneros, y Del Val (2015) demostraron que Pinus pseudostrobus Lindl. incrementó la biomasa aérea y radical cuando se inoculó con Pisolithus tinctorius Pers. Perea-Estrada et al. (2009) registraron aumento en la altura, peso seco de raíz y diámetro de plantas de Pinus patula Schl. et Cham. y Pinus hartwegii Lindl. inoculadas con Hebeloma spp., Laccaria spp. y Clavulina aff. cinerea. De igual forma, Sebastiana, Tolentino, Alcantara, Salomé, y Bernardes (2013) registraron que el peso seco de plantas de Quercus suber L., inoculadas con P. tinctorius, incrementó 40 % en comparación con las plantas sin inocular. La presente investigación es la primera que evalúa el efecto de la coinoculación de hongos ectomicorrízicos y bacterias sobre el crecimiento y fisiología en P. montezumae. El sinergismo registrado debido a la coinoculación de hongos ectomicorrízicos y bacterias también se ha reportado previamente. Por ejemplo, Kataoka y Futai (2009) reportaron el incremento de biomasa en la raíz de Pinus thumbergii Parl. coinoculado con Suillus granulatus L. y Burkholderia sp. Por otra parte, Zhao, Xiao-Qin, Jian-Ren, Hao, y Gui-E (2014) demostraron que la coinoculación con la bacteria Bacillus sp. y los hongos P. tinctorius y Lactarius insulsus (Fr.) Fr. (cuyo nombre válido actualmente es L. zonarius [Bull.] Fr.) incrementó el crecimiento y la colonización ectomicorrízica de árboles de Populus deltoides Marsh.
Tasa fotosintética de P. montezumae
De acuerdo con el Cuadro 2, las diferencias en la tasa fotosintética de las plantas inoculadas y no inoculadas se observaron a partir de los 300 ddib; los valores más altos se registraron en las plantas inoculadas con Hm, Hm + C y Hm + Ab. La tasa fotosintética a los 360 ddib fue 3.7 y 4.0 veces mayor en las plantas inoculadas con Hm + C y Hm + Ab, respectivamente, en comparación con las plantas sin inocular. Conforme el tiempo transcurrió, la tasa fotosintética incrementó en todos los tratamientos, particularmente en Hm + Ab; en este caso, la tasa fotosintética a los 360 ddib fue 2.6 veces mayor que a los 240 días. A los 300 y 360 ddib, no se observaron diferencias entre las plantas inoculadas únicamente con bacterias y las no inoculadas. Esta es la primera ocasión que se evalúa la tasa fotosintética en plantas de P. montezumae coinoculadas con hongos ectomicorrízicos y bacterias.
Cuadro 2 Tasa fotosintética en plantas de Pinus montezumae bajo distintos tratamientos de inoculación con un hongo ectomicorrízico comestible y dos bacterias promotoras del crecimiento vegetal.
| Tratamiento | Tasa fotosintética (g CO2·m-2·h-1) | ||
|---|---|---|---|
| 240 ddib | 300 ddib | 360 ddib | |
| Plantas sin inocular | 0.21 ± 0.14 a | 0.24 ± 0.05 c | 0.23 ± 0.07 c |
| Hebeloma mesophaeum (Hm) | 0.73 ± 0.07 a | 0.77 ± 0.06 ba | 0.79 ± 0.16 ba |
| Cohnella sp. (C) | 0.28 ± 0.09 a | 0.28 ± 0.06 c | 0.25 ± 0.06 c |
| Azospirillum brasilense (Ab) | 0.32 ± 0.03 a | 0.34 ± 0.05 bc | 0.40 ± 0.03 bc |
| Hm + C | 0.71 ± 0.01 a | 0.73 ± 0.07 ba | 0.84 ± 0.05 ba |
| Hm + Ab | 0.36 ± 0.04 a | 0.88 ± 0.07 a | 0.94 ± 0.06 a |
ddib: días después de la inoculación bacteriana (realizada 100 días después de la siembra de P. montezumae). Valores con la misma letra en la misma columna son iguales según la prueba de Tukey (P = 0.05). ± Error estándar de la media (n = 3).
El incremento en la tasa fotosintética debido a la inoculación exclusivamente con hongos micorrízicos ya ha sido reportado; sin embargo, a la fecha, no se había investigado el efecto de la coinoculación con bacterias. Canton et al. (2016) indicaron que la inoculación de P. tinctorius en E. grandis originó mayores tasas fotosintéticas que en las plantas no inoculadas. Xu et al. (2015) mencionaron que el hongo ectomicorrízico Laccaria bicolor Maire inoculado en Picea glauca (Moench) Voss no solo incrementa la tasa fotosintética, sino que también origina una mayor transpiración.
Contenido de clorofilas y carotenos de P. montezumae
El contenido de clorofilas a y b, clorofilas totales y carotenos fue mayor (P = 0.05) en las plantas inoculadas, independientemente del tratamiento. Las plantas inoculadas con Hm tuvieron mayor contenido de clorofila a en comparación con las plantas sin inocular, lo cual no ocurrió en el caso de los contenidos de clorofila b, clorofilas totales y carotenos (Cuadro 3). Yin, Deng, Chet, y Song (2014) indicaron que los contenidos de clorofila a y b, y carotenos incrementaron en plantas de Pinus sylvestris L. inoculadas con S. luteus (L. ex Fr.) Gray.
Cuadro 3 Contenido de clorofilas y carotenos en plantas de Pinus montezumae bajo distintos tratamientos de inoculación con un hongo ectomicorrízico comestible y dos bacterias promotoras del crecimiento vegetal. Resultados a los 420 días después de la inoculación bacteriana* .
| Tratamientos | Clorofila (mg·g-1) | Carotenos (μg·g-1) | ||
|---|---|---|---|---|
| a | b | Total | ||
| Plantas sin inocular | 30.22 ± 1.59 b | 31.91 ± 1.23 b | 62.12 ± 2.50 b | 10.73 ± 0.53 b |
| Hebeloma mesophaeum (Hm) | 42.24 ± 2.84 a | 42.43 ± 4.15 ba | 84.65 ± 6.92 ba | 10.83 ± 0.60 b |
| Cohnella sp. (C) | 39.53 ± 2.49 ba | 50.27 ± 3.39 a | 89.77 ± 5.69 a | 11.85 ± 0.72 ba |
| Azospirillum brasilense (Ab) | 36.63 ± 2.24 ba | 44.22 ± 2.83 ba | 80.83 ± 4.99 ba | 11.75 ± 0.51 ba |
| Hm + C | 43.89 ± 3.61 a | 49.08 ± 4.75 a | 92.94 ± 8.26 a | 13.41 ± 0.88 a |
| Hm + Ab | 39.06 ± 2.13 ba | 39.89 ± 1.74 ba | 78.93 ± 3.80 ba | 13.41 ± 0.48 a |
*La inoculación bacteriana se hizo a los 100 días después de la siembra de P. montezumae. Valores con la misma letra en la misma columna son iguales según la prueba de Tukey (P = 0.05). ± Error estándar de la media (n = 7).
En el presente trabajo, la concentración de carotenos fue mayor cuando las bacterias se inocularon solas o en combinación con el hongo Hm. Este incremento coincide con lo reportado por Mrnka, Tokárová, Vosátka, y Matejka (2009), quienes inocularon Hebeloma bryogenes Vesterh. y Cadophora finlandica C. J. K. Wang et H. E. Wilcox. en Picea abies L.
Micorrización de P. montezumae
La Figura 2 muestra las estructuras diagnósticas de la ectomicorriza. Los tratamientos Hm, Hm + Ab y Hm + C produjeron los porcentajes más altos de raíces vivas micorrizadas; 76.1, 76.4 y 68.7 %, respectivamente (Cuadro 4).
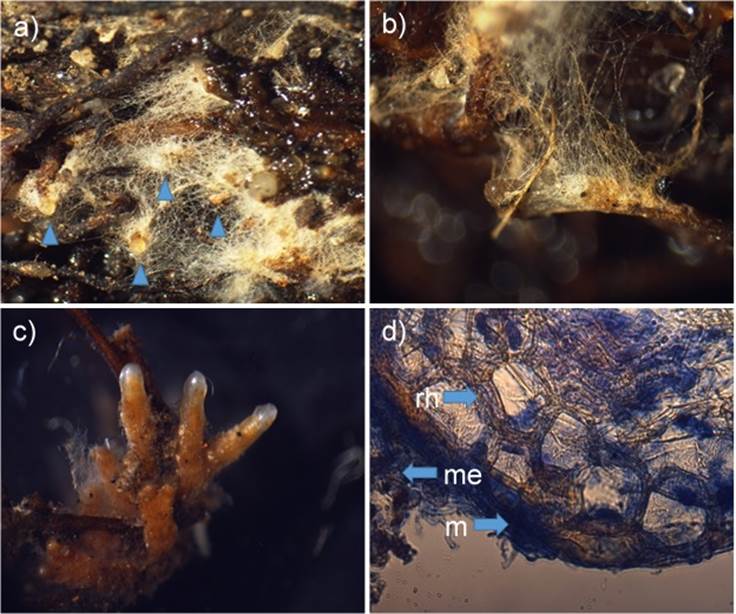
Figura 2 Características generales de las ectomicorrizas de Hebeloma mesophaeum (Hm). a) Vista general de morfotipos de Hm mostrando micelio externo abundante de color blanquecino a crema; b) Morfotipo de Hm con Azopirillum brasilense mostrando el micelio externo que cubre la totalidad de la ectomicorriza; c) Morfotipo de Hm + Ab, de la cual se le ha retirado el micelio externo; d) Corte transversal: red de Hartig (rh), manto (m) y micelio externo (me).
Cuadro 4 Colonización micorrízica de plantas de Pinus montezumae bajo distintos tratamientos de inoculación con un hongo ectomicorrízico comestible y dos bacterias promotoras del crecimiento vegetal. Resultados a los 421 días después de la inoculación bacteriana*.
| Tratamientos | Raíces vivas (%) | Raíces muertas (%) | ||
|---|---|---|---|---|
| Micorrizadas | No micorrizadas | Micorrizadas | No micorrizadas | |
| Plantas sin inocular | 2.75 ± 0.25 c | 84.60 ± 0.77 a | 1.88 ± 0.27 b | 10.74 ± 0.96 a |
| Hebeloma mesophaeum (Hm) | 76.15 ± 1.36 a | 8.62 ± 2.18 b | 8.73 ± 2.31 a | 6.47 ± 1.82 a |
| Cohnella sp. (C) | 12.89 ± 7.85 c | 66.81 ± 6.27 a | 1.82 ± 0.59 b | 18.35 ± 8.79 a |
| Azospirillum brasilense (Ab) | 12.95 ± 5.37 bc | 71.2 ± 5.95 a | 4.57 ± 0.98 ba | 11.27 ± 1.77 a |
| Hm + C | 68.67 ± 2.18 a | 10.85 ± 0.78 b | 10.52 ± 2.07 a | 9.94 ± 0.66 a |
| Hm + Ab | 76.41 ± 5.13 a | 5.02 ± 1.13 b | 10.82 ± 2.01 a | 7.70 ± 2.09 a |
*La inoculación bacteriana se hizo a los 100 días después de la siembra de P. montezumae. Valores con la misma letra en la misma columna son iguales según la prueba de Tukey (P = 0.05). ± Error estándar de la media (n = 3).
Los valores de micorrización en este trabajo son similares a los reportados por Méndez-Neri, Pérez-Moreno, Quintero, Hernández, y Lara (2011), quienes determinaron 77 % de colonización en Pinus greggii Engelm. inoculado con H. mesophaeum, Laccaria laccata Scop. y Suillus aff. pseudobrevipes A. H. Sm. Dichos autores utilizaron las mismas concentraciones de esporas y método de inoculación que los empleados en la presente investigación. Por otra parte, Sanchez-Zabala et al. (2013) registraron menos de 30 % de colonización en plantas de Pinus pinaster Aiton inoculadas con Lactarius deliciosus L., Lactarius quieticolor Romagn., Pisolithus arhizus Scop. y S. luteus.
Contenido de N, P y K en P. montezumae
El Cuadro 5 muestra el contenido de nutrientes en las plantas de P. montezumae con los distintos tratamientos de inoculación. Cuando se inoculó Hm solo o coinoculado con cualquiera de las dos bacterias existió mayor cantidad de N en la parte aérea, raíz y total, en comparación con las plantas no inoculadas. Cuando se inoculó exclusivamente con cualquiera de las dos bacterias, no existieron diferencias en la cantidad de N, P y K en comparación con las plantas no inoculadas, independientemente de la parte de la planta. El mejor tratamiento en el caso del N se registró en las plantas inoculadas con Hm + Ab, mientras que en el caso de P y K estuvo constituido por el hongo ectomicorrízico solo o coinoculado con cualquiera de las dos bacterias. Se observó un efecto sinérgico del tratamiento Hm + Ab sobre la cantidad de N en la parte aérea y total.
Cuadro 5 Contenido de nutrientes en plantas de Pinus montezumae bajo distintos tratamientos de inoculación con un hongo ectomicorrízico comestible y dos bacterias promotoras del crecimiento vegetal. Resultados a los 420 días después de la inoculación bacteriana*.
| Nutriente | Plantas sin inocular | Plantas inoculadas | ||||
|---|---|---|---|---|---|---|
| Hm | C | Ab | Hm + C | Hm + Ab | ||
| N (mg) | ||||||
| Aéreo | 1.96 ± 0.29 c | 5.18 ± 1.40 b | 1.82 ± 0.08 c | 2.08 ± 0.29 c | 4.28 ± 0.38 cb | 10.52 ± 0.65 a |
| Raíz | 1.40 ± 0.20 b | 6.47 ± 0.71 a | 2.65 ± 0.29 b | 2.45 ± 0.29 b | 5.42 ± 0.38 a | 6.02 ± 0.23 a |
| Total | 3.36 ± 0.48 c | 11.64 ± 1.73 b | 4.48 ± 0.32 c | 4.53 ± 0.57 c | 9.69 ± 0.69 b | 16.54 ± 0.8 a |
| P (mg) | ||||||
| Aéreo | 0.48 ± 0.07 b | 1.68 ± 0.34 a | 0.35 ± 0.02 b | 0.56 ± 0.08 b | 1.69 ± 0.15 a | 1.54 ± 0.09 a |
| Raíz | 0.37 ± 0.05 b | 1.49 ± 0.16 a | 0.53 ± 0.06 b | 0.88 ± 0.10 b | 1.62 ± 0.11 a | 1.70 ± 0.07 a |
| Total | 0.85 ± 0.12 b | 3.17 ± 0.50 a | 0.88 ± 0.06 b | 1.44 ± 0.18 b | 3.31 ± 0.24 a | 3.24 ± 0.15 a |
| K (mg) | ||||||
| Aéreo | 0.37 ± 0.05 c | 3.08 ± 0.62 a | 0.67 ± 0.03 c | 1.48 ± 0.21 bc | 3.10 ± 0.28 a | 2.30 ± 0.14 ab |
| Raíz | 0.23 ± 0.03 c | 1.41 ± 0.16 a | 0.82 ± 0.09 b | 0.90 ± 0.11 b | 1.21 ± 0.09 a | 1.60 ± 0.06 a |
| Total | 0.60 ± 0.09 c | 4.49 ± 0.77 a | 1.49 ± 0.10 c | 2.38 ± 0.31 bc | 4.31± 0.34 a | 3.89 ± 0.19 ba |
*La inoculación bacteriana se hizo a los 100 días después de la siembra de P. montezumae. Hm = H. mesophaeum, C = Cohnella sp., Ab = Azospirillum brasilense. Valores con la misma letra en la misma fila son iguales según la prueba de Tukey (P = 0.05). ± Error estándar de la media (n = 4).
La importancia de la adquisición de N, P y K en plantas micorrizadas ha sido demostrada y estudiada (Smith & Read, 2008). Por ejemplo, recientemente: i) Kayama, Qu, y Koike (2015) indicaron que la presencia de hongos ectomicorrízicos estimuló el incremento de N de plantas Larix kaempferi Lamb.; ii) Zong et al. (2015) registraron un incremento de P significativamente mayor en Pinus densiflora Siebold y Zucc. y Quercus variabilis Blume. inoculados con Pisolithus sp., Cenococcum geophilum Fr. y L. laccata que en las plantas no inoculadas; y iii) Martínez-Reyes et al. (2012) reportaron el efecto positivo en la translocación de K en plantas de P. greggii inoculadas con H. mesophaeum.
En el presente trabajo, el hongo Hm y la bacteria Ab mostraron un efecto de sinergismo reflejado en el contenido de N aéreo y total. Xiao-Qin et al. (2012) también reportaron que la colonización ectomicorrízica, el crecimiento y la movilización de N, P y K incrementaron en las plantas de P. thunbergii Parl. inoculadas con el hongo ectomicorrízico Boletus edulis Rostk. y la bacteria Bacillus cereus Franklan, en comparación con las plantas no inoculadas.
Conclusiones
La inoculación de Hebeloma mesophaeum, solo o combinado con Cohnella sp. (C) y Azospirillum brasilense (Ab), mejoró el crecimiento y la calidad fisiológica de plantas de Pinus montezumae, dado que la biomasa, tasa fotosintética, concentración de clorofilas y carotenos, y contenido de N, P y K incrementaron. En contraste, la inoculación de C y Ab, por separado, no mostraron efectos significativos en las variables evaluadas, a excepción de la concentración de carotenos. Se observó un efecto sinérgico en términos de biomasa radical y contenido de N en la parte aérea de la planta cuando se inoculó con Hm + Ab. Estos efectos estuvieron asociados con colonizaciones ectomicorrízicas de 69 a 76 % en los tratamientos inoculados con Hm solo y coinoculado. El presente trabajo demuestra que la inoculación con Hm, solo o coinoculado con las bacterias auxiliadoras de la micorrización C y Ab, posee potencial en la producción de plantas de calidad de P. montezumae, una de las especies más utilizadas en los programas de reforestación y restauración de suelos en México. Adicionalmente, la inoculación con Hm ofrece la oportunidad de cosechar basidiomas comestibles, los cuales constituyen un producto forestal no maderable de importancia económica social y cultural.
Agradecimientos
El primer autor agradece al CONACYT por el apoyo financiero para la realización de estudios de Maestría en Ciencias y de la presente investigación a través del proyecto CONACYT-24667.
REFERENCIAS
Agerer, R. (1994). Characterization of ectomycorrhizal. In J. R. Norris, D. J. Read, & A. K. Varma (Eds.), Techniques for mycorrhizal research (pp. 25-73). London: Academic Press. [ Links ]
Allen, S. E., Grimshaw, H. M., Parkinson, J. A., & Quarmbym, C. (1997). Chemical analysis of ecological materials. Oxford, UK: Blackwell Scientific Publications. [ Links ]
Bremner, J. M. (1965). Total nitrogen. Agronomy, 9, 1149-1178. [ Links ]
Canton, C. C., Bertolazi, A. A., Cogo, A. J. D., Eutrópio, J. F., Melo, J., de Souza, B. S., …Ramos, C. A. (2016). Biochemical and ecophysiological responses to manganese stress by ectomycorrhizal fungus Pisolithus tinctorius and in association with Eucalyptus grandis. Mycorrhiza, 26, 475-487. doi: 10.1007/s00572-016-0686-3 [ Links ]
Cetina, V. M. (2004). Deforestación y reforestación. In M. L. I. de Bauer (Ed.), Temas ambientales del siglo XXI (pp. 12-13). México: Colegio de Postgraduados. [ Links ]
Cumming, J. R., Zawaski, C., Desai, S., & Collart, F. R. (2015). Phosphorus disequilibrium in the tripartite plant-ectomycorrhiza-plant growth promoting rhizobacterial association. Journal of Soil Science and Plant Nutrition, 15(2), 464-485. doi: 10.4067/S0718-95162015005000040 [ Links ]
Food and Agriculture Organization of the United Nations (FAO). (2010). Global forest resources assessment 2010. Rome, Italy: FAO. [ Links ]
Gómez-Romero, M., Lindig-Cisneros, R., & Del Val, E. (2015). Efecto de la sequía en la relación simbiótica entre Pinus pseudostrobus y Pisolithus tinctorius. Botanical Sciences, 93, 731-740. doi: 10.17129/botsci.193 [ Links ]
Kataoka, R., & Futai, K. (2009). A new mycorrhizal helper bacterium, Ralstonia species, in the ectomycorrhizal symbiosis between Pinus thunbergii and Suillus granulatus. Biology and Fertility of Soils, 45, 315-320. doi: 10.1007/s00374-008-0340-0 [ Links ]
Kayama, M., Qu, L., & Koike, T. (2015). Elements and ectomycorrhizal symbiosis affecting the growth of Japanese larch seedlings regenerated on slopes of an active volcano in northern Japan. Trees, 29, 1567-1579. doi: 10.1007/s00468-015-1238-8 [ Links ]
Lichtenthaler, H. K. (1987). Chlorophyll and carotenoids: pigments of photosynthetic biomembranes. Methods in Enzymology, 148, 350-382. doi: 10.1016/0076-6879(87)48036-1 [ Links ]
Martínez-Reyes, M., Pérez-Moreno, J., Villarreal-Ruiz, L., Ferrera-Cerrato, R., Xoconostle-Cázares, B., Vargas-Hernández, J. J., & Honrubia-García, M. (2012). Crecimiento y contenido nutrimental de Pinus greggii Engelm. inoculado con el hongo comestible ectomicorrízico Hebeloma mesophaeum (Pers.) Quél. Revista Chapingo Serie Ciencias Forestales y del Ambiente, 18(2), 183-192. doi: 10.5154/r.rchscfa.2010.11.112 [ Links ]
Méndez-Neri, M., Pérez-Moreno, J., Quintero, L. R., Hernández, A. E., & Lara, H. A. (2011). Growth and nutrimental content of Pinus greggii inoculated with three edible ectomycorrhizal fungi. Terra Latinoamericana, 29(1), 73-81. [ Links ]
Mrnka, L., Tokárová, H., Vosátka, M., & Matejka, P. (2009). Interaction of soil filamentous fungi affects needle composition and nutrition of Norway spruce seedlings. Trees, 23, 887-897. doi: 10.1007/s00468-009-0330-3 [ Links ]
Perea-Estrada, V. M., Pérez-Moreno, J., Villareal, R. L., Trinidad, S. A., De la I. de Bauer, M. L., Cetina-Alcalá, V. M., & Tijerina, C. L. (2009). Humedad edáfica nitrógeno y hongos ectomicorrízicos comestibles en el crecimiento de pino. Revista Fitotecnia Mexicana, 32, 93-102. Retrieved from http://www.scielo.org.mx/pdf/rfm/v32n2/v32n2a4.pdf [ Links ]
Pérez-Moreno, J. (2016). Los hongos silvestres y el cambio climático global y bosques. In M. L. de la Isla de Bauer(Ed.), Producción de alimentos en casa: Agricultura urbana y periurbana (pp.153-176). México: Comité de Acción para el Saneamiento Ambiental. [ Links ]
Pérez-Moreno, J., Lorenzana, F. A., Carrasco, H. V., & Yescas-Pérez, A. (2010). Aspectos biotecnológicos de los hongos comestibles silvestres del Parque Nacional Izta-Popo, Zoquiapan y anexos. México: Colegio de Postgraduados-SEMARNAT- CONACyT [ Links ]
Rinaldi, A. C., Comandini, O., & Kuyper, T. W. (2008). Ectomycorrhizal fungal diversity: Separating the wheat from the chaff. Fungal Diversity, 33, 1-45. Retrieved from https://www.researchgate.net/publication/37792709_Ectomycorrhizal_fungal_diversity_Separating_the_wheat_from_the_chaff [ Links ]
Sanchez-Zabala, J., Majada, J., Martín-Rodríguez, N., Gonzales-Murua, C., Ortega, U., Alonso-Graña, M., …Duñabeitia, M. K. (2013). Physiological aspects underlying the improved outplanting performance of Pinus pinaster Ait. seedlings associated with ectomycorrhizal inoculation. Mycorrhiza , 23, 627-640. doi: 10.1007/s00572-013-0500-4 [ Links ]
Sebastiana, M., Tolentino, P. V., Alcántara, A., Salomé, P. M., & Bernardes, S. A. (2013). Ectomycorrhizal inoculation whith Pisolithus tinctorius increases the performance of Quercus suber L. (cork oak) nursery and field seedlings. New Forest, 44, 937-949. doi: 10.1007/s11056-013-9386-4 [ Links ]
Smith, S. E., & Read, D. J. (2008). Mycorrhiza l symbiosis (3rd. edition). New York, USA: Academic Press. doi: 10.1016/B978-012370526-6.50002-7 [ Links ]
Sousa, R. N., Franco, R. A., Ramos, A. M., Oliveira, S. R., & Castro, L. M. P. (2015). The response of Betula pubescens to inoculation with an ectomycorrhizal fungus and a plant growth promoting bacterium is substrate-dependent. Ecological Engineering, 81, 439-443. doi: 10.1016/j.ecoleng.2015.04.024 [ Links ]
Statistical Analysis System (SAS Institute Inc.). (2009). SAS/STAT® 9.2 User’s Guide (Second edition). Cary, NC, USA: Author. [ Links ]
Valdés, R. M., Ambriz, P. E., Camacho, V. A., & Fierros, G. A. M. (2010). Inoculación de plántulas de pinos con diferentes hongos e identificación visual de la ectomicorriza. Revista Mexicana de Ciencias Forestales, 2, 53-64. Retrieved from http://www.scielo.org.mx/pdf/remcf/v1n2/v1n2a5.pdf [ Links ]
Xiao-Qin, W., Liang-Liang, H., Jiang-Mei, S., Jia-Hong, R., Zheng, L., Chen, D., & Jian-Ren, Y. (2012). Effects of ectomycorrhizal fungus Boletus edulis and mycorrhiza helper Bacillus cereus on the growth and nutrient uptake by Pinus thunbergii. Biology and Fertility of Soils, 48, 385-391. doi: 10.1007/s00374-011-0638-1 [ Links ]
Xu, H., Kemppainen, M., El Kayal, W., Lee, H. E., Pardo, G. A., Cooke, K. E. J., & Zwiazek, J. J. (2015). Overexpression of Laccaria bicolor aquaporin JQ585595 alters root water transport properties in ectomycorrhizal white spruce (Picea glauca) seedlings. New Phytologist, 205, 757-770. doi: 10.1111/nph.13098 [ Links ]
Yin, D., Deng, X., Chet, I., & Song, R. (2014). Physiological responses of Pinus sylvestris var. mongolica seedlings to the interaction between Suillus luteus and Trichoderma virens. Current Microbiology, 69, 334-342. doi: 10.1007/s00284-014-0589-5 [ Links ]
Zhang, Z. X. (1986). Determination of chlorophyll content of plants - acetone and ethanol mixture method. Liaoning Agricultural Science, 3, 26−28. [ Links ]
Zhao, L., Xiao-Qin, W., Jian-Ren, Y., Hao, L., & Gui-E, L. (2014). Isolation and characterization of a mycorrhiza helper bacterium from rhizosphere soils of poplar stands. Biology and Fertility Soils, 50, 693-601. doi: 10.1007/s00374-013-0880-9 [ Links ]
Zong, K., Huang, J., Nara, K., Chen, Y., Shen, Z., & Lian, C. (2015). Inoculation of ectomycorrhizal fungi contributes to the survival of tree seedlings in a copper mine tailing. Journal of Forest Research, 20, 493-500. doi: 10.1007/s10310-015-0506-1 [ Links ]
Recibido: 27 de Enero de 2017; Aprobado: 14 de Septiembre de 2017











 texto en
texto en 


