Introducción
Los plaguicidas químicos sintéticos se han empleado desde la segunda mitad del siglo XX como primera opción para controlar insectos plaga y minimizar las pérdidas de las cosechas en todo el mundo. Su uso ha ido en aumento de manera descontrolada de casi 280 mil toneladas en 1964 solo para Estados Unidos hasta más de 2.3 millones de toneladas en 2007 a nivel mundial (EPA 2011). Como consecuencia del uso indiscriminado de plaguicidas, la salud humana y la ambiental se han visto afectadas por su interacción con la actividad biológica de los organismos benéficos para el ambiente (González-Castillo et al. 2012). Debido a que estos compuestos no son específicos, pueden causar efectos perjudiciales sobre el ecosistema y el ser humano (Bouchard et al. 2006) y amenazar el equilibrio ecológico (Hemingway y Ranson 2000).
Los compuestos organoclorados (OC) fueron los primeros en emplearse ampliamente en el control de insectos plaga por su alta efectividad en eliminarlos, particularmente el DDT (Snedeker 2001). Sin embargo, este compuesto fue prohibido al descubrir los efectos adversos de su uso tales como la alta capacidad carcinogénica y la alteración de la permeabilidad de la membrana neuronal, características comunes con otros OC. Además, al ser altamente lipofílicos, los OC se bioacumulan en los tejidos grasos y pueden biomagnificarse a través de las redes tróficas hacia los eslabones superiores, por lo cual se pueden detectar los compuestos o sus derivados dentro de los tejidos como evidencia de su exposición (Albert y Loera 2013). De igual manera, pueden producir a largo plazo disrupción endócrina, al imitar la acción de algunas hormonas como estrógenos y andrógenos debido a la similitud en su estructura química con una hormona endógena, llevando a cabo un efecto biológico similar (agonista) al de la hormona original o bloqueándolo (antagonista; Salame Méndez et al. 2008). Asimismo, estos compuestos son muy estables química y bioquímicamente, ya que su vida media en el ambiente es superior a los diez años y en muchos casos los productos de degradación parcial de estas sustancias son más estables que el compuesto original, como es el caso del DDT cuya vida media se estima en 10 años, mientras que sus productos de degradación, el DDE y DDD pueden durar en el ambiente por más de 30 años (Albert y Loera 2013).
Como una alternativa al uso de OC, se han empleado plaguicidas organofosforados (OP) y carbamatos, los cuales son más solubles en agua y poco solubles en lípidos, por lo que no se acumulan en los tejidos grasos y se degradan a una velocidad mayor en el ambiente (Lartiges y Garrigues 1995). Estos compuestos se consideran anticolinérgicos, es decir, impiden la hidrólisis del neurotransmisor acetilcolina (ACh) en colina y ácido acético por acción de la enzima acetilcolinesterasa (AChE), por lo cual la ACh se acumula en las terminaciones del sistema nervioso central y periférico (Albert y Loera 2013). De esta manera, se alteran funciones como la termorregulación y el comportamiento (actividad, tiempo de forrajeo, habilidad de aprendizaje y el consumo de agua o alimento), lo cual conlleva a pérdida de peso, problemas en el desarrollo, y bajo éxito reproductivo en aves y mamíferos (Story y Cox 2001).
Las respuestas biológicas de los vertebrados ante los plaguicidas pueden permanecer por semanas después de que los compuestos se han degradado en el ambiente, por lo que estas respuestas pueden servir como indicadores de su exposición, también llamados biomarcadores de exposición. Los biomarcadores de exposición se definen como respuestas biológicas que permiten detectar y medir una sustancia exógena o sus metabolitos, o el producto de una interacción entre el agente xenobiótico y algunas moléculas o células blanco dentro de un organismo (van der Oost et al. 2003). Esto permite confirmar y evaluar la exposición de individuos a una sustancia o grupo de sustancias en particular, relacionando la exposición externa y la dosimetría interna (van der Oost et al. 2003). La actividad de la enzima AChE es uno de los biomarcadores de exposición más usados para evaluar la exposición a plaguicidas anticolinérgicos por ser fácil de medir en laboratorio y poco costoso en comparación con otros métodos (Walker et al. 2012).
Con el propósito de estimar el impacto de los plaguicidas sobre la fauna silvestre, numerosos estudios han evaluado, bajo condiciones controladas, su efecto sobre animales en laboratorio como peces (Fulton y Key 2001), roedores (Astroff y Young 1998; Timofeeva et al. 2008; Roegge et al. 2008) y aves (Fildes et al. 2009), tomando en cuenta el papel de las características inherentes a los organismos como la especie, el sexo y la edad.
Como consecuencia, los efectos sobre la fauna silvestre aún no son comprendidos del todo, ya que existen factores ambientales que juegan roles fundamentales en la cinética de degradación y persistencia de los plaguicidas, que influyen en la exposición de los organismos a los plaguicidas (Albert y Loera 2013). De igual forma, la manera en la cual los organismos responden a dichos factores y las interacciones con otros organismos, son importantes para elucidar el efecto ecológico de los plaguicidas. Algunas respuestas conductuales asociadas a interacciones interespecíficas como la depredación pueden verse alteradas por la exposición a plaguicidas e impactar a nivel poblacional disminuyendo el número de individuos. Esto debido a que los animales pueden ser más susceptibles a ser capturados o, en el caso de los depredadores, pueden no ser lo suficientemente hábiles para cazar a sus presas. Por otra parte, pueden bioacumular y biomagnificar los plaguicidas, y producir a largo plazo la disminución en el éxito reproductivo (Fernie y Letcher 2010; Bourgeon et al. 2013).
Debido a que los plaguicidas son transportados largas distancias dependiendo de su persistencia, pueden afectar a organismos que estén alejados de la zona de influencia (como es el caso del DDT aplicado en zonas tropicales y que se ha detectado como DDE en el ártico viajando miles de kilómetros). Además, pueden sufrir transformaciones dependiendo de las características del medio a través del cual son transportados (aire, agua, suelo), la manera en que se aplican y la presencia de cuerpos de agua o de precipitación (Castro y Yoshida 1971, Ghadiri et al. 1995). Tal es el caso de la temperatura y la salinidad en ambientes acuáticos, mientras que en ambientes terrestres, son de gran importancia la estructura y la química del suelo (Poissant et al. 2008). Asimismo, las características químicas propias del plaguicida y la vida media están relacionadas con su persistencia en el ambiente, mientras que el tiempo desde la aplicación y la distancia influyen en los productos de degradación detectados en un sitio determinado (Karpuzcu et al. 2013; Mackay et al. 2014).
Como parte la fauna no dañina que se ve afectada por los plaguicidas se encuentran aquellas especies que habitan en los humedales. Estos ecosistemas son de gran importancia por ser zonas de transición entre los ambientes terrestres y marinos. Fungen como zonas de refugio y crianza para muchas especies, además de ser reservorio de nutrientes y metales que escurren de los ambientes circundantes, y que en cantidades excesivas pueden fungir como contaminantes, a lo cual se suma la descarga de plaguicidas y otros compuestos procedentes de los asentamientos humanos cercanos (Mitsch y Gosselink 2000).
Entre los organismos que se encuentran en contacto directo con los plaguicidas adsorbidos en el suelo están los mamíferos herbívoros, tal es el caso de los roedores debido a sus hábitos de forrajeo, removiendo el suelo para encontrar u ocultar semillas y depredar raíces y plántulas. Los roedores son importantes ya que fungen como sostén de muchos depredadores, conectando el nivel de los productores primarios con los consumidores secundarios o depredadores en los ecosistemas terrestres (Chamucero-Santacoloma et al. 2011).
Los humedales del Área de Protección de Flora y Fauna Laguna de Términos (APFFLT ) en Campeche en conjunto con la Reserva de la Biósfera Pantanos de Centla en Tabasco, forman la unidad ecológica costera más importante de Mesoamérica por su productividad natural y biodiversidad (CONAGUA 2007). Históricamente, la Laguna de Términos ha sido una zona fuertemente impactada por el humano debido al crecimiento poblacional y a las actividades productivas como la agricultura, ganadería y la industria petrolera (Villalobos 2015). A pesar de que los OC como el DDT dejaron de usarse en México oficialmente desde el año 2000 para el control de vectores de enfermedades como el paludismo y dengue (SSA 2001), en el área de Laguna de Términos se ha reportado la presencia de compuestos de las familias del diclorodifeniltricloroetano (DDT), endosulfanes, drines, clordanos, isómeros del hexaclorociclohexano (HCHs) y el OP Clorpirifos, tanto en sedimento como en biota acuática, (Carvalho et al. 2009; Ramírez-Elías et al. 2016) y se ha dejado de lado el conocimiento sobre el impacto de estos compuestos en los organismos terrestres.
Por lo anterior, el presente trabajo tiene como objetivo identificar si existe una exposición reciente a plaguicidas OC y anticolinérgicos en tres especies de ratones (Oryzomys couesi, Peromyscus leucopus y Reithrodontomys gracilis), esto, a través de determinar y cuantificar los plaguicidas OC acumulados en el hígado, y de caracterizar y comparar la actividad de la enzima acetilcolinesterasa (AChE) en músculo esquelético y cerebro como efecto de la exposición a plaguicidas anticolinérgicos (OP y carbamatos) en diferentes zonas del APFFLT.
Materiales y métodos
Área de estudio. El APFFLT se localiza al suroeste de México, en la costa del estado de Campeche y comprende parte de los municipios de Carmen, Palizada y Champotón. Es parte del complejo ecológico de la planicie costera que controla los procesos deltaicos del sistema de ríos Grijalva- Usumacinta, que es el de mayor volumen de descarga de agua dulce y sedimentos terrígenos hacia el mar en todo el país. El clima es tropical húmedo y la precipitación anual va de 1,100 a 2,000 mm. Se presentan tres temporadas, lluvias (junio a septiembre), secas (febrero a mayo) y nortes (octubre a enero; CONAGUA 2007).
El trabajo de campo se llevó a cabo de febrero a agosto de 2015 en nueve sitios del APFFLT: Rancho Nohan, Rancho R1 y Tixchel, Aguacatal, Las Bodegas, La Toza, Los Corralitos, San Román, La Leona/Nicte-Ha (Figura 1).

Figura 1 Distribución de los sitios de muestreo en El Área de Protección de Flora y Fauna Laguna de Términos en Campeche. Los sitios muestreados fueron Rancho Nohan, Tixchel, Rancho R1, El Aguacatal, La Leona/Nicté-Ha, Los Corralitos, Las Bodegas, San Román y La Toza.
Captura de roedores. En cada sitio de muestreo la captura se realizó con 100 trampas Sherman cebadas con una mezcla de avena-semillas de girasol-vainilla dispuestas cada una a 10 m dentro de una cuadricula de 100 x 100 m (Jones y Teeling 2006). Se eligieron individuos adultos de Oryzomys couesi, Peromyscus leucopus y Reithrodontomys gracilis por ser abundantes en el área y debido a que no se encuentran bajo algún estado de protección (SEMARNAT 2010; IUCN 2015). Se identificaron hasta especie con el apoyo de guías de campo (Reid 2009; Álvarez-Castañeda et al. 2015) y se tomaron las medidas morfométricas convencionales (longitud total, longitud de la cola, longitud de la pata trasera, longitud de la hendidura de la oreja, masa, sexo y edad). Estos organismos se sacrificaron siguiendo el método de eutanasia por dislocación cervical (SAGARPA 2014) para tomar muestras de cerebro, de músculo esquelético e hígado, los cuales fueron congelados a una temperatura de -20 a -4 °C hasta el momento de su análisis en laboratorio.
Trabajo de Laboratorio. La determinación de la actividad de la enzima AChE en cerebro y músculo esquelético se hizo siguiendo el método de Ellman et al. (1961), adaptado a un microensayo (Campoy et al. 1992). La proteína se determinó con el método de Bradford (1976). A partir de los valores de proteínas se procedió a estimar la actividad de la acetilcolinesterasa (AChE) mediante el método de Ellman et al. (1961).
Para la determinación de los compuestos OC, las muestras de hígado se homogenizaron y secaron con sulfato de sodio, la extracción se realizó mediante el método Soxhleth en cloruro de metileno:hexano (1:1; EPA 1996). Se empleó un cromatógrafo de gases Varian 3800 con un detector de captura de electrones con fuente de 63Ni, con columna cromatográfica capilar HT8 (60 m x 0.25 mm; 25 μm film thickness) (SGE Analytical Science, USA). El cálculo de las áreas de los picos se realizó con el programa Star Chromatography Workstation versión 6. La identificación y cuantificación de los plaguicidas OC se realizó con un estándar cuya mezcla de compuestos (SUPELCO 47426-U CLP Organochlorine Pesticide Mix) fueron: alfa, beta, gamma y delta-HCH, heptacloro, epóxido de heptacloro, α-endosulfán, β-endosulfán, endosulfán sulfato, dieldrín, aldrín, endrín, endrín aldehido, p,p'-DDD, p,p ́-DDE y p,p ́-DDT.
Todos los análisis de laboratorio se realizaron bajo la supervisión del Jaime Rendón von Osten en el Laboratorio de Ecotoxicología del Instituto de Ecología, Pesquerías y Oceanografía del Golfo de México (EPOMEX) de la Universidad Autónoma de Campeche.
Análisis de datos. Los análisis estadísticos se realizaron con el programa InfoStat/S Versión 2016e. Se analizaron 20 individuos de R. gracilis (seis hembras y 14 machos); 23 O. couesi (cuatro hembras y 18 machos) y 14 P. leucopus (seis hembras y ocho machos). El área de estudio se dividió en dos zonas para el análisis de la actividad de la enzima AChE: la zona de ríos que incluye los sitios La Leona/Nicte-Ha, Los Corralitos, Las Bodegas, La Toza y San Román; y la zona de costa que incluye los sitios Nohan, Tixchel, Rancho R1 y El Aguacatal. Se realizaron análisis de U de Mann-Whitney para comparar la actividad de la AChE en músculo esquelético, en cerebro y entre sexos, entre zonas en O. couesi y R. gracilis. La actividad de esta enzima para P. leucopus sólo se reportó debido a que se encontró únicamente en la zona de costa (Quinn y Keough 2007).
Las concentraciones de plaguicidas determinados en las muestras de hígado se compararon entre especies y sitios mediante análisis de ANOVA mixto (Quinn y Keough 2007). Los resultados de los plaguicidas se agruparon en familias con el mismo peso molecular o de acuerdo a sus productos de degradación como se muestra a continuación:
ΣDDT = p,p'-DDT + p,p'-DDD + p,p'-DDE
ΣEndosulfanes = α-Endosulfán + β-Endosulfán + Endosulfán Sulfato
ΣHCH = α-HCH + β-HCH + γ-HCH (lindano) + δ-HCH
ΣAldrines = Aldrín + Dieldrín
ΣEndrines = Endrín + Endrín aldehído + Endrín cetona
ΣHeptacloros = Heptacloro + Epóxido de Heptacloro
ΣClordanos = trans-Clordano + cis-Clordano
Metoxicloro
Además, se determinó la temporalidad de la exposición a los plaguicidas mediante el cálculo de la proporción que ocupan los productos de degradación e isómeros presentes en los plaguicidas de grado técnico, con respecto al total de las concentraciones de cada tipo de plaguicida, expresadas como sumatorias (Σ). Así, si la proporción de los productos de degradación e isómeros en el hígado corresponde a la proporción que contienen los plaguicidas de grado técnico con respecto a la sumatoria del plaguicida (Σ), se consideró un indicio de que la exposición a alguno de los compuestos encontrados ha ocurrido en un tiempo menor a la vida media del compuesto, por lo tanto es reciente.
Resultados
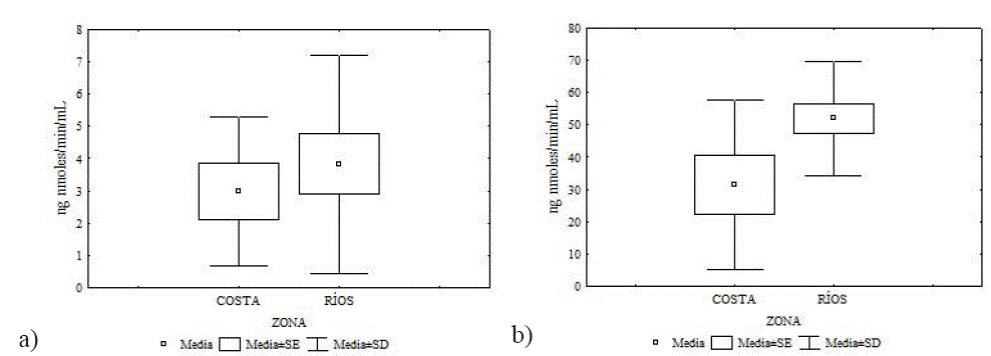
Actividad de la enzima AChE. No se encontraron diferencias significativas en la comparación entre sexos para ninguna de las tres especies. Para O. couesi no se encontraron diferencias significativas en la actividad de la AChe en músculo esquelético entre zonas (U = 71, p = 0.84). Sin embargo, se encontraron diferencias significativas en la actividad de la AChE en cerebro entre zonas (U = 63, p = 0.03; Tabla 1, Figura 2).
Tabla 1 Resultado de la prueba U de Mann Whitney en la comparación de la actividad de la enzima AChE en músculo esquelético y cerebro de Oryzomys couesi entre zonas.

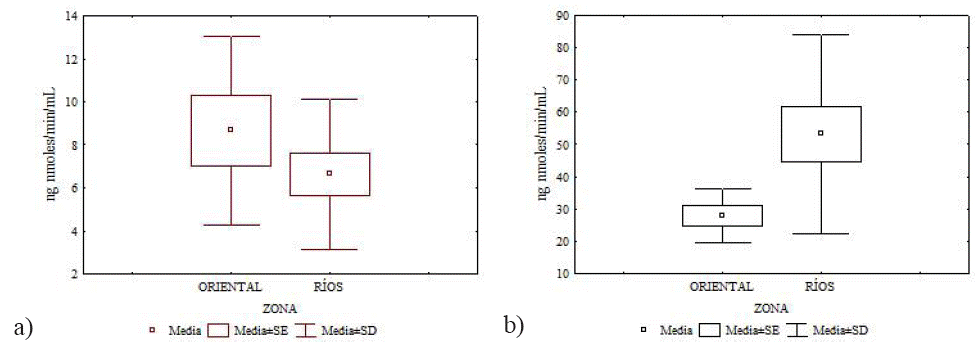
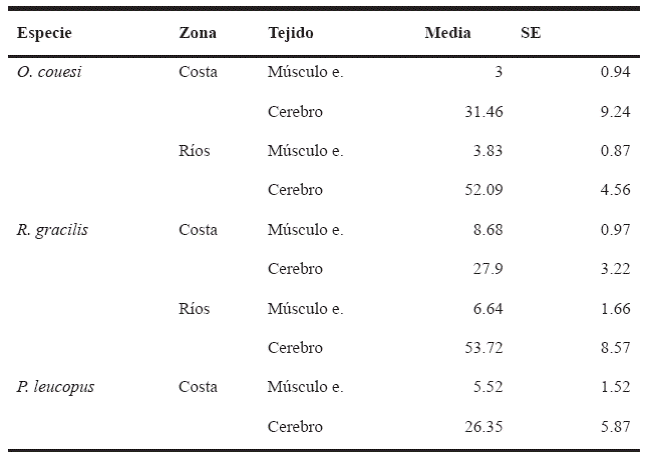
De manera similar, para R. gracilis no se encontraron diferencias significativas en la actividad de la AChE en músculo esquelético entre zonas (U = 83, p = 0.45), mientras que en la actividad de la AChE en cerebro sí se encontraron diferencias significativas (U = 47, p = 0.03). En tanto P. leucopus se registró una actividad promedio de AChE en cerebro de 26.35 ± 5.87 ng nmoles/min/mL, y en músculo fue 5.52 ± 1.52 ng nmoles/min/mL (Tabla 3).
Tabla 2 Resultado de la prueba U de Mann Whitney en la comparación de la actividad de la enzima AChE en músculo esquelético y cerebro de Reithrodontomys gracilis entre zonas.

Tabla 3 Actividad enzimática en músculo esquelético y cerebro de las tres especies de roedores evaluados.
Plaguicidas OC en ratones. Se detectaron 20 compuestos OC entre los que se encuentran las familias de DDT, drines, clordanos, heptacloros, metoxicloro, isómeros de HCH y endosulfán (Tabla 4). En las concentraciones de las sumas de plaguicidas en hígado de ratón se encontró que las concentraciones varían por sitio para las sumas de cada familia de compuestos OC, pero la especie y la interacción entre la especie y el sitio no influyeron de manera significativa en esta variación (Tabla 5).
Tabla 4 Concentración de plaguicidas organoclorados (ng.g-1 peso seco) en hígado por especie y sitio.

Tabla 5 Resultados del ANOVA mixto para contrastar el efecto de los factores sitio y especie sobre la sumas de los plaguicidas organoclorados, en donde sólo se muestran los resultados del factor sitio por tener un efecto significativo en la variabilidad de todos los plaguicidas. Un asterisco (*) indica una P < 0.05, dos asteriscos (**) indican un P < 0.001,

Los OC ΣDDTs, ΣHCHs y ΣEndrín fueron los de mayor concentración en los ratones del área de estudio con promedios de 876.6 ng·g-1, 546.1 ng·g-1 y 451.9 ng·g-1 respectivamente. Los sitios con más OC fueron La Leona/Nicte-Ha, Rancho Nohan y San Román con más de quince compuestos. Por otra parte en Aguacatal se encontraron cuatro compuestos: heptacloro, metoxicloro, α-HCH y β-HCH, en Lo Corralitos se detectaron tres compuestos: heptacloro, metoxicloro y α-HCH, en La Toza se encontraron dos compuestos: endosulfán sulfato y β-HCH, mientras que en el sitio Las Bodegas no se detectaron plaguicidas (Tabla 4).
Los integrantes de la familia del DDT estuvieron presentes en cinco sitios de los nueve muestreados siendo más abundantes en los sitios La Leona/Nicte-Ha, San Román y Tixchel en donde se observaron proporciones de DDT/ΣDDT > 0.75, en comparación con las proporciones DDE/ΣDDT < 0.1 y DDE/ΣDDT < 0.15. En Rancho R1 se presentaron proporciones de DDT/ΣDDT = 0.32, DDE/ΣDDT = 0.43 y DDE/ΣDDT = 0.24, mientras en Tixchel las proporciones fueron DDT/ ΣDDT = 0.96 y DDE/ΣDDT = 0.03 (Tabla 4).
La familia de los endosulfanes estuvo presente en seis sitios. En La Leona/Nicte-Ha se observaron la proporciones α-Endosulfán/ΣEndosulfanes = 0.26, β-Endosulfán/ΣEndosulfanes = 0.54, en San Román se encontró α-Endosulfán/ΣEndosulfanes = 0.11 β-Endosulfán/ΣEndosulfanes = 0.72 y Sulfato de Endosulfán/ΣEndosulfanes = 0.16 y en la Toza se detectó únicamente el sulfato de endosulfán. Por otra parte, en Tixchel sólo se encontró β-Endosulfán, en tanto que en R1sólo se detectó el sulfato de endosulfán, y en Tixchel se detectó el β-Endosulfán (Tabla 4, Figura 5).

Figura 4 Actividad de la AChE en músculo (a) y cerebro (b) en Peromyscus. leucopus en la zona de costa.

Figura 5 Proporción que ocupan los productos de degradación e isómeros de cada familia de plaguicida por sitio
Los HCHs se encontraron en todos los sitios. Se observaron proporciones de α-HCH/ΣHCH = 0.06, β-HCH/ΣHCH = 0.22, γHCH/ΣHCH = 0.18 y δHCH/ΣHCH = 0.31 en La Leona/Nicte-Ha. En San Román se observaron proporciones de α-HCH/ΣHCH = 0.14, β-HCH/ΣHCH = 0.25, γHCH/ΣHCH = 0.25 y δHCH/ΣHCH = 0.33. En Corralitos se detectó sólo α-HCH y en La Toza β-HCH. En Rancho R1 predominó el lindano con proporción γHCH/ΣHCH = 0.44, en Rancho Nohan predomina el β-HCH /ΣHCH = 0.72, en Tixchel las proporciones fueron δHCH/ΣHCH = 0.46 y γHCH/ΣHCH = 0.38, y en Aguacatal se encontraron proporciones de α-HCH/ΣHCH = 0.66 y β-HCH /ΣHCH = 033 (Tabla 4, Figura 5).
Los drines estuvieron en las siguientes proporciones: Aldrín/ΣAldrín = 0.25, Dieldrín/ΣAldrín = 0.69 en La Leona/Nicte-Ha, En Rancho R1 y Tixchel sólo se encontró aldrín, En Rancho R1 y San Román sólo se encontró endrín cetona, y sólo en Rancho Nohan se detectó endrín en proporción de Endrín/ΣEndrín = 0.3 (Tabla 4, Figura 5).
Los heptacloros se encontraron en ocho de los nueve sitios con proporciones de Heptacloro/ ΣHeptacloro > 0.8 y Epóxido de heptacloro/ΣHeptacloro < 0.2 (Tabla 4).
Los clordanos se encontraron cuatro de los nueve los sitios. En La Leona/Nicte-Ha se observaron proporciones de trans-Clordano/ΣClordanos = 0.57 y cis-Clordano/ΣClordanos = 0.42, en San Román las proporciones fueron trans-Clordano/ΣClordanos = 0.27 y cis-Clordano/ΣClordanos = 0.72, y en Rancho Nohan se observaron proporciones de trans-Clordano/ΣClordanos = 0.3 y cis- Clordano/ΣClordanos = 0.69 (Tabla 4, Figura 5).
Discusión y conclusiones
Inhibición de la AChE. La actividad de las colinesterasas es uno de los procesos metabólicos más susceptibles de ser alterados, de manera inmediata, en presencia de plaguicidas OP y carbámicos. Es por ello que su cuantificación se emplea como un instrumento para determinar la exposición a dichos compuestos, aún después de que éstos se han degradado en el ambiente (Depledge y Fossi 1994). Sin embargo, se ha reportado que esta enzima se puede inhibir ante la presencia de grandes cantidades de metales pesados como Cd2+, Hg2+, Pb2+, así como sulfato de cobre y cloruro de cadmio, y productos de la combustión de hidrocarburos (Payne et al. 1996).
Para el área de Laguna de Términos se encontró evidencia de la disminución en la actividad de la enzima AChE en cerebro en O. couesi y R. gracilis únicamente en cerebro, en donde la menor actividad se observó en la zona de costa a pesar de que en la zona de ríos hay una fuerte actividad agrícola y uso de plaguicidas OP, particularmente por las plantaciones arroceras en las que se emplean compuestos como clorpirifos etil, monocrotofos y malatión contra insectos plaga como la chinche café (Oevalus insularis), el gusano soldado (Spodoptera frugiperda) y otros gusanos defoliadores o cortadores como el gusano cabezón (Telicota sp.) y el gusano medidor (Trichoplusia sp.; Orona-Castro 2008). También es empleado paratión para combatir otras plagas como la mosca de la fruta (Anastrepha sp.), trips (Selenothrips rubocinctus) y escamas (Coccus mangiferae), así como el carbamato carbofurán para el control de barrenadores (Xiloborus sp., Apate sp. y Batocera sp.) (Tucuch Cauich et al. 2005, Reyes-Montero 2014).
En la zona de costa hay poca actividad agrícola entre la que destaca el cultivo de chile (Capsium annuum) en donde se emplean los OP malatión y metamidofos para el control de plagas (Botello et al. 1998). No obstante, la actividad preponderante es la extracción de hidrocarburos, la cual podría estar exponiendo a los ratones a metales pesados y a productos de combustión de hidrocarburos, los cuales en grandes cantidades pueden estar influyendo en la inhibición de la AChE (Payne et al. 1996).
Además, la inhibición diferencial de la AChE en cerebro y músculo puede deberse a la presencia de la enzima BChE predominantemente en el músculo esquelético, la cual ha demostrado tener un efecto protector frente a la intoxicación por OP en roedores como ratas y cobayas, así como en primates al hidrolizar a la acetilcolina auxiliando en la transmisión del impulso nervioso (Raveh et al. 1997; Allon et al. 1998; Mehrani 2004).
Para el género Peromyscus se cuenta con valores de referencia de otras especies como P. manuculatus, cuya actividad de AChE cerebral en condiciones de laboratorio fue de 7.931 μmol/ AThCh hidrolizada/min/g de cerebro en machos y de 7.731 μmol/AThCh hidrolizada/min/g en hembras (Block et al. 1993), mientras que la actividad de la misma especie en ejemplares silvestres fue cercano a 9.2 μmol/AThC hidrolizada/min/g de cerebro (Block et al. 1999). Además, Block et al. (1993) reporta que, en vida silvestre, la actividad de la AChE en P. maniculatus y P. leucopus no son estadísticamente diferentes.
De igual manera, Andrade-Herrera (2011) reportó valores de actividad promedio de AChE en músculo de 5.134 nmoles/min/mL en P. difficilis y de 6.579 nmoles/min/mL en P. melanotis. En este trabajo P. leucopus tuvo una actividad promedio máxima en músculo de 16.26 ng nmoles/min/ mL de proteína, mientras que en cerebro fue de 65.90 ng nmoles/min/mL de proteína, valores por encima de lo reportado para otras especies del mismo género.
Sin embargo, se debe tomar en cuenta que los organismos de diferentes especies e incluso de la misma, pueden tener variaciones en sus respuestas a los estímulos ambientales como consecuencia de las adaptaciones regionales, e incluso, especies provenientes de los mismos sitios de colecta pueden presentar respuestas diferenciales entre las condiciones de laboratorio y en vida silvestre (Dell'Omo et al. 2003). Las colinesterasas pueden verse afectadas por factores naturales como la genética, la edad, el género, el estado reproductivo, la regulación endocrina e incluso los ritmos circadianos y épocas climáticas, el estado nutricional y de salud de los organismos, la temperatura o la presencia en el medio de metales o biotoxinas (Roberts et al. 1988, Alves-Amaral et al. 2010). Por ello, la evaluación de la AChE como biomarcador específico para la exposición a plaguicidas OP debe complementarse con otros biomarcadores de exposición que puedan dar más información sobre los riesgos que representa los plaguicidas OP.
Compuestos OC en ratones. En este trabajo, las mayores concentraciones de plaguicidas OC se observaron en los ratones de Leona/Nicte-Ha con concentraciones de ΣDDT = 5416.7 ng.g-1, ΣEndosulfán = 2899.5 ng.g-1, ΣHCH = 4378.7 ng.g-1, ΣAldrín = 1077.3 ng.g-1, ΣEndrín = 1933.3 ng.g-1, y ΣHeptacloro = 2085.4 ng.g-1.
En peces de sitios cercanos a esta área en el sistema Palizada del Este, Díaz-González et al. (2005) reportan concentraciones de ΣDDT = 928.8 ng.g-1, ΣEndosulfán = 11.3 ng.g-1, ΣHCH = 12.56 ng.g-1, ΣAldrín = 52.2 ng.g-1, ΣEndrín = 1686.3 ng.g-1, ΣHeptacloro = 44.01 ng.g-1. De manera similar, en ostras y peces de zonas aledañas en Laguna del Este, evaluadas por Carvalho et al. (2009) se detectaron compuestos OC pero en concentraciones aún menores, del orden de picogramos.
Esta disminución en las concentraciones de OC en organismos acuáticos del área puede indicar que los compuestos están poco disponibles ya que se sedimentan junto con las partículas orgánicas a las que se unen por adsorción. En contraste, los organismos terrestres se encuentran en contacto directo con los plaguicidas que se adhieren a la materia orgánica del suelo y puede permanecer por más tiempo.
Para la mayoría de los plaguicidas detectados en el hígado de los ratones, los productos de degradación se encuentran concentrados en mayor proporción indicando mayor exposición de los ratones a dichas sustancias y sugieren que ha transcurrido mucho tiempo desde la última vez que fueron aplicados. Sin embargo, en los sitos La Leona/Nicte Ha, San Román y Tixchel, la proporción p,p'-DDT/ΣDDT fue mayor a 0.75, mientras las de p,p'-DDE/ΣDDT y p,p'-DDD/ΣDDT fueron menores a 0.25, lo que podría sugerir una exposición reciente al p,p ́DDT ya que este compuesto ocupa del 60-80 % del DDT de grado técnico. Sin embargo, la proporción alta de p.p'- DDT no necesariamente es signo de una aplicación reciente del plaguicida DDT como tal, ya que el producto de su degradación, el p,p'DDE, tiene mayor volatilidad (hasta ocho veces más que el DDT) y podría estar menos disponible al contacto con los organismos, y por consiguiente se puede bioacumular menos (ATSDR 2002a), por lo que las concentraciones de DDT pueden ser los remanentes de la aplicación intensiva de este compuesto en las campañas de control de vectores en los 90s.
Por otra parte, desde el 2014 la Secretaría de Agricultura, Ganadería, Desarrollo Rural Pesca y Alimentación (SAGARPA) ha implementado en Campeche el uso del plaguicida organoclorado dicofol en la estrategia para el control del ácaro rojo de las palmas (Raoiella indica Hirst) en los municipios de Carmen y Palizada, al igual que para el control de plagas del limón como el ácaro blanco (Polyphagotar senomuslatus) y el arador o negrilla del fruto. El dicofol de brado técnico puede contener p,p'-DDT y p,p'-DDE como impurezas, explicando la presencia de estos compuestos (ATSDR 2002a).
En ratones, se han observado alteraciones en hígado como alargamiento de las células y túbulos centrales a partir de 0.25 a 0.5 mg/kg/día. El nivel de efecto adverso observable más bajo (LOAEL por sus siglas en inglés) para el DDT en ratones se estima en 0.5 mg/kg/día para efectos en el desarrollo neuronal, impidiendo la habituación de los organismos (ATSDR 2002a). En este estudio se encontraron concentraciones máximas equivalentes a ΣDDT = 2.3 mg/kg en San Román y ΣDDT = 5.4 mg/kg en La Leona/Nicte-Ha, lo lleva a suponer que los roedores silvestres pueden presentar las alteraciones antes mencionadas en la células hepáticas y en el sistema nervioso.
Otro compuesto que se encontró en proporciones altas en ratones es el HCH. Este suele ser más abundante en su isómero α-HCH en los ambientes acuáticos y en la atmósfera, mientras que el isómero β-HCH, el isómero más hidrofóbico y estable, se encuentra mayormente asociado a suelos, tejidos y fluidos animales, similar al isómero γ-HCH (Walker 1999). En contraste, se encontró en mayor concentración el isómero α-HCH en el hígado de ratones de los sitios Aguacatal y Los Corralitos, y el γ-HCH en Rancho R1, lo cual podría indicar una aplicación reciente de HCHs en los sitios antes mencionados, ya que el lindano de grado técnico que se emplea en el control de plagas es una mezcla de varios isómeros del HCH, en donde el α-HCH ocupa del 60-70% con una vida media de 20 a 50 días, y el γ-HCH (el único con acción insecticida) con una vida media de 20 semanas comprende del 6-10% (ATSDR 2005). El lindano se emplea como tratamiento para el control de plagas durante la germinación de semillas y en el proceso y el control de ácaros y pulgas en el ganado.
En ratas, el LOAEL en una exposición crónica para el α-HCH a dosis de 0.8 mg/kg/día por más de 107 semanas produce efectos en hígado, mientras para el β-HCH es de 0.18 mg/kg/día por 13 días para efectos en el hígado. Para el γ-HCH, el LOAEL en ratones para inmunotoxicidad es de 6.25 mg/kg/día durante cinco semanas (ATSDR 2005). Además, en un estudio realizado por Srivastava y Raizada (2000) se observó que la exposición a dosis de 13.1 mg/kg/día en la época de apareamiento produce una disminución en la viabilidad de las crías. En este trabajo se encontraron concentraciones máximas de α-HCH equivalentes a 0.54 mg/kg, concentraciones de β-HCH de 1.28 mg/kg y γ-HCH con 0.9 mg/kg en La Leona/Nicte-Ha, lo cual sugiere que estos compuestos pueden no estar causando efectos hepáticos o reproductivos negativos en las poblaciones de roedores silvestres.
El aldrín de grado técnico está conformado en más del 90 % de aldrín, 3.5 % de isodrín y el 6 % restante se reparte entre más de diez compuestos diferentes, y el principal producto de degradación de este compuesto es el dieldrín el cual en suelos tropicales puede desaparecer hasta en un 90 % en un mes, mientras que en zonas templadas puede permanecer hasta cinco años (ATSDR 2002b). Las proporciones Aldrín/ΣAldrín = 1 en Rancho R1 y Tixchel indican que han estado expuestos únicamente a esa sustancia y no a otros productos de degradación, por lo que se asume la exposición relativamente reciente de este OC, ya que el aldrín se metaboliza rápidamente en el organismo y en el ambiente hacia dieldrin, el cual se bioacumula y biomagnifica (Kloskowski et al. 1981). El principal uso del aldrín fue en el control de termitas, sin embargo, no parece haber alguna fuente local de este OC por lo que podría estar poniéndose en contacto con los organismos mediante deposiciones atmosféricas.
El LOAEL para la toxicidad en el desarrollo embrionario de ratones, el aldrín se estima en 2 mg/kg/día, en tanto que de 2 - 4 mg/kg/día al final de la gestación produce un aumento en el umbral de convulsiones por shock electroconvulsivo cerebral, y una exposición aguda a 25 mg/kg produce crías con patas palmeadas (ATSDR 2007). En este trabajo se encontró una concentración máxima equivalente a ΣAldrín = 1.07 mg/kg en el sitio La leona/Nicte-Ha la cual puede no estar causando un efecto observable en los roedores silvestres.
El Heptacloro también se encontró en proporciones de Heptacloro/ΣHeptacloro > 0.75 en todos los sitios, indicando la exposición relativamente reciente de los organismos a dicho compuesto. Esto debido a que el heptacloro de grado técnico está integrado por más del 70 % de Heptacloro (ATSDR 2007), por lo cual se encuentra acumulado en grandes proporciones en comparación con la proporción Epóxido de heptacloro/ΣHeptacloro que apenas alcanza 0.24 en el sitio La Leona/ Nicte-Ha. No se encontró evidencia del uso local de este compuesto por lo que podría encontrarse debido a las deposiciones atmosféricas.
En ratones, el LOAEL en una exposición perinatal aguda en ratas a Heptacloro es de 0.03 mg/kg/día con efectos en el desarrollo de los sistemas nervioso e inmune. En ratas macho, una exposición durante 70 días a 0.65 mg/kg/día disminuye el número de espermas en el epidídimo e incrementa su reabsorción, mientras en hembras la exposición a 1.8 mg/kg/día disminuye la fertilidad y aumenta la resorción de oocitos. También se puede observar lesión hepática, hepatitis, hepatomegalia y necrosis en una exposición aguda de 5-10 mg/kg/día de Heptacloro, en tanto que los daños neurológicos se pueden observar en una exposición aguda a 7mg/kg/día (ATSDR 2007). En este trabajo se detectaron las mayores concentraciones equivalentes a ΣHeptacloro = 0.24 mg/kg en Rancho Nohan y ΣHeptacloro = 2.1 mg/kg para el sitio La Leona/Nicte-Ha, con lo que los sistemas, nervioso, inmune y reproductivo reproductivos pueden verse afectados y podría repercutir en el éxito reproductivo de los roedores silvestres de estos sitios.
Los plaguicidas antes mencionados presentan evidencia de aplicación reciente. Sin embargo, la CICOPLAFEST (2004) categoriza al lindano (HCHs) y al DDT como de uso restringido ya que solamente las instancias de gobierno como la Secretaría de Salud tienen permitido su uso para campañas sanitarias como el control de vectores de enfermedades. De manera similar, el aldrín se encuentra bajo la categoría de uso prohibido, categorías bajo la cual han permanecido estos plaguicidas desde 1991. Por otra parte, el heptacloro no ha sido registrado como plaguicida en México, por lo que su comercio y uso no están permitidos, en tanto que su uso en el área de estudio no está reportado.
Implicaciones para la conservación. Como se ha descrito previamente, los ratones del APFFLT están expuestos a una gran cantidad de plaguicidas derivadas de las actividades agrícolas como los compuestos OP y Carbamatos, así como OC y sus productos de degradación, los cuales se han concentrado y acumulado en el hígado y posiblemente en otros tejidos.
En el presente trabajo no se puede hablar de una evidencia específica de la exposición a plaguicidas OP ya que la inhibición de la actividad de la enzima AChE en músculo y cerebro no fue contundente para la zona de ríos con mayor actividad agrícola y por consiguiente una mayor aplicación de compuestos OP y carbamatos. Se deben tomar en cuenta fuentes adicionales de contaminación las cuales podrían estar influyendo en la inhibición de la AChE como lo son los metales pesados, producto de la extracción de hidrocarburos en la zona costera, en donde se observó menor actividad enzimática. Cabe mencionar que los mecanismos que compensan la inhibición de la AChE, como la actividad de la butirilcolinesterasa, puede estar ayudando a los roedores a compensar los efectos de la exposición a plaguicidas anticolinérgicos, evitando los efectos anticolinérgicos como la dificultad de termorregular y la el riesgo a enfermedades neurológicas, lo cual los puede hacer más susceptibles a la depredación (Albert y Loera 2005; Timofeeva et al. 2008; Roegge et al. 2008).
En el caso de los plaguicidas OC, aunque fueron pocos los encontrados en concentraciones por encima del LOAEL, no hay que dejar de lado los posibles efectos adversos a largo plazo. Estos compuestos son altamente bioacumulables debido a que son muy solubles en grasa, lo que les permite unirse a las moléculas lipídicas y permanecer en el tejido graso hasta que se utiliza, momento en el cual los plaguicidas se liberan y producen efectos tóxicos. Como consecuencia se puede producir desde estrés oxidativo, alteraciones en la estructura de las células en órganos internos o pueden fungir como disruptores endócrinos impidiendo la maduración de los gametos hasta la masculinización o feminización de los individuos, además de ser teratogénicos e incluso cancerígenos (Gupta et al. 2009).
La alteración en las respuestas de los ratones ante los cambios ambientales y las interacciones con otros organismos pueden repercutir de manera directa en la composición, estructura y dinámica poblacional al aumentar las tasas de depredación y disminuir la fertilidad cambiando la dinámica de las poblaciones silvestres (Block et al. 1999). Además, los plaguicidas concentrados en los roedores se biomagnifican hacia los niveles superiores de la redes tróficas, con lo cual los depredadores también se ven afectados de diferentes maneras. Uno de los ejemplos más claros se observó en la década de los 60s en las aves rapaces a partir de la disminución del grosor del cascarón de los huevos como consecuencia de la aplicación del DDT (Ratcliffe 1970; Jiménez et al. 2007).
La información obtenida en este trabajo es un panorama general de uno de los eslabones más bajos de la red trófica que puede impactar de manera importante en el nivel superior o a incluso al ecosistema. Es recomendable realizar un monitoreo de los efectos de los plaguicidas sobre los ratones y la fauna que se asocia a ellos en el área de Laguna de Términos mediante el uso de biomarcadores de exposición para determinar los efectos individuales a corto plazo, así como realizar censos, que en conjunto pueden ayudar a comprender los cambios en las estructuras poblacionales a largo plazo.
En este contexto, es importante que las instancias de gobierno encargadas de regular en materia de plaguicidas como son SAGARPA, SEMARNAT y la Secretaría de Salud impulsen la implementación y seguimiento de las estrategias ya existentes de regulación y vigilancia en la distribución y uso de plaguicidas. Dichas acciones deben seguirse particularmente para algunos OC que se encuentran prohibidos o son de uso restringido de acuerdo a las leyes federales como lo son el lindano, aldrín y heptacloro, y que se han encontrado de manera reiterada por diferentes estudios en el área de Laguna de Términos, incluyendo el presente trabajo, y que se encuentran prohibidos o restringidos por las leyes Federales. Además, en el caso de los compuestos anticolinérgicos como los OP y carbamatos que se encuentran permitidos, es crucial que se respeten las dosis y frecuencias recomendadas para el control de plagas en los diferentes cultivos, ya que en muchos casos las aplicaciones se realizan sin tomar en cuenta estos parámetros, afectando a la fauna hacia la cual no van dirigidos dichos compuestos. Lo anterior es fundamental en áreas de importancia biológica como las áreas naturales protegidas como el Área de Protección de Flora y Fauna Laguna de Términos, ya que es uno de los principales reservorios de agua dulce del país y además cuenta con una gran biodiversidad terrestre y acuática que es ampliamente aprovechada por los habitantes de poblados inmersos en dicha zona.
Adicionalmente, es fundamental impulsar el desarrollo de alternativas de producción que no incluyan el uso de plaguicidas sintéticos. Dentro de estas alternativas se encuentra el control biológico de plagas bien diseñado y el uso de compuestos naturales que puedan degradarse con mayor rapidez que a largo plazo producen efectos adversos menores en el ambiente. La agricultura orgánica y el policultivo son opciones que pueden ser benéficas al aumentar la diversidad de especies vegetales y pueden contribuir en la restauración el suelo.











 nueva página del texto (beta)
nueva página del texto (beta)