Introducción
Quillaja saponaria Molina (quillay) es un árbol endémico de cuatro países sudamericanos: Chile, Bolivia, Perú y Ecuador (INDAP, 2000). En Chile, su distribución limita al norte con el paralelo 30° 30’’ de latitud sur, en la IV región de Coquimbo. El límite sur se ubica al norte de la IX región en los alrededores de la ciudad de Algol, 38° de latitud sur (Gallardo y Gastó, 1987).
De acuerdo con el Catastro y Evaluación de los Recursos Vegetacionales de Chile (CONAF et al., 1997), Q. saponaria forma parte del tipo forestal esclerófilo que cubre una superficie de 324 631 ha, equivalentes a 2.6 % de los bosques nativos del país (Donoso y Escobar, 2006). De su madera y corteza se extraen saponinas, moléculas de gran importancia económica utilizadas con fines farmacéuticos, industriales y agronómicos (Kensil et al., 1991; Hoffmann, 1995). En la actualidad, la alta demanda de su corteza como principal fuente de saponinas y el cambio de uso del suelo han reducido la presencia de árboles maduros, en particular, en la zona centro de Chile.
Esta situación fue determinante para realizar un proyecto silvícola y de manejo forestal para la especie, respaldado por un programa de propagación vegetativa (Prehn et al., 2003), en el cual se diseñaron protocolos de modelos de desarrollo morfogénico para propagar vegetativa y masivamente árboles adultos de quillay, mediante el uso de semillas como explantes, mismas que reúnen un alto contenido de saponinas de buena calidad y de baja toxicidad (Prehn et al., 2003).
Como una contribución complementaria a la propagación in vitro, en el presente estudio se ensayó la técnica de micropropagación denominada organogénesis directa. Se evaluó el efecto de componentes hormonales sobre la capacidad morfogénica de segmentos caulinares, apicales y basales provenientes de árboles adultos.
La utilidad práctica del método consiste en establecer las diferencias y dilucidar aspectos de la competencia morfogénica a partir de segmentos caulinares de individuos adultos, los cuales pueden ser utilizados como fuentes de germoplasma para la propagación clonal.
Materiales y Métodos
El experimento se hizo en el Laboratorio de Biotecnología Forestal de la Universidad de Concepción, ubicada en Concepción, Chile (36°46’ S y 73°03’ O), 500 km al sur de la capital del país. Concepción es una ciudad y comuna del centro-sur de Chile, y es la capital de la VIII región del Bío Bío.
Medio de cultivo
El medio básico para el cultivo fue el MS (Murashige y Skoog, 1962) con sus macronutrientes reducidos a 1/2, suplementado con una combinación y balance hormonal de ácido indolbutírico (AIB) y bencilaminopurina (BAP). Como fuente energética, se adicionó sacarosa (30 g L-1) y, se ajustó el pH a 5.8 con NaOH (hidróxido de sodio); como agente gelificante, se adicionó agar (7 g L-1).
Material vegetal
Se utilizaron explantes provenientes de la zona apical y basal de árboles adultos, los cuales se colocaron en posición vertical en contacto directo con el medio nutritivo; se sembraron 180 explantes por cada réplica y fueron cultivados en frascos de vidrio (5 cm de alto x 4 cm de diámetro) y ubicados en una cámara de crecimiento bajo condiciones de luz continua (40 μmol·m-2·s-1) y temperatura (25±1 °C). Posteriormente, se efectuaron observaciones cada 15 días, en las que se registraron el tamaño y la coloración del explante; a las seis semanas de cultivo, se llevó a cabo una primera cuantificación de la presencia de puntos de crecimiento, número de brotes y elongación caulinar.
Diseño experimental y análisis estadístico
El experimento se estableció bajo un diseño completamente al azar balanceado, con cinco repeticiones y con arreglo factorial de tratamientos. Los factores que se estudiaron fueron el ácido indol 3-butírico (AIB) y la 6-bencilaminopurina (BAP) en tres niveles, para un total de nueve tratamientos (Cuadro 1). La unidad experimental fue un frasco de vidrio con cuatro explantes, lo cual constituyó 45 réplicas por condición. A los 90 días de cultivo, se evaluaron las variables número de yemas, número de brotes y longitud de entrenudos por explante. A la información, se le practicó un análisis de varianza (ANDEVA) a través del procedimiento PROC GLM del programa estadístico SAS (Statistical Analysis System, 1999). La comparación de medias de los tratamientos se hizo con el procedimiento prueba de rangos múltiples de Duncan, con un nivel de significancia de 5 %.
Estudio histológico
Para el análisis histológico, se tomaron seis muestras de explantes con brotes durante las etapas de proliferación y elongación. El material se fijó entre 24-48 horas en FAA [formalina (5 %)-ácido acético (5 %)-alcohol etílico (90 %)]. En seguida, se lavaron con agua corriente durante 24 horas. Una vez concluido el lavado, el tejido fue deshidratado en soluciones seriadas de alcohol etílico (50, 75, 85 y 95 %) cada dos horas. A continuación, las muestras se pasaron tres veces por alcohol etílico puro, durante dos horas en los primeros dos deslizamientos y toda la noche en la última traslación. Posteriormente, se realizaron tres inmersiones en xilol por dos horas en cada deslizamiento, y se impregnaron en tres pases de parafina cada dos horas. Las muestras se incluyeron en bloques de parafina, a los que se les realizaron cortes en secciones transversales y longitudinales con un grosor de 5-8 μ m, con un micrótomo de deslizamiento vertical tipo Minot. Por último, cada corte fue adherido a un portaobjetos y teñido con azul de astra safranina al 1 %. Para la observación del material, se utilizó un microscopio Axioskop OPTON y las imágenes se fotografiaron (40x) con una cámara digital Canon Power Shot G5 adaptada al microscopio.
Resultados y Discusión
En plantas leñosas la propagación in vitro resulta más difícil de lograr por su condición estructural y los procesos de la madurez asociados con la edad. Al respecto, se mencionan tres etapas que explican lo anterior: envejecimiento cronológico, referido a cambios expresados en función del tiempo; envejecimiento ontogénico, relacionado a la transición gradual e irreversible regulada bajo control genético; y envejecimiento fisiológico, asociado con la pérdida de vigor causada por cambios hormonales, condiciones nutricionales y ambientales (Pierik, 1990; Russell et al., 1990; Gutiérrez, 1995; Pacheco, 1995; Andrés et al., 2002). En particular, la capacidad morfogénica del explante está fuertemente influenciada por la ontogenia, la cual varía de acuerdo con la posición del material vegetal en el árbol (Magini, 1984).
En el presente estudio se observó una capacidad morfogénica superior en los explantes provenientes de la zona basal (Figura 1A), atribuible a las diferencias de la ontogenia de los tejidos donde se originan los brotes, y por las diferentes concentraciones hormonales en las distintas zonas del árbol. Estos resultados concuerdan con los obtenidos por Fouret et al. (1986); Thanh et al. (1987) y Yeung et al. (1998), quienes demostraron la existencia de una mayor competencia morfogénica en microtallos basales y una mejor utilización de las reservas nutritivas para la elongación celular.

A, B y C. Proliferación de múltiples zonas de crecimiento; D, E y F. Elongación de microtallos de origen basal.
Figura 1 Secuencia fotográfica que exhibe la proliferación y elongación de los segmentos caulinares de Quillaja saponaria Molina a los 120 días de cultivo.
Sánchez-Olate et al. (2005) y Hasbún (2006) indican que los microtallos basales son ontogénicamente más jóvenes y ostentan una mejor respuesta morfogénica, debido a que han sido generados a partir de tejidos meristemáticos latentes. Morisset et al. (2012) señalan la importancia de otros factores como la cantidad de agua, luz y carbohidratos que los microtallos basales aprovechan del material parental durante su desarrollo. Los microtallos de origen apical tuvieron menores tasas de proliferación y una estrecha elongación caulinar. Von Aderkas y Bonga (2000), Andrés et al. (2002), Fraga et al. (2002), Tang et al. (2004), Ramarosandratanam y Van Staden (2005) sugieren que las diferencias en las respuestas de la proliferación y elongación de los microtallos basales y apicales podría vincularse a la existencia de marcadores de tipo bioquímico y a diferencias en las concentraciones hormonales dentro del árbol donador.
Acorde con los resultados del ANDEVA, para el factor tratamiento se obtuvo efecto significativo (P<0.01, F = 77.46 y 12.82) sobre las variables número de brotes, así como para la longitud de entrenudos y brotes. En el caso de la variable número de brotes, el tratamiento T4 (1.0/2.0 mg L-1 de AIB/BAP) fue el que originó un número más grande, con un promedio de siete brotes por explante (Cuadro 2). En contraste, el tratamiento T1 (0.1/2.0 mg L-1 de AIB/BAP) estimuló múltiples puntos de crecimiento (Figura 1A), y el tratamiento T5 (1.0/3.0 mg L-1 de AIB/BAP) promovió brotes de aspecto y forma de roseta con gran cantidad de callo circundante (Figuras 1B y 1F).
Cuadro 2 Prueba comparativa entre medias de tratamientos mediante la prueba de rangos múltiples de Duncan.
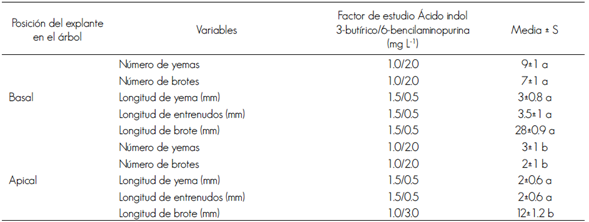
Letras diferentes indican diferencias estadísticamente significativas (P < 0.01).
Congruente con estos resultados, queda demostrado y fundamentado el papel que juegan las relaciones hormonales auxina-citoquinina como factores clave en el control de la morfogénesis. Además, coinciden con los obtenidos en Persea americana Mill por Mohamed-Yasseen (1995), Pliego- Alfaro y Murashige (1988), así como en Persea lingue Ness por Cob et al. (2010). Asimismo, otros estudios confirman que la inducción de órganos por efecto de las citoquininas está orientada a la formación de puntos de crecimiento, que se reflejan favorablemente en proporciones altas de citoquinina, con respecto a la auxina.
En varias especies se ha comprobado que a medida que aumenta la concentración de la citoquinina, se aprecia una disminución en la longitud de los brotes, hasta exhibir una forma de roseta (Sánchez-Olate et al., 2005; Rodríguez et al., 2003; Sotolongo et al., 2003). Al respecto, Orellana (1998) señala que el balance auxina-citoquinina es determinante para el coeficiente de proliferación.
La longitud de los microtallos se favoreció al disminuir la concentración de la citoquinina en la relación AIB/BAP; el óptimo se alcanzó con el tratamiento T9 (1.5/0.5 mg L-1 de AIB/ BAP) (figuras 1C, 1D, 1E). En contraste, los microtallos que fueron cultivados en el tratamiento T5 (1.0/3.0 mg L-1 de AIB/BAP) no elongaron, y se observaron explantes en forma de roseta (Figura 1B). Los del tratamiento T9 alcanzaron, en promedio, 28 mm de longitud y los del T5, en promedio, 12 mm (Cuadro 2).
Lo anterior, coincide con lo obtenido en Juglans regia L. (Scaltsoyiannes et al., 1997), en Nerium oleander L. (Ollero et al., 2010) y en Legrandia concinna (Phil.) Kausel (Uribe y Cifuentes, 2004). Algunos autores registran un incremento en la elongación celular de brotes laterales, mediante el empleo de bencilaminopurina en bajas concentraciones, con respecto a la auxina, esto es atribuible a que disminuye la división celular y se promueve el alargamiento del tejido, debido a la acción de la auxina.
Al respecto, Von Arnold (1988) cita que con frecuencia es necesario reducir la dosis de las citoquininas en el medio nutritivo para lograr un incremento en la elongación de los entrenudos, lo cual redunda en la obtención de brotes de mayor longitud. Guohua (1998), Read y Preece (2003) registran que las citoquininas en concentraciones altas estimulan la proliferación de múltiples puntos de crecimiento; en contraste, las auxinas inducen el alargamiento de la pared celular, que se refleja en un alargamiento de los microtallos. Tamas (1995) indica que el efecto en la elongación caulinar debido a la adición y concentración hormonal en el medio de cultivo es diferencial para cada tipo de hormona, lo que se evidencia al variar los niveles de la relación auxina-citoquinina.
El análisis histológico incluyó cortes transversales y longitudinales; corroboró el proceso de regeneración in vitro vía organogénesis directa (figuras 2A, 2B, 2C y 2D).
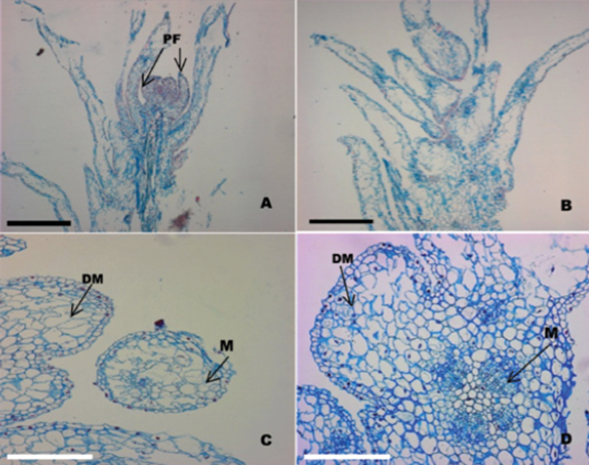
A. Sección longitudinal de una protuberancia separada del tejido inicial que muestra la presencia de primordios foliares en desarrollo (PF) (barra = 5 mm); B. Sección longitudinal de una protuberancia con primordios foliares después de 45 días de iniciado el cultivo (barra = 5 mm); C. Sección transversal de un ápice caulinar que muestra la formación del domo meristemático (DM) y la presencia de un meristemoide (M) (barra = 8 mm); D. Sección longitudinal de un ápice caulinar, nótese la presencia del domo meristemático (DM) y meristemoides (M) (barra = 8 mm).
Figura 2 Secuencia histológica de la formación de protuberancias a partir de segmentos nodales de Quillaja saponaria Molina cultivados in vitro (40x).
La Figura 2A, muestra, claramente, un domo meristemático y primordios foliares bien definidos. El domo meristemático está constituido por una capa de células superficiales alineadas, del cual surgió el primer par de primordios de hojas (figuras 2B y 2C) que marcan el inicio del desarrollo de un brote vegetativo adventicio. Asimismo, se evidenciaron los procesos que implica la formación de nódulos; se observa que la principal actividad morfogénica de las células sucede en los tejidos que conforman a la región meristemática.
Los resultados concuerdan con los de Mitra y Mukherjee (2001) y Lara et al. (2003), quienes documentan que las células de las zonas meristemáticas son las que originan a los brotes caulinares, a través de un proceso organogénico. Estas estructuras meristemáticas se caracterizan por permanecer en estado juvenil y son susceptibles a señales externas de inducción y reprogramación celular. Por lo tanto, la formación de áreas con actividad morfogénica siempre estará presente en las zonas meristemáticas (Figura 2D), las cuales mediante procesos mitóticos, primeramente, formarán un domo meristemático y en seguida los primordios foliares. Lo anterior es atribuible a las altas concentraciones de hormonas en las regiones meristemáticas, que promueven, permanentemente, una activa división y expansión celular. Además, la aplicación exógena de reguladores de crecimiento en el medio de cultivo, afectó de manera directa los niveles hormonales endógenos y, por consiguiente, a la actividad meristemática que redundó en un incremento de los procesos de desarrollo celular.
Conclusiones
El cultivo in vitro de Quillaja saponaria es exitoso en las etapas de la multiplicación y elongación caulinar de microtallos provenientes de explantes de la zona basal. Específicamente, mediante la aplicación de una relación óptima de ácido indol 3-butírico (AIB) y 6-bencilaminopurina (BAP) en el medio nutritivo, se estimuló el desarrollo de organogénesis adventicia. Por otro lado, la contribución de este estudio radica en afirmar los cimientos científicos en torno a la competencia morfogénica de explantes provenientes de diferentes alturas del árbol donador. No obstante, aún existen interrogantes en torno al tema, dignos de ser incorporados en futuros estudios. Asimismo, se requiere optimizar los procesos con base en la replicación de otros ensayos bajo condiciones similares.











 texto en
texto en 



