Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de ciencias pecuarias
versión On-line ISSN 2448-6698versión impresa ISSN 2007-1124
Rev. mex. de cienc. pecuarias vol.3 no.2 Mérida abr./jun. 2012
Notas de investigación
Identificación de biotipos de Staphyloccocus aureus en vacas lecheras de producción familiar con mastitis subclínica en la región centro–este del Estado de México
Staphylococcus aureus biotypes in cows presenting subclinical mastitis from family dairy herds in the Central–Eastern State of Mexico
Ana María Manjarrez Lópeza, Soledad Díaz Zarcoa, Félix Salazar Garcíaa, Benjamín Valladares Carranzaa, Adriana del Carmen Gutiérrez Castilloa, Alberto Barbabosa Plliegoa, Martín Talavera Rojasa, María Uxúa Alonso Fresána, Valente Velázquez Ordoñeza
a Centro de Investigación y Estudios Avanzados en Salud Animal, Facultad de Medicina Veterinaria y Zootecnia, Universidad Autónoma del Estado de México. Km. 15.5 50200 Carretera Toluca–Atlacomulco, México. Tel. 72 22 96 5555, Fax 72 22 96 89 80. hanna1505@yahoo.com.mx Correspondencia al primer autor.
Recibido el 17 de diciembre de 2010.
Aceptado el 2 de julio de 2011.
Resumen
La mastitis ocasiona grandes pérdidas económicas en los hatos lecheros. El Staphylococcus aureus es uno de los principales agentes causales de la enfermedad, considerado de importancia en la salud pública y la salud del hato. El objetivo del estudio fue determinar la frecuencia de S. aureus y los biotipos predominantes en vacas con mastitis subclínica en hatos de producción lechera familiar en la región económica I, Centro–Este del Estado de México. Se condujo un estudio trasversal, en 269 vacas de diferentes etapas de lactación e información del hato en una encuesta cerrada. La muestra de leche se recolectó de cada vaca. La detección de mastitis se realizó mediante la prueba de California. Los biotipos de S. aureus se caracterizaron por medio de la técnica de agar tripticasa soya adicionado con cristal violeta 1:100,000. En las vacas estudiadas la prevalencia de mastitis subclínica fue del 48.3 % (IC95% 42.22 a 54.47) y de mastitis clínica 6.1 % (IC95% 3.44 a 9.48). Se obtuvieron 62 aislamientos de S. aureus, el 79 % correspondió al biotipo C (humano), el 11.3 % al A (bovino), el 6.5 % al E (canino) y el 3.2 % a hospederos no específicos. El tamaño del hato resultó un factor de riesgo asociado a la mayor frecuencia de S. aureus, especialmente cuando el hato fue mayor de 13 vacas (OR = 5.63, IC95% 1.72 a 18.21). Se identifico una prevalencia elevada de mastitis subclínica asociada a la infección por S. aureus Biotipos C y A considerados de importancia en la salud pública.
Palabras clave: Mastitis bovina, Explotaciones familiares, Staphylococcus aureus, Biotipos, Salud pública.
Abstract
Mastitis causes great economic loss in dairy farms. One of the main agents involved is Staphylococcus aureus, which is important not only in public health but in herd health as well. The aim of this study was to determine S. aureus frequency and the predominant biotypes in cows presenting subclinical mastitis from family dairy farms in the Central–Eastern zone of the State of Mexico. A transversal study was conducted considering 269 dairy cows in different lactation periods and herd information was taken through a closed questionnaire. Individual milk samples were taken and California test was used for mastitis detection. Biotypes were identified using soy tripticase agar with violet cristal added (1:100,000). Results show a subclinical mastitis prevalence of 48.3 % (CI95% 42.22 to 54.47) and for clinical mastitis 6.1 % (CI95% 3.44 to 9.48). 62 S. aureus isolations were obtained, from which 79 % were biotype C (Human), 11.3 % A (Bovine), 6.5 % E (Canine) and 3.2 % from non specific hosts. Herd size represented a risk factor associated to S. aureus frequency, especially when the herd was larger than 13 cows (OR=5.63, CI95% 1.72 to 18.21). In the family dairy herds there was a high prevalence of subclinical mastitis associated to the infection produced by S. aureus Biotypes C and A, considered important in public health.
Key words: Bovine mastitis, Family dairy herds, Staphylococcus aureus, Biotypes, Public health.
En México la producción lechera se concentra principalmente en las regiones templada y semiárida, donde se identifican sistemas de lechería especializada, familiar y de doble propósito, definidos por el nivel de tecnificación y uso de los recursos de producción(1).
La lechería especializada se localiza principalmente en el norte de México, con sistemas de producción que aportan el mayor volumen de la producción nacional. Son altamente tecnificadas, mecanizadas en la producción de forrajes, en el ordeño y manejo de la leche(2).
La lechería de doble propósito localizada en las regiones tropicales se caracteriza por una producción estacional. El manejo del ganado y su alimentación se basan en el pastoreo en praderas de gramíneas nativas y pastizales inducidos, y la dieta se complementa con subproductos agrícolas. En este sistema de producción los costos de alimentación disminuyen por el pastoreo(3).
La lechería familiar es el sistema de producción predominante en México, localizada principalmente en la región central del país, en unidades de producción a pequeña escala manejadas por la familia. La alimentación del ganado está basada en el pastoreo en pequeñas superficies agrícolas con pastos nativos, forrajes y esquilmos suministrados en el pesebre(4). El sistema depende de hatos estabulados y semi–estabulados en los que predomina la raza Holstein y las cruzas con la raza criolla(5). El nivel de tecnificación y uso de insumos para la producción es limitado, con un manejo tradicional del hato y generalmente el ordeño es realizado de forma manual(6). La venta local de leche y los productos lácteos el aborados domésticamente generan ingresos adicionales a la familia, aunados a otras actividades agrícolas y de jornal. En el Valle de Toluca prevalece el sistema de producción lechera de tipo familiar, el cual es considerado una actividad relevante que favorece el empleo de la familia y el desarrollo regional (4).
En las vacas el nivel de infección de la glándula mamaria por S. aureus en el hato, depende de la prevalencia en la población y la dinámica de la infección asociada con los factores de virulencia propios del agente(7). La caracterización fenotípica de S. aureus por medio del biotipo permite identificar el origen presuntivo de las cepas(8).
En los hatos lecheros a pequeña escala, las condiciones de higiene y el manejo sanitario frecuentemente son deficientes; esta situación contribuye al desarrollo de la mastitis, enfermedad de gran importancia sanitaria y económica en la producción lechera(9) . La mastitis afecta considerablemente la salud de la glándula mamaria y la calidad sanitaria de la leche, representando un riesgo potencial a la salud pública por la posible contaminación de la leche y sus productos por cepas de S. aureus de origen animal(10).
El presente estudio se realizó para determinar la presencia de mastitis subclínica, la frecuencia de infección de S. aureus y los biotipos presentes en los hatos lecheros de producción familiar en la región centro–este del Estado de México, que comprende los municipios de Chapultepec, Mexicaltzingo, Santa María Rayón, San Antonio la Isla y Tenango de Valle, con un clima templado sub–húmedo C(w2)(w)b(I)g de la clasificación de Koeppen(11).
La población lechera de los hatos se caracterizó a partir de los datos obtenidos al aplicar una encuesta cerrada para determinar el tamaño de hato, el tipo de ordeño y la asociación de la prevalencia de mastitis clínica y subclínica, con la infección por S. aureus y sus biotipos.
Se realizó un estudio trasversal con un muestreo aleatorio en 26 hatos, de donde se obtuvieron 269 muestras de leche de vacas en línea de ordeño, previo consentimiento del productor. Las muestras de leche se obtuvieron con el procedimiento establecido por el National Mastitis Council(12) mediante ordeño manual de los cuatro cuartos glandulares, depositando aproximadamente 25 ml de leche en tubos estériles de vidrio conservados a 4 °C, durante su transporte para su análisis bacteriológico en el laboratorio. El criterio de inclusión de los animales muestreados fue el siguiente: vacas en producción de hatos a pequeña escala de producción y sin signos aparentes de mastitis en los hatos(13).
El diagnóstico de mastitis se realizó mediante la prueba de California con la técnica descrita por Blowey(14), la reacción a la prueba en la muestra de leche de los cuartos glandulares fue interpretada en una escala ordinal (0=no hay reacción, 1=reacción trazas, 2 = reacción uno, 3 = reacción dos y 4= reacción tres).
El aislamiento bacteriológico se realizó inoculando 0.010 ml de leche sobre placas de agar sangre y manitol sal agar, incubadas a 37 ºC en aerobiosis durante 24 h. Las unidades formadoras de colonias (UFC) se identificaron mediante los procedimientos bacteriológicos descritos por el National Mastitis Council(12) para identificar el S. aureus; se observó el tipo de hemólisis sobre las placas de agar sangre, se realizó la tinción de Gram, las pruebas de catalasa y coagulasa en tubo efectuada con plasma humano y de bovino, Voges Proskauer y caldo nitrato(15); la fermentación anaerobia de manitol y aerobia de la maltosa(16). Se emplearon las cepas de S.aureus ATCC25923 y S. epidermidis ATCC 12228 como testigo del análisis bacteriológico.
La determinación de los biotipos de S. aureus se efectuó sobre placas de agar cristal violeta (agar tripticasa soya adicionado con cristal violeta 1:100,000), en consideración al sistema simplificado(8,17), al observar la producción de estafilocinasa, tipo de hemólisis de las UFC en agar sangre preparado con eritrocitos de ovino y la coagulación del plasma de bovino en tubo, y la reacción positiva al cristal violeta de las UFC consistente en una coloración morada y un halo ligeramente amarillo sobre las placas de agar después incubar a 3 7 ºC durante 2 4 h(17). Posteriormente se observaron las características de crecimiento y los cambios de coloración de las UFC. La identificación de los biotipos estableció un origen presuntivo de las cepas(17,18): A de humano, coagularon el plasma humano y las UFC mostraron una coloración violeta con un ligero halo amarillento; C de bovino, coagularon plasma humano y de bovino, las UFC se observaron de color crema, la reacción al cristal violeta fue negativa; y E de canino, produjo UFC de color blanco.
Los datos obtenidos, se analizaron a partir de cuadros y gráficas de frecuencia para el análisis de prueba de hipótesis de proporciones. La frecuencia de mastitis subclínica y clínica se obtuvo al analizar los resultados de la prueba de California en asociación con la infección de S. aureus y su intervalo de confianza al 95 %. El riesgo se estimó por medio de la Razón de Momios (OR, IC 95%)(19).
En las unidades de producción estudiadas, el 66.7 % tuvieron un sistema de ordeño mecánico y el tamaño de hato promedio fue de 11.2 vacas en línea de ordeño, con una producción media de 10.76 L/vaca al día. De las 269 vacas muestreadas, la frecuencia de mastitis subclínica fue del 48.3 % (IC95% 42.22 a 54.47) y de mastitis clínica del 6.1 % (IC95% 3.44 a 9.48). El cuadro 1 muestra la distribución de aislamientos de S. aureus por tamaño de hato. La mayor frecuencia de infección (30.7 %) (OR = 5.63, IC95% 1.72 a 18.21) se obtuvo en los hatos con una población entre 13 y 18 vacas. La tasa de positividad específica de S. aureus fue 23. 04 %, predominante sobre la frecuencia decreciente de aislamiento de otros agentes; Staphylococcus coagulasa negativos, Streptococcus ssp, Escherichia coliy otros organismos coliformes.
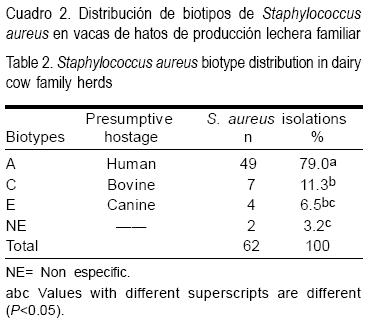
La frecuencia de cuartos negativos al aislamiento bacteriológico fue del 47.20 %. Los biotipos de S. aureus identificados fueron diferentes en su frecuencia; el 79 % correspondieron al biotipo A, el 11.3 % al biotipo C, el 6.5 % al biotipo E y el 3.2 % se consideraron como hospederos no específicos (Cuadro 2). La distribución de los biotipos identificados en los hatos (Cuadro 3) mostró diferencias con respecto al sistema de ordeño empleado. El biotipo C se consideró predominante en las vacas evaluadas.
En el presente estudio se estimó un nivel de producción promedio en línea de ordeño de 10.76 L/vaca y un tamaño de hato no mayor a 30 vacas semejante al informado en otros trabajos(20). En los hatos evaluados se observó un predominio del sistema de ordeño mecánico realizado con pequeñas unidades portátiles. Es posible que esta situación incremente el riesgo de infección en la glándula mamaria, y el desarrollo de la mastitis por agentes patógenos de tipo contagioso y ambiental, como S. aureus y la E. coli, que pueden estar presentes en el hato al momento del ordeño. Se ha observado que en hatos pequeños existe una mayor prevalencia de mastitis subclínica, cuando los animales son ordeñados mecánicamente comparados con los que se ordeñan manualmente(21). Sin embargo, se ha demostrado que la mala higiene durante el ordeño contribuye significativamente al desarrollo de infección intraglandular mamaria por S. aureus y otros agentes de importancia clínica en la mastitis(22).
El nivel de infección por S. aureus mostró una frecuencia similar a la estimada en estudios realizados en otros países(23). La frecuencia de mastitis subclínica determinada fue elevada relacionada con la alta tasa de infección por S. aureus, situación que compromete la salud de la glándula mamaria, además de generar pérdidas económicas importantes y riesgos a la salud animal e inocuidad alimentaria de la leche, indicando la urgente necesidad de implementar programas de prevención y control de la mastitis(24,25), debido a la importancia clínica de la infección por S. aureus, en las vacas portadoras de la infección glandular por cepas con factores de virulencia capaces de comprometer seriamente la salud de la glándula mamaria y la salud pública(26).
La caracterización fenotípica de los biotipos del S. aureus permitió identificar el origen presuntivo de las cepas consideradas; de origen humano, bovino y canino, que tienden a explicar la dinámica de la infección, resaltando la importancia epidemiológica del biotipo C, el cual puede estar involucrado en la infección cruzada entre las vacas lecheras y el hombre. Es posible que la contaminación de la leche y sus derivados pueda contribuir a la diseminación del agente entre la población humana, al ingerir leche no pasteurizada y productos lácteos elaborados sin adecuadas practicas de higiene(27,28). La contaminación de la leche puede ocurrir a través de la infección de la glándula mamaria, los utensilios y el equipo de ordeño(29).
Los biotipos de S. aureus sugieren una variación importante entre las cepas relacionadas con ecovares presentes en la zona estudiada(18), asociados a los factores de virulencia de las cepas; esta variación puede ser evaluada mediante el gen de la coagulasa, que facilita la determinación de la variación genética entre las cepas de S. aureus en una región geográfica en la cual se observa una predominancia de ciertos genotipos, relacionados con el aumento en la virulencia de S. aureus(30).
El biotipo C de S. aureus predominante denota su importancia para la salud pública, debido a que este biotipo también se ha detectado en carne procedente de mercados de Bélgica, en donde se determinó un alto porcentaje del biotipo en las cepas de S. aureus identificadas(31). En otros trabajos relacionados, se menciona que los aislamientos de S. aureus de origen animal tienden a ser menos enterotoxigénicos comparados con las cepas de origen humano(32). En estas últimas se observa generalmente una tendencia a producir cantidades importantes de Proteína A y alfa toxina, que incrementan notablemente el peligro para la población humana al detectar cepas de S. aureus de tipo epidémico(33,34).
Es probable que la mayor frecuencia del biotipo C presente en la población de las vacas estudiadas, sea debido a prácticas inadecuadas en el manejo e higiene del ordeño; esta situación de acuerdo con la literatura favorece una infección cruzada hombre–vaca, al indicar que el hombre es una fuente potencial de S. aureus para la ocurrencia de infecciones intramamarias en el ganado lechero(35). En otros estudios utilizando técnicas de biología molecular en cepas aisladas de pacientes humanos y de leche de bovinos con mastitis, se indica que la fuente de las cepas de S. aureus difiere entre los reservorios identificados en humanos y bovinos, al representar dos subpoblaciones separadas raramente presentes en infecciones cruzadas(36). Sin embargo, otros autores coinciden señalando que pueden ocurrir frecuentemente infecciones entre las vacas y el hombre en los hatos lecheros(37,38).
El riesgo epidemiológico de infección por S. aureus para el hombre, se puede incrementar si consideramos que la leche y sus derivados son una parte importante en la nutrición del humano(39); la transferencia de S. aureus entre las vacas y el hombre puede dar como resultado un problema serio de salud pública, por el desarrollo de infecciones de origen alimentario por cepas de S. aureus productoras de enterotoxinas que afecten la inocuidad y calidad de la leche, así como el creciente incremento de la resistencia a los antibióticos al S. aureus en las vacas lecheras, particularmente al observar cepas resistentes a oxacilina y meticilina (ORSA/MRSA), y multi–resistencia a los antibióticos. El S. aureus de origen bovino puede contribuir a incrementar la presión de infección humana por cepas MRSA y las resistentes a fluoroquinolonas(40,41,42).
En los hatos de producción lechera familiar estudiados en la región centro–este del estado de México; existe una alta tasa de positividad de S. aureus biotipos C y A considerados de origen humano y de bovino, asociados con la presentación de mastitis subclínica en las vacas lecheras.
AGRADECIMIENTOS
Al Consejo Nacional de Ciencia y Tecnología (CONACyT) por la beca # 212841 otorgada a Ana María Manjarrez López para cursar los estudios de Maestría. A los productores lecheros que contribuyeron en la realización del estudio.
LITERATURA CITADA
1. Antúnes PC. La ganadería lechera mexicana. Situación actual y necesidades de investigación. Instituto de recursos genéticos y productividad. Especialidad Ganadera. Colegio de posgraduados en Ciencias Agrícolas. (Edición ecónomica). Montecillo, Texcoco, México; 2000. [ Links ]
2. Cuevas OS. Situación y perspectivas de la producción intensiva de leche. En: Cavalloti VB, Hernández MM, Reyes CR editores. Ganadería, Sustentabilidad y Desarrollo rural. 1st ed. México: Impresos América; 2005. [ Links ]
3. Martínez BE, Salas QH. Globalización e integración en la producción y desarrollo tecnológico de la lechería mexicana. 1st ed. México: Miguel Ángel Porrúa; 2002. [ Links ]
4. Bernal ML, Rojas GM, Vázquez FC, Espinoza OA, Estrada FJ, Castelán OO. Determinación de la calidad físico–química de la leche cruda producida en sistemas campesinos en dos regiones del estado de México. Vet Méx 2007;38(4):395–407. [ Links ]
5. SAGARPA. Secretaría de Agricultura, Ganadería, Desarrollo Rural, Pesca y Alimentación. Situación actual y perspectivas de la producción de la leche en México. Edición económica. México; 2001. [ Links ]
6. FIRA. Fideicomisos Instituidos en Relación a la Agricultura. Oportunidades de desarrollo de la leche en México. Boletín informativo. No. 294. Vol. XXIX. México. 1997. [ Links ]
7. Velázquez OV. Establecimiento de un programa de monitoreo en mastitis en un hato lechero del Valle de Toluca. Facultad de Medicina Veterinaria y Zootecnia. Universidad Autónoma del Estado de México. Documento básico. 1985;16:143–146. [ Links ]
8. Devriese LA. A simplied system for biotyping Staphylococcus aureus strains isolated from animal species. J Appl Bacteriol 1984;56(2):215–220. [ Links ]
9. Manjarrez LAM, Velázquez OV, Alonso MU, Díaz ZS, Lagunas BS, Valladares CB, Saltijeral OJ. Niveles de infección producidos por Staphylococcus aureus en hatos lecheros del Estado de México [resumen]. Reunión Nacional de Investigación Pecuaria, Yucatán, México. 2008. [ Links ]
10. Velázquez OV, Lagunas BS, Gutiérrez GB, Talavera RM, Alonso FM, Saltijeral OJ. Staphylococcus aureus methicillin resitant strain (MRSA) minimum inhibitory enrofloxacin concentration in Staphylococcus aureus isolations obtained from cows with subclinical mastitis in family dairy farms [abstract]. Inter Soc Anim Hygiene Cong. ISAH – Warsaw, Poland. 2005;1:338. [ Links ]
11. Álvarez JR. Enciclopedia de México. Tomos II, VI y IX. Compañía editora de Enciclopedias de México, Secretaría de Educación Pública. México. 1988. [ Links ]
12. NMS. National Mastitis Council. Laboratory handbook on Bovine Mastitis. Madison, USA: National Mastitis Council Inc; 2005. [ Links ]
13. Arriaga CJ, Albarran PB, García MA, Espinoza OA, Castelán OO. Investigación y desarrollo participativo de estrategias de alimentación apropiadas para sistemas de producción de leche en pequeña escala. 6ş coloquio de investigación. Ciencias Agropecuarias, Universidad Autónoma del Estado de México. Toluca, México. 2000. [ Links ]
14. Blowey RP, Edmonson P. Control de la mastitis en granjas de vacuno de leche: Guía práctica ilustrada. 3a ed. Zaragoza, España: Editorial Acribia; 1995. [ Links ]
15. Boerlin P, Kuhnert P, Hüssy D, Schaellibaum M. Methods for identification of Staphylococcus aureus isolates in cases of bovine mastitis. J Clin Microbiol 2003;(41):767–771. [ Links ]
16. Cohen G. Microbiología y Biología molecular. 2nd ed. Barcelona, España: Colección Métodos. 1977. [ Links ]
17. Cottral GE. Manual de métodos estandarizados en microbiología veterinaria. 4a ed. México: Prensa Médica Mexicana; 1978. [ Links ]
18. Devriese LA. Staphylococci in healthy and diseased animals. J Appl Bacteriol 1990;71S–80S. [ Links ]
19. Steel RG D, Torrie JH . Bioestadística: Principios y procedimientos. 2a ed. México: McGraw–Hill; 1990. [ Links ]
20. Wiggins S, Tzintuzn RR, Ramírez GM, Ramírez GR, Ramírez VJ, Ortiz UG, Pina CB, et al. Costos y retornos de la producción en pequeña escala en la zona central de México. La lechería como empresa. Cuarta época, México; 2001. [ Links ]
21. Faría RJ, García UA, D'Pool G, Valero LK, Allara CM, Angelosante G. Detección de mastitis subclínica en bovinos mestizos de doble propósito ordeñados de forma manual o mecánica. Comparación de tres pruebas diagnósticas. Revista Científica 2005;15(2):109–118. [ Links ]
22. Ávila TS, Gutiérrez CA. Comparación del estado de la ubre y la calidad sanitaria de la leche de vacas ordeñadas manual o mecánicamente. Vet Méx 2002;33:387–394. [ Links ]
23. Seegers H, Fourichon C, Beaudeau, F. Production effects related to mastitis economics in dairy cattle herds. J Vet Res 2003;(34):475–491. [ Links ]
24. Velázquez VO, Vázquez CJ, Pescador SN, Saltijeral OJ. Nivel de células somáticas en leche y resistencia de las vacas lecheras a la mastitis. Rev Prod Anim 2005;20(207):15–23. [ Links ]
25. Zecconi A, Piccini R, Fox LK, Epidemiological study of noncontagius intramamaria infections in nine commercial dairy herds following a Staphylococcus aureus control program. J Vet Med B 2004;51:333–336. [ Links ]
26. Jaramillo JA, Barajas RJ, Velázquez, OV. Factores de riesgo asociados a infecciones subclínicas producidas por los biotipos humano y bovino de Staphylococcus aureus en la glándula mamaria de vacas en lactancia. Rev Vet Zoot de Caldas. 1999;11(1):14–18. [ Links ]
27. Dimitraccopoulus G, Sakellauriou C, Papavassilius J. Animal fecal carriership and biotypes of Staphylococcus aureus. Appl Environ Microbiol 1977;34(5):461–464. [ Links ]
28. Kivaria FM, Noordhuizen JP, Kapaga GM. Evaluation of the hygienic quality and associated public health hazards of raw milk marketed by smallholder dairy producers in the Dar es Salaam region, Tanzania. Trop Anim Health Prod 2006;38:185–194 [ Links ]
29. Fagundes H, Fernández OC. Infecçoes intramamarias causadas por Staphylococcus aureus e suas implicaççoes en paúde pública. Ciencia Rural, Brasil; 2004;34(004): 1315–1320. [ Links ]
30. Omega R, Deighton M, Capstick J, Gerraty N. Molecular typing of Staphylococcus aureus of bovine origin by polymorphisms of the coagulase gene. Vet Microbiol 1999;66(4):275–84. [ Links ]
31. Isigidi BK, Mathieu A–M, Devriese' LA, Godard' C, Van Hoof J. Enterotoxin production in different Staphylococcus aureus biotypes isolated from food and meat plants. J Appl Bacteriol 1992;(72):16–20. [ Links ]
32. Yasser H. Al–Tarazi, Albetar MA, Alaboudi AR. Biotyping and enterotoxigenicity of Staphylococci isolated from fresh and frozen meat marketed in Jordan. Food Res Intl 2009;(42):374–379. [ Links ]
33. Isigidi BK, Devriese LA, Godar C, Van Hoof J. Characteristics of Staphylococcus aureus associated with meat products and meat workers. Lett Appl Microbiol 1990;(1):145–147. [ Links ]
34. Velázquez OV, Saltijeral JO, Alonso FMU, Lagunas BS, Enríquez E. Phenotypical expression of Staphylococcus aureus virulence factors isolated from dairy cows with subclinical mastitis. Int Soc Anim Hygiene. Saint–Malo, France.2004;1:397–398. [ Links ]
35. Schukken YH, Wilson DJ, Welcome F, Tikofsky LG, Gonzalez RN. Monitoring udder health and milk quality using somatic cell counts. Vet Res. 2003;(34)579–596. [ Links ]
36. Lange C, Cardoso M, Senczek D, Schwarz S. Molecular subtyping of Staphylococcus aureus isolates from cases of bovine mastitis in Brazil. Vet Microbiol 1999;67(2):127–41. [ Links ]
37. Karahan M, Cetinkaya B. Coagulase gene polymorphisms detected by PCR in Staphylococcus aureus isolated from subclinical bovine mastitis in Turkey. J Vet 2007;174(2):428–31. [ Links ]
38. Trovó F, Lemos MV, Givisiez PE. Fluorescent amplified fragment length polymorphism genotyping of human and animal Staphylococcus aureus isolates from dairy farms with manual milking. Vet Microbiol.2005;109(1–2):57–63. [ Links ]
39. Hata E, Katsuda K, Kobayashi H, Nishimori K, Uchida I, Higashi de M, et al. Bacteriological characteristics of Staphylococcus aureus isolates from humans and bulk milk. J Dairy Sci 2008;(91):564–569. [ Links ]
40. Lagunas BS, Velázquez VO, Vázquez CJ. Detection of the mec A gene in strains of Staphylococcus aureus methillicin resistant isolated from milk samples of dairy cows through the polymerase chain reaction (PCR). Int Soc Anim Hygiene. Int Cong Anim Hygiene. México. 2003;I:189–192. [ Links ]
41. López JM, Higuera RJ, Ochoa ZA, Chassin NO, Valdez AJ, Bravo PA, Baizabal AB. Caracterización molecular de aislamientos de Staphylococcus spp. asociados a mastitis bovina en Tarímbaro, Michoacán, México. Téc Pecu Mex 2006;44(1):96–106. [ Links ]
42. Loh JV, Percival SL, Woods EJ, Williams NJ. Christine A Cochrane Silver resistance in MRSA isolated from wound and nasal sources in humans and animals. Int Wound J 2009;6(1):32–38. [ Links ]














