Introducción
El género Capsicum es una de las especies más cultivadas y producidas en todo el mundo (Antonio et al., 2018), pertenece a la familia Solanaceae, son plantas herbáceas de comportamiento anual y perenne, es originario de México, evidencias arqueológicas han permitido estimar que se cultiva desde el año 9000 aC, en las regiones de Tehuacán, Puebla y Ocampo, Tamaulipas (García-Jiménez et al., 2018). En el año 2020, la producción de chile a nivel mundial fue más de 40.2 Mt y México ocupó el segundo lugar con más de 2.8 Mt superado solo por China con más de 16.9 Mt (FAOSTAT, 2022).
La gran diversidad de usos del chile jalapeño ha resaltado su importancia socioeconómica, este fruto se utiliza en fresco, seco o polvo, siendo uno los condimentos básicos en las familias mexicanas (Campos et al., 2022). Se consume en salsas, en mole, en rellenos, en rajas y en condimentos para diversos alimentos (Pérez-Vargas et al., 2017; Campos et al., 2022). Además, posee propiedades nutraceúticas al producir capsaicina, fenoles, flavonoides, antioxidantes, proteína y otros compuestos benéficos para la salud (Espinosa-Palomeque et al., 2020; Medina et al., 2022; Campos et al., 2022), por el tratamiento de enfermedades cardiovasculares, el cáncer y la diabetes (Chamikara et al., 2016; Parvez, 2017; Bonaccio et al., 2019).
En el país se cultivan más de 40 variedades de chile y destacan el chile jalapeño, serrano, pimiento morrón, poblano, chilaca, Anaheim, mirasol, soledad, de árbol y piquín (SIAP-SAGARPA, 2022). La producción del chile jalapeño puede limitarse por diversos factores, destacando las enfermedades por hongos, bacterias y virus (Morra y Bilotto, 2015; Hernández-Huerta, et al., 2021), la baja fertilidad del suelo, condiciones de heladas, plagas y pocos apoyos gubernamentales, provocando descenso en la baja producción, pérdidas económicas y bajo interés por el cultivo (Galindo, 2007; Sánchez-Toledano et al., 2021).
Los hongos que afectan el cultivo de chile son Phytophthora capsici, Fusarium sp., Sclerotiorum sp., Rhizoctonia solani y Pythium causando el Damping off o la marchitez (Morra y Bilotto, 2015; Hyder et al., 2021). Para contrarrestar los problemas de fertilidad en los suelos y presencia de enfermedades, los productores se apoyan con el uso de productos químicos, los cuales, al hacer uso excesivo de estos, provocan contaminación en los ecosistemas y el medio ambiente, resultando la salinidad del suelo, la eutrofización del agua y la acumulación de nitritos y nitratos, mismos que pueden ser una fuente de contaminación ambiental y una amenaza para la salud humana (Castellanos et al., 2017).
Para reducir el uso excesivo de productos químicos y evitar la contaminación de los suelos, existen alternativas amigables y sustentables con el medio ambiente; por ejemplo, utilizar microorganismos benéficos como las rizobacterias promotoras del crecimiento vegetal (RPCV). Las RPCV habitan de forma natural la rizosfera de las plantas, los cuales pueden cultivarse e inocularse como biofertilizantes debido a su capacidad para promover el crecimiento de las plantas, mediante mecanismos como el incremento de movilización y absorción de nutrientes, sobre todo de N, P y K (Dahiya et al., 2019; Etesami y Adl, 2020), control biológico de patógenos y producción de reguladores del crecimiento vegetal (fitohormonas) (Yadav et al., 2015; Chauhan et al., 2015).
Las cepas utilizadas en este trabajo fueron identificadas como Serratia marcescens (fijador de nitrógeno), S. plymuthica (solubiliza fósforo), S. liquefaciens (produce ácido indolacético) y Arthrobacter sp. (produce ácido indolacético), con números de accesión al GenBank KX259560, KX259564, KX259559 y KX258420 (González et al., 2017). Estas rizobacterias han sido estudiadas como promotores del crecimiento en chile poblano (González et al., 2017; Quiroz-Sarmiento et al., 2019), pero no han sido estudiados en plántulas y plantas del chile jalapeño, el objetivo de este trabajo fue evaluar el efecto de las cepas anteriores como RPCV en el crecimiento y rendimiento de plantas en este cultivo.
Materiales y métodos
Establecimiento del experimento
El estudio se realizó en la Facultad de Agricultura y Zootecnia, de la Universidad Juárez del Estado de Durango, localizado en el km 32 de la Carretera Gómez Palacio-Tlahualilo, del ejido Venecia, municipio de Gómez Palacio, Durango, México, con coordenadas geográficas 25° 78’ 60’’ latitud norte y 103° 35’ 07’’ longitud oeste, altitud de 1 110 m. Se estableció un experimento a nivel de invernadero, en el que se utilizaron cuatro cepas de rizobacterias promotoras del crecimiento vegetal (RPCV) provenientes de suelo rizosférico del cultivo de chile poblano, muestreadas en la Sierra Nevada, Puebla, México, identificados como Serratia marcescens, S. plymuthica, S. liquefaciens y Arthrobacter sp. (González et al., 2017).
El invernadero utilizado fue de estructura metálica cubierto de plástico blanco y malla sombra al 50%, con temperatura en promedio de 22 °C (mínima 9 °C y máxima de 35 °C). Antes de realizar el experimento en invernadero, se probaron el efecto de las RPCV en plántulas de chile jalapeño a nivel in vitro (cajas de Petri) y semillero, en el que se probaron cinco tratamientos (SM, SP, SL, AB y testigo) y 15 repeticiones, evaluándose las variables altura y número de hojas; la primera se midió con una regla graduada en cm y la segunda variable de forma visual. En estos experimentos se utilizaron como sustrato peat moss, perlita y vermiculita (relación 1:1:1 p/p), esterilizados en autoclave a 18 lb de presión durante 6 h.
La semilla utilizada fue chile jalapeño colectada en la misma facultad, se desinfectaron antes de la siembra con cloro al 1% por 3 min y lavada tres veces con agua destilada. Una vez que la semilla pasó por la desinfección, fueron sembradas en las cajas de Petri y en el semillero (charola germinadora con 288 cavidades). Ocho días después de la germinación, con alturas de 2 cm (±0.5), las plántulas fueron inoculadas con las RPCV, agregando 1 ml del medio caldo nutritivo, el cual contenía la carga bacteriana de 109 UFC ml de medio líquido (cuantificación por dilución seriada).
El experimento se estableció en invernadero, se evaluó el efecto de las RPCV en el crecimiento y rendimiento del chile jalapeño, por lo que las plántulas fueron trasplantadas en macetas tipo bolsas negras de plásticos de 15 x 30 cm, previamente llenadas con aproximadamente 5 kg de suelo. Las características físico-químicas del suelo fueron analizados según la norma oficial mexicana (NOM-021-RECNAT-2000), presentando un pH medianamente alcalino (8.4) (relación suelo, agua 1:2), materia orgánica de 2.2% (Walkley y Black), nitrógeno total de 0.09% (micro Kjeldhal), N inorgánico de 61.5 mg kg-1, fósforo disponible de 20.2 mg kg-1 (Bray y Kurtz), potasio y calcio extraíble de 12 404 y 375 mg kg-1 (extracto de saturación), la textura fue franco arcillosa (Bouyoucos).
El diseño experimental fue completamente al azar con seis tratamientos [testigo absoluto (TA), testigo fertilizado (TF), Serratia marcescens (SM), S. plymuthica (SP), S. liquefaciens (SL) y Arthrobacter sp. (AB)] y 15 repeticiones cada uno. Las plántulas fueron trasplantadas después de 57 días de la siembra en semilleros, debidamente inoculadas con las rizobacterias y procesadas según este apartado, las alturas al momento del trasplante fueron de 6.5 (TA), 6.7 (TF), 6.7 (AB), 6.5 (SP), 7.6 (SL) y 7.4 cm (SM). Se trasplantaron dos plántulas por macetas, eliminando una de ellas posteriormente, estas fueron regadas cada tercer día. La fertilización en dicho tratamiento fue con base en la dosis de 120 kg N ha-1 en tres aplicaciones.
Características de las rizobacterias promotoras del crecimiento vegetal
Serratia marcescens (SM) es una cepa con capacidad para fijar nitrógeno atmosférico, con número de accesión al GenkBank KX259560, inhibe Phytophthora capsici en un 44% y Fusarium sp. En un 5%. La cepa S. plymuthica (SP) solubiliza fósforo en una cantidad de 744 μg ml-1, inhibe el desarrollo de P. capsici en 42% y Fusarium sp. En 37%. Su número de accesión al GenBank es KX259564 (González et al., 2017).
S. liquefaciens (SL) tienen capacidad para producir auxinas (ácido indolacético 23.9 μg ml-1), inhibe el desarrollo de P. capsici en 34.5% y Fusarium sp. En un 39.4%, con número de accesión al GenBank KX259559. Finalmente, Arthrobacter sp. (AB) es una rizobacteria con capacidad para producir auxinas en 22.5 μg ml-1, inhibe 44.6% de P. capsici y 12% de Fusarium sp., su número de accesión al GenBank es KX258420, González et al. (2017). Antes de su inoculación las cepas fueron reactivadas en medio solido Agar nutritivo y sembradas en cajas de Petri mediante estría cruzada e incubándolos a 28 °C.
Variables evaluadas
A los 121 días después del trasplante (DDT) se terminó el experimento y se evaluaron las variables altura, número de hojas, área foliar, biomasa seca (en raíz, tallos y hojas), índice de contenido de clorofila, número de frutos, largo y ancho del mismo. La altura de plántula se midió con una regla graduada en cm, desde el cuello radical hasta el ápice de la planta, el número de hojas se cuantificó de forma visual en cada una de las plantas. El área foliar se determinó con un medidor de área marca LI-COR, modelo LI-3100 área meter, al final del experimento se separaron las hojas y se pasaron en la banda del medidor de área foliar, la producción de biomasa seca en raíz, tallos y hojas se obtuvo al separar las partes indicadas y fueron puestos en papel estraza, posteriormente, se sometió en un horno de secado a 70 °C por 72 h, el peso seco se midió con una balanza analítica AdventurePro.
Para determinar el índice de contenido de clorofila (ICC) en las plantas, se utilizó un medidor de clorofila (Fluorímetro) Marca Opti-Sciences (CCM-200 Plus). El número de frutos se cuantificó de manera visual, esta variable se determinó al principio de la fructificación y como única medición, debido a que inició el periodo de invierno, el diámetro y largo del mismo se determinó utilizando un vernier electrónico graduada en mm.
Análisis estadístico
Los datos obtenidos de las variables estudiadas fueron sometidos a prueba de normalidad y homogeneidad de varianzas, las variables que no cumplieron con dichas pruebas fueron transformados a logaritmo natural, posteriormente se realizó un análisis de varianza y una comparación de medias según la prueba de Tukey (p≤ 0.05). Todos los datos se analizaron con la ayuda del paquete estadístico SAS 2002, recomendado para Windows versión 9.0.
Resultados y discusión
Efecto de las RPCV en el crecimiento de plántulas
Los resultados indicaron que la altura y el número de hojas en plántulas de chile jalapeño sembradas a nivel in vitro (cajas de Petri) y en semilleros, fueron estadísticamente diferentes según las cepas inoculadas (Tukey, p≤ 0.05) (Figura 1). A nivel in vitro, las plántulas inoculadas con la cepa Serratia plymuthica (SP) presentaron mayor altura con 8 cm, seguido del tratamiento con S. marcescens (SM) al presentar 7.8 cm de alto. Las plantas no inoculadas (testigo) presentaron menor altura con 5.8 cm, los incrementos en altura del tratamiento con SP fue de 38% más comparado con la altura de las plántulas en el testigo.
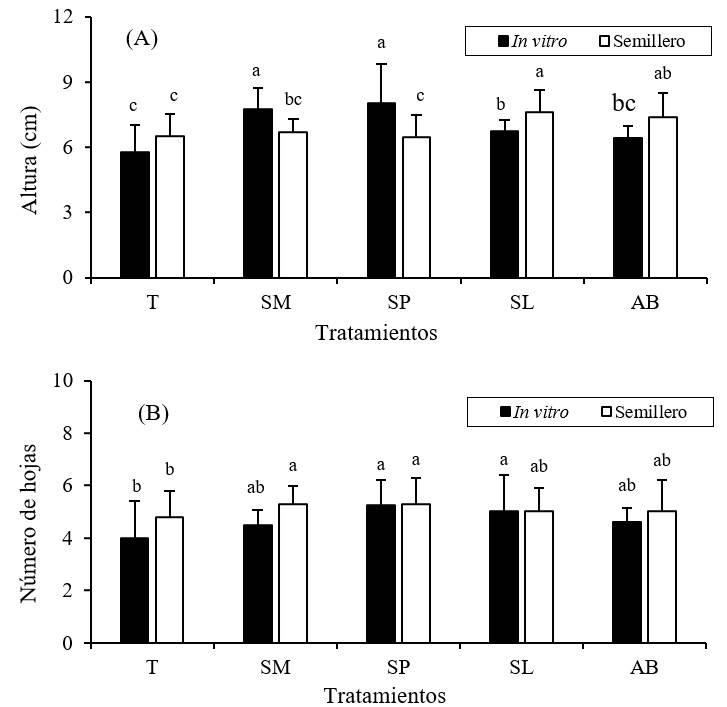
Figura 1 Altura (A) y número de hojas (B) en plántulas de chile jalapeño (in vitro y semillero), según el efecto de diferentes cepas rizobacterianas. SM= Serratia marcescens; SP= S. plymuthica; SL= S. liquefaciens; AB= Arthrobacter sp., T= testigo. Letras diferentes sobre las barras indican diferencias estadísticas significativas (Tukey, p≤ 0.05); n= 15 ± error estándar.
En semillero, fue mejor S. liquefaciens (SL) quien presentó en promedio 7.6 cm de alto por plántulas, el testigo presentó nuevamente menor altura con 6.5 cm. Los incrementos en SL respecto al testigo fueron de 17% más en altura (Figura 1A). El número de hojas en plántulas fue diferente según las RPCV inoculadas, hubo mayor número de hojas en plántulas tratadas con SP, tanto in vitro como en semilleros, ambos con 5.3 hojas (Figura 1B). Los incrementos fueron de 33 y 10% más en número de hojas respecto a las plántulas (in vitro y semillero) sin inoculación microbiana.
Los efectos positivos de estas cepas no han sido reportados con chile jalapeño, pero si con chile poblano, González et al. (2017) reportaron incrementos de 15, 30 y 11% más en altura, área foliar y producción de biomasa seca en plántulas, cuando inocularon con S. plymuthica, con esta misma cepa, pero en chile jalapeño, este trabajo reporto un incremento de 38% en altura. Otro trabajo comparable, en el que evaluaron diferentes cepas de RPCV en plántulas de chile poblano, encontraron los mejores efectos al inocular S. plymuthica y S. liquefaciens, representando incrementos de hasta 28 y 26% en altura (13.3 cm) y número de hojas (7.2), además incrementaron el área foliar y la producción de biomasa seca (Quiroz-Sarmiento et al., 2019). Los efectos positivos encontrados en altura y número de hojas por efecto de las cepas bacterianas posiblemente estén relacionados con la capacidad que tienen para solubilizar fósforo (SP, 744 μg ml-1), producir auxinas (SL, 23.9 μg ml-1) e inhibir Fusarium sp. y Phytophthora capsici (González et al., 2017).
Efectos de las RPCV en el crecimiento y rendimiento del chile jalapeño
La inoculación de las RPCV en plantas de chile jalapeño, trasplantadas en macetas, influenció en el crecimiento y rendimiento de las plantas cultivadas en invernadero. Los resultados indicaron que la altura y el número de hojas fueron estadísticamente diferentes entre los tratamientos (Tukey, p≤ 0.05) (Cuadro 1). Al final del experimento, se encontró mayor altura en las plantas inoculadas con Serratia marcescens (SM) con un promedio de 32 cm (Tukey, p≤ 0.05) (Cuadro 1); el valor más bajo fue localizado en los tratamientos con S. plymuthica (SP) y S. liquefaciens (SL), plantas con 21 cm respectivamente. La altura final en las plantas inoculadas con SM, representó 45% más respecto a la altura encontrada en el testigo absoluto (TA, 22 cm), por otro lado, comparado con el testigo fertilizado (TF, 24 cm) se encontró 33% más en altura de las plantas.
Cuadro 1 Efecto de rizobacterias promotoras del crecimiento vegetal en altura, número de hojas, área foliar e índice de contenido de clorofila (ICC) en plantas chile jalapeño.
| Tratamientos | Abreviación | Altura (cm) | Hojas | Área foliar (cm2) | Clorofila (ICC) |
| Testigo absoluto | TF | 24 (±6) b | 27 (±10) bc | 486 (±103) c | 39 (±12) bc |
| Testigo fertilizado | TA | 22 (±4) bc | 24 (±7) c | 574 (±65) bc | 36 (±16) c |
| Arthrobacter sp. | AB | 23 (±6) bc | 38 (±14) ab | 490 (±245) c | 38 (±14) bc |
| Serratia plymuthica | SP | 21 (±2) c | 31 (±13) bc | 609 (±203) bc | 52 (±10) a |
| Serratia liquefaciens | SL | 21 (±2) c | 29 (±7) bc | 688 (±143) ab | 48 (±9) ab |
| Serratia marcescens | SM | 32 (±6) a | 45 (±16) a | 782 (±151) a | 40 (±14) bc |
Letras diferentes en las columnas indican diferencias estadísticas significativas (Tukey, p≤ 0.05); n= 8, ± error estándar.
Se observó mayor producción de hojas en las plantas inoculadas con RPCV, el valor más alto (45 hojas) fue encontrado en las plantas inoculadas con SM, seguido de las plantas inoculadas con AB, al obtener en promedio 38 hojas por plantas. Nuevamente, las plantas sin inoculación microbiana presentaron los valores más bajos con 24 (TA) y 27 (TF) hojas por planta. El número de hojas encontrado con la cepa SM, al final del experimento, representa 88% más respecto al número de hojas encontrado en las plantas sin inoculación bacteriana (TA, 24 hojas) y 67% más comparado con las plantas fertilizadas (TF, 27 hojas) (Cuadro 1).
El área foliar de las plantas se incrementó en tres de las cuatro cepas inoculadas, siendo estos, estadísticamente diferentes a los demás tratamientos (Tukey, p≤ 0.05) (Cuadro 1). Los resultados mostraron mayor área foliar con 782 cm2, en las plantas tratadas con SM, el testigo fertilizado obtuvo menor área foliar con 486 cm2. La inoculación con SM produjo 61% más de área foliar comparado con el testigo fertilizado y 36% más respecto al TA quien presentó 574 cm2.
El índice de contenido de clorofila (CCI), fue estadísticamente diferente entre los diferentes tratamientos evaluados (Tukey, p≤ 0.05) (Cuadro 1). Las plantas tratadas con Serratia plymuthica presentaron mayor clorofila con 52 unidades de ICC, el testigo absoluto presentó menos clorofila con 36 unidades ICC. El contenido de clorofila en las plantas con SP representa 44 y 33% más respecto al ICC encontrados en los tratamientos TA (36 ICC) y TF (39 ICC).
La producción de biomasa seca en hojas (BSH), raíz (BSR) y tallo (BST) mostraron diferencias estadísticas significativas por el efecto de la inoculación de RPCV (Tukey, p≤ 0.05) (Figura 2). El valor más alto en la BSH (8519 mg), BSR (2690 mg) y BST (5594 mg), fue encontrado en las plantas inoculadas con la cepa Serratia marcescens; los valores más bajos fueron localizados en los tratamientos TA (3 553, 1 218 y 1 783 mg de BSH, BSR y BST) y TF (3 056, 1 406 y 1 702 mg de BSH, BSR y BST), respectivamente. Los incrementos en la producción de biomasa seca total, encontrada en las plantas con SP (16 803 mg), fueron de 156 y 172% más comparado con la biomasa total encontrada en los tratamientos TA (6 554 mg) y TF (6 164 mg).
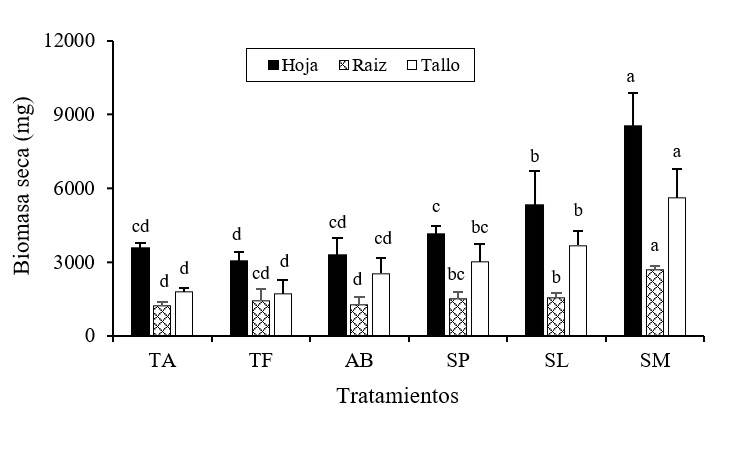
Figura 2 Producción de biomasa seca en hojas, tallo y raíz, en plantas de chile jalapeño según el efecto de diferentes cepas rizobacterianas. SM= Serratia marcescens; SP= Serratia plymuthica; SL= Serratia liquefaciens; AB= Arthrobacter sp., T= testigo. Letras diferentes sobre las barras indican diferencias estadísticas significativas (Tukey, p≤ 0.05); n= 8 ± error estándar.
Serratia marcescens logro incrementar las variables altura, número de hojas, área foliar y producción de biomasa seca en raíz, hojas y tallos, esta bacteria es un microorganismo ubicuo, capaz de pervivir en múltiples ambientes (Adeolu et al., 2016). Los efectos de esta rizobacteria han sido reportados como promotores del crecimiento vegetal por su efecto antifúngico (Troskie et al., 2014; González et al., 2017) y por mejorar el crecimiento y desarrollo de los cultivos agrícolas, principalmente de Capsicum annuum (Amaresan et al., 2012; González et al., 2017; Ahmed et al., 2022). Las cepas de RPCV utilizadas en este trabajo tienen la capacidad de producir auxinas y solubilizar fosfatos, además, tienen la capacidad de inhibir el desarrollo de fitopatógenos como Fusarium sp. y Phytophthora capsici (González et al., 2017), por lo que sus efectos positivos en el crecimiento pueden estar relacionadas con estos atributos.
En un estudio realizado por Amaresan et al. (2012) al inocular diversas especies de RPCV, incluyendo S. marcescens, en Capsicum annuum cultivado en macetas, encontraron mayor número de raíces primarias y secundarias, mayor altura y mejor producción de biomasa seca; al respecto, S. marcescens representó 56 y 43% más altura (19.9 cm) y producción de biomasa seca aérea (0.02 g) comparado con el tratamiento testigo (12.8 cm altura y 0.014 g de biomasa seca), los autores concluyen que esta mejoría en el crecimiento se debe a que esta cepa puede inhibir Sclerotium rolfsii, Colletotrichum capsici, Fusarium oxysporum y Pythium sp., además de su capacidad para producir sideróforos, solubilizar fosfatos y producir ácido indolacético.
En otro estudio, al inocular Bacillus subtilis en chile pimiento, demostró la inhibición de Phytophthora capsici, logrando incrementar la altura (32.02 cm) y la producción de biomasa seca (8.75 g), estas variables se incrementaron en 5 y 13% más comparado con las plantas sin inoculación microbiana quien presentó 30.45 cm de altura y 7.78 g de biomasa seca (Irabor y Mmbaga, 2017). La inoculación de SM en cultivo de avena, en condiciones de macetas, mejoraron 45 y 28% la altura y el peso fresco de plantas (Liu et al., 2015), en la producción de té Camellia sinensis se reportaron incrementos de hasta 54% en la producción de biomasa seca (entre 5 y 10 g) cuando se inocularon con SM respecto a las plantas no inoculadas (1.3 y 6.5 g) (Chakraborty et al., 2013).
El número de frutos producidos por plantas fueron relativamente bajos, debido a que el experimento aun se encontraba en proceso y el clima no era favorable para la fructificación, esto debido al frio de invierno, sin embargo, la producción de frutos por plantas y el tamaño de este (largo y ancho) presentaron diferencias estadísticas significativas entre los tratamientos (Tukey, p≤ 0.05) (Cuadro 2). El valor más alto se obtuvo con la inoculación de SL, al producir 5.3 frutos por planta, mientras que el testigo absoluto (TA) y el testigo fertilizado (TF) mostraron menor número de frutos, con 2.7 y 2.3, respectivamente.
Cuadro 2 Efecto de rizobacterias promotoras del crecimiento vegetal en el número de frutos, largo y diámetro del fruto de chile jalapeño.
| Tratamientos | Abreviación | Frutos | Largo de fruto (mm) | Ancho de fruto (mm)> |
| Testigo absoluto | TA | 2.7 (±0.6) bc | 57 (±0.9) a | 20 (±1) b |
| Testigo fertilizado | TF | 2.3 (±0.7) c | 57 (±0.7) a | 21 (±0.6) ab |
| Arthrobacter sp. | AB | 3.7 (±1) b | 56 (±0.6) a | 23 (±0.7) ab |
| Serratia plymuthica | SP | 3 (±0.5) bc | 60 (±1.1) a | 24 (±1.1) a |
| Serratia liquefaciens | SL | 5.3 (±1.1) a | 62 (±1) a | 21 (±0.8) ab |
| Serratia marcescens | SM | 3(±0.9) bc | 59 (±1) a | 22 (±1) ab |
Letras diferentes entre las columnas indican diferencias estadísticas significativas (Tukey, p≤ 0.05). n= 8 ± error estándar.
El tamaño de los frutos varió entre tratamientos, el largo de fruto fue mejor cuando se inoculo las RPCV SL y SP, ambos con 62 y 60 mm de largo, aunque no se encontraron diferencias estadísticas significativas, SL representó un incremento del 9 y 11% en largo de fruto comparado con las plantas del TA (57 mm) y TF (57 mm). El valor más alto, en el ancho de fruto, se encontró en las plantas tratadas con las rizobacterias SP y AB, ambos con 24 y 23 mm, respectivamente, los valores más bajos fueron encontrados en las plantas sin inoculación microbiana con 20 (TA) y 21 mm (TF) (Cuadro 2). El ancho obtenido con SP fue de 20 y 14% más comparado con el ancho de fruto encontrado en el TA y TF.
Inocular a los cultivos con RPCV reduce sustancialmente el uso de fertilizantes sintéticos y los impactos negativos al suelo, incrementa el crecimiento y rendimiento de los cultivos, contribuyendo en la seguridad alimentaria, en la producción sustentable y en el menor riesgo de la salud humana (Odoh, 2017). Los resultados de este trabajo demostraron que la inoculación de RPCV mejoró el crecimiento de la planta de chile, el rendimiento y el tamaño del fruto, por lo que pueden ser utilizados en la producción de plantas, tanto en semillero como en invernadero. Resultados similares, pero con diferentes RPCV fueron encontrados por Gou et al. (2020), al inocular Bacillus sp. y Pseudomonas sp. en Capsicum annuum reflejaron un incremento de las variables anteriores; Raheem et al. (2018) bajo ensayos en macetas con trigo (Triticum aestivum L.), encontraron incrementos en el rendimiento del 34% cuando se inocularon con B. amyloliquefaciens.
Irabor y Mmbaga (2017) al inocular Bacillus subtilis en chile pimiento, encontraron un incremento en el contenido de clorofila y en el número de frutos; el contenido de clorofila reportado (8.96) no presentó diferencias estadísticas; sin embargo, fueron más altos que en las plantas sin inoculación microbiana (7.24), representando incrementos de 24% más el ICC comparado con el testigo. Respecto al número de frutos, fueron mejores las plantas inoculadas (dos frutos), representando un incremento de 166% más respecto al testigo (0.75 frutos).
Conclusiones
Las rizobacterias Serratia plymuthica y S. marcescens mejoraron la altura y el número de hojas en plántulas de chile jalapeño en los primeros experimentos (in vitro y semillero), en condiciones de macetas bajo invernadero sobresalieron las rizobacterias S. marcescens y S. liquefaciens, la primera acrecentó el crecimiento de las plantas y la segunda demostró mayor número y tamaño de los frutos, además se observó que S. plymuthica indujo mayor tamaño en el ancho de fruto. Estas rizobacterias pueden ser alternativas para implementar su uso como biofertilizantes en cultivos de chile jalapeño.











 texto en
texto en 


