Introducción
En la actualidad, el impacto del cambio climático, la degradación del suelo, el alto costo de los fertilizantes sintéticos y ante la demanda de producir alimentos inocuos y con un alto valor nutricional, mejorar la productividad y calidad agrícola es vital para elevar el nivel de vida mundial y promover la producción sostenible de alimentos frente a los crecientes desafíos para la agricultura (Ortiz-Bobea et al., 2021). La fertilización orgánica es una alternativa para la recuperación de los suelos y mejorar la calidad de los alimentos, debido a que proporcionan las cantidades necesarias de nutrientes a las plantas, colaboran con la producción de estimulantes para el crecimiento de plantas, mejora la estabilidad del suelo y colabora a la biodegradación de sustancias (Peñaloza-Monroy et al., 2019), también, el uso de los biofertilizantes favorece a mejorar las condiciones socioeconómicas, ecológicas, y la preservación del ambiente (Chew et al., 2019).
Una de las medidas para complementar los beneficios del uso de los abonos orgánicos, es la integración de microrganismos benéficos del suelo y entre los más importantes se encuentran los HMA (Xiao et al., 2020) que colonizan 90% de las especies de las plantas. Los HMA ayudan a incrementar el intercambio de agua y nutrientes de las plantas y por lo tanto, tienen efectos positivos en el crecimiento y nutrición de las plantas, en especial en suelos deficientes de fósforo (Tedersoo et al., 2020), además, aumentan significativamente los rendimientos de los cultivos al tiempo que reducen la cantidad de fertilizantes sintéticos y mejoran la resistencia a los insectos de los cultivos (Wang et al., 2020; Krzyzaniak et al., 2021).
Las plantas y los HMA, han desarrollado estrategias para la obtención de nutrientes de los suelos, el cual se da a través de la colonización de las raíces por los HMA y crea una vía de absorción de nutrientes, además de la vía directa de absorción a través de los pelos de las raíces. Por lo que, el uso de estos microorganismos es una alternativa para mejorar la nutrición de cultivos, especialmente en sistemas agrícolas de subsistencia o de bajos insumos (Comby et al., 2017). En la actualidad, los abonos orgánicos y los HMA representan una alternativa para mantener la sostenibilidad de los cultivos agrícolas, por lo tanto, es necesario seguir con los estudios de la relación entre ambos, principalmente para conocer la respuesta en la calidad de fruto, debido a que se conoce que el uso de abonos orgánicos ayuda a mejorar el sabor y aroma (Ma et al., 2020).
En estudios previos, la respuesta al uso de abonos orgánicos junto con micorrizas ha sido positiva. En este sentido, Jiménez Ortiz et al. (2019) obtuvieron una respuesta significativa en el rendimiento de maíz forrajero, utilizando compost de estiércol como sustrato en interacción con micorrizas. Asimismo, Cos et al. (2013) demostraron que el tratamiento Glomus cubense + humus de lombriz obtuvieron rendimiento medio de 73.47 t ha-1 de producción de tomate. Por lo anterior, se ha demostrado que el uso de abonos orgánicos asociado con el uso de las micorrizas arbusculares son una buena alternativa como biofertilizantes, reduciendo con ellos los problemas de degradación del suelo, nutrientes para las plantas y en suma más amigable con el ambiente, sin embargo, existen pocos estudios sobre el efecto de los abonos orgánicos y los HMA en el rendimiento y la calidad nutraceútica del pepino. Por lo tanto, el objetivo del trabajo fue evaluar el efecto de los abonos orgánicos asociados con HMA en el rendimiento y la calidad nutraceútica del pepino.
Materiales y métodos
Descripción del área de estudio
El estudio se realizó en primavera-verano de 2019, en el área de invernaderos de la Universidad Autónoma Agraria Antonio Narro, Unidad Laguna (UAAAN-UL), la cual se encuentra localizada en el municipio de Torreón, Coahuila, México, a 25° 33’ 26” latitud norte y 103° 22’ 21” latitud oeste, a una la altitud de 1 120 msnm.
Descripción de los tratamientos
Los tratamientos fueron sustratos obtenidos por mezcla de estiércol de ganado equino (EE), caprino (EC), bovino (EB), compost, suelo y arena. Las mezclas de sustratos se formularon en base a volumen, posteriormente, se pasaron por un tamiz número cinco para tener sustratos homogéneos y después se esterilizaron a baño María por cuatro horas. Los tratamientos consistieron en cinco diferentes sustratos adicionados con micorrizas y un testigo que fue arena regado a base de solución nutritiva (Cuadro 1).
Cuadro 1 Descripción de los tratamientos obtenido en base a los diferentes tipos de sustratos.
| Tratamiento | Composición de los tratamientos |
| AEBE | Arena de río (75%) + estiércol bovino (25%) + Ecomic® |
| AECE | Arena de río (75%) + estiércol caprino (25%) + Ecomic® |
| AEEE | Arena de río (50%) + estiércol equino (50%) + Ecomic® |
| SEE | Suelo esterilizado (100%) + Ecomic® |
| ACE | Arena de rio (75%) + compost (25%) + Ecomic® |
| ASNS | Arena de río (100%) + solución nutritiva Steiner |
Antes de la siembra, los tratamientos fueron lavados con agua durante cinco días, con el objetivo de disminuir la concentración de sales en los sustratos. Posteriormente, al momento de realizar la siembra, se adicionó biofertilizante comercial ECOMIC® que está compuesto por esporas de diferentes especies de HMA, principalmente de Glomus geosporum, G. fasciculatum, G. costrictum, G. tortuosum, Gigaspora margarita y Acaulospora sp. Para el agua de riego, se realizó el análisis de pH y conductividad eléctrica (CE).
El pH se analizó mediante un potenciómetro digital (Hanna Instruments Hl 98107®), mientras que la CE se midió mediante el método conductímetro, de acuerdo con la norma oficial mexicana NOM.021-RECNAT-200 (SEMARNAT, 2014). Los valores medios obtenidos fueron de 8.4 para el pH y de 1.9 dS cm-1 para la CE. Para poder realizar el riego, se aplicó ácido cítrico a concentración de 1 g L-1 de agua, para bajar el pH a una concentración final de 5.5. Asimismo, antes de la siembra se realizó los análisis fisicoquímicos de los diferentes sustratos obtenidos (Cuadro 2).
Cuadro 2 Características fisicoquímicas de los cinco tipos de sustratos.
| Sustratos | Textura | pH | CE | MO | N | P | Mg | Ca | Cl | SO4 | CO3 | HCO3 | |||
| (dS cm-1) | (%) | (mg kg-1) | (meq L-1) | ||||||||||||
| AEB | A-A | 7.8 | 6.94 | 1.88 | 1.67 | 48.6 | 116.64 | 162.32 | 39.2 | 189 | 3.8 | 16.4 | |||
| AEC | F-A | 7.7 | 6 | 1.44 | 1.67 | 97.31 | 182.25 | 272.54 | 32 | 171 | 3.2 | 11.2 | |||
| AEE | F-A | 7.7 | 4.07 | 1.15 | 1.6 | 29.04 | 92.34 | 132.26 | 15.6 | 151.5 | 4.2 | 9.6 | |||
| SE | F-A | 8 | 8.89 | 1.27 | 1.58 | 232.29 | 131.22 | 166.33 | 49.6 | 130.78 | 5.2 | 16 | |||
| AC | A-A | 7.3 | 5.34 | 1.33 | 1.6 | 17.65 | 182.25 | 280.56 | 23.8 | 139.5 | 1.6 | 6.2 | |||
AEB= arena de río + estiércol bovino; AEC= arena de rio + estiércol caprino; AEE= arena de río + estiércol equino; SE= suelo esterilizado; AC= arena de río + composta; AA= arena arcillosa; FA= franco arcilloso; CE= conductividad eléctrica; MO= materia orgánica.
Establecimiento del cultivo
La siembra se realizó el 12 de mayo de 2019, bajo un sistema de invernadero de 200 m2 de estructura metálica, cubierta de polietileno con espesor 0.7 mm y una malla anti-áfida, con dos ventanas laterales y dos ventiladores. La siembra se realizó en bolsas de polietileno negro con capacidad de 15 kg y como material vegetal se utilizaron semillas de pepino del hibrido Poinsett®. Para tener plantas uniformes, se realizó la siembra de manera directa colocando dos semillas por maceta y cuando las plántulas tenían dos hojas verdaderas se eliminó una, para tener una densidad de cuatro plantas por metro cuadrado. Al realizar la siembra, junto con las semillas se agregaron 100 g del biofertilizante. El riego se realizó de forma manual, aplicando 500 ml de agua por día y fue incrementando de acuerdo con el ciclo del cultivo, hasta regar un máximo de dos litros por día en la etapa de producción. Para los cinco tratamientos con micorrizas agua natural y el testigo (ASS) con solución nutritiva Steiner.
Variables evaluadas
La altura de la planta y el diámetro del tallo se evaluaron a partir de los ochos días después de la siembra (dds), mientras que la cosecha se realizó a partir de los 65 dds y se midieron las propiedades físicas del fruto: longitud, diámetro pola, firmeza, peso y rendimiento por planta. Posteriormente se determinó la calidad del fruto por medio de las variables: solidos solubles, capacidad antioxidante, fenoles totales y flavonoides. Al término de la cosecha se determinó el porcentaje de colonización de micorrizas.
Altura de planta y rendimiento
Las mediciones de la altura de la planta y el diámetro del tallo se realizaron a partir de la formación de las primeras hojas verdaderas y se midieron una vez por semana, hasta los 82 dds. La altura de la planta se midió con una cinta métrica midiendo la planta al ras del suelo hasta el ápice de crecimiento, mientras que el diámetro de tallo se efectuó con un vernier marca Stainless Hardened® en la parte superior de la primera hoja madura.
La cosecha de frutos se realizó a partir de los 65 dds, antes de alcanzar su madurez comercial, considerando las características del cambio de color de verde a oscuro, extremidad apical del fruto redondeada, las estrías estén menos pronunciadas, la firmeza y el brillo externos indican estado prematuro deseado. En total se realizaron cuatro cortes, donde se evaluó el rendimiento contando el número de frutos cosechados y el peso de los frutos por planta (kg). En cuanto a la medición de la longitud y el diámetro polar del fruto se realizaron con un vernier Stainless Hardened®, mientras que la firmeza se midió con el apoyo de un penetrómetro (Fruit Hardness Tester FHT200) y los sólidos solubles totales (°Brix), se cuantificó en fruto freso con un refractómetro digital (CIVEQ® modelo CVQ-4012).
Extracción y cuantificación de fenoles totales, flavonoides y capacidad antioxidante
Se utilizó como solvente de extracción, acetona al 80%. Se pesó100 mg de muestra fresca y se adicionó 1.5 ml de acetona, posteriormente se agitó por 2 min en un vortex y después se centrifugó a 10 000 rpm durante 15 min, se recuperó el sobrenadante, al pellet se le agregó 500 µl de acetona al 100%, se agitó nuevamente en un vortex por 2 min y se centrifugó a 10 000 rpm por 15 min, el sobrenadante se recuperó y se mezcló con el anterior, el mismo procedimiento se repitió hasta completar 2 ml, el cual se almacenó a 4 °C en oscuridad para la cuantificación de fenoles totales, flavonoides y capacidad antioxidante.
Cuantificación de fenoles totales
El contenido de fenoles totales se determinó colorimétricamente por el método de Folin-Ciocalteu (Singleton et al., 1999). Para la cuantificación se realizó una mezcla del extracto obtenido y los reactivos de la técnica original (0.5 ml de Folin-Ciocalteu, agua desionizada 7.5 ml, 1.5 ml de carbonato de sodio (Na2CO3). Para la reacción, se colocaron 200 µl del extracto, 100 µl del reactivo de Folin-Ciocalteu 1M, 200 µl de Na2CO3 al 20% y 1.5 ml de agua destilada, antes de la lectura de las muestras se incubaron por 30 min en oscuridad y luego se midió la absorbancia a 765 nm en un espectrofotómetro Genesys 10S UV-Vis®. Los resultados se expresaron como miligramos equivalentes de ácido gálico por 100 g de muestra de peso fresco (mg EAG 100 g-1 pf).
Contenido de flavonoides
El contenido de flavonoides totales se determinó por el método propuesto por Barros et al. (2010) que se basa en la formación de un complejo flavonoide-aluminio. Se realizó una mezcla de 500 μl del extracto, 200 μl de agua destilada y 150 μl de nitrato de sodio al 5% (w/v), se agitó y se dejó reposar 6 min, posteriormente se adicionó 150 μl de cloruro de aluminio al 10% (w/v), se volvió a agitar y se dejó reposar por 6 min y por último se adicionó a la mezcla 2 000 μl de hidróxido de sodio al 4% y 200 μl de agua destilada, se agitó y se dejó reposar 15 min, a continuación, se midió la absorbancia a 415 nm en un espectrofotómetro. El contenido total de flavonoides se determinó mediante una curva de calibración con quercetina para concentraciones de 200 a 400 mg L-1. Los resultados se expresaron en miligramos equivalentes de quercetina por 100 g de peso fresco (mg EQ 100 g-1 pf).
Capacidad antioxidante
La capacidad antioxidante se determinó por el método de Brand-Williams et al. (1995), mediante la capacidad captadora de radical libre 1,1-difenil-2-picril-hidrazilo (DPPH). Para la determinación de la capacidad antioxidante, en tubos eppendorf se mezclaron 200 μl del extracto cetónico previamente obtenido y 2 ml de la solución DPPH al 0.1 M, se agitaron en el vortex por tres minutos y la muestra obtenida se incubó por 1 h, pasado el tiempo se agitó en el vortex por tres segundos y se leyó a una absorbancia de 515 nm en un espectrofotómetro Genesys 10S UV-Vis®. Todas las mediciones se realizaron por triplicado. La capacidad antioxidante se determinó mediante una curva de calibración en base a Trolox diluido en etanol absoluto. Los resultados se expresaron en miligramos equivalentes de Trolox por 100 g de peso fresco (mg ET 100 g-1 pf).
Porcentaje de colonización
Las raíces de plantas separadas en cada una de las muestras fueron colocadas en cápsulas de plástico, envolviéndolas en tela fina, para evitar la pérdida de raíces más finas. Posteriormente, las capsulas fueron incubadas en una solución de KOH al 10% durante 12 h, pasado el tiempo, las raíces se lavaron tres veces con agua desionizada, inmediatamente, se pasaron a una solución H2O2 al 10% durante 10 min y se realizaron dos lavados con agua y se colocaron en una solución de HCl al 10% por cinco minutos. Después del tiempo, las muestras a una solución de azul de tripano por tres minutos, y fueron colocadas en una olla de presión para llevar a 10 lb pulg-2 (psi) durante 10 min, posteriormente, se realizó lavado con agua y las capsulas con las raíces fueron puestas en refrigeración a ±4 °C hasta su observación al microscopio (Phillips y Hayman, 1970).
Las raíces se cortaron en secciones de 1 cm de longitud, se colocaron en portaobjetos y posteriormente se aplicó una gota de solución de Lacto-glicerol para su observación al microscopio. La colonización fue en base a la presencia del porcentaje de las estructuras fúngicas dentro de la raíz y se realizó por triplicado en cada tratamiento (Parra-Rivero et al., 2018). El porcentaje de colonización se obtuvo mediante la siguiente formula:
Diseño experimental y análisis estadístico
Los datos obtenidos se sometieron a análisis de varianza bajo un diseño completamente al azar con seis tratamientos y siete repeticiones. Se utilizó la probabilidad de significancia para comparar los tratamientos con la prueba de Tukey p≤ 0.05, mediante el programa estadístico SAS (SAS, 2009).
Resultados y discusión
Efecto de los sustratos orgánicos y micorrizas al crecimiento de las plantas de pepino
Las curvas de crecimiento para la variable altura de planta muestran una mejor respuesta de los tratamientos AEBE, ACE y AEEE (Figura 1a), sin embargo, el tratamiento ASNS (testigo), obtuvo un crecimiento lento durante los primeros 40 dds y posteriormente mejoró la tendencia. Por otra parte, el tratamiento de suelo esterilizado con micorrizas (SEE), fue el que presentó un crecimiento más lento y con plantas pequeñas con respecto al resto. Se observa que en los tratamientos con abonos orgánicos combinados con HMA presentan mayor efecto en el crecimiento de la planta.
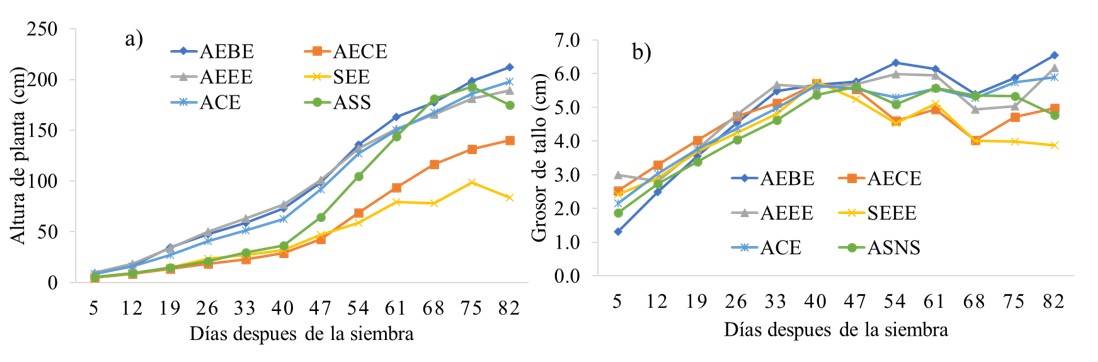
Figura 1 Altura de la planta y grosor de tallo del pepino en sustratos orgánicos con micorrizas. Medias con diferentes letras, significa diferencia estadística (p≤ 0.05) entre tratamientos. AEBM= arena + estiércol bovino + Ecomic; AECM= arena + estiércol caprino + Ecomic; AEEM= arena + estiércol equino + Ecomic; SEEM= suelo + estiércol + equino + Ecomic; ACM= arena + compost + Ecomic; ASNS= arena + solución nutritiva Steiner.
Este hecho se puede atribuir al rico contenido de minerales que proveen los sustratos orgánicos, junto con el efecto positivo de las micorrizas sobre la absorción de nutrientes, y se manifiestan en un mayor crecimiento de planta que puede garantizar una mayor productividad tanto biológica como agronómica (Alvarado-Carrillo et al., 2018; Elliot et al., 2020), aunado a esto, los abonos derivados del estiércol retiene la humedad por más tiempo y es una fuente de nutrientes que libera de manera paulatina a través de todo el ciclo fenológico (Fortis-Hernández et al., 2009). Sin embargo, en los tratamientos que presentaron plantas pequeñas, es posible que se deba a las altas concentraciones de sales y de pH en los sustratos (Cuadro 2), porque se conoce que las sales reducen el potencial hídrico del agua en suelo generando un desequilibrio iónico y produciendo una toxicidad y desbalance (Ayuso-Calles et al., 2021).
Para la variable diámetro del tallo, los resultados menos favorables se obtuvieron con el tratamiento SEEE, que presentó menor diámetro de tallo. En el resto de los tratamientos se obtuvieron valores más altos respecto al testigo (Figura 1b), con valores medios que oscilaron entre 4.22 y 4.95 cm. Estos resultados son similares a los reportados por Rojas-Rodríguez y Ortuño (2007), donde obtuvieron mejor grosor de tallo en cebolla (Allium cepa) producidos con abonos orgánicos y micorrizas en comparación con la fertilización química.
Los resultados de este estudio demuestran que las plantas de pepino cultivados con abonos orgánicos e inoculados con HMA fueron similares a la fertilización química en cuanto a crecimiento de las plantas, y grosor de tallo, lo cual puede ser debido a que con la actividad simbiótica HMA-planta se obtiene un mejor aprovechamiento de los nutrimentos inmóviles del suelo y ayuda a mejorar el crecimiento vegetativo (Pérez et al., 2021). En este sentido, la producción orgánica es favorable debido a que permite ahorrar hasta 90% del volumen de los productos químicos, por lo tanto, favorece la reducción de los insumos y costos de producción.
Rendimiento y calidad del fruto de pepino producido con abonos orgánicos y micorrizas
Para la longitud y diámetro del fruto se encontraron diferencias significativas (p≤ 0.05) entre los tratamientos (Cuadro 3), oscilando entre 14.73 y 19.75 cm de longitud, siendo el tratamiento testigo (ASNS) el de frutos con mayor longitud. Sin embargo, en las plantas del tratamiento testigo se obtuvieron los frutos de menor grosor. Los resultados de la longitud de fruto diferentes a los reportados por Alvarado et al. (2014) que obtuvieron incrementos en el tamaño del fruto de tomate cuando las plantas fueron inoculadas con R. intraradices.
Cuadro 3 Efecto de los abonos orgánicos y micorrizas en el rendimiento del pepino.
| Tratamientos | Longitud de fruto (cm) | Diámetro del fruto (mm) | Peso fruto (g) | Rendimiento (t ha-1) | Solidos solubles (°Brix) | Firmeza |
| AEBE | 19.04 a | 55.1 a | 275.9 a | 24.88 b | 4.26 a | 0.47 a |
| AECE | 18.51 a | 54.1 ab | 219.33 a | 17.38 b | 4.7 a | 0.53 a |
| AEEE | 14.99 b | 53.95 ab | 212.2 a | 10.63 b | 3.81 b | 0.55 a |
| SEE | 14.73 b | 53.78 ab | 117.35 b | 6.32 b | 4.33 a | 0.53 a |
| ACE | 17.75 ab | 47.99 b | 232.58 a | 16.28 b | 3.93 b | 0.67 a |
| ASNS | 19.75 a | 47.45 b | 251.5 a | 52.41 a | 4.38 a | 0.79 a |
Medias con letras iguales en una columna para cada factor no son estadísticamente diferentes (Tukey,p≤ 0.05); los tratamientos son: AEBE= arena + estiércol bovino + Ecomic; AECE= arena + estiércol caprino + Ecomic; AEEE= arena + estiércol equino + Ecomic; SEEE= suelo + estiércol equino + Ecomic; ACE= arena + compost + Ecomic; ASNS= arena + solución nutritiva Steiner.
Para el peso de fruto, todos los tratamientos son iguales estadísticamente, excepto SEE que presento los frutos más pequeños con 117.35 g. Sin embargo, a pesar de que los tratamientos con abonos orgánicos fueron superiores en cuanto al peso de fruto, la producción en sustrato de arena + solución nutritiva (testigo) fue mayor con 52.41 t ha-1, duplicó al tratamiento AEBE que obtuvo 24.88 t ha-1, siendo éste el mejor tratamiento de abonos orgánicos en cuanto al rendimiento. Estos resultados son similares a los reportados por Galindo-Pardo et al. (2014) en el cual, los mayores rendimientos de pepino lo obtuvieron en el tratamiento testigo fertilizado con la solución nutritiva.
En este sentido, De-Oliveira et al. (2020) señalan que los abonos orgánicos favorecen el desarrollo de los cultivos en invernadero, cuando éstos se utilizan como sustratos y que las diferencias detectadas en las variables de rendimiento evaluadas se deben a su contenido de elementos nutritivos y a la naturaleza de sus comunidades microbianas. Estos resultados indican que los sustratos orgánicos representan una opción viable como fuentes de nutrientes para pepino en invernadero cuando se busca disminuir el uso de fertilizantes convencionales. En este sentido, Diaz-Franco et al. (2017) indican que la fertilización orgánica puede ser competitiva con la fertilización sintética, aunque los abonos orgánicos tienen menor cantidad de nutrimentos, en comparación con los fertilizantes inorgánicos, la disponibilidad de dichos elementos es más constante durante el desarrollo del cultivo por la mineralización lenta y gradual a que están sometidos (Iqbal et al., 2019).
El tratamiento AEBE puede ser una alternativa para sustituir la fertilización sintética, dado que la obtención de hortalizas con abonos orgánicos y el uso de biofertilizantes reducen el costo de producción, provee de alimentos de mejor calidad y contrarresta los efectos negativos para el ambiente (Canchani et al., 2018). Por otra parte, el bajo rendimiento obtenido en sustratos orgánicos del estudio se puede compensar con el precio del producto, principalmente en hortalizas que se incrementan desde 3.31 a 5.84 veces mayor que el convencional (Kwikiriza et al., 2018).
La firmeza del fruto es una de las características importantes en las hortalizas debido a que definen el grado de madurez, y está asociado con el color y sabor de un fruto, por lo tanto, se relaciona con la calidad. En este sentido, la firmeza del fruto de pepino no presentó diferencia significativa para ninguno de los tratamientos evaluados. Mientras que para solidos solubles, los tratamientos AECE, ASNS, SEEE y AEBE fueron los que presentaron mayor concentración de azúcares con 4.7, 4.3, 4.36 y 4.26 °Brix respectivamente.
En esta variable se refleja la calidad del pepino producido con abonos orgánicos, debido a que presenta los valores similares o incluso superiores al testigo. En otros estudios, se han logrado incrementar el contenido de solidos solubles de diferentes hortalizas al ser cultivado en abonos orgánicos (Pieper y Barrett, 2009; González-Rodríguez et al., 2018) y una forma de incrementar los sólidos solubles es aumentando la salinidad en el medio radical (Safdar et al., 2019; Naeem et al., 2020). En el presente estudio, las macetas con tratamientos orgánicos presentaron una mayor CE, comparada con la solución nutritiva inorgánica y también mayor o igual contenido de sólidos solubles.
Para el análisis de correlación entre las variables de producción, se obtuvo una correlación significativa (p≤ 0.05) entre la longitud y el peso del fruto (r= 0.94), mientras que la longitud de fruto y rendimiento fue de r= 0.79; asimismo, el peso del fruto con el rendimiento fue r= 0.83. Solo el diámetro del fruto no fue significativo con ninguna variable (Cuadro 4).
Cuadro 4 Análisis de correlación entre variables de producción de pepino con abonos orgánicos inoculados con micorrizas.
| Longitud | Diámetro | Peso fruto | Rendimiento | |
| Longitud | 1 | 0.29 | 0.94 | 0.79 |
| Diámetro | 0.29 | 1 | 0.65 | 0.22 |
| Peso fruto | 0.94* | 0.65 | 1 | 0.83 |
| Rendimiento | 0.79* | 0.22 | 0.83* | 1 |
*= variables significativas.
Calidad nutracéutica del fruto de peino
Los antioxidantes, son compuestos capaces de inhibir o retardar la oxidación, mediante la captación de radicales libres que disminuyen el riesgo de muchas patologías relacionadas con el estrés oxidativo (Petruk et al., 2018). La capacidad antioxidante y el contenido de fenoles totales presentaron diferencias significativas (p≤ 0.05) entre los tratamientos (Cuadro 5). Los valores de la capacidad antioxidante oscilaron entre 56.97 y 79.01 mg Trolox 100 g-1 pf, siendo el tratamiento SEEE el que presentó la mejor concentración. Mientras que para el contenido de fenoles totales el tratamiento AECE presentó el mayor contenido con 13.51 mg EAG 100 g-1 pf, superando al testigo en un 4.49 mg.
Cuadro 5 Calidad nutracéutica de fruto de pepino obtenidos en invernadero en abono orgánicos inoculados con micorrizas.
| Tratamiento | Capacidad antioxidante (mg Trolox 100 g-1 pf) | Fenoles totales (mg EAG 100 g-1 pf) | Flavonoides (mg EQ 100 g-1 pf) |
| AEBE | 61.11 bc | 10.07 cd | 0.76 c |
| AECE | 56.97 cd | 13.51 a | 1.82 b |
| AEEE | 57.11 cd | 10.79 bc | 0.22 d |
| SEEE | 79.01 a | 11.94 b | 2.76 a |
| ACE | 66.44 b | 8.71 e | 0.88 c |
| ASNS | 53.49 d | 9.02d e | 0.72 c |
Medias con letras iguales en una columna para cada factor no son estadísticamente diferentes (Tukey,p≤ 0.05). Los tratamientos son: AEBE= arena + estiércol bovino + Ecomic; AECE= arena + estiércol caprino + Ecomic; AEEE= arena + estiércol equino + Ecomic; SEEE= suelo + estiércol equino + Ecomic; ACE= arena + compost + Ecomic; ASNS= arena + solución nutritiva Steiner; DPPH= capacidad antioxidante por 2,2-difenil-1-picrilhidracilo; los resultados se expresaron como mg de Trolox 100 g-1 de peso fresco. Los fenoles totales se expresaron en base mg equivalentes de ácido gálico 100 g-1 de peso fresco. El contenido de flavonoides se expresó en miligramos equivalentes de quercetina por 100 g-1 de peso fresco (mg EQ 100 g-1pf).
Se sabe que el contenido de compuestos fenólicos y la capacidad antioxidante en las frutas depende de las condiciones de crecimiento, las prácticas agronómicas, la época de producción y la madurez fisiológica (Morales-Morales et al., 2020), por lo tanto, la diferencia de los compuestos fenólicos y la capacidad antioxidante entre el testigo y los abonos orgánicos con micorrizas, podría deberse al estrés que genera el bajo contenido de nutrientes en los abonos orgánicos, lo que provoca un estrés nutricional en las plantas durante el crecimiento, además, del estrés generado por las altas temperaturas y por lo consiguiente, promueven aumentos en la producción de compuestos fenólicos, aumentando la capacidad antioxidante.
Estos resultados concuerdan con otros estudios, que reportan una mayor capacidad antioxidante y contenido fenólico en tomates (Aldrich et al., 2010), tomate cherry (García et al., 2017) y pepinos (Santiago-López et al., 2016), que fueron cultivados bajo suministro de abonos orgánicos en comparación con tratamientos fertilizados sintéticamente. Los flavonoides son compuestos antioxidantes de gran importancia, ya que exhiben varias actividades biológicas incluyendo antialergénicos, antitumorales y antivirales (Agati et al., 2020). En este sentido, los resultados obtenidos sobre el efecto de los abonos orgánicos en los flavonoides mostraron diferencia significativa (p≤ 0.05) por efecto de los tratamientos evaluados (Cuadro 5).
Los valores fluctuaron entre 0.22 y 2.76 mg EQ 100 g-1 pf, siendo el tratamiento AEEE que presentó la mayor concentración de flavonoides y superó al testigo por 3.8 veces. Los resultados del tratamiento AEEE coincide con los resultados de Aguiñaga-Bravo et al. (2020) donde reportaron que flavonoide se vio favorecida con el uso de abono orgánico + 50% de fertilización sintética, mejorando la calidad de fruto con el manejo de abonos orgánicos como el bocashi. En este sentido, se ha reportado que el aumento de concentración de sales en el sustrato provoca aumentos en la acumulación de flavonoides en el fruto (Rosas-Medina et al., 2020), mismos que se reflejan en este estudio.
Porcentaje de colonización
Se sabe que el 90% de las plantas agrícolas forman relaciones simbióticas con los HMA, en especial las hortalizas y cereales (Diagne et al., 2020). En él porcentaje de micorrización en la raíz del pepino, se observó que cuatro tratamientos (AEBE, AECE, AEEE y ACE) superaron 80% de colonización total (Figura 2). En cuanto a las estructuras, las vesículas fueron las más abundantes (50.0-64.8%), seguido por los arbúsculos e hifas. El alto porcentaje de colonización no se vio reflejada en el rendimiento del pepino, pero tuvo un impacto significativo en la calidad. En este sentido, Cavagnaro (2014) menciona que inoculación de las micorrizas arbusculares y el compost pueden tener un papel importante en los sistemas agrícolas, especialmente aquellos que ponen un fuerte énfasis en los sistemas de suministro de nutrientes regulados biológicamente.

Figura 2 Porcentaje de colonización de la micorriza en la raíz del pepino con sustratos orgánicos. Porcentaje de micorrización de H= hifas; V= vesículas; E= esporas; A= arbúsculos; AEBE= arena + estiércol bovino + Ecomic; AECM= arena + estiércol caprino + Ecomic; AEEM= arena + estiércol equino + Ecomic; SEEM= suelo + estiércol equino + Ecomic; ACM= arena + compost + micorrizas.
Conclusiones
La fertilización orgánica y el uso de micorrizas en el cultivo de pepino tuvieron una respuesta positiva en el crecimiento de la planta y en la calidad del fruto (solidos solubles, antioxidantes, fenoles y flavonoides); sin embargo, se vio afectado en el rendimiento, donde el testigo obtuvo los mejores resultados.











 texto en
texto en 


