Introducción
La familia Cucurbitaceae comprende muchos cultivos, incluidos pepinos, calabazas, luffas, melones y sandías (Pessarakli, 2016). Los calabacines y calabazas (Cucurbita spp.) son las especies hortícolas cultivadas desde regiones frescas hasta tropicales. La especie C. pepo es de las más ampliamente cultivadas, tiene un alto impacto económico y se consume principalmente como verdura fresca porque el fruto es de alto valor nutritivo. Las semillas se consumen en algunas regiones y producen aceite que es altamente valorado en Europa central (Paris et al., 2012).
Entre las plagas y enfermedades que afectan significativamente el rendimiento y la calidad del fruto de calabaza, las más importantes son las provocadas por virus fitopatógenos, debido a que causan fuertes pérdidas económicas. Se han identificado más de 35 virus en Cucurbitaceae (Ozaslan et al., 2006), incluyendo los geminivirus (familia Geminiviridae) con genoma de ADN monocatenario circular, encapsulado dentro de partículas isométricas; los cuales se diferencian mediante el vector, el rango de hospedantes y la organización del genoma (Varsani et al., 2017).
Los begomovirus, transmitidos por moscas blancas, tienen genomas con componentes simples o bipartitos (ADNs A y B) e infectan plantas dicotiledóneas. El ADN A codifica la proteína de la cubierta (AV1), así como las proteínas requeridas para la replicación (AC1), la regulación de genes (AC2) y la mejora de la replicación (AC3). El ADN B es esencial para la producción de síntomas de enfermedades, pero no influye en la replicación del ADN (RRosen et al., 2015). Los dos productos génicos (BV1 y BC1), codificados por este componente, están involucrados en la propagación del virus en toda la planta, la producción de síntomas y el rango de hospedantes (Ramesh et al., 2017).
En los últimos años, numerosos begomovirus transmitidos por mosca blanca han emergido como patógenos devastadores, particularmente en trópicos y subtrópicos, en donde causan enormes pérdidas en diversos cultivos de importancia económica (Al-Musa et al., 2008). La enfermedad del rizado foliar de la calabaza se observó por primera vez en cultivos de calabaza (Cucurbita foetidissima), en California durante 1977 y 1978, así como en Búfalo y Arizona (Rosemeyer et al., 1986). La incidencia de SLCV se restringía a América Central y América del Norte; sin embargo, en 2003, se realizó el primer registro en Israel, donde causó epidemias severas con incidencia cerca de 100% (Antignus et al., 2003); posteriormente, Idris et al. (2006) informaron que SLCV-EG causó síntomas severos en cultivos de calabaza (Cucurbita pepo) en Egipto.
Asimismo, en el valle del Jordán se observaron síntomas parecidos a los provocados por geminivirus en plantas de C. pepo. (Al-Musa et al., 2008). Recientemente, el SLCV-PAL se reportó en Palestina, por Ali-Shtayeh et al. (2014), causando daños en plantas de calabaza (C. pepo), sandía (Citrullus lanatus) y pepino (Cucumis sativus). Las actividades de monitoreo y vigilancia son factores clave para el manejo de begomovirus, porque a medida que se identifican las áreas recién afectadas, se facilita la focalización de las medidas de control; asimismo, sirven para determinar los patrones de propagación de enfermedades y predecir las áreas que podrían afectarse en el futuro (Szyniszewska et al., 2017).
Como en la mayoría de los insectos, Bemisia tabaci coloniza hojas y toda la planta, en todas las etapas del cultivo. Para determinar la agregación y comportamiento de las poblaciones de B. tabaci dentro de los campos de cultivo, es importante determinar la estructura espacial y temporal de las poblaciones de plagas y definir los planes de muestreo (Naranjo, 1996). Debido a la importancia de B. tabaci y la transmisión del SLCV como factores limitantes en la producción comercial de calabaza, es necesario comprender ampliamente la dinámica poblacional y la severidad del virus SLCV.
Esta investigación tuvo como objetivos: i) investigar la etiología de la enfermedad provocada por el virus de la hoja rizada de la calabaza; ii) conocer la dinámica de población del vector, comparar la efectividad de trampas amarillas pegajosas contra charolas amarillas y determinar el efecto del sitio de ubicación de las trampas, en el monitoreo de B. tabaci durante el ciclo de cultivo; y iii) estudiar la distribución espacio-temporal y severidad de virosis en calabaza.
Materiales y métodos
Localización
El estudio se realizó en el Campo Experimental del Colegio Superior Agropecuario del Estado de Guerrero (CSAEGro), en Cocula, Guerrero, México, localizado entre las coordenadas 18° 26’ 27.20’’ latitud norte y -99° 65’ 07.98’’ longitud oeste, a 635 msnm. El cultivo experimental de calabaza var. Grey Zucchini se estableció entre dos afluentes de agua, el Rio San Juan y el Canal de agua de riego Las Juntas.
Detección del Virus de la hoja rizada de la calabaza y análisis filogenético
De 15 hojas sintomáticas de calabaza, se extrajo ADN con el kit DNeasy Plant (QIAGEN®). Los oligonucleótidos degenerados prV324 (5-gccyatrtayagraagccmag-3’) y CoPR (5-gangsatghgtrcadgccatata-3’) se utilizaron para detectar begomovirus en general y SLCV en particular, estos oligonucleótidos se unen al ADN de begomovirus y amplifican fragmentos de 570 pb (Wyatt y Brown, 1996; Yongping et al., 2008). Las reacciones de PCR se realizaron siguiendo un programa con una temperatura inicial de 94 °C durante 4 min, seguido por 35 ciclos de 94 °C 60 s, 50 °C 45 s y 72 °C 45 s; con una temperatura de extensión final de 72 °C por 6 min.
Para la amplificación del ADN se utilizó un termociclador Thermo™ (Thermo Scientific, Wilmington, DE) y la visualización de los productos amplificados se efectuó mediante electroforesis en geles de agarosa al 1% a 62 volts por 5 min, seguido de 100 volts por 40 min, y se observaron en un transiluminador de luz UVMR (Labnet, Edison, NJ). Se secuenciaron dos muestras representativas de los productos de PCR, y las secuencias obtenidas se compararon con la base de datos del Banco de Genes (GenBank) del Centro Nacional para la Información Biotecnológica (NCBI) (http://www.ncbi.nlm.nih.gov/).
Las secuencias consenso se editaron y ensamblaron con la opción CAP (Contig Assembly Program) del Sofware BioEdit 7.2.5 (Tom Hall Ibis Biosciences) (Hall, 2004). En el análisis evolutivo, todas las secuencias consenso se alinearon con el programa ClustalW (Thompson et al., 1994) incluido en el software MEGA 7 (Kumar et al., 2016). Las reconstrucciones filogenéticas de los datos se realizaron con el método de máxima parsimonia, utilizando el algoritmo Subtree-Pruning-Regrafting, opción de búsqueda (nivel=1) con el árbol inicial por adición al azar (10 repeticiones) y los espacios faltantes se consideraron como deleciones completas. Para calcular los valores de confianza de los clados del árbol, se realizó una prueba de bootstrap con 1 000 repeticiones (Felsenstein, 1985). La secuencia obtenida se depositó en la base de datos del GenBank del NCBI.
Patogenicidad del virus SLCV
La prueba de transmisión de SLCV, por mosca blanca (B. tabaci), se realizó en calabaza (C. pepo) var. Grey Zucchini durante febrero-marzo de 2015. Esta se efectuó en jaulas elaboradas con dos vasos de poliestireno expandido de 1 L de capacidad, con ventanas cubiertas con tela de organza.
El 15 de marzo se colectaron adultos de B. tabaci utilizando un succionador bucal, en un cultivo de calabaza con síndrome de virosis establecido en el campo experimental del Colegio Superior Agropecuario del Estado de Guerrero. Se colocaron 30 insectos por jaula, las cuales contenían una planta de calabaza. Para ello se incluyeron cinco repeticiones y dos testigos. Se inspeccionaron durante 21 días para detectar la aparición de síntomas de virosis. De las hojas infectadas, obtenidas de las jaulas, se seleccionó una y se extrajo ADN y mediante PCR se detectó al virus usando los oligonucleótidos degenerados prV324/CoPR.
Fluctuación poblacional de B. tabaci y análisis espacio-temporal de la severidad de SLCV
En febrero de 2015, se sembró calabaza var. Grey Zucchini en un lote de 2 880 m2, en donde se realizó un censo en 20 cuadrantes con 10 surcos y 20 plantas por surco. Se distribuyeron trampas en los cuatro puntos cardinales y en el centro del lote mediante un diseño experimental de bloques completos al azar con dos repeticiones.
Los tipos de trampas fueron: a) trampa amarilla pegajosa de 18 × 24 cm colocada sobre un soporte metálico de 1 m de altura y 1 cm de diámetro; y b) trampa de charola amarilla de 17 y 12 cm de diámetros superior e inferior y 10 cm de profundidad con capacidad de almacenar 1 L de agua. Las trampas se inspeccionaron en 12 ocasiones, cada tres y cuatro días, excepto en la última evaluación donde el intervalo fue de 10 días. Se contabilizó el número de adultos de moscas blancas en ellas.
Los datos de estas variables se analizaron con el programa estadístico SAS 9.4. La severidad de virosis se calculó con la escala de Van Der Plank (1963) y se realizaron cinco evaluaciones cada ocho días. Para determinar el efecto que genera este problema fitopatológico durante todo el ciclo de cultivo de calabaza y comparar la epidemia de la virosis, se calculó el área bajo la curva del progreso de la enfermedad (ABCPE) utilizando los datos del porcentaje de severidad (Campbell y Madden, 1990). El análisis de los datos incluyó mapas de la distribución espacial, como superficies de respuesta y curvas de contornos (isolíneas) obtenidos mediante el método de interpolación kriging, usando el programa estadístico SAS 9.4.
Resultados y discusión
Detección del SLCV y análisis filogenético
Se observaron síntomas severos de enrollamiento de hoja de calabaza en el sitio experimental. Los análisis de PCR y secuenciación revelaron que las hojas con síntomas de virosis obtenidas en el Valle de Cocula, estaban infectadas con SLCV. La secuencia del genoma del virus obtenida en el presente trabajo fue depositada en el GenBank del NCBI (accesión KX620945.1 DAAV-1).
El-Dougdoug et al. (2009) identificaron al SLCV en C. pepo var. Eskandrani, utilizando los mismos oligonucleótidos que en la presente investigación; reportaron que los ADN amplificados tuvieron una talla de 480 pb. El análisis filogenético mostró que SLCV encontrado en Guerrero, se relaciona estrechamente con las accesiones de SLCV encontradas en El Cairo (DQ285019) y El Valle Imperial de California (USA) (DQ285016), con valor de confiabilidad del bootstrap de 96%. Además, las accesiones de origen americano y de Medio Oriente, se diferenciaron del grupo de accesiones asiáticas (AM260206, EU47910 y EFQ99774) (74%) (Figura 1).
Patogenicidad de SLCV
Los resultados de esta prueba indicaron que el SLCV transmitido por mosca blanca en calabaza es patogénico. Los síntomas se manifestaron a los 8 días después de la introducción de mosca blanca en las jaulas. La infección por SLCV causa el enrollamiento de hojas, retraso del crecimiento, epinastia, clorosis intervenal y moteado de hojas (Figura 2). Estos resultados coinciden con lo reportado por Idris et al. (2006), quienes estudiaron al virus SLCV en cucurbitáceas, en Jordania y Egipto y encontraron que la infección afectó el tamaño de las hojas y redujo 40% el crecimiento de las plantas.

Figura 2 Prueba de patogenicidad de SLCV en plantas de calabaza var. Grey Zucchini. Hoja sana (izquierda) y hojas infectadas con el virus de la hoja rizada de la calabaza con distinto grado de severidad (derecha).
Asimismo, Sobh et al. (2012) reportaron que la infección por SLCV provocó síntomas severos de enrollamiento de hojas de calabaza (Cucurbita sp.) variedad Camelia F1, a las dos semanas después de la inoculación; es decir, se presentaron en el doble de tiempo en comparación con los resultados del presente ensayo. De igual modo, concuerdan con Taha et al. (2016), que confirmaron que el virus SLCV se transmite por mosca blanca e induce retraso severo del crecimiento, enchinamiento de hojas y causa pérdidas graves en la producción de cucurbitáceas. Además, se determinó que el producto amplificado del SLCV, obtenido de hojas infectadas de calabaza del experimento, presentaba un tamaño de 464 pb. La secuencia se depositó en el GenBank del NCBI (accesión KX620948.1 DAAV-2).
Fluctuación poblacional de B. tabaco
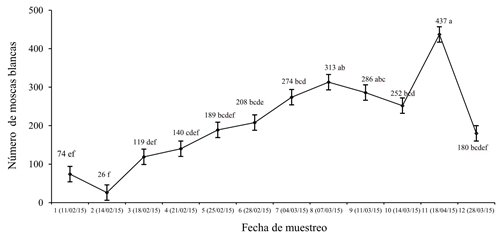
El número de adultos de mosca blanca presentó diferencias significativas en la mayoría de los muestreos, por efecto del tipo de trampa. Se encontró que, en todas las fechas de muestreo, la trampa pegajosa fue más efectiva que la de charola con agua, para capturar estos insectos, cuyos promedios fluctuaron de 7.4 (muestreo 2) a 379 (muestreo 11).
El análisis del acumulado de todos los muestreos indicó que en la trampa pegajosa se capturaron 2 082 adultos (datos no mostrados), en comparación con la trampa tipo charola (416 especímenes). La ubicación de la trampa sólo influyó significativamente en la cantidad de insectos capturados en los muestreos 1, 3 y 6. En los primeros muestreos (1 y 3), los promedios indican que las mayores poblaciones de moscas se registraron en el sitio Oeste; sin embargo, en las evaluaciones finales, la mayor densidad de insectos se presentó en las trampas del este y norte.
La cantidad acumulada más alta de B. tabaci se obtuvo en el lado Este, con 538 individuos, el valor menor fue de 443 y se encontró en el sitio Sur (Cuadro 1). Por otro lado, se presentaron diferencias significativas entre las fechas de muestreo (Figura 3), ya que las poblaciones variaron en un rango de 26 (fecha 2) a 437 insectos (fecha 11). Los programas de manejo de plagas se deben basar en el conocimiento preciso de los principales factores responsables de los cambios en la dinámica de la población insectil objetivo.
Cuadro 1 Comparación de medias del número de moscas blancas en el tipo de trampa, la fecha de muestreo y la ubicación cardinal.
Muestreo/fecha |
Número de adultos de mosca blanca |
DSH |
Probabilidad |
||
Charola amarilla con agua |
Trampa amarilla pegajosa |
||||
1 (11/02/15) |
0 b† |
7.4 a |
1.44 |
<0.0001 |
|
2 (14/02/15) |
6 a |
22 a |
2.88 |
0.2453 |
|
3 (18/02/15) |
42 a |
66 a |
25 |
0.2825 |
|
4 (21/02/15) |
44 b |
96 a |
31 |
0.0003 |
|
5 (25/02/15) |
43 b |
146 a |
5.97 |
0.0032 |
|
6 (28/02/15) |
52 b |
156 a |
4.11 |
0.0002 |
|
7 (04/03/15) |
60 b |
214 b |
4.03 |
<0.0001 |
|
8 (07/03/15) |
15 b |
298 a |
6.28 |
<0.0001 |
|
9 (11/03/15) |
62 b |
224 a |
9.56 |
0.0036 |
|
10 (14/03/15) |
16 b |
236 a |
8.95 |
0.0003 |
|
11 (18/03/15) |
58 b |
379 a |
7.45 |
<0.0001 |
|
12 (28/02/15) |
12 b |
168 a |
9.99 |
0.006 |
|
Localización |
Medias de los 12 muestreos |
||||
Norte |
497 a†† |
||||
Sur |
443 a |
||||
Este |
538 a |
||||
Oeste |
506 a |
||||
Centro |
514 a |
||||
†, ††= valores con letras iguales en la misma hilera (columna) no son estadísticamente diferentes (Tukey, α= 0.05).
Los parámetros del ciclo biológico estimados en diferentes condiciones bióticas y abióticas proporcionan las herramientas básicas para comprender los cambios y comportamiento de las especies de plagas. La especie B. tabaci es un organismo poiquilotermo, es decir, la temperatura influye en el ciclo biológico; por lo cual es importante considerar este factor para explicar la ecología de la población. Al respecto, Drost et al. (1998) reportaron que, además de la temperatura, las plantas hospederas y los biotipos influyen en la biología de B. tabaci.
Los resultados obtenidos confirman lo que reportaron Curnutte et al. (2014), quienes mencionan que la oviposición, la supervivencia de las ninfas y la reproducción de B. tabaci; fueron afectadas significativamente por la temperatura, ya que la capacidad reproductiva total disminuyó 36.4% a 33 °C, también, notaron que 28 °C fue la temperatura favorable para el desarrollo de la mosca blanca; sin embargo, determinaron que la temperatura óptima para la reproducción de B. tabaci fluctúa de 28 a 33 °C.
En este estudio, se encontró que durante los muestreos se incrementó la temperatura media; las cuales en combinación con la fenología del cultivo favorecieron el aumento de la tasa reproductiva de B. tabaci. Se ha demostrado que las temperaturas de 30 a 32 °C favorecieron el desarrollo de B. tabaci (Bonato et al., 2007; Curnutte et al., 2014). Al respecto, Quintela et al. (2016) encontraron que la población máxima del biotipo B de B. tabaci en maíz (Zea mays), coincidió con temperaturas altas en Brasil.
Estos hallazgos son semejantes a lo obtenido en el presente estudio, donde la población de la plaga aumentó con relación al incremento de la temperatura. Por el contrario, Bonato et al. (2007) reportaron que la temperatura de 32.5 °C fue la óptima para el desarrollo de ninfas de B. tabaci (biotipo Q); además, determinaron que la fecundidad total (huevos por hembra) varió de 105.3 (21 °C) a 41 (35 °C) y que la longevidad disminuyó conforme aumentó la temperatura. De igual manera, argumentaron que la asociación entre la temperatura y los parámetros del ciclo biológico son útiles para predecir el efecto de la temperatura sobre la dinámica de la población.
Análisis espacio-temporal de la severidad de SLCV
El promedio del porcentaje de severidad (PS) registrada; a través, de las fechas de evaluación fluctuó entre 5.14 y 73.28. Se determinó que, a partir de la evaluación 5, el promedio de PS se mantuvo estable, en tanto que la temperatura registró una tendencia creciente, lo cual se relacionó con la severidad del SLCV (Figura 4).
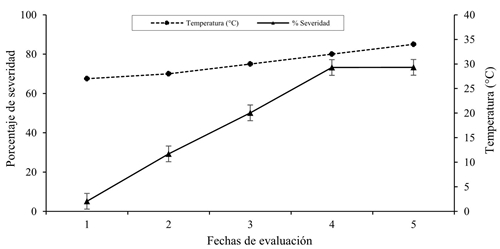
Figura 4 Relación de la temperatura promedio y la severidad del SLCV en plantas de calabaza var. Gray Zucchini, en cinco evaluaciones en Cocula, Guerrero.
La relación entre la severidad y la temperatura observada en este trabajo coincide con lo reportado por Ali et al. (2014) quienes reportaron que las temperaturas entre 37.16 y 37.78 °C propiciaron el desarrollo de la enfermedad; no obstante, la temperatura promedio mínima de 27.43 °C fue favorable para la incidencia de geminivirus en algodón y mostró efecto significativo durante dos ciclos consecutivos de cultivo. El análisis combinado, a través de las fechas de evaluación indicó que los cuadrantes 7 a 10 y 16 a 20 tuvieron un mayor PS (47.88 a 54.87%).
Se encontró que el ABCPE registró diferencias significativas (p< 0.0001) entre cuadrantes y surcos; la mayor incidencia de enfermedad se presentó entre los cuadrantes 7 a 10 y 16 a 20, con valores de 1431.72 a 1674.41; asimismo, se observó que la severidad en los cuadrantes 1 a 6 y 11 a 15 fue inferior a 50%, mientras que los cuadrantes 17 y 19 presentaron la mayor severidad de virosis en el cultivo de calabaza. El PS y el ABCPE fueron menores en los cuadrantes 2 al 5, con valores de 39.90 a 40.23 % y de 1049.78 a 1134.66, respectivamente, lo que indica que las epidemias inducidas por SLCV resultaron de alta intensidad, monitoreada a través de cambios en la severidad de la virosis (infección activa y progresiva) (Figura 5).
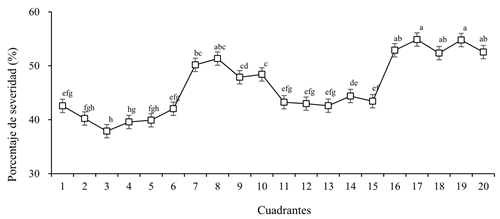
Figura 5 Porcentaje de severidad del SLCV por cuadrante en plantas de calabaza var. Grey Zucchini, en diferentes evaluaciones en Cocula, Guerrero.
Se observó un pronunciado gradiente del PS de SLCV en los cuadrantes con dirección al norte y noreste del área de estudio, comparativamente con las partes central y sureste que fueron poco afectadas (Figura 6). En la gráfica de contornos, las áreas claras indican una menor intensidad de la severidad, mientras que las áreas oscuras señalan mayor severidad de la virosis. Se percibió un aparente efecto de orilla atribuible a la fuente de inóculo primario, quizá por malezas perennes de la rivera del Río San Juan; pero no se detectó distribución uniforme de la enfermedad en el cultivo.
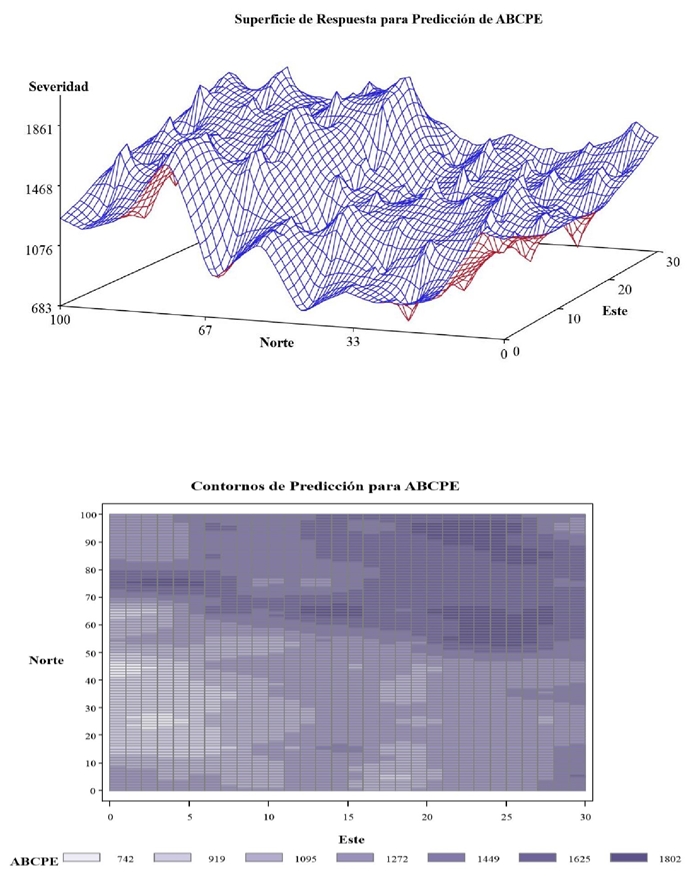
Figura 6 Mapa de superficie de respuesta y plano de curvas de contorno o isolíneas, de la dispersión y frecuencia de la distribución de severidad del SLCV en calabaza var. Grey Zucchini.
El patrón de distribución del SLCV en la zona de estudio, reveló una fuerte asociación espacial entre la severidad de la virosis y la incidencia de B. tabaci, ya que la primera aumentó en la parte occidental durante el ciclo de cultivo. Resultados similares reportaron una estrecha asociación espacial entre las variables incidencia y severidad del virus en varios ciclos, las cuales tendieron a incrementarse hacia una parte localizada y específica del área de estudio, durante el análisis espacial y cambio temporal en la pandemia de un geminivirus en yuca en el noroeste de Tanzania (Szyniszewska et al., 2017).
En el presente estudio la distribución espacial de la incidencia y severidad del SLCV, proporcionó información para explicar el arribo y distribución de las poblaciones de B. tabaci como vector del virus, procedentes de malezas presentes en áreas anexas al Río San Juan, donde la humedad es permanente y favorece la incidencia permanente de arvenses que funcionan como reservorios de B. tabaci.
Estas observaciones han sido respaldadas por el reporte de Mubin et al. (2009), quienes argumentan que las malezas actúan como reservorios de begomovirus y son responsables de la aparición de las virosis al inicio del ciclo de cultivo, convirtiéndose en severas epidemias de las plantas cultivadas; mientras que, en temporada de estiaje, las malezas desempeñan el papel crucial en la propagación de diversos virus, actúan en la redistribución del inóculo primario y sirven de refugio de insectos vectores, que forman parte importante en la epidemiología de los begomovirus (Zaidi y Mansoor, 2017).
En otro estudio, se mencionó que el patrón de variación más significativo en la incidencia de mosca blanca, se registró entre cuadrantes durante la misma temporada, además la severidad de un begomovirus, es asociada a condiciones ambientales, ya que durante uno de los ciclos de experimentación, se presentó un clima fresco y la severidad de virosis fue menor, en comparación con el ciclo que tuvo un clima cálido y seco y por lo tanto, la severidad se incrementó sobre la distribución espacial y temporal del begomovirus en yuca (Szyniszewska et al., 2017). Los hallazgos obtenidos en la presente investigación corroboran los resultados publicados por Legg (2010), quien confirmó que los cambios de incidencia de mosca blanca y los patrones de diseminación de virosis, están estrechamente correlacionados.
Conclusiones
El análisis de PCR, secuenciación y filogenia, confirmaron la incidencia del Virus de la hoja rizada de la calabaza (SLCV) en esta misma especie. Bemisia tabaci transmite a SLCV, el cual reduce significativamente el crecimiento de la planta. La trampa amarilla pegajosa fue más eficiente que la charola amarilla. Las fechas de muestreo fueron útiles para detectar la fluctuación temporal poblacional de B. tabaci. La incidencia de B. tabaci y la severidad de SLCV se presentaron en todas las etapas fenológicas del cultivo con variación espacial en el lote experimental y se relacionaron con el nivel de temperatura.











 texto en
texto en