Introducción
La costa este de la península de Yucatán alberga una gran variedad de ecosistemas terrestres y acuáticos, entre los que se encuentran selvas, manglares, sistemas lagunares, pastizales marinos y arrecifes de coral. La gran diversidad biológica de la región la hicieron acreedora al nombramiento de Reserva de la Biosfera Caribe Mexicano en diciembre de 2016. El área de la reserva engloba 17 áreas naturales protegidas decretadas con anterioridad a la creación de la reserva y comprende una superficie total de 5,754,055 h, de las cuales 99.5% corresponde a la porción marina (Conanp, 2018).
El origen calcáreo de la península de Yucatán induce una rápida infiltración de las aguas en el suelo provocando poco drenaje superficial (Bauer-Gottwein et al., 2011). La plataforma continental en el Caribe mexicano es estrecha en su mayor parte (< 5 km), lo que puede resultar en una fuerte influencia oceánica. Casi toda la costa está bordeada por el Sistema Arrecifal Mesoamericano, el cual tiene una longitud aproximada de 1,000 km, de los cuales 400 se encuentran frente a México (Conanp, 2018; Rioja-Nieto y Álvarez-Filip, 2019). En consecuencia, el litoral está caracterizado por la presencia de lagunas arrecifales de extensión variable dependiendo de los sitios. Hacia el sur, frente a la localidad de Mahahual, la barrera arrecifal se aproxima hasta 100 m de distancia de la costa y forma una laguna arrecifal estrecha (Daltabuit-Godás et al., 2007).
Dentro del zooplancton, los moluscos holoplanctónicos son un grupo marino particularmente interesante debido a los distintos niveles tróficos que ocupan en el ecosistema pelágico y las adaptaciones morfológicas que presentan para sobrevivir en el plancton (Lalli y Gilmer, 1989). A pesar de ser poco abundantes, estos animales revisten una gran importancia como indicadores de masas de agua y acidificación de los océanos, vectores de contaminantes y formadores de depósitos de calcita y aragonita en los fondos marinos (Gazeau et al., 2013; Sánchez-Beristain et al., 2016; van der Spoel, 1996a; van der Spoel y Boltovskoy, 1981). En Mahahual se han llevado a cabo varias investigaciones que refieren el conocimiento de algunos grupos del zooplancton, como copépodos, larvas de peces y medusas (Suárez-Morales y Gasca, 2000; Suárez-Morales et al., 1999; Vásquez-Yeomans et al., 1998). En este estudio se da a conocer, por primera vez, la fauna de moluscos holoplanctónicos recolectados en aguas neríticas frente a Mahahual, proporcionando una estimación de la riqueza de especies. Se hipotetiza una homogeneidad en la distribución de la comunidad de moluscos holoplanctónicos debido a lo estrecho de la plataforma continental, la escasa escorrentía de aguas continentales y la fuerte influencia oceánica.
Materiales y métodos
El área de estudio se localiza entre las coordenadas geográficas 18°40’48” - 18°50’24” N, 86°36’ - 87°43’12” O, frente a Mahahual, Caribe mexicano (fig.1). La laguna arrecifal es somera y el sustrato es arenoso cubierto por pastos marinos. La época de lluvias va de junio a octubre y alcanza el nivel máximo en septiembre (104.2 mm mes-1), la época de secas es durante la primavera y abril es el mes más seco (12.8 mm mes-1) (Conanp, 2018). Los vientos dominantes provienen del norte en invierno, en tanto que el resto del año, proceden del sureste (Suárez-Morales y Rivera-Arriaga, 1998). La circulación costera en el Caribe mexicano fluye hacia el norte paralela a la costa, aunque en la porción interna de la plataforma es común detectar contracorrientes y giros influidos por la topografía de la región que inducen un transporte de agua hacia la línea de costa (Merino-Ibarra, 1986). Dentro de las lagunas arrecifales, la circulación está regida por la fuerza del oleaje y los tiempos de residencia del agua al interior de las lagunas son variables dependiendo de las condiciones locales (Mariño-Tapia et al., 2011).
El muestreo de zooplancton se llevó a cabo del 12 al 14 de abril de 2008 y se realizó mediante arrastres superficiales utilizando 2 redes cónicas de 50 cm de diámetro y de 333 y 505 µm de luz de malla, a bordo de una lancha con motor fuera de borda. A cada red se le colocó un flujómetro para estimar el volumen de agua filtrada. Se recolectaron 66 muestras distribuidas en 33 estaciones (fig. 1). Las muestras obtenidas se fijaron con una solución de formaldehído al 4% neutralizado con borato de sodio y agua de mar. En cada estación se tomó registro de la profundidad con una ecosonda manual modelo SM-5 con una resolución de ± 1 m, se midió la temperatura y salinidad del agua mediante un salinómetro-conductímetro YSI 85, con precisiones de ± 0.01°C en temperatura y ± 0.01 en salinidad.
En el laboratorio, se estimó la biomasa de zooplancton en peso húmedo (g 100 m-3) utilizando las muestras recolectadas con la malla de 333 µm. Cada muestra se sometió a un sistema de vacío a fin de remover el líquido intersticial entre los organismos. Este sistema consiste de una bomba de vacío, un matraz Kitasato y un embudo Buchner con una malla de 250 µm, donde se vació la muestra. El proceso terminó cuando el intervalo entre gota y gota del líquido extraído fue de 15 segundos; el peso húmedo se obtuvo pesando la muestra en una balanza analítica (Zavala-García y Flores-Coto, 1989). Los moluscos holoplanctónicos se extrajeron de ambas redes y se identificaron según los criterios de literatura especializada (Lalli y Gilmer, 1989; Richter y Seapy, 1999; van der Spoel y Boltovskoy, 1981). Los conteos de cada taxón se estandarizaron a 100 m3 de agua filtrada (ind 100 m-3) y con ellos se construyó una matriz de densidad de taxones y estaciones de muestreo. Dado que en cada estación de muestreo existían 2 redes de captura, en la matriz de datos se colocó el máximo valor de densidad obtenido para cada taxón. Con el fin de determinar si existieron diferencias en la distribución de los moluscos en las plataformas interna (< 2 km de distancia a la costa) y externa (> 2 km) se aplicó una prueba Anosim (análisis de similitud), bajo la hipótesis nula de que no hay diferencias en composición y abundancia entre las plataformas interna y externa. La prueba calcula un estadístico R global, el cual es comparado con los obtenidos de aleatorizar n veces (9,999 en este caso) la matriz de datos. Si el estadístico R global cae en el 5% (nivel de significancia elegido) de los valores en el extremo de la distribución, se rechaza la hipótesis nula. El programa utilizado fue PRIMER ver. 7 (Clarke et al., 2014).
Resultados
La temperatura registrada en aguas superficiales frente a Mahahual en abril de 2008 fue elevada y fluctuó entre 25.5 y 30.6 °C. La salinidad fue más homogénea y varió entre 36.7 y 37 ups.
Los valores de biomasa de zooplancton fluctuaron entre 0.02 y 7.51 g 100 m-3 (X̄ = 1.2 g 100 m-3), con los mayores valores sobre la plataforma interna (< 2 km de distancia a la costa) (fig. 2). Entre los moluscos holoplanctónicos se identificaron 8 especies, que en orden decreciente de abundancia fueron: Creseis acicula (Rang, 1828), Heliconoides inflatus (d’Orbigny, 1835), Atlanta lesueurii Gray, 1850, Diacavolinia longirostris (Blainville, 1821), Limacina trochiformis (d’Orbigny, 1835), Limacina lesueurii (d’Orbigny, 1836), Firoloida desmarestia Lesueur, 1817 y Limacina bulimoides (d’Orbigny, 1835) entre las que destacó la alta abundancia de las 2 primeras (tabla 1). Se registraron además juveniles del género Cavolinia Abildgaard, 1791, los cuales se distinguen de los adultos porque aún no han desarrollado las espinas laterales y la curvatura de la espina caudal es menos pronunciada (van der Spoel, 1981). Estos especímenes se encuentran en el Laboratorio de Ecología de Sistemas Pelágicos del Instituto de Ciencias del Mar y Limnología.
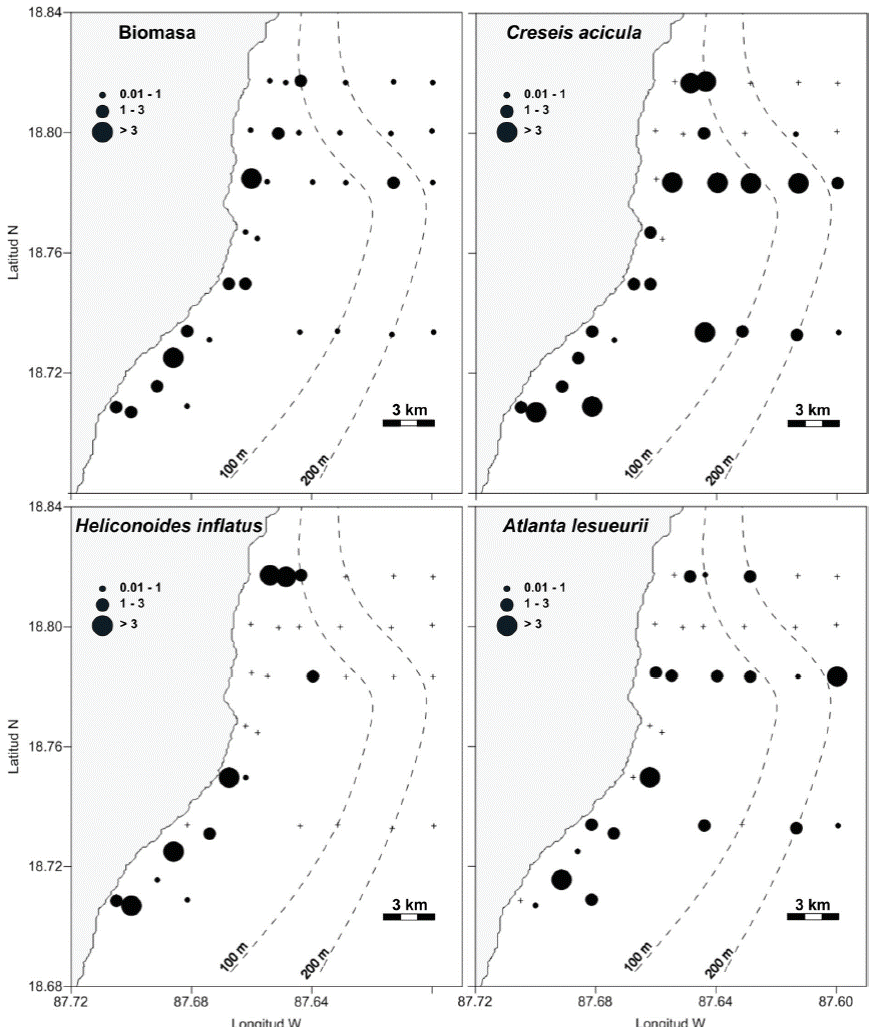
Figura 2 Distribución de biomasa de zooplancton (g 100 m-3) y de las 3 especies de moluscos holoplanctónicos más abundantes en Mahahual (ind 100 m-3) en abril de 2008.
Tabla 1 Densidad promedio (ind 100 m-3) de moluscos holoplanctónicos recolectados sobre la plataforma continental frente a Mahahual, Caribe mexicano, en abril de 2008.
| Especie | Total | % | Plataforma interna | Plataforma externa |
|---|---|---|---|---|
| Creseis acicula | 3.30 ± 5.81 | 40.0 | 3.99 ± 7.14 | 2.27 ± 2.83 |
| Heliconoides inflatus | 1.75 ± 4.21 | 21.2 | 2.84 ± 5.19 | 0.10 ± 0.38 |
| Atlanta lesueurii | 1.15 ± 1.58 | 13.9 | 1.14 ± 1.75 | 1.17 ± 1.34 |
| Diacavolinia longirostris | 0.83 ± 2.74 | 10.1 | 1.24 ± 3.44 | 0.22 ± 0.83 |
| Limacina trochiformis | 0.40 ± 1.29 | 4.8 | 0.62 ± 1.63 | 0.06 ± 0.23 |
| Limacina lesueurii | 0.29 ± 0.57 | 3.5 | 0.37 ± 0.65 | 0.16 ± 0.42 |
| Cavolinia sp. | 0.27 ± 0.42 | 3.3 | 0.25 ± 0.42 | 0.30 ± 0.42 |
| Firoloida desmarestia | 0.24 ± 0.54 | 2.9 | 0.17 ± 0.37 | 0.34 ± 0.72 |
| Limacina bulimoides | 0.03 ± 0.16 | 0.3 | 0.05 ± 0.21 | - |
Creseis acicula fue la especie dominante, casi 2 veces más abundante en la plataforma interna que en la externa; H. inflatus tuvo una fuerte afinidad costera, pues su abundancia fue 28 veces superior en la plataforma interna; la tercera especie en abundancia, A. lesueurii, registró densidades similares en las plataformas interna y externa. El resto de las especies tuvieron una densidad promedio menor a 1 ind 100 m-3 y se observaron tanto en plataforma interna como externa, con excepción de L. bulimoides de la cual sólo se recolectó un individuo (tabla 1).
Los resultados del Anosim empleado para verificar si existieron diferencias entre las plataformas interna (< 2 km de distancia a la costa) y externa (> 2 km) arrojaron un valor de R global = 0.02, el cual, de acuerdo a la distribución nula de los valores aleatorizados, resultó no ser significativo, lo que indica una homogeneidad en la distribución de las especies en ambas zonas.
Discusión
Los registros de temperatura (25.5 a 30.6 °C) y salinidad (36.7 a 37 ups) en aguas superficiales frente a Mahahual durante abril están dentro de los intervalos de variación registrados por otros estudios (Conanp, 2018; Suárez-Morales y Rivera-Arriaga, 1998). Los valores y homogeneidad en la salinidad denotan la falta de escorrentías de agua dulce provenientes del continente.
El Caribe mexicano se caracteriza por ser un ambiente oligotrófico (Strömberg et al., 2009). Esta baja productividad se ve reflejada en las estimaciones de biomasa de este estudio (0.02 a 7.51 g 100 m-3). Estos valores tienen el mismo orden de magnitud a los registrados en las regiones norte y centro del Caribe mexicano (Álvarez-Cadena et al., 2007; Castellanos-Osorio y Suárez-Morales, 1997; Sanvicente-Añorve et al., 2003). La mayor concentración de biomasa observada en la zona interna de la plataforma (fig. 2) puede estar relacionada con las altas densidades de pastos marinos en donde los organismos del zooplancton encuentran refugio (Suárez-Morales y Rivera-Arriaga, 1998). Comparativamente, el Caribe mexicano es menos productivo que el sur del golfo de México. Este último tiene una plataforma continental ancha y exhibe grandes aportes de aguas epicontinentales que llevan nutrientes hacia las aguas marinas costeras y generan una alta productividad primaria (Flores-Coto et al., 1988). Sanvicente-Añorve (1990) registró valores de biomasa en diferentes épocas que oscilaron entre 10 y 100 g 100 m-3, frente al sistema fluvial Grijalva-Usumacinta.
Este es el primer estudio que da a conocer la riqueza de especies de moluscos holoplanctónicos en Mahahual. Las especies aquí registradas (tabla 1) se distribuyen en aguas tropicales y subtropicales del mundo (Lalli y Gilmer, 1989; van der Spoel y Boltovskoy, 1981; van der Spoel y Dadon, 1999). Las 2 especies dominantes fueron C. acicula y H. inflatus, con 61.2% de la abundancia total (tabla 1). La primera tiene afinidad por aguas neríticas, donde suele ser la especie dominante (van der Spoel y Boltovskoy, 1981). Estudios previos realizados en el Caribe mexicano y sur del golfo de México (Lemus-Santana et al., 2014a; Suárez- Morales y Gasca, 1998) señalan a esta especie como la más abundante, lo que concuerda con estos registros. Heliconoides inflatus, la segunda en abundancia, es una especie común en el Mar Caribe occidental y zonas centro y sur del golfo de México (Suárez, 1994), tiene una fuerte afinidad nerítica y en ocasiones es muy abundante en áreas costeras (van der Spoel, 1996a), lo que es coincidente con este estudio (fig. 2).
Atlanta lesueurii y D. longirostris aportaron 24% de la abundancia total (tabla 1). En el golfo de México y entre los heterópodos, A. lesueurii suele ser la especie más abundante (Lemus-Santana et al., 2014b), al igual que en este estudio. van der Spoel (1996b) indica que la mayoría de los heterópodos habita aguas oceánicas, aunque algunas especies del género Atlanta pueden penetrar hacia la plataforma interna; específicamente, Seapy (1990) observó que A. lesueurii comúnmente se encuentra en aguas de profundidad mayor a 100 m. En el Pacífico oriental, Cruz (1983) consideró que la presencia de la especie en el golfo de Guayaquil es un indicio del desplazamiento de aguas oceánicas hacia el golfo. En este estudio, A. lesueurii fue registrada en las plataformas interna y externa, con una densidad ligeramente mayor en esta última (tabla 1). La presencia de esta especie en aguas cercanas a la costa es un indicio de la influencia oceánica. Diacavolinia longirostris se encuentra en aguas neríticas, pero preferentemente en las oceánicas (van der Spoel y Dadon, 1999). En un estudio sobre aguas neríticas del sur del golfo de México, Lemus-Santana et al. (2014a) encontraron a la especie más abundante en áreas productivas cercanas a la costa. En concordancia, en este estudio la especie registró mayor densidad en la plataforma interna (tabla 1), lo que hace suponer que la preferencia por aguas neríticas u oceánicas puede depender de los sitios de estudio.
De las especies restantes, se sabe que L. lesueurii, L. bulimoides y F. desmarestia tienen una distribución preferentemente oceánica (Lemus-Santana et al., 2015; Suárez, 1994; van der Spoel, 1996b; van der Spoel y Dadon, 1999). La escasa presencia de estas especies en la zona de estudio (tabla 1) indicaría su origen oceánico. Por otro lado, se ha observado que L. trochiformis se distribuye indistintamente en las zonas nerítica y oceánica (van der Spoel y Dadon, 1999); en este estudio fue más abundante en la plataforma interna (tabla 1).
Si bien los juveniles del género Cavolinia aquí encontrados no fueron identificados, se sabe que Cavolinia uncinata (d’Orbigny, 1835), Cavolinia inflexa (Lesueur, 1813) y Cavolinia gibbosa (d’Orbigny, 1835) tienen registros en el Caribe mexicano (Parra-Flores y Gasca, 2009; Suárez, 1994; Suárez-Morales y Gasca, 1998). van der Spoel y Dadon (1999) mencionan el carácter oceánico de estas especies. No se tiene evidencia precisa sobre los hábitos reproductivos de las especies mencionadas, pero Lalli y Gilmer (1989) mencionan que en zonas cálidas con pocas variaciones de temperatura, la reproducción de los cavolínidos suele ser continua durante el año. Cavolinia. uncinata, las más común entre las 3 especies, se ha registrado en diferentes épocas del año en el Caribe mexicano, con su mayor abundancia en agosto (Suárez-Morales y Gasca, 1998). Esto puede ser indicativo de una reproducción continua a lo largo del año, con una mayor actividad en verano.
Los resultados del Anosim mostraron que no hubo diferencias significativas en la distribución de las especies en las plataformas interna y externa. Este resultado, aunado a la escasa escorrentía superficial (Bauer-Gottwein et al., 2011) y a la presencia de especies de origen preferentemente oceánico (A. lesueurii, D. longirostris, L. lesueurii, L. bulimoides y F. desmarestia), son un indicio de la fuerte influencia de las aguas oceánicas sobre la fauna planctónica nerítica del Caribe mexicano.
La riqueza de especies es la medida de biodiversidad más frecuentemente utilizada para describir una comunidad y hacer comparaciones. Estudios previos realizados en aguas neríticas y oceánicas del Caribe mexicano, desde Contoy hasta Xcalac, registraron la presencia de 47 especies (Castellanos y Suárez-Morales, 2001; Gasca et al., 1994; Parra-Flores y Gasca, 2009; Suárez, 1994; Suárez-Morales y Gasca, 1998). Aunque el número de taxones aquí registrados pudiera parecer pequeño (9), hay que considerar 2 factores: el tamaño de la muestra y el área muestreada. El volumen de muestras aquí analizado, obtenido con redes manuales a bordo de lanchas con motor fuera de borda, es menor al volumen de muestras adquiridas con redes Bongo a bordo de embarcaciones mayores; por otro lado, una mayor cobertura de muestreo implicará una mayor diversidad de hábitats que albergarán un mayor número de especies. Finalmente, se considera que la información aquí proporcionada es de gran relevancia para el conocimiento de la biodiversidad y conservación de la biota pelágica en la Reserva de la Biosfera Caribe Mexicano.











 nueva página del texto (beta)
nueva página del texto (beta)



