Introducción
Los manantiales geotermales son aquellos cuya temperatura del agua se incrementa como consecuencia de la actividad geológica de la zona. Son ecosistemas peculiares en los que el factor limitante principal para la vida es la temperatura (Pantoja-Alor y Gómez-Caballero, 2000, 2004). Otras características como el pH o la salinidad pueden asociarse con esta para presentar situaciones aún más extremas. En manantiales geotermales con pH neutro y con salinidades moderadas podemos encontrar una amplia gama de manifestaciones de vida en un amplio intervalo de temperaturas. Los ambientes con temperaturas muy altas son escasos en la superficie de la Tierra y el gradiente térmico en todos ellos es muy amplio, de modo que la temperatura, a partir del punto donde emana el agua, decae rápidamente, por lo que los espacios colonizables con alta temperatura son reducidos (Margalef, 1983).
La temperatura es un factor ambiental muy importante que puede afectar considerablemente al desarrollo de los organismos, ya sea acelerando las reacciones metabólicas o haciendo que las proteínas, ácidos nucleicos y otros componentes celulares sufran daño y se inactiven irreversiblemente (Brock, 1978; Madigan, Martinko y Parker, 2001). En temperaturas entre los 20 y 30 °C se presenta la mayor diversidad de especies acuáticas y esta disminuye drásticamente después de los 40 °C. Arriba de los 60 °C solo se presentan organismos procariotas, y el único grupo que puede llevar a cabo la fotosíntesis oxigénica en estas condiciones son las Cyanophyceae (Lengeler, Drews y Schleger, 1999).
Los organismos que resisten las temperaturas más altas son bacterias y arqueas; las bacterias han sido encontradas vivas y funcionales en aguas termales de 90 a 91 °C en Yellowstone, Estados Unidos de América; de 97 a 98 °C en Islandia y de 99.5 a 100.8 °C en Nueva Zelanda (Margalef, 1983); mientras que se han encontrado arqueas en temperaturas hasta de 113 °C (Madigan et al., 2001). Mann y Schlichting (1967) encontraron crecimientos óptimos de especies de cianobacterias en el rango de 60 a 77 °C, pero además registraron 2 especies Phormidium bijahensis Copeland —actualmente Leptolyngbya bijahensis (Copeland) Anagnostidis— y Synechococcus elongatus var. amphigranulatus Copeland —sinónimo de Synechococcus bigranulatus Skuja— a 86.6 °C, que sería hasta ahora el mayor registro de temperatura para este grupo.
Los organismos eucariotas no resisten temperaturas muy altas y Brock (1978) considera que el límite máximo para estos organismos oscila alrededor de los 60 °C, siendo los hongos los que mayor temperatura toleran. Margalef (1983) menciona que el límite máximo para las algas eucariontes se considera alrededor de los 40 °C, aunque existen especies que superan esta temperatura. Tal es el caso de la rodofita, Cyanidium caldarium (Tilden) Geitler, que se presenta entre los 56 y 60 °C en condiciones ácidas (Brock, 1978; Tamsey y Brock, 1972). Brock (1978) considera que las diatomeas pueden presentarse hasta los 44 °C. Existen algunos registros de diatomeas a 48 °C y hasta los 70 °C, mientras que algunas especies de clorofitas de los géneros Oedogonium, Mougeotia, Spirogyra, Ulothrix, Closterium y Cosmarium se han registrado entre los 41 y 48 °C, lo cual contrasta con los límites reconocidos por Bilgrami, Munshi, Yadava y Bhowmick, (1985); Brock (1978); Mann y Schlichting, (1967).
En México existe un elevado número de zonas geotérmicas que están relacionadas con una gran actividad volcánica (Ferrusquía-Villafranca, 1998). Algunos de estos manantiales han sido estudiados por la importancia de los procesos geotérmicos y su posibilidad de empleo en la generación de electricidad. Sin embargo, el conocimiento de la biota que habita en estos ambientes es escaso. Específicamente de Michoacán, se han llevado a cabo estudios geotérmicos y geoquímicos en varias regiones, dentro de las cuales se encuentra el manantial Los Hervideros, localidad del presente estudio. Este manantial, cuando emerge a la superficie, forma una corriente que presenta un gradiente de temperatura muy marcado que se forma por la presencia de 2 sistemas acuáticos diferentes y que confluyen sus aguas. De uno de ellos emana agua fría, aproximadamente a 20 °C, y el otro es propiamente termal, en donde el agua brota a más de 90 °C (Tovar-Aguado y García-Estrada, 1991). Debido a las características ambientales propias del manantial Los Hervideros, en este trabajo se presenta un análisis de la diversidad taxonómica de las algas, tomando en cuenta el gradiente de temperatura, que nos permitió identificar y establecer intervalos de tolerancia a la temperatura para las especies observadas, para lo cual tomamos en cuenta la propuesta de Jjemba (2004), que clasifica a los microorganismos basándose en el intervalo de temperatura que pueden tolerar como: psicrófilos (-7 a 18 °C), mesófilos (9 a 48 °C), termófilos (39 a 73 °C) y extremófilos (65 a 110 °C).
Materiales y métodos
El manantial Los Hervideros se ubica al suroeste del poblado de Araró, Michoacán. Se localiza en los 19°53’N,100°48’O, a 1,879 m sobre el nivel del mar. El tipo de vegetación presente es bosque espinoso, y el clima es seco o estepario con régimen de lluvias en verano (BSw); cuenta con una precipitación promedio anual de 780.2 mm y una temperatura ambiental promedio anual de 18.6 °C (Inegi, 2009; fig. 1). El manantial está formado por agua termal a una temperatura de hasta 92 °C y un manto freático somero (1 m) de agua fría, aproximadamente a 20 °C, que se puede llegar a mezclar con el agua termal. Encima del nivel freático existe una capa arcillosa formada por depósitos lacustres que actúan como capa sello, lo que hace que el termalismo se manifieste solo en donde existe la rotura de la capa (Tovar-Aguado y García-Estrada, 1991), por tanto, el agua brota a la superficie en forma de pozos calientes con poco gasto —en un promedio de 10 a 20 l min-1— y temperatura de 92 a 22 °C, formando una corriente con un gradiente de temperatura muy marcado.
Este manantial es salino, los aniones principales son los cloruros y bicarbonatos, los cuales presentan los siguientes valores: Cl− = 1,290.2 ppm, HCO3 − = 158.5 ppm, SO4 − = 153.6 ppm y NO3 − = 0.2 ppm; mientras que los principales cationes son: Na+ = 756.5 ppm, K+ = 60.6 ppm, Ca+ = 32.6 ppm y Mg+ = 0.5 ppm (Ramírez-Domínguez, Verma, Nieva, Quijano y Moreno, 1988). Esta área de manantiales termales representa una importante actividad económica para los pobladores de las zonas aledañas, ya que el agua se utiliza con fines recreativos y terapéuticos en los balnearios.
Se llevaron a cabo 2 recolectas, en abril de 2004 y en enero de 2005. Se determinó el máximo de temperatura del agua midiéndola en los puntos de emanación termal. Se tomaron muestras de los crecimientos algales visibles de la localidad. Se recolectaron un total de 13 muestras. En cada uno de los puntos de muestreo se registró la temperatura, el pH y la conductividad específica con un medidor de conductividad marca Conductronic PC-18 (Puebla, México). La temperatura también se midió empleando un termómetro de mercurio (-10 a 110 °C). Las muestras se transportaron al laboratorio en frío (4 °C) para observar el material in vivo y observar características como coloración y movimiento de las algas. En el laboratorio las muestras fueron fijadas con formalina al 4%. La limpieza de diatomeas para su identificación se llevó a cabo con la técnica de oxidación ácida (St. Clair y Rushforth, 1976) y, posteriormente, las frústulas fueron montadas con resina Naphrax®. Para la observación de las muestras se utilizó un microscopio óptico Olympus BX51 (Tokio, Japón) y la toma de fotografías se hizo con una cámara digital Olympus DP12 (Tokio, Japón). La identificación de las especies se llevó a cabo con los siguientes esquemas taxonómicos: Germain (1981) y Krammer y Lange-Bertalot (1986, 1988, 1991) para Bacillariophyceae; Komárek (2013) y Komárek y Anagnostidis (1998, 2005) para Cyanophyceae, y Mrozinska (1985) para Chlorophyceae.
Resultados
El manantial estudiado presentó variaciones importantes en la temperatura del agua por el decaimiento al alejarse de la fuente y por la mezcla con agua fría. Se registraron temperaturas desde los 92 °C en los puntos de emanación del manantial y disminuyeron hasta los 22 °C. Se observó una variación significativa de la temperatura en menos de 1 m desde el inicio de la corriente. Debido a que la emanación de agua caliente se presenta en diferentes puntos, no se registró un gradiente lineal, sino más bien un mosaico de temperaturas. El pH del agua fue circumneutral a ligeramente alcalino (7.5-8) y con una elevada conductividad específica (3,400 a 4,430 μS cm−1), lo que concuerda con la dominancia de cloruros y carbonatos previamente registrados (Ramírez-Domínguez et al., 1988).
Se identificaron un total de 34 especies, de las cuales 21 (63%) pertenecen a la clase Bacillariophyceae, 12 (34%) a la clase Cyanophyceae y 1 (3%) a la clase Chlorophyceae (tabla 1). Cuatro de ellas representan nuevos registros para nuestro país: Chroococcus thermalis, Mastigocladus laminosus, S. bigranulatus y Luticola mutica. A continuación se presentan sus descripciones.
Tabla 1 Listado florístico y presencia en relación con la temperatura.
| Clase/Especie | Temperatura (°C) | Clas. a | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 22.2 | 30.4 | 35.5 | 47 | 54.7 | 58 | 61 | 70.8 | 73 | 76 | ||
| Cyanophyceae | |||||||||||
| Arthrospira sp. (fig. 2A) | x | x | x | x | x | T-E | |||||
| Chroococcus thermalis (Meneghini) Nägeli (fig. 2E) | x | M | |||||||||
| Chroococcus sp. (fig. 2F) | x | M | |||||||||
| Leptolyngbya sp. (fig. 2B) | x | x | x | x | x | x | x | T-E | |||
| Mastigocladus laminosus Frémy (fig. 2I) | x | T | |||||||||
| Nostoc sp. (fig. 2H) | x | x | M | ||||||||
| Phormidium sp. (fig. 2G) | x | M | |||||||||
| Pseudoanabaena thermalis Anagnostidis (fig. 2K) | x | x | x | x | x | x | x | T-E | |||
| Pseudoanabaena sp. (fig. 2J) | x | x | T | ||||||||
| Synechococcus bigranulatus Skuja (fig. 2C) | x | x | x | T-E | |||||||
| Synechococcus sp. (fig. 2L) | x | x | T | ||||||||
| Synechocystis sp. (fig. 2D) | x | x | x | x | x | x | x | x | T-E | ||
| Chlorophyceae | |||||||||||
| Oedogonium sp. (figs. 3A, B, C) | x | x | M | ||||||||
| Bacillariophyceae | |||||||||||
| Achnanthidium exiguum (Grunow) D. B. Czarnecki (fig. 3L) | x | x | x | M-T | |||||||
| Anomoeoneis costata (Kützing) Hustedt (fig. 3H) | x | x | M-T | ||||||||
| Caloneis silicula (Ehrenberg) Cleve (fig. 3I) | x | T | |||||||||
| Cocconeis placentula Ehrenberg (fig. 4A) | x | x | M-T | ||||||||
| Denticula thermalis Kützing (fig. 4B) | x | T | |||||||||
| Diploneis elliptica (Kützing) Cleve (fig. 3E) | x | x | M-T | ||||||||
| Epithemia turgida (Ehrenberg) Kützing (fig. 3J) | x | T | |||||||||
| Gomphonema gracile Ehrenberg (fig. 4C) | x | T | |||||||||
| Halamphora veneta (Kützing) Levkov (fig. 3D) | x | T | |||||||||
| Luticola mutica (Kützing) D. G. Mann (fig. 3F) | x | T | |||||||||
| Navicula cincta (Ehrenberg) Ralfs (fig. 4D) | x | x | x | M-T | |||||||
| Nitzschia amphibia Grunow (fig. 4G) | x | x | M-T | ||||||||
| Nitzschia aff. clausii Hantzsch (fig. 3G) | x | T | |||||||||
| Nitzschia sp. (fig. 4I) | x | T | |||||||||
| Pinnularia joculata (Manguin) K. Krammer (fig. 4K) | x | T | |||||||||
| Pinnularia viridis (Nitzsch) Ehrenberg (fig. 4J) | x | x | T | ||||||||
| Pinnularia sp. (fig. 3K) | x | T | |||||||||
| Rhopalodia gibberula (Ehrenberg) O. Müller (fig. 4L) | x | x | x | M-T | |||||||
| Tryblionella aff. calida (Grunow) D. G. Mann (fig. 4E) | x | T | |||||||||
| Tryblionella granulata (Grunow) D. G. Mann (fig. 4F) | x | T | |||||||||
M: mesófilo; T: termófilo; E: extremófilo.
a Fuente: clasificación de Jjemba (2004) por sus intervalos de tolerancia a la temperatura.
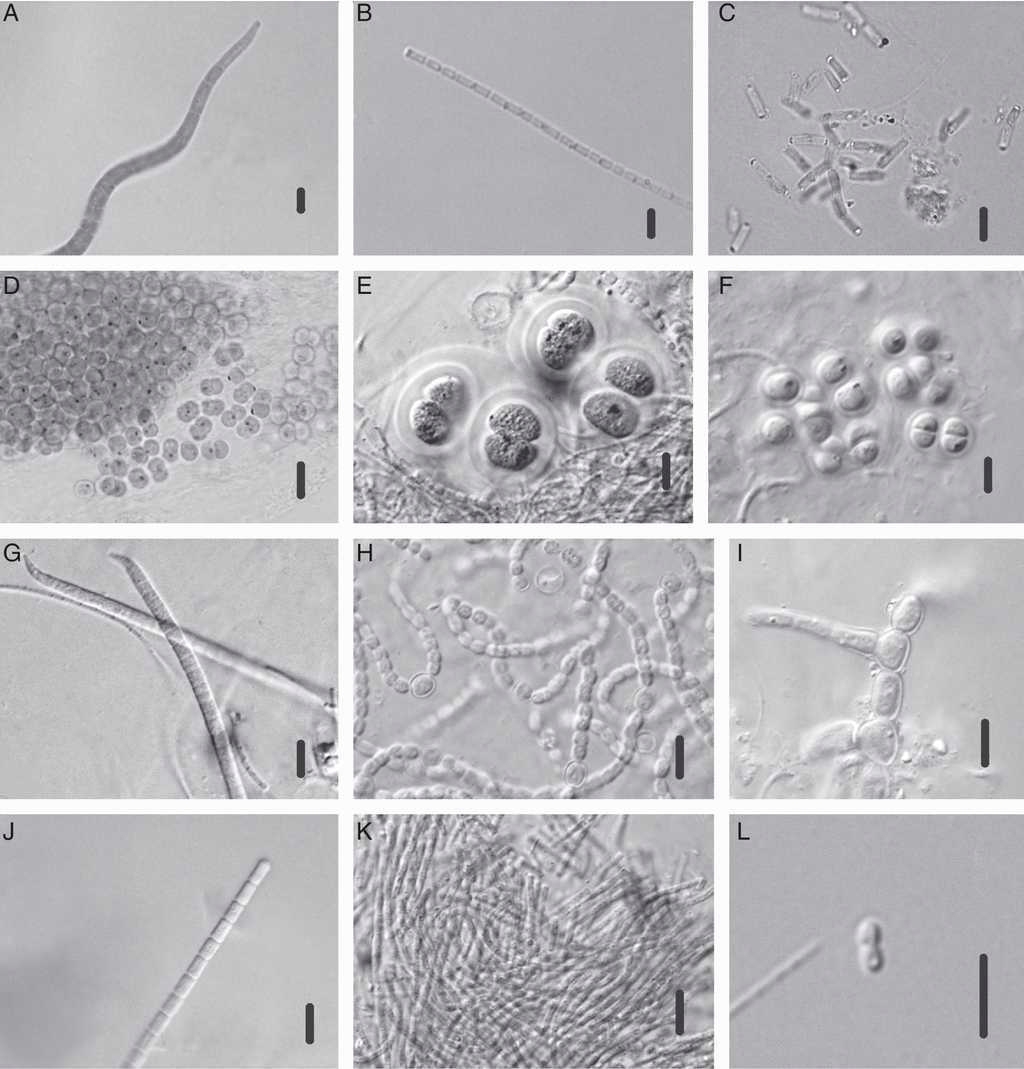
Figura 2 Especies de Cyanophyceae identificadas en el manantial Los Hervideros: A) Arthrospira sp.; B) Leptolyngbya sp.; C) Synechococcus bigranulatus; D) Synechocystis sp.; E) Chroococcus thermalis; F) Chroococcus sp.; G) Phormidium sp.; H) Nostoc sp.; I) Mastigocladus laminosus; J) Pseudoanabaena sp.; K) Pseudoanabaena thermalis; L) Synechococcus sp. Escala de la barra: 6μm para figuras A-K; 7μm para figura L.
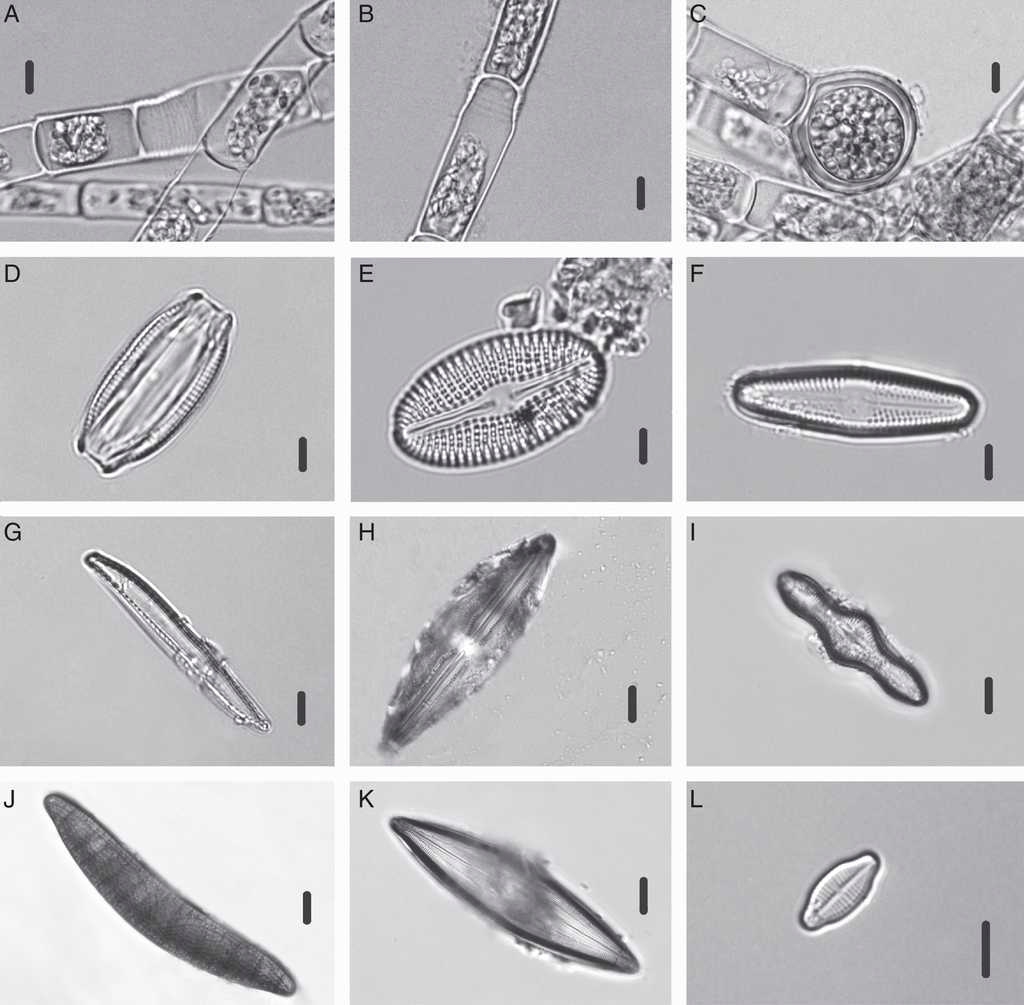
Figura 3 Chlorophyceae y especies de Bacillariophyceae identificadas en el manantial Los Hervideros: A, B, C) Oedogonium sp.; D) Halamphora veneta; E) Diploneis elliptica; F) Luticola mutica; G) Nitzschia aff. clausii; H) Anomoeoneis costata; I) Caloneis silicula; J) Epithemia turgida; K) Pinnularia sp.; L) Achnanthidium exiguum. Escala de la barra: 3μm para figuras C, D, J, H; 6μm para las figuras Q, A, B. E, F, G, I, L; 20μm para figura K.
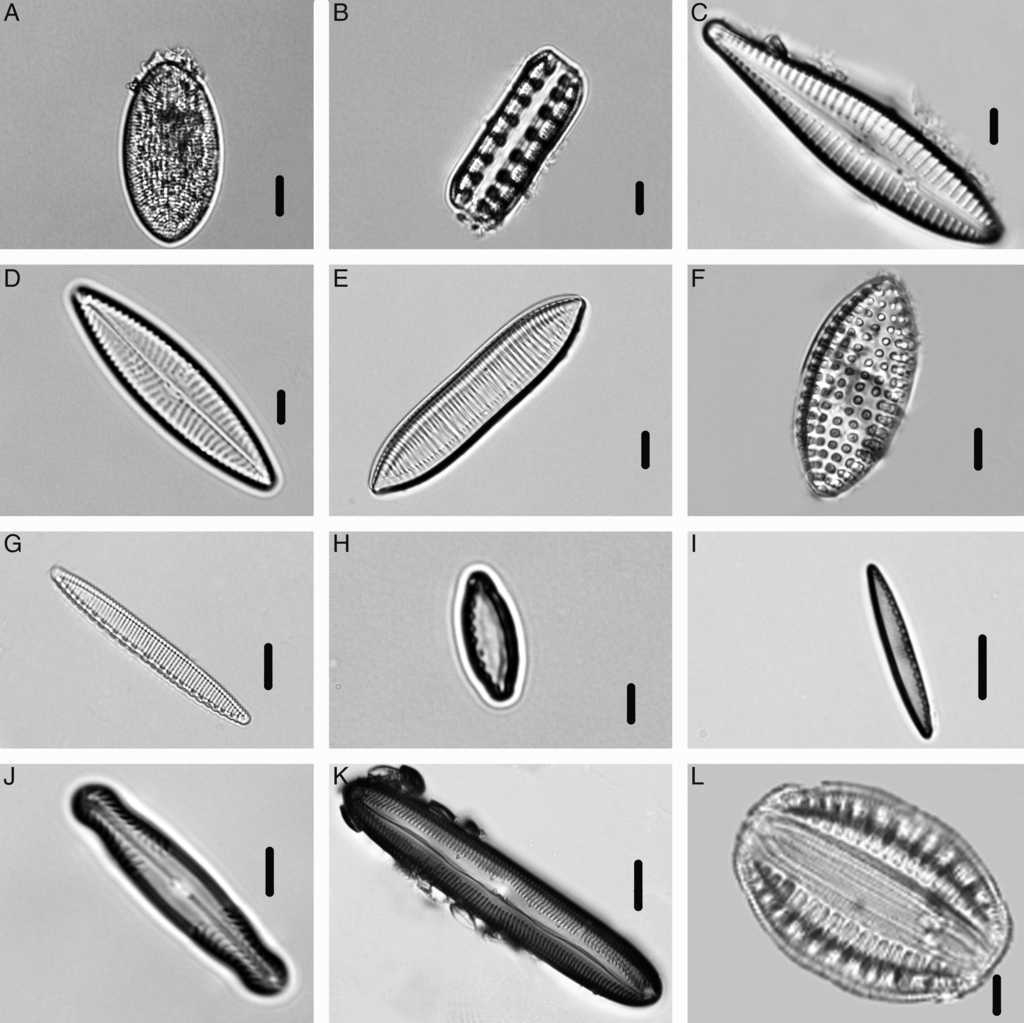
Figura 4 Especies de Bacillariophyceae identificadas en el manantial Los Hervideros: A) Cocconeis placentula; B) Denticula thermalis; C) Gomphonema gracile; D) Navicula cincta; E) Tryblionella aff. calida; F) Tryblionella granulata; G) Nitzschia amphibia; H) Nitzschia inconspicua; I) Nitzschia sp.; J) Pinnularia viridis; K) Pinnularia joculata; L) Rhopalodia gibberula. Escala de la barra: 3μm para figura B; 6μm para figuras C, I-K; 7μm para figuras A, D-H, L.
Chroococcus thermalis (Figura 2E)
Sinónimo: Chroococcus turgidus var. thermalis (Meneghini) Rabenhorst ex Hansgirg, 1932. (fig. 2).
Se observan colonias formadas por pocas células (2 a 4 células), encerradas en un mucílago hialino de 2 a 4 μm de espesor, homogéneo; cuando hay más de 2 células se ve lamelado, que adquiere la forma de las células; en ocasiones no es visible. Generalmente mezcladas con otras especies, raramente se encuentran solitarias. Las células son de color verde azul brillante, a veces ligeramente opacas, con contenido granular, de 11 a 16 μm de diámetro y de 5 a 14 μm de largo.
Mastigocladus laminosus (Figura 2I)
Presentan filamentos densamente entremezclados, de color azul verde, de 4-8 μm de ancho, con una vaina fina y con ramificaciones verdaderas, tipo T o V. Las ramas son más delgadas que el filamento principal, en ocasiones atenuadas. Los tricomas son cilíndricos, divaricados en ángulo recto y constreñidos en las partes viejas, pero no en las ramas. Se observan células en forma de barril en el filamento principal, cilíndricas en las ramas y frecuentemente más largas que anchas, y heterocitos intercalares, esféricos, elipsoidales o cilíndricos de hasta 6.5 μm de ancho y de hasta 9 μm de diámetro.
Synechococcus bigranulatus Skuja, 1933 (Figura 2C)
Sinónimos: S. elongatus f. thermalis Geitler, 1932; S. elongatus var. amphigranulatusCopeland, 1936; S. elongatus var. vestitusCopeland, 1936. S. elongatus f. indefinitus Emoto et Hirose, 1942; Synechococcus amphigranulatus (Copeland) Yoned, 1943.
Se observan células solitarias o en grupos de 2 después de la división celular, cilíndricas con los extremos redondeados, rectas o ligeramente curvadas, de color azul verde o verde oliva; presentan gránulos en los extremos de la célula. El contenido celular es homogéneo, de 2 a 3 μm de ancho y de 4 a 8 μm de largo.
Comentarios taxonómicos y ecológicos
El género Synechococcus incluye especies con una amplia variedad de formas y requerimientos ecológicos, por lo que seguramente es heterogéneo. Por una parte, incluye formas con adaptaciones a la vida a altas temperaturas y, por otra, formas que habitan otros tipos de ambientes especializados, como el planctónico marino. Copeland (1936) describió varias especies y variedades de Yellowstone, que incluyen Synechococcus lividus y sus variedades, Synechococcus vulcanus y sus variedades, así como Synechococcus elongatus y sus variedades (S. elongatus var. amphigranulatus es sinónimo de S. bigranulatus). La delimitación de especies es problemática, pues está basada en el tamaño, forma, curvatura y presencia de gránulos y su posición. Varias de estas características son muy variables y dependen de las condiciones ambientales. Recientemente fue propuesto por Katoh, Itoh, Shen e Ikeuchi (2001) el género Thermosynechococcus con 2 especies, Thermosynechococcus elongatus y Thermosynechococcus vulcanus, tradicionalmente ubicadas en el género Synechococcus. Sin embargo, este género no se reconoce como un taxón válido, pues su diagnóstico no ha sido publicado.
Luticola mutica (Kützing) D.G. Mann (Figura 3F)
Sinónimo: Navicula mutica Kützing. (fig. 3).
Los ejemplares pequeños de esta especie presentan frústulos de forma romboidal; los miembros más grandes presentan formas capitadas y los de tamaño intermedio se encuentran entre estas formas de frústulos. Presentan frústulos lanceolados, que tienen una longitud de 11 a 20 μm y 5 a 7 μm de ancho; el número de estrías en 10 μm va de 16 a 25 y son un poco radiadas. Las estrías se interrumpen en la parte central, donde queda un rectángulo vacío y solo se puede apreciar un estigma ubicado en la posición centrolateral.
Comentarios taxonómicos y ecológicos
Anteriormente fue conocida como N. mutica Kützing, hoy día este es un sinónimo; se ha observado en ambientes húmedos, subaéreos, entre musgos y salobres, y en pH alrededor de 7. Es una especie de ambientes continentales y cosmopolita. Se presentaron diferentes tipos de crecimientos algales, siendo los más conspicuos los tapetes microbianos con diferentes coloraciones. Estos estuvieron constituidos principalmente por cianofitas como Arthrospira sp. (fig. 2A), Leptolyngbya sp. (fig. 2B), S. bigranulatus (fig. 2C) y Synechocystis sp. (fig. 2D).
El grupo que presentó la mayor tolerancia a elevadas temperaturas fue el de las cianobacterias, seguido por las diatomeas y, por último, la única especie de clorofita. Varias especies de cianobacterias se presentaron en intervalos definidos de temperatura. En temperaturas por debajo de los 35 °C se observó a C. thermalis (fig. 2E), Chroococcus sp. (fig. 2F), Phormidium sp. (fig. 2G) y Nostoc sp. (fig. 2H). Synechococcus sp. se presentó principalmente entre los 47 a 54 °C, mientras que Arthrospira sp., Leptolyngbya sp., M. laminosus (fig. 2I), Pseudoanabaena thermalis (fig. 2K), Pseudoanabaena sp. (fig. 2J) y Synechocystis sp. estuvieron presentes principalmente entre los 54.7 y 73 °C. Algunas especies de cianobacterias también se encontraron hasta los 76 °C, como Leptolyngbya sp., Arthrospira sp. P. thermalis, S. bigranulatus y Synechocystis sp. (tabla 1). El mayor número de especies de diatomeas se presentó a los 47 °C (21 spp.), mientras que en las cianobacterias el mayor número de especies estuvo presente a los 54.5 °C y la clorofita, representada por una especie del género Oedogonium (figs. 3A-C), se presentó entre los 30.5 y 35.5 °C (tabla 1). Oedogonium sp. y algunas especies de cianobacterias (Chroococcus sp., C. thermalis, Phormidium sp. y Nostoc sp.) corresponden a formas mesotermófilas (M en tabla 1), mientras que la mayoría de las diatomeas se ubican como termófilas en la clasificación de Jjemba (2004). Otras especies presentaron traslapes en los intervalos de temperatura; varias especies de diatomeas se ubicaron como mesotermófilas (M-T en tabla 1) y algunas cianobacterias como termoextremófilas (T-E en tabla 1).
Discusión
La diversidad de especies encontradas en Los Hervideros resultó elevada (34 spp., tabla 1) en relación con el área, el número de muestras y el tipo de ambiente considerado extremo. Del total de especies, 29 se presentaron en temperaturas por arriba de los 45 °C, es decir, temperaturas en las que se considera que se desnaturalizan las proteínas. El grupo de algas más diverso en temperaturas por arriba de los 40 °C fue el de las diatomeas, con 21 especies, seguidas por las cianofitas con 8 especies. Sin embargo, las cianofitas fue el grupo que presentó mayor tolerancia a las altas temperaturas, siendo S. bigranulatus, Synechocystis sp. Leptolyngbya sp. y P. thermalis las especies con mayor tolerancia, presentándose hasta los 76 °C. Por arriba de los 54 °C solo se presentaron cianofitas.
Las diatomeas se registraron en temperaturas de hasta 47 °C, por lo que podemos considerar que el límite máximo para el grupo es cercano a esta cifra. Brock (1978) considera, basándose en estudios de cultivo, que el límite máximo para este grupo es de 42-44 °C, y que para algunas especies como A. exiguum (como Achnanthes exiguum), la temperatura óptima de crecimiento es de 40 °C. En el caso de las cianofitas se observó que varias especies se mostraron en intervalos definidos. Arthrospira sp. fue abundante e incluso dominante en los tapetes microbianos con temperatura entre los 54 y los 61 °C, reduciéndose de manera considerable por arriba de los 61 °C. M. laminosus se presentó en temperaturas cercanas a los 50 °C (47.5 °C), que corresponde con registros previos de tolerancia a la temperatura de entre 45 y 62 °C (Brock, 1978; Komárek, 2013). Esta especie tiene una distribución cosmopolita, pero siempre creciendo en condiciones ecológicas restringidas. Por arriba de los 73 °C y hasta los 76 °C se reconocieron tapetes microbianos dominados por S. bigranulatus, Synechocystis sp., Leptolyngbya sp. y P. thermalis, representando el límite superior de la fotosíntesis oxigénica en el área de estudio. Varias especies de los géneros Synechococcus, Synechocystis, Leptolyngbya y Pseudoanabaena han sido descritas como características de ambientes termales y son consideradas los organismos oxifotótrofos que toleran las temperaturas más elevadas. En particular, S. lividus es considerada la cianofita con mayor tolerancia y puede representar el límite máximo en el que se desarrolla la fotosíntesis oxigénica, que es alrededor de los 74 °C (Meeks y Castenholz, 1971). Algunos autores han documentado la presencia de cianofitas en temperaturas más elevadas (Mann y Schlichting, 1967; Sompong, Hawkins, Besley y Peerapornpisal, 2005), aunque Brock (1978) considera que los registros de presencia en temperaturas mayores pueden deberse a posibles errores en la medición, a un registro de otra bacteria no fotosintética o a la ausencia de una evaluación de las condiciones fisiológicas.
En el caso de este estudio, las temperaturas fueron medidas puntualmente en donde se presentó el crecimiento. La integridad física de las células se verificó por la observación al microscopio de la forma, coloración y movimiento, registrando tapetes microbianos dominados por cianofitas en temperaturas de hasta 76 °C. Es posible que en la naturaleza se desarrollen tapetes microbianos dominados por cianofitas en temperaturas mayores a las previamente establecidas, lo cual probablemente se relaciona con la habilidad fisiológica y acomodo de las especies en los tapetes microbianos.
Como casos particulares, se encontraron especies que consideramos como raras, ya que no se registraron más de 5 ejemplares en las preparaciones analizadas, como es el caso de Anomoeoneis costata (2 ejemplares); Caloneis silicula (fig. 3I; un ejemplar); Epithemia turgida (fig. 3J; 5 ejemplares); Pinnularia sp. (fig. 3K; 2 ejemplares); Nitzschia aff. clausii (fig. 3G; 3 ejemplares) y Cocconeis placentula (fig. 4A; 5 ejemplares). A pesar del número reducido de ejemplares, pudieron ser determinados a nivel de género y especie.
La localidad de Los Hervideros es una localidad peculiar por presentar una elevada heterogeneidad espacial, con cambios bruscos en la temperatura relacionados con un rápido decaimiento, y por la mezcla de 2 sistemas hídricos con diferentes temperaturas que provoca un gradiente térmico a manera de mosaico. Varias de las especies encontradas son características de ambientes termales como: S. bigranulatus, M. laminosus, P. thermalis, C. thermalis, A. exiguum y Pinnularia joculata.
Varias de las poblaciones estudiadas no correspondieron con los diagnosticos de especies previamente descritos, ya sea en morfometría o en ecología. En estos casos preferimos poner el epíteto «sp.» En particular, la ubicación de Arthrospira sp. no está clara. Puede corresponderse con las poblaciones identificadas como Phormidium terebriformis (sin. Oscillatoria terebriformis) registradas de manantiales termales de Estados Unidos de América (Brock, 1978). Sin embargo, P. terebriformis se presenta en aguas frías estancadas o corrientes (Komárek y Anagnostidis, 2005). En otros casos como en Leptolyngbya, se han descrito cerca de 80 especies, aun cuando no están claros los criterios de delimitación específicos. En resumen, podemos decir que existen muchos problemas taxonómicos en las cianofitas de estos ambientes.
Los manantiales termales son ecosistemas que presentan una amplia diversidad de organismos con adaptaciones para la vida en altas temperaturas y cuyo estudio permitirá entender aspectos importantes de la evolución de la vida sobre la Tierra. México, a pesar de contar con una enorme cantidad de recursos geotérmicos, se encuentra rezagado en cuanto al conocimiento de la biota que habita en esos ecosistemas. Esto resulta preocupante si consideramos que estos recursos enfrentan altos riegos de alteración a corto plazo debido al uso para fines de obtención de energía o como balnearios recreativos. Es urgente llevar a cabo estudios que complementen la biodiversidad que se presenta en estos ambientes tan peculiares.











 nueva página del texto (beta)
nueva página del texto (beta)



