Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Boletín médico del Hospital Infantil de México
versión impresa ISSN 1665-1146
Bol. Med. Hosp. Infant. Mex. vol.67 no.5 México sep./oct. 2010
Artículo de revisión
Aproximación práctica al diagnóstico de la alergia alimentaria
Practical approach to the diagnosis of food allergy
Marco Antonio Góngora-Meléndez,1 Juan José Luis Sienra-Monge,2 Blanca Estela Del Río-Navarro,1 Lourdes Ávila Castañón1
1 Departamento de Alergia e Inmunología Clínica
2 Subdirección de Servicios Auxiliares de Diagnóstico, Hospital Infantil de México Federico Gómez, México D.F., México
Autor de correspondencia:
Dr. Juan José Luis Sienra-Monge
Correo electrónico: jsienra@himfg.edu.mx
Fecha de recepción: 26-03-10.
Fecha de aceptación: 09-07-10.
Resumen
La alergia alimentaria representa la primera expresión clínica de atopia durante la vida, ya sea con manifestaciones gastrointestinales o cutáneas, seguidas de asma y rinitis. A este continuo desarrollo de enfermedades se ha denominado "marcha atópica". Es un problema importante de salud, no sólo para los pacientes sino también incluye al grupo familiar y social.
Se define como una respuesta inmunológica anormal ante la ingesta de proteínas alimenticias que ocasionan una reacción clínica adversa. La mayoría de las personas desarrolla tolerancia a los antígenos alimentarios, los cuales constantemente acceden al organismo. Sin embargo, cuando la tolerancia falla, el sistema inmune responde con reacciones de hipersensibilidad.
El diagnóstico de la alergia alimentaria todavía es un ejercicio clínico que depende de una historia cuidadosa, de la determinación específica de IgE, pruebas de parche, una apropiada dieta de exclusión y la realización de reto cegado.
Palabras clave: diagnóstico, alergia, alimentos, atopia, antígenos.
Abstract
Food allergy has become the first clinical expression of atopy, beginning with dermal o gastric manifestations to continue with asthma an rhinitis ("the atopic march"), a very severe health problem not only for many children and parents, but also for the entire medical and paramedical community. Food allergy is defined as an abnormal immunological reaction to food proteins, which causes an adverse clinical reaction. Most of the people become tolerant to many foods; however, these tolerances sometimes fail and become an immunological reaction.
The evaluation of a child with suspected food allergy includes detailed medical history, physical examination, screening tests and response to elimination diet and to oral food challenge. None of the screening tests —alone or in combination— can definitely diagnose or exclude it.
Key words: diagnosis, food, allergy, atopy, antigen.
Introducción
El objetivo del presente trabajo fue realizar una revisión del tema, con énfasis en el abordaje clínico y en algunos auxiliares de diagnóstico, de una patología frecuente que se puede prestar a múltiples confusiones, lo que lleva a errores diagnósticos y terapéuticos.
Como muchas alteraciones médicas, el diagnóstico de la alergia alimentaria inicia con la historia clínica y el examen físico. En base a esta información, se derivarán las acciones a seguir y que puedan ser de utilidad.1-4
La habilidad del médico en la recolección de síntomas del paciente es fundamental para diferenciar entre los desórdenes provocados por los alimentos, y poder clasificarlos para diferenciarlos de reacciones de intolerancia no inmunológica,
o bien si es derivado de un proceso de origen inmunológico (Figura 1).
A pesar de ello, menos de la mitad de las reacciones alérgicas a alimentos pueden ser verificadas por el "estándar de oro", que es el Reto Oral Doble Ciego Placebo Controlado (RODCPC).5,6
Diagnóstico
La información requerida para establecer qué ocurre en una reacción alérgica, y proponer la realización de un reto, incluye lo siguiente: (1) conocer el alimento que se sospecha ha provocado la reacción, (2) el tipo del alimento ingerido, (3) el tiempo entre la ingesta y desarrollo de los síntomas, (4) los síntomas similares desarrollados en otras ocasiones cuando el alimento fue ingerido, (5) otros factores asociados, (ej. ejercicio) y (6) tiempo desde que ocurrió la última reacción (Tabla 1).
Cualquier alimento puede causar una reacción alérgica, aunque cerca del 90% de los involucrados en adultos corresponden a cacahuates, nueces, pescado y mariscos; en niños pequeños son leche, huevo, soya y trigo. Sin embargo, en alteraciones crónicas (ej. dermatitis atópica, asma y urticaria entre otras), la historia es muchas veces un indicador poco confiable sobre el alérgeno ofensor.
La historia clínica debe incluir la naturaleza de los síntomas y su tiempo de aparición después de la exposición al alérgeno, la consistencia de la respuesta alergénica y la respuesta del paciente al tratamiento (Tabla 2).7

Los diarios de síntomas son un instrumento fundamental en el estudio de estos padecimientos. El paciente debe ser instruido en mantener un registro cronológico de todos los alimentos ingeridos durante un periodo específico de tiempo; deben incluirse aquéllos que sólo se ponen en la boca, como la goma de mascar, para registrar cualquier síntoma que se presente, que nos sirve para tratar de determinar cuál es la relación entre los alimentos ingeridos y los síntomas experimentados. Con este diario se pueden detectar asociaciones no reconocidas entre el alimento y los síntomas. Contrario a la historia clínica, esta información es prospectiva y no depende de la memoria del paciente o su familiar, por lo que debe emplearse selectivamente ya que frecuentemente el paciente y la familia se enfocan obsesivamente en los alimentos y no en otros desencadenantes potenciales de sus reacciones.
Las dietas de eliminación, además de ser usadas como tratamiento como se vera más adelante, son utilizadas frecuentemente para el diagnóstico, ya que si ciertos alimentos son sospechosos de provocar las alteraciones, estos son completamente omitidos de la dieta. Su éxito depende de la identificación correcta de los alérgenos, la habilidad del paciente de mantener una dieta complementaria libre y de asumir que otros factores no son los que provocan síntomas similares durante el periodo de estudio; desafortunadamente, rara vez se logran estas condiciones. En lactantes pequeños que reaccionan a la leche de vaca, la resolución de los síntomas después de la sustitución con una fórmula de soya o hidrolizado de caseína o fórmula elemental es altamente sugestiva de alergia, aunque también pudiera tratarse de una intolerancia a la lactosa. Sin embargo, se recomienda primero evitar el alérgeno alimentario sospechoso antes de retos cegados o dietas de eliminación extensas.
Las pruebas cutáneas de alergia son reproducibles y frecuentemente utilizadas en pacientes con sospecha de alergia alimentaria mediada por IgE. Los extractos alimentarios, teniendo un apropiado control positivo y negativo, deben ser aplicados mediante la técnica de piquete o punción ("prick test"). El criterio para interpretarlas fue establecido por Bock desde hace 30 años, y afirmaba que la roncha debería ser 3 mm mayor que el control positivo.8 Recientemente, se ha evaluado la utilidad de usar el diámetro medio de la roncha como predictor de reactividad, aunque ésta varía de un alérgeno a otro. Hill y cols. reportaron que las pruebas cutáneas que inducen ronchas con diámetro >8 mm son diagnósticas de alergia a la leche, huevo y cacahuate, con una predicción de reactividad clínica mayor al 95%;9 en términos generales, se considera una prueba positiva cuando el diámetro medio de la roncha es ≥3 mm comparado con el control negativo.10,11
Para un mejor diagnóstico, es necesaria la estandarización de los reactivos y los procedimientos de las pruebas cutáneas; si los extractos utilizados son de buena calidad, una prueba positiva debe ser interpretada como la posibilidad de que el paciente tenga reactividad a un alimento específico. Sin embargo, si es negativa, confirma la ausencia de reacción mediada por IgE (valor predictivo negativo mayor del 95%).5,8,12-15 Existen ciertas excepciones a esta afirmación: 1) la IgE media la sensibilidad a muchas frutas y vegetales (ej. manzanas, naranjas, plátanos, peras, melones, papas, zanahorias, apio), y no es frecuentemente detectada con los preparados comerciales, al parecer debido a la labilidad de los alérgenos responsables;16 2) los extractos comerciales algu-nas veces carecen del alérgeno apropiado al cual el individuo es reactivo, como se ha demostrado con el uso de alimentos frescos para las pruebas cutáneas; 3) los niños menores de un año de edad pueden tener alergia mediada por IgE en ausencia de pruebas cutáneas positivas o que las ronchas sean pequeñas, presumiblemente debido a la falta de reactividad de la piel;17 y, por el contrario, 4) si un alimento es claramente causa de una respuesta anafiláctica grave, no se debe hacer una prueba cutánea por el riesgo que esto implica.
Las propiedades predictivas intrínsecas del "prick test" pueden ser influenciadas por la calidad de los reactivos a evaluar y la técnica usada, por lo que estos aspectos deben ser apreciados en la interpretación de la prueba. Es por ello que, en algunos casos, es preferible el uso de alimentos frescos, particularmente cuando se prueban frutas y vegetales que son proclives a la degradación. Esto se realiza mediante el "prick-prick test",18,19 que consiste en hacer una pequeña punción sobre el alimento fresco a explorar y posteriormente, con el mismo aplicador impregnado del alimento, hacer la punción en la piel, similar a la prueba tradicional de "prick". Los resultados se interpretan de la misma manera.
Las pruebas cutáneas intradérmicas son más sensibles que las epicutáneas pero menos específicas, e incrementan el riesgo de inducir reacciones sistémicas, por lo que sólo hay que realizarlas en condiciones muy particulares.8,12
En años recientes se ha incrementado el interés en el uso de las pruebas de parche para el diagnóstico de alergia alimentaria no mediada por IgE.20-22 Desafortunadamente, no hay reactivos ni métodos estandarizados, por lo que su utilidad es limitada. Recientemente, Mehl y cols. concluyeron que las pruebas de parche añaden un pequeño beneficio al diagnóstico comparado con las pruebas diagnósticas estándar.23
La determinación de IgE sérica alérgenoespecífica in vitro tiene menor sensibilidad que las pruebas cutáneas,5 aunque con algunas técnicas usadas actualmente se puede lograr una sensibilidad hasta del 90%, como el sistema UniCAP, que permite detectar valores de >0.35kUA/L, o el Inmuno CAP-Phadia, que permite detectar valores de hasta 0.1kUA/L.24 Lasmediciones cuantitativas han mostrado tener un valor muy importante en la predicción de la alergia alimentaria mediada por IgE (Tabla 3).25,26
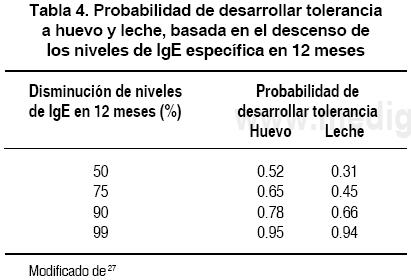
Los niveles que exceden los "valores diagnósticos" indican que el paciente tiene más del 95% de probabilidad de experimentar una reacción alérgica si ingiere el alimento específico. Además, los niveles de IgE pueden ser monitorizados y sicaen a menos de 2 kUA/L para huevo, leche o cacahuate, el paciente debe ser reevaluado para determinar si ha "superado" su alergia alimentaria.27 Shek y cols.28 reportaron que los porcentajes de disminución de los niveles de IgE específica en el tiempo, pueden predecir la posibilidad de presentar tolerancia a la leche y al huevo. Esto ofrece a los clínicos ayuda para dar un pronóstico y tiempo para realizar retos alimentarios subsecuentes (Tabla 4).
Los ensayos de activación/liberación de histamina del basófilo (LHB), reservados generalmente para uso en investigación, utilizan pequeñas cantidades de sangre total para la búsqueda de múltiples alérgenos alimentarios. Con estos ensayos se puede evitar el problema de la liberación espontánea de histamina encontrada en individuos alérgicos que continúan la ingesta del alérgeno responsable y tiene una buena correlación con los niveles de IgE específica.29
La provocación intragástrica bajo endoscopía (PIBE) se utiliza desde hace más de 60 años,30 y se relaciona positivamente con el RODCPC,31 aunque los pacientes experimentaron síntomas sistémicos, lo que sugiere que este procedimiento no es más seguro que los retos orales.
El RODCPC se ha etiquetado como el "estándar de oro" para el diagnóstico de la alergia alimentaria.2 Se ha utilizado exitosamente tanto en niños como en adultos. La selección de los alimentos a ser evaluados se basa en la historia, pruebas cutáneas o resultados de IgE in vitro. Los alimentos que son poco probables de causar una reacción alérgica deben ser evaluados mediante retos abiertos o ciego simple. Sin embargo, las respuestas positivas deben ser confirmadas mediante el RODCPC, a menos que uno o dos alérgenos "principales" (huevo, leche, soya, trigo) provoquen síntomas de alergia clásicos o en lactantes pequeños. Es necesario, antes de realizar el reto, eliminar el alimento sospechoso 7-14 días antes y, en caso de que se trate de algún desorden gastrointestinal no mediado por IgE, este periodo debe ser mayor. Los antihistamínicos deben ser retirados para evitar falsos negativos por bloqueo de los receptores. En algunos pacientes asmáticos, los ciclos cortos de esteroides pueden ser necesarios para asegurar la adecuada reserva pulmonar para evaluación (VEF1 (volumen espiratorio forzado) mayor al 70% del predicho).32-35 El reto alimentario se realiza en ayuno, empezando con una cantidad pequeña poco probable de que provoque síntomas (5-250 mg de alimentos liofilizados).36 La dosis se duplica cada 15 a 60 minutos, dependiendo del tipo de reacción esperada. Una vez que el paciente ha tolerado la dosis acumulada de 10 g del alimento, prácticamente no hay posibilidad de que posteriormente presente síntomas, pero hay que confirmarlo con alimentación libre bajo observación para descartar que sea un reto falso negativo.
Para evitar los factores confusores se debe hacer un número igual de retos con antígeno alimentario y placebo, administrándolos en forma aleatoria por una tercera persona.37 La calificación es por medio de un sistema estandarizado; el tiempo de observación dependerá del tipo de reacción esperada, por ejemplo, 2 horas para las reacciones mediadas por IgE, más de 4-8 horas para enterocolitis inducida por leche, 3-4 días para gastroenteritis alérgica eosinofílica, etc. Los resultados de los retos ciegos para signos y síntomas objetivos raramente están equivocados, pero pueden realizarse, además de los datos clínicos, algunos exámenes de laboratorio como histamina en plasma, pruebas de función pulmonar y resistencia de la vía nasal.38
El RODCPC es el mejor medio para controlar la gran variabilidad de los desórdenes crónicos (ej. urticaria, dermatitis atópica), así como cualquier efecto temporal y las exacerbaciones agudas secundarias por reducir o retirar la medicación. Otros factores precipitantes son controlados o, al menos, neutralizados; los factores psicogénicos, errores del paciente y del observador son eliminados. Los retos falsos negativos son raros, pero pueden presentarse cuando el paciente no recibe la cantidad de alimento necesario o por alteraciones en el liofilizado que cambie los epítopos alérgicos relevantes (ej. pescado).
En las reacciones alimentarias no mediadas por IgE, por ejemplo enterocolitis inducida por proteínas de la dieta, los retos pueden requerir más de 0.3 g de alimento por kilogramo de peso corporal administrado en una o dos dosis,39,40 mientras que en la esofagitis o gastritis eosinofílica alérgica habrá que realizar la administración repetida por varios días para desencadenar los síntomas. En la mayoría de los cuadros mediados por IgE se pueden realizar cada 1-2 días, no así en los no mediados por IgE, que deben ser de al menos 3-5 días por separado.
Estas pruebas se deben realizar en un hospital, por personal entrenado y con equipo disponible para tratar una reacción anafiláctica que amenace la vida.32,41 La evaluación de muchas reacciones "retardadas" (ej. la mayoría de la alergias gastrointestinales IgE negativas) puede ser realizada con seguridad en el consultorio médico, excepto por el síndrome de enterocolitis inducida por proteínas de la dieta, ya que es necesario contar con un acceso intravenoso debido al riesgo de hipotensión. Cuando los síntomas sean dudosos, se requiere la repetición en por lo menos tres oportunidades para concluir que existe una relación causa-efecto. Si existe el antecedente de anafilaxia que amenace la vida, los pacientes sólo deben ser retados cuando el antígeno causal no pueda ser determinado concluyentemente.
Para concluir, podemos decir que el diagnóstico aún permanece como un ejercicio clínico que depende de una historia cuidadosa, de la determinación de IgE específica (in vivo o in vitro), pruebas de parche, una apropiada dieta de exclusión y la realización de retos cegados.
Al momento actual, no existe evidencia que apoye el valor diagnóstico por medio de niveles de anticuerpos IgG o IgG4 a alimentos específicos,42 los complejos antígeno alimento, activación del linfocito o por provocación intracutánea o sublingual.43 Si el problema es a nivel gastrointestinal, se requieren biopsias pre y post-reto.
Cuando el cuadro sea mediado por IgE, el tratamiento indicado será por medio de una dieta de eliminación de todos los alimentos implicados mediante historia o prueba cutánea, que debe ser llevada por al menos 2 semanas. En la enterocolitis y colitis inducidas por alimentos, debe ser por más de 12 semanas, seguidas de biopsias adecuadas. Si no se observa ninguna mejoría, es poco probable que participe una alergia alimentaria.
En casos de dermatitis atópica y asma crónica, otros factores precipitantes pueden dificultar la discriminación de los efectos de los alérgenos alimentarios de otros factores provocadores.
Las alergias múltiples se presentan con más frecuencia, especialmente en los alérgenos menores, por lo que el médico debe valorar el beneficio de identificar con certeza la reactividad clínica y el riesgo del reto. Las dietas de eliminación pueden llevar a desnutrición o desórdenes alimentarios, especial-mente si incluyen una gran cantidad de alimentos o si se utilizan por un largo periodo de tiempo.
Por último, se presenta un algoritmo de abordaje a un paciente con alergia alimentaria, en este caso tomando al huevo como ejemplo (Figura 2).
Referencias
1. Shaker M, Woodmansee D. An update on food allergy. Curr Opin Pediatr 2009;21:667-674. [ Links ]
2. Sampson HA. Food allergy. Part 2: diagnosis and management. J Allergy Clin Immunol 1999;103:981-999. [ Links ]
3. Sicherer SH. Food allergy. Lancet 2002;360:701-710. [ Links ]
4. Sampson HA. Food allergy – accurately identifying clinical reactivity. Allergy 2005;60(suppl 79):19-24. [ Links ]
5. Sampson HA, Albergo R. Comparison of results of skin tests, RAST, and double-blind, placebo-controlled food challenges in children with atopic dermatitis. J Allergy Clin Immunol 1984;74:26-33. [ Links ]
6. Burks AW, Mallory SB, Williams LW, Shirrell MA. Atopic dermatitis: clinical relevance of food hypersensitivity reactions. J Pediatr 1988;113:447-451. [ Links ]
7. Lack G. Food Allergy. N Engl J Med 2008;359:1252-1260. [ Links ]
8. Bock SA, Buckley J, Holst A, May CD. Proper use of skin tests with food extracts in diagnosis of hypersensitivity to food in children. Clin Allergy 1977;7:375-383. [ Links ]
9. Sporik R, Hill DJ, Hosking CS. Specificity of allergen skin testing in predicting positive open food challenges to milk, egg and peanut in children. Clin Exp Allergy 2000;30:1540-1546. [ Links ]
10. Hill DJ, Hosking CS, Reyes-Benito LV. Reducing the need for food allergen challenges in young children: a comparison of in vitro with in vivo tests. Clin Exp Allergy 2001;31:1031-1035. [ Links ]
11. Berstein IL, Li JT, Berstein DI, Hamilton R, Spector SL, Tan R, et al. Allergy diagnostic testing: an update practice parameter. Ann Allergy Asthma Immunol 2008;100:S1-S148. [ Links ]
12. Bock SA, Atkins FM. Patterns of food hypersensitivity during sixteen years of double-blind, placebo-controlled food challenges. J Pediatr 1990;117:561-567. [ Links ]
13. Sampson HA. Comparative study of commercial food antigen extracts for the diagnosis of food hypersensitivity. J Allergy Clin Immunol 1988;82:718-726. [ Links ]
14. Atkins FM, Steinberg SS, Metcalfe DD. Evaluation of immediate adverse reactions to foods in adult patients. I. Correlation of demographic, laboratory, and prick skin test data with response to controlled oral food challenge. J Allergy Clin Immunol 1985;75:348-355. [ Links ]
15. Sampson HA. Role of immediate food hypersensitivity in the pathogenesis of atopic dermatitis. J Allergy Clin Immunol 1983;71:473-480. [ Links ]
16. Ortolani C, Ispano M, Pastorello EA, Ansaloni R, Magri GC. Comparison of results of skin prick tests (with fresh foods and commercial food extracts) and RAST in 100 patients with oral allergy syndrome. J Allergy Clin Immunol 1989;83:683-690. [ Links ]
17. Ménardo J, Bousquet J, Rodiere M, Astruc J, Michel FB. Skin test reactivity in infancy. J Allergy Clin Immunol 1985;75:646-651. [ Links ]
18. Sicherer SH, Teuber S, Adverse Reactions to Food Committee. Current approach to the diagnosis and management of adverse reactions to foods. J Allergy Clin Immunol 2004;114:1146-1150. [ Links ]
19. Chapman JA, Bernstein L, Lee RE, Oppenheimer J, Nicklas RA, Portnoy JM, et al. Food allergy: a practice parameter. Ann Allergy Asthma Immunol 2006;96:S1-S68. [ Links ]
20. Niggemann B, Reibel S, Wahn U. The atopy patch test (APT) – a useful tool for the diagnosis of food allergy in children with atopic dermatitis. Allergy 2000;55:281-285. [ Links ]
21. De Boissieu D, Waguet JC, Dupont C. The atopy patch tests for detection of cow's milk allergy with digestive symptoms. J Pediatr 2003;142:203-205. [ Links ]
22. Spergel JM, Andrews T, Brown-Whitehorn TF, Beausoleil J, Liacouras CA. Treatment of eosinophilic esophagitis with specific food elimination diet directed by a combination of skin prick and patch tests. Ann Allergy Asthma Immunol 2005;95:336-343. [ Links ]
23. Cocco R, Solé D. Patch test in the diagnosis of food allergy. Allergol Immunopathol 2009;37:205-207. [ Links ]
24. Hamilton R. Clinical laboratory assessment of immediate-type hypersensitivity. J Allergy Clin Immunol 2010;125(suppl 2):S284-S296. [ Links ]
25. Sampson H, Ho DG. Relationship between food-specific IgE concentration and the risk of positive food challenges in children and adolescents. J Allergy Clin Immunol 1997;100:444-451. [ Links ]
26. Sampson HA. Utility of food-specific IgE concentrations in predicting symptomatic food allergy. J Allergy Clin Immunol 2001;107:891-896. [ Links ]
27. Perry TT, Matsui EC, Conover-Walker MK, Wood RA. The relationship of allergen-specific IgE levels and oral food challenge outcome. J Allergy Clin Immunol 2004;114:144-149. [ Links ]
28. Shek LP, Soderstrom L, Ahlstedt S, Beyer K, Sampson HA. Determination of food specific IgE levels over time can predict the development of tolerance in cow's milk and hen's egg allergy. J Allergy Clin Immunol 2004;114:387-391. [ Links ]
29. Sampson HA, MacDonald SM. IgE-dependent histaminereleasing factors. Springer Semin Immunopathol 1993;15:89-98. [ Links ]
30. Pollard HM, Stuart GJ. Experimental reproduction of gastric allergy in human beings with controlled observations on the mucosa. J Allergy 1942;13:467-473. [ Links ]
31. Reimann H, Ring J, Ultsch B, Wendt P. Intragastral provocation under endoscopic control (IPEC) in food allergy: mast cell and histamine changes in gastric mucosa. Clin Allergy 1985;15:195-202. [ Links ]
32. Bock SA, Sampson HA, Atkins FM, Zeiger RS, Lehrer S, Sachs M, et al. Double-blind, placebo-controlled food challenge (DBPCFC) as an office procedure: a manual. J Allergy Clin Immunol 1988;82:986-997. [ Links ]
33. Berni CR, Ruotolo S, Discepolo V, Troncone R. The diagnosis of food allergy in children. Curr Opin Pediatr 2008;20:584-589. [ Links ]
34. Hansen TK, Bindslev-Jensen C. Codfish allergy in adults. Identification and diagnosis. Allergy 1992;47:610-617. [ Links ]
35. Norgaard A, Bindslev-Jensen C. Egg and milk allergy in adults. Diagnosis and characterization. Allergy 1992;47:503-509. [ Links ]
36. Sicherer SH, Morrow EH, Sampson HA. Dose-response in double-blind, placebo-controlled oral food challenges in children with atopic dermatitis. J Allergy Clin Immunol 2000;105:582-586. [ Links ]
37. Metcalfe D, Sampson H. Workshop on experimental methodology for clinical studies of adverse reactions to food and food additives. J Allergy Clin Immun 1990;86:421-442. [ Links ]
38. Sampson HA, Mendelson LM, Rosen JP. Fatal and near-fatal anaphylactic reactions to food in children and adolescents. N Engl J Med 1992;327:380-384. [ Links ]
39. Sicherer SH, Eigenmann PA, Sampson HA. Clinical features of food protein-induced enterocolitis syndrome. J Pediatr 1998;133:214-219. [ Links ]
40. Powell G. Food protein-induced enterocolitis of infancy: differential diagnosis and management. Compr Ther 1986;12:28-37. [ Links ]
41. Executive Committee AAA & I. Personnel and equipment to treat systemic reactions caused by immunotherapy with allergic extracts. American Academy of Allergy and Immunology. J Allergy Clin Immunol 1986;77:271-273. [ Links ]
42. Stapel SO, Asero R, Ballmer-Weber BK, Knol EF, Strobel S, Vieths S, et al. Testing for IgG4 against foods is not recommended as a diagnostic tool: EAACI Task Force Report. Allergy 2008;63:793-796. [ Links ]
43. Cerecedo I, Zamora J, Shreffler WG, Lin J, Bardina L, Dieguez MC, et al. Mapping of the IgE and IgG4 sequential epitopes of milk allergens with a peptide microarray–based immunoassay. J Allergy Clin Immunol 2008;122:589-594. [ Links ]
44. López GH, Copto GA, Reynés MJ, Heller RS, Flores HS, González MM, et al. Consenso de alimentación del niño con alergia alimentaria. Asociación Mexicana de Pediatría. Acta Pediatr Mex 2005;26:270-292. [ Links ]
45. Sampson HA. Adverse reactions to foods. In: Adkinson N, Bochner B, Busse W, Holgate S, Lemanske R, Simone F, eds. Adkinson: Middleton's Allergy: Principles and Practice. St. Louis: Mosby, 2008. pp. 1139-1168. [ Links ]














