Introducción
La producción de hidrocarburos se encuentra asociada a una cierta cantidad de agua, denominada agua de producción, la cual se encuentra saturada con sales minerales que generalmente son nativas del yacimiento y que dan origen a la formación de las incrustaciones (Contento, 2009). Entre los más grandes problemas relacionados con la explotación de estos recursos se puede destacar el hecho de que a medida que se agota el yacimiento se produce un incremento en la producción de agua (Nabzar & Duplan, 2010) siempre y cuando exista algún acuífero activo adyacente o la presencia de un proceso de inyección de agua, haciendo más severos los depósitos de estas sales. La mayor parte de las incrustaciones que se encuentran en los campos petroleros se forman por precipitación de minerales presentes en el agua de formación, o bien, como resultado de que el agua producida se sobresatura de componentes minerales cuando dos aguas incompatibles se encuentran en el fondo del pozo (Crabtree et al., 1999).
Como señalan Larrea & Malavé (1999), la formación de incrustaciones origina accidentes de seguridad operacional cuando se deposita en válvulas de seguridad de superficie y de fondo, así también como problemas de atascamientos de bombas eléctricas sumergibles, la imposibilidad de trabajar con guaya fina; además de ser causantes de desgaste y corrosión de los diferentes equipos y de una restricción al flujo, puede llegar a niveles tan críticos donde se hace necesaria la extracción de equipos desde el fondo del pozo para su reemplazo, reperforación de intervalos productivos, estimulación de la formación petrolífera obstruida y otros trabajos de reparación que generan altos egresos y pérdidas para la industria, por la detención de las operaciones de producción (Espinosa, 2015).
De acuerdo con la industria petrolera, los métodos más utilizados para el control del fenómeno antes mencionado son los denominados inhibidores de incrustación, que interactúan con los cristales precipitados mediante diferentes mecanismos teniendo como objetivo principal la prevención de la formación de incrustaciones. Para el desarrollo de dichos inhibidores, es necesario conocer esencialmente los factores que afectan el equilibrio de la solución y la cinética de la precipitación (Bradley, 1992).
Los tratamientos químicos convencionales empleados para la prevención o mitigación de las incrustaciones pueden tener procedencia orgánica e inorgánica. En la actualidad se han invertido grandes esfuerzos para el desarrollo de nuevas formulaciones de tratamientos químicos antiincrustantes basadas en los enunciados de la química verde. Dichas formulaciones brindan eficiencias muy similares a los productos convencionales pero con la gran ventaja de que minimizan los riesgos ambientales (Chaussemier et al., 2014). Entre algunas de las investigaciones previas relacionadas con la disertación en estudio, autores como Fuenmayor & Peña (2016) investigaron el efecto experimental de la pectina de Passiflora edulis en hidrogel sobre la precipitación de incrustaciones de Sulfato de Calcio (CaSO4); además de Reyes et al. (2019), quienes midieron el uso del mucílago de la hoja de Hibiscus rosasinensis en muestras de aguas de producción y sintética. Asimismo en el año 2012 fue indagada la acción antiincrustante que tiene una pectina modificada sobre incrustaciones de CaSO4 (Chauhan et al., 2012).
Por ello, la presente investigación permitió llevar a cabo la formulación de un químico antiincrustante elaborado a partir de pectina deshidratada a base de una materia prima local y natural representada por la parchita. Con base en esto se evaluó la capacidad de este químico para inhibir la precipitación de las incrustaciones minerales o escamas de Sulfato de Calcio (CaSO4), por lo que se caracterizaron muestras de agua sintética, pectina e inhibidores previamente formulados, que en conjunto con HCl (tomado como inhibidor patrón), permitieron ser evaluadas y comparadas sus respectivas eficiencias.
Desarrollo
El estudio se desarrolló en los laboratorios de Procesamiento de Hidrocarburos, Perforación y Yacimientos del Departamento de Ingeniería de Petróleo, así como en el laboratorio de Forrajes de la Escuela de Agronomía, de la Universidad de Oriente, Núcleo de Monagas, Campus Los Guaritos; y en el Laboratorio de Tamices Moleculares de la Universidad de Oriente, Núcleo de Monagas, Campus Juanico. Los reactivos para la formulación del agua sintética fueron suministrados por el personal del Laboratorio de Química de la referida universidad y los aditivos para la determinación de las propiedades del agua y de los productos formulados fueron aportados por los laboratorios donde se realizaron los ensayos respectivos, todos ellos ubicados en el estado Monagas, Venezuela.
Extracción y caracterización de la pectina de Passiflora edulis
La materia prima (cáscaras) para el desarrollo de la extracción de la pectina generalmente es un desecho del proceso del despulpado de la fruta respectiva (parchita Passiflora edulis). La pectina necesaria para la ejecución de esta investigación se obtuvo mediante un proceso de hidrólisis ácida, en el cual las cáscaras del fruto con un grado de madurez intermedio, fueron sometidas a suspensión en una solución de agua desionizada con ácido cítrico regulado a un pH de 2.9 en una proporción de 80 g de cáscaras por 350 mL de solución, adicionando calor hasta alcanzar el punto de ebullición para lograr de esta forma la solubilización de la pectina. La solución obtenida se sometió a precipitación mediante la adición de etanol a 95 % en una relación de 140 mL de alcohol por 250 mL de solución pectínica para posteriormente ser filtrada.
El gel resultante se sometió a calefacción mediante el uso de un horno hasta lograr su deshidratación, para finalmente ser triturado y pulverizado en un molino Thomas-Wiley, Modelo 4. Para las pruebas de caracterización se necesitó la pectina tanto en forma de gel como deshidratada, considerándose ambas presentaciones, ya que varias pruebas estaban limitadas a muestras secas.
Una vez obtenida la pectina, se caracterizó a través de pruebas fisicoquímicas, especificadas en la Tabla 1.
Tabla 1 Pruebas para la caracterización de la pectina de Passiflora edulis
| Prueba | Norma |
| Color y apariencia | - |
| Densidad / gravedad específica | ASTM D854 |
| Rendimiento | Método de Estrada & López (1998) |
| Humedad | COVENIN 242-79 |
| Solubilidad | ASTM E1148-02 |
| Tamaño de partículas | ASTM C136-01 |
| Apariencia microscópica | ASTM E1951-98 |
| Estabilidad térmica | Método de Malavé, Marín, Acevedo & Parra, (2016) |
| Peso equivalente | Método de Owens & McCready (1988) |
| Contenido de Metoxilos | Método de Owens & McCready (1988) |
| Grado de esterificación | Método de Owens & McCready (1988) |
| pH | COVENIN 2462-87 |
| Grupos funcionales | ASTM E168/ ASTM E1252 |
Formulación y caracterización del agua sintética
La formulación de la salmuera sintética se realizó siguiendo lo establecido por la norma NACE TM0374-2007, que contempla la evaluación de inhibidores de incrustación en un sistema acuoso sintético. El agua sintética consistió en la mezcla de una solución rica en iones Calcio, y otra rica en iones Sulfato. La composición de estas se presenta en la Tabla 2.
Tabla 2 Composición de aguas sintéticas según norma NACE TM0374-2007
| Solución rica en Calcio | Solución rica en Sulfato |
| 7.50 g/L NaCl | 7.50 g/L NaCl |
| 11.10 g/L CaCl2*2H2O | 10.66 g/L Na2S04 |
Entre las pruebas realizadas para la caracterización se tienen: contenido de sólidos sólidos totales y suspendidos (COVENIN 2461-87), sólidos disueltos (CO-VENIN 2342-86), Cloruros (COVENIN 3141-1995), dureza cálcica (COVENIN 2771-91) y pH (COVENIN 2462-87).
Formulación y caracterización de los inhibidores de incrustación a distintos tamaños de partículas de pectina deshidratada
En esta etapa se formularon las diferentes muestras de inhibidor de incrustaciones al mezclar las partículas de pectina deshidratada por parchita con agua destilada. Tales formulaciones se llevaron a cabo tomando en consideración dos parámetros principales; en primer lugar el tamaño de partículas de las cuales se seleccionaron dos con base al estudio granulométrico previo (mayores o iguales a 841 micrones y menores o iguales a 420 micrones); en segundo lugar, se consideraron tres concentraciones (2 %, 4 % y 6% m/V). Una vez realizadas las diversas formulaciones de los antiincrustantes se procedió a caracterizarlas a partir de sus propiedades fisicoquímicas como viscosidad (ASTM D2196-18e1) y densidad (ASTM D369). La determinación del contenido de sólidos totales, pH y estabilidad térmica se llevaron a cabo siguiendo lo establecido en las normas anteriormente presentadas para la caracterización de la pectina y el agua sintética.
Evaluación del inhibidor experimental
Los ensayos de evaluación de la eficiencia de los inhibidores de incrustaciones formulados a escala de laboratorio se realizaron en estado estático en capilares de vidrio, siguiendo el procedimiento especificado en la norma NACE TM-0374-2007. El ensayo tuvo una duración de 24 horas, a una temperatura de 71 ± 1 ºC (160 ± 2 °F) y a presión atmosférica.
Dicha norma permitió determinar la capacidad de los químicos antiincrustantes para mantener soluble el Sulfato de Calcio (CaSO4) evitando su precipitación, que estuvo basado en la obtención del porcentaje de eficiencia con dosis aplicadas en partes por millón (ppm); 10 ppm y 100 ppm y una adicional considerada por los investigadores (55 ppm). En estos ensayos se emplearon los inhibidores de incrustaciones formulados con pectina deshidratada a base de parchita y el ácido clorhídrico (HCl), tomado como agente referencial. Transcurridas las 24 horas de calentamiento, la muestra se dejó en reposo hasta una temperatura de 25 ± 5 °C (77 ± 9 °F), luego se extrajo la cantidad de muestra suficiente para determinar las concentraciones disueltas de Calcio en forma de dureza cálcica, obteniendo las eficiencias de los químicos antiincrustantes empleados, mediante la siguiente expresión:
Donde:
Ca = dureza cálcica en ppm de la muestra tratada después de la precipitación
Cb = dureza cálcica en ppm del blanco después de la precipitación (blanco caliente)
Cc = dureza cálcica en ppm del blanco antes de la precipitación (blanco frío)
Posteriormente, se realizó un estudio estadístico de acuerdo con los resultados obtenidos asociados a la efectividad de las formulaciones realizadas en esta etapa. Este análisis se hizo fundamentado en un ANOVA (Análisis de varianza) simple; un procedimiento que se basa en una prueba estadística que ejecuta de forma simultánea e independiente la comparación entre las medias de más de dos poblaciones, permitiendo identificar las fuentes de variación y estimar la varianza de todos los datos sin atender a su causa. Los datos considerados para llevar a cabo este análisis fueron las medias de los valores de dureza cálcica arrojados por cada muestra de agua sintética luego de la aplicación de los tratamientos antiincrustantes, utilizando para ello el programa Statgraphics Centurion XVI.II Versión 16.02.0004.
Discusión y análisis de resultados
Con base en el gel obtenido, luego de la precipitación de la solución pectínica con el etanol, se puede decir que este presentó un color amarillo traslúcido, y en cuanto a su apariencia fue un gel firme y consistente. En el caso de la pectina deshidratada, el color presentado fue de tonalidades variantes entre marrón claro y oscuro con una apariencia de laminilla. Tales características se atribuyen al proceso de deshidratación del mismo al someterlo a calentamiento. En la Figura 1, se aprecia a la izquierda el hidrogel pectínico y a la derecha la presentación deshidratada.

Figura 1. Presentación en hidrogel (izquierda) y deshidratada (derecha) de la pectina de Passiflora edulis obtenida
Como paso inicial se obtuvo la clasificación de los tamaños de partículas a través de un análisis granulométrico. En la Tabla 3 se muestran los valores correspondientes a los tamaños de partículas de pectina deshidratada obtenidos luego de su paso por los diferentes tamices empleados.
Tabla 3 Análisis granulométrico de la pectina de parchita deshidratada
| Tamaño Partícula (micrones) | Cantidad de pectina (g) |
| ≥ 841 | 37.55 |
| 420 | 32.46 |
| 250 | 7.65 |
| 177 | 2.67 |
| 149 | 1.60 |
| 74 | 1.53 |
| 44 | 0.74 |
Para efectos de este estudio se discretizaron dos tamaños de partículas; uno con un tamaño mayor o igual a 841 micrones y otro menor o igual a 420 micrones. La mayor cantidad de pectina correspondió a las partículas de mayor tamaño (≥ 841 micrones), observándose una disminución de las cantidades de las mismas conforme disminuyó la dimensión de estas. Los diferentes tamaños reflejaron distintos comportamientos en las evaluaciones realizadas, donde resultaron ser más o menos solubles según el caso.
En la Tabla 3 se exhiben los resultados obtenidos una vez realizadas las diferentes pruebas de laboratorio para la caracterización física y química de la pectina de parchita deshidratada.
El gel de la pectina a base de parchita arrojó un rendimiento de 14.5 %, lo que permitió deducir que el proceso de hidrólisis ácida empleado para la extracción de dicha pectina pudo verse afectado por algunos parámetros durante su desarrollo, entre los cuales pueden mencionarse el tiempo de duración de la hidrólisis, la temperatura de operación, el pH establecido y el grado de madurez de las cáscaras utilizadas. Otro aspecto influyente en el proceso de extracción del precipitado pectínico lo constituyó el alcohol empleado, cuya concentración pudo no haber sido la requerida.
Por otra parte, el rendimiento de la pectina deshidratada obtenido fue de 0.50 %; lo cual puede considerarse un valor bajo, atribuyéndose esto a la considerable cantidad de líquido retenido en la pectina en gel. En síntesis, se puede decir que los rendimientos no fueron los esperados, todo esto basado en las aseveraciones de fuentes bibliográficas que califican a la parchita como una de las frutas con mayor cantidad de pectina presente en el mesocarpio, exhibiendo rendimientos en gel comprendidos entre 15 y 20 % según lo establecido por Rojas et al. (2008). En el caso de la pectina deshidratada se esperan valores cercanos a 5.38 % según lo indicado por (Cruz, 2011).
El valor correspondiente al porcentaje de humedad fue de 96.56 %; lo que es un indicativo de la alta cantidad de líquido presente en la pectina en gel, el cual proviene del agua que conforma la cáscara del fruto, el alcohol utilizado en el proceso de gelificación de la solución pectínica y el agua del proceso de hidrólisis, donde se deduce que la pectina obtenida al ser de alta humedad, requiere de mayor tiempo para su deshidratación, además de ser fácil su adherencia. Esto permite justificar el bajo rendimiento obtenido para el caso de la pectina deshidratada.
En cuanto al pH de la pectina en gel fue de 4.88; este es producto de la utilización de ácido cítrico como agente extractor en el proceso de hidrólisis llevado a cabo. Dicho valor, correspondiente al potencial de hidrógeno de la pectina, permite confirmar la estabilidad de esta, ya que entre más ácida sea la pectina, mayor será su tendencia a gelificar, es decir, a menor pH se obtendrá una mayor gelificación del precipitado pectínico.
Tabla 4 Propiedades fisicoquímicas de la pectina de Passiflora edulis obtenida
| Prueba | Unidad | Resultado |
|---|---|---|
| Color y apariencia (Gel/Deshidratada) | - | 14.5 |
| Rendimiento (Gel) | % | 0.50 |
| Rendimiento (Polvo) | % | 96.56 |
| Humedad | % | 4.88 |
| pH | - | 0.9211 |
| Densidad | g/mL | 0.9211 |
| Gravedad específica | - | 3298.11 |
| Peso equivalente | mg/meq | 27.19 |
| Contenido de Metoxilo | % | 96.66 |
| Grado esterificación | % | 78.36 % (≥ 841 micrones) |
| Solubilidad | % | 83.68 % (≤ 420 micrones) |
El valor correspondiente a la densidad del gel pectínico fue de 0.9211 g/mL. Dichas propiedades resultan menores al valor de densidad y gravedad específica manejadas comúnmente para el agua pura a temperatura ambiente. De acuerdo con esto, dichos valores permiten estimar el grado de solubilidad que tendrá la pectina, donde la misma presentará cierta facilidad para solubilizarse en agua debido a que su densidad es menor que la presentada por el medio donde se solubilizará.
Relacionado con lo anterior, los resultados de solubilidad se obtuvieron con base en los dos rangos de tamaños de partículas que se emplearon, siendo para el tamaño 1 (≥ 841 micrones) de 78.36 % y para el tamaño 2 (≤ 420 micrones) de 83.68 %; lo que permite corroborar que mientras menor sea el tamaño de las mismas, mayor será la capacidad de la pectina de disolverse en un medio acuoso y, por ende, menor será la cantidad de sólidos que permanezcan. Desde el punto de vista de la pectina empleada como inhibidor de incrustaciones minerales, un menor tamaño de partícula resultaría más propicio a fin de que exista una menor cantidad de sólidos dispersos en la fase acuosa.
Respecto al grado de esterificación de la pectina obtenida, este fue de 96.66 %; lo que permite definirla como de alto grado de esterificación debido a que el resultado fue mayor a 50 %. Tal y como lo especifica Vaclavik (1998), dicho valor representa que 96.66 % de grupos carboxilos fueron esterificados con metanol. Este parámetro se relaciona con la madurez y especie de la fruta, procedimiento para la extracción de la pectina y escenarios empleados para dicho proceso. Es importante destacar que una pectina al ser de alta esterificación habla de una óptima capacidad para la formación de geles en sistemas acuosos y una vez llevada a cabo la interacción molecular, contribuye a la firmeza de la viscosidad de la sustancia expuesta a los efectos de la pectina.
El contenido de Metoxilos fue de 27.19 %; dando un indicio de la proporción de los ácidos carboxílicos presentes en la pectina, los cuales se encuentran metoxilados (esterificados con metanol), permitiendo calificarla como una pectina de bajo metoxilo por considerar este valor menor a 50 %. Al relacionar el contenido de metoxilo con el grado de esterificación, se comprobó que intervienen en la esterificación con los grupos carboxilos de los ácidos anhidrogalacturónicos que conforman la cadena pectínica. Este parámetro juega un papel importante en la estabilidad de la pectina como agente enlazante hidrofílico. Lo precedente se corrobora por Yúfera (2000), que indica que las pectinas con alto grado de esterificación o metoxilación, como la obtenida, generalmente presentan una alta solubilidad en agua, una rápida gelificación y solidificación de sus moléculas.
El peso equivalente de la pectina de Passiflora edulis, arrojó un valor aproximado a 3298.11 mg/meq; representando este la cantidad de grupos carboxilos libres que conforman la cadena de la pectina, los cuales aumentan con el estado de maduración de la fruta. Se espera que el peso equivalente sea menor a medida que el pH disminuye (aumenta la acidez del medio). El valor obtenido resultó cercano al de otras especies de frutas como el mango (Ferreira et al., 1995) señalando valores que fluctúan entre los 3000 y 7000 mg/meq. El peso equivalente permite tener una idea de la viscosidad y del poder gelificante de la pectina obtenida, ya que estas características están muy asociadas con el peso molecular y el tamaño de la cadena de pectina, parámetros que resultan técnica y económicamente difíciles de conocer, pero que pueden obtenerse a partir del conocimiento del valor del peso equivalente de la misma.
Con relación a la presencia de los grupos funcionales presentes en la base química estudiada, estos se determinaron mediante un espectro infrarrojo, el cual proporciona una serie de curvas de absorbancia, las cuales varían de acuerdo con determinadas energías de vibración características de cada tipo de enlaces químicos. Basados en la Figura 2, se puede observar la presencia de enlaces OH-, grupo perteneciente al etanol, cuya existencia es producto de su utilización como precipitante de la pectina, los cuales aparecen en un rango comprendido entre los 3600 y 3300 cm-1, asimismo, en el rango comprendido entre los 3100 y los 2900 cm-1 se evidencia una interacción carbono-hidrógeno (C-H).
En la región de los 2700 cm-1 y los 2300 cm-1 se ubican los grupos carboxilos (C=O) de los ésteres. Luego en la posición de los 2100 hasta los 1750 cm-1 se puede observar la presencia de los grupos carbonilos (C=O) de los ácidos. Más adelante, se evidencia la presencia de agua en forma de vapor en el rango de los 1500 cm-1 y por último se visualizan unas oscilaciones entre 1000 cm-1 y 700 cm-1 propias de los anillos benzoicos.
Como se puede observar en la Figura 3, las partículas en suspensión en el centro y en el contorno del lente manifiestan una alta presencia de elementos insolubles.
Además de esto, se puede observar el encapsulamiento del etanol como resultado del proceso eficaz de hidratación de las partículas de pectina tan pronto ambos entraron en contacto. Asimismo, la presencia tan marcada del alcohol en el sistema hace que este sea más susceptible a la variación de la temperatura, lo que se traduce en una rápida degradación térmica.
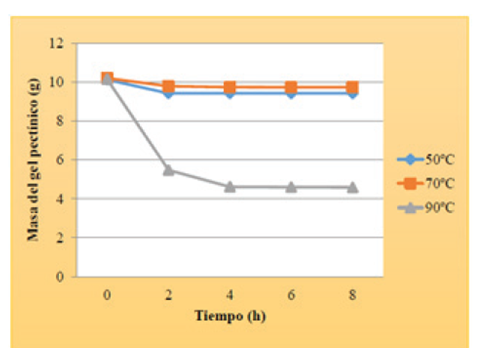
En la siguiente Figura 4 se muestra el comportamiento correspondiente a las variaciones de las masas que experimentó el gel pectínico durante el desarrollo de la prueba de estabilidad térmica. Conviene aclarar que las masas correspondientes al tiempo cero (0) representan la masa inicial de la muestra sometida al estudio.
Se puede observar claramente que para la temperatura de 50 ºC y 70 ºC el gel mostró una disminución de la masa respecto al valor inicial, pero luego de transcurridas las dos horas de exposición a temperatura, la misma se estabilizó. Sin embargo, para la temperatura de 90 ºC se observa que la variación de la masa del gel fue más marcada, por lo que tardó un poco más en alcanzar la estabilización. De acuerdo con esto se puede deducir, que la pectina en gel no se degradó térmicamente al exponerla a temperaturas menores a los 70 ºC, pero al superar este valor la misma comenzó a hacerse cada vez más inestable arrojando variaciones de su masa, debido a que al sobrepasar los 75 ºC la pectina es fácilmente degradable, según lo planteado por Yúfera (2000).
Respecto al agua sintética formulada en base a Sulfato de Calcio (CaSO4), siguiendo lo establecido por la norma NACE TM0374-2007, esta presentó las propiedades fisicoquímicas mostradas en la Tabla 5. Esta muestra de agua formulada se caracterizó por presentar un elevado poder incrustante y corrosivo, en función a los valores de dureza cálcica y cloruros arrojados. En cuanto a los cloruros, la Organización Mundial de la Salud (OMS) considera que una concentración de cloruros mayor a 250 ppm influye en la corrosividad del agua (Vargas, 2004). Sin embargo, el contenido de esta propiedad del agua sintética formulada arrojó un valor de 599.86 ppm. Asimismo, la Asociación Regional de Empresas de Petróleo y Gas Natural en Latinoamérica y el Caribe (ARPEL) (2007) establece que el contenido de cloruros para un agua de formación debe ser menor a 250 ppm, tomando 300 ppm como máximo valor aceptable.
Tabla 5 Propiedades físicas y químicas del agua sintética formulada
| Prueba | Unidad | Resultado |
| pH | - | 6.91 |
| Cloruros | ppm | 599.86 |
| Sólidos totales | ppm | 17200 |
| Sólidos disueltos | ppm | 11440 |
| Sólidos suspendidos | ppm | 5760 |
| Dureza cálcica | ppm | 1200 |
| Calcio | ppm | 480 |
La dureza cálcica (1200 ppm) la califica como un agua muy dura dado que la misma se encuentra por encima de los 500 ppm, valor límite estipulado por el Decreto 883 (1995) para las aguas Sub-Tipo 1A y Sub-Tipo 1B. A fin de prevenir la formación de las incrustaciones, este parámetro es uno de los principales que se desea controlar mediante la implementación de los diferentes inhibidores.
En la Tabla 6 se evidencian los resultados de la caracterización de los inhibidores naturales a base de pectina de Passiflora edulis, en función de la diferenciación hecha por los rangos de tamaño de partículas considerados. Basados en las diferentes concentraciones a las cuales se formularon los inhibidores, se puede observar que a mayor concentración mayor resultó ser la densidad y el con tenido de sólidos totales, valor que incluye tanto los sólidos disueltos como los sólidos suspendidos.
Tabla 6 Caracterización de las muestras de inhibidor formuladas a diversas concentraciones y tamaños de partículas
| Propiedad | Tamaño Partículas | 2 % m/V | 4 % m/V | 6 % m/V |
|---|---|---|---|---|
| Sólidos Totales (ppm) | ≥ 841 micrones | 1742 | 2872 | 4900 |
| ≤ 420 micrones | 1956 | 2412 | 4252 | |
| pH | ≥ 841 micrones | 4.37 | 4.24 | 4.16 |
| ≤ 420 micrones | 4.36 | 4.21 | 4.12 | |
| Viscosidad (cPs) (25 °C) | ≥ 841 micrones | 13.93 | 653.25 | 5782.88 |
| ≤ 420 micrones | 9.48 | 492 | 1938.75 | |
| Densidad (g/mL) | ≥ 841 micrones | 1.0119 | 1.0182 | 1.0193 |
| ≤ 420 micrones | 1.009 | 1.0152 | 1.0173 |
Desde el punto de vista de la función del inhibidor, se busca que el contenido de sólidos totales sea lo más bajo posible a fin de no introducir más sólidos al sistema de producción. Este parámetro no determina directamente la eficiencia del inhibidor, pero si resulta importante su consideración, ya que se espera una menor cantidad de sólidos involucrados en el sistema para así evitar problemas o daños a equipos (Crabtree et al., 1999).
Concerniente al pH, se aprecia que a mayor concentración se obtuvo un menor valor de esta propiedad, debido a que al mismo tiempo se está involucrando o adicionando una mayor cantidad de pectina, la cual se caracteriza por ser ácida, confiriéndole así una mayor acidez al inhibidor conforme se aumenta la cantidad empleada del mismo.
Por otro lado, atendiendo el tamaño de partículas, se puede observar que el tamaño 2 (≤ 420 micrones), por ser los más solubles, son los que incrementan la acidez de los inhibidores, es decir, generan una disminución del potencial de hidrógeno. Con base en los inhibidores de incrustaciones disponibles en el mercado, que en su mayoría se caracterizan por ser ácidos, se puede decir que mientras menor sea el pH mayor será la eficiencia de los mismos previniendo la formación de incrustaciones.
Según los valores obtenidos en la Tabla 6, se expone que la viscosidad varía proporcionalmente con la concentración de los inhibidores formulados, es decir, que a mayor concentración, mayor resulta ser la viscosidad, dado que existe una mayor cantidad o concentración de sólidos presentes en el inhibidor haciéndolo más viscoso. Respecto a los tamaños de partículas, se puede observar que para el menor tamaño, es decir, las partículas menores o iguales a 420 micrones, la viscosidad fue menor que para los inhibidores formulados a base de pectina de tamaño mayor o igual a 841 micrones, lo cual se atribuye al hecho de que a menor tamaño la solubilidad se ve favorecida y en consecuencia se ve reducida la viscosidad del inhibidor.
En la Tabla 7 se muestran los valores de porcentajes de inhibición obtenidos para las diferentes concentraciones a partir de las que se generaron los inhibidores, considerando además de esto las dosis en las cuales se utilizaron los mismos.
Tabla 7 Resultados de la aplicación de la prueba de botella según la norma NACE TM0374-2007
| Concentración (% m/V) | Dosis (ppm) | Tamaño Partículas (micrones) | Eficiencia (%) |
| ≥ 841 | 14.17 | ||
| 10 | ≤ 420 | 19.17 | |
| ≥ 841 | 22.50 | ||
| 2 | 55 | ≤ 420 | 27.50 |
| ≥ 841 | 33.33 | ||
| 100 | ≤ 420 | 39.17 | |
| ≥ 841 | 39.17 | ||
| 10 | ≤ 420 | 44.17 | |
| ≥ 841 | 47.50 | ||
| 4 | 55 | ≤ 420 | 55.83 |
| ≥ 841 | 60.83 | ||
| 100 | ≤ 420 | 66.67 | |
| ≥ 841 | 58.33 | ||
| 10 | ≤ 420 | 66.67 | |
| ≥ 841 | 80.83 | ||
| 6 | 55 | ≤ 420 | 83.33 |
| ≥ 841 | 85.83 | ||
| 100 | ≤ 420 | 89.17 | |
| 10 | 33.33 | ||
| HCl | 55 | 66.67 | |
| 100 | 85.83 |
Como se visualiza, se obtuvieron diferentes porcentajes de eficiencia, los cuales oscilaron entre 14.17 % y 89.17 % correspondiente al inhibidor de 6 % m/V de concentración, dosis de 100 ppm y tamaño de partículas menor o igual a 420 micrones. Los químicos antiincrustantes formulados actuaron en pro de mantener el contenido de Calcio lo más cercano posible al valor de la solución madre (blanco frío), ya que si dicho contenido disminuye, significa que el resto ha precipitado dando lugar a las incrustaciones.
La tendencia incrustante del agua sintética establecida por la norma NACE TM 0374-2007 que resulta de la mezcla de una salmuera rica en Calcio y otra rica en Sulfato, es mayor a las que se encuentran comúnmente en aguas de producción de sistemas reales, lo cual se debe a que el procedimiento descrito en la norma, intenta contrarrestar los efectos de realizar los ensayos en condiciones estáticas, permitiendo prever un mejor desempeño del producto en condiciones de campo menos extremas.
Una mayor o menor eficiencia de los inhibidores se atribuye al hecho de que a mayor concentración de los mismos, mayor fue la retención del Calcio en solución durante la realización de los ensayos, evitando así la precipitación de las sales. Por otro lado, atendiendo al tamaño de partículas, se pudo observar que mientras menos soluble fue la pectina empleada en la formulación del inhibidor, caso correspondiente a las partículas de tamaño mayor o igual a 841 micrones, menor fue la eficiencia obtenida; todo lo contrario ocurre con los inhibidores a base de partículas más solubles, correspondientes a un tamaño menor o igual a 420 micrones, donde se alcanzaron mayores grados o porcentajes de eficiencia.
Respecto al inhibidor formulado a base de pectina, el valor de inhibición obtenido para la concentración de 6 % m/V estuvo por encima de la obtenida con la dosis de 100 ppm de HCl, pero aun así este químico arrojó un porcentaje de inhibición cercano al máximo valor de inhibición de la pectina deshidratada. Dicho ácido actúa sobre las sales, principalmente sobre el CaCO3 aumentando el pH del agua e incrementando así la solubilidad de dicha sal que impide la formación de incrustaciones. Sin embargo, el mismo se empleó en una salmuera de Sulfato de Calcio debido a que es uno de los químicos utilizados para tratamientos antiincrustantes que se encontraba disponible en el laboratorio. El HCl es el más recomendado por su bajo costo y fácil aplicación para remover depósitos de Carbonato de Calcio (CaCO3) y Magnesio bajo variadas condiciones. Normalmente se implementa acompañado de un inhibidor de corrosión para proteger la superficie metálica de la acción corrosiva del ácido (Duplant & Méndez, 2002).
En la Figura 5 se especifican gráficamente los comportamientos encontrados de acuerdo con las eficiencias de los inhibidores experimentales y el HCl (referencial), como paso previo al análisis estadístico que se llevó a cabo. Ahí se exterioriza que los inhibidores de incrustación a base de pectina de Passiflora edulis a sus respectivas concentraciones (2, 4 y 6 % m/V) pero distintos tamaños (≥ 841 y ≤ 420 micrones) presentaron comportamientos similares entre sí, además de apreciarse que el agente antiincrustante de mayor concentración (6 % m/V) formulados en sus dos tamaños de partículas, evidenciaron conductas similares al aditivo patrón (HCl). Lo anterior se corrobora en las tablas estadísticas seguidamente (Tablas 8 y 9); acotando que para efectos de dicho análisis estadístico, el tamaño de partículas mayor o igual a 841 micrones, se señala como uno (1) y el otro tamaño (≤ 420 micrones) como dos (2).
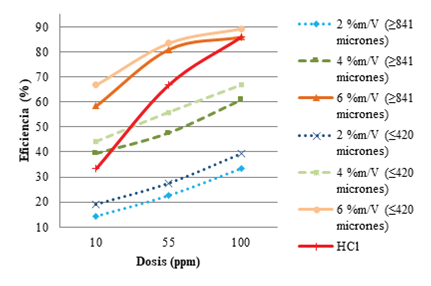
Figura 5. Comportamientos de las eficiencias de los inhibidores experimentales respecto al ácido Clorhídrico (HCl)
Tabla 8 Análisis de Varianza simple para las eficiencias del inhibidor a base de pectina de Passiflora edulis deshidratada y el producto referencial (HCl)
| Fuente | Suma de cuadrados | Gl | Cuadrado medio | Razón-F | Valor-P |
| Entre grupos | 8319.74 | 6 | 1386.62 | 6.49 | 0.0019 |
| Intra grupos | 2991.88 | 14 | 213.705 | ||
| Total (Corr.) | 11311.6 | 20 |
Tabla 9 Prueba de múltiples rangos para las eficiencias del inhibidor a base de pectina de Passiflora edulis deshidratada y el producto referencial (HCl)
| Nivel | Casos | Media | Grupos homogéneos |
| 2 % m/V-1 | 3 | 23.3333 | X |
| 2 % m/V-2 | 3 | 28.6133 | XX |
| 4 % m/V-1 | 3 | 49.1667 | XX |
| 4 % m/V-2 | 3 | 55.5567 | XX |
| HCl | 3 | 61.9433 | XX |
| 6 % m/V-1 | 3 | 74.9967 | X |
| 6 % m/V-2 | 3 | 79.7233 | X |
El ANOVA simple aplicado a la eficiencia del producto experimental en sus tres concentraciones y dos tamaños de partículas, respecto al inhibidor patrón, en la tabla anterior se expone que existieron diferencias estadísticamente significativas (Valor-P menor a 0.05); valorándose lo indicado en el componente entre grupos de la tabla señalada, concediendo esto al hecho de que no todas las medias de cada dosificación son iguales entre sí. Para verificar cuáles medias son significativamente disímiles de otras, seguidamente en la Tabla 9, se muestran los resultados de la prueba de múltiples rangos para los inhibidores a base de pectina con relación al producto referencial.
Se nota que al contrastar las medias de cada agente respecto a los otros, es comprobado lo que se señaló, asociado a que el inhibidor de 2 % m/V formulado en sus dos tamaños de partículas (1 y 2) no presentan diferencias significativas entre sí; ocurriendo lo mismo para las concentraciones de 4 y 6 % m/V. Además se percibe que el inhibidor experimental en su máxima concentración (6 % m/V) presenta similitud conductual respecto al agente modelo (HCl).
Una vez obtenidos los resultados se deduce que el agente químico a base de Passiflora edulis a 6 % m/V (en sus tres dosificaciones y sus dos tamaños de partículas) presentó un comportamiento estadísticamente similar con el agente comercial, que lo cataloga como una buena alternativa experimental a considerar en el ámbito de la industria petrolera, a pesar de que en términos cuantitativos, el producto formulado al menor tamaño de partícula (≤ 420 micrones) resultó con mejor desempeño.
El contraste de los resultados del estudio, con una investigación precedente, en la cual se empleó pectina de Passiflora edulis, en presentación gelificada (Fuenmayor & Peña, 2016), permitió identificar que el antiincrustante en hidrogel generó una eficiencia máxima de 87.18 % a una concentración de 40 %m/V y 100 ppm de dosificación, lo cual le da ventaja a la pectina deshidratada en cuanto a desempeño por aproximadamente dos (2) puntos porcentuales y a una concentración menor (6 % m/V), además de que la presentación deshidratada es propensa a ostentar menor capacidad de degradación por microorganismos que su contraparte gel.
De la investigación derivada de Chauhan et al. (2012), del agente antiincrustante a base de una pectina sintetizada, se exteriorizaron eficiencias máximas de 100 y 97.7 % para inhibir la precipitación de iones de Calcio y Sulfato, respectivamente. Lo anterior coloca en desventaja al producto experimental de pectina de Passiflora edulis, pero es válido acotar que la sintetización mejora las características de desempeño de cualquier agente químico, lo cual por lógica se evidenció en los resultados expuestos por los investigadores foráneos.
Conclusiones
La pectina en estudio resultó altamente soluble en agua, sobre todo en el caso de las que presentaron partículas menores o iguales a 420 micrones, con un valor 83.68 %, confiriéndole esto al producto formulado a este tamaño de partículas, las características físicas más relevantes y una eficiencia para inhibir incrustaciones minerales de Sulfato de Calcio de 89.17 % a 6 % m/V y 100 ppm de dosificación, aunado a la presencia química de compuestos carboxílicos, los cuales se evidenciaron como los principales agentes inhibitorios. Como sugerencia futura de investigación se plantea la realización de pruebas experimentales con otras fuentes naturales de extracción de pectinas sobre la inhibición de incrustaciones, así como la medición del efecto sobre depósitos minerales de Carbonato de Calcio o Sulfato de Bario.











 nueva página del texto (beta)
nueva página del texto (beta)