ANTECEDENTES
El síndrome de Leriche es una enfermedad poco frecuente (menos de 1%) que se origina por la oclusión aguda o crónica de las ramas principales de la aorta abdominal, por debajo de la salida de las arterias renales, con afectación de todo el árbol arterial, incluidas las arterias ilíacas y femorales. Quain la describió por primera vez en 1847 pero no fue sino hasta 1923 cuando Rene Leriche llevó a cabo un estudio más exhaustivo. La mayor parte de las veces este síndrome se asociaba con ateroesclerosis como causa, porque aparecía en pacientes de edad avanzada (alrededor de la sexta década de la vida), sobre todo de sexo masculino y con factores de riesgo para enfermedad arterial periférica (tabaquismo, diabetes, hipertensión arterial, dislipidemia y obesidad). También se han reportado casos en mujeres con trastornos asociados con vasculitis: lupus eritematoso sistémico o espondilitis anquilosante y se ha relacionado con hipoplasia aórtica, radiación, infección congénita por rubéola, sífilis aórtica, enfermedad de Ormond, enfermedad de Buerger y arteritis de Takayasu.1,2
CASO CLÍNICO
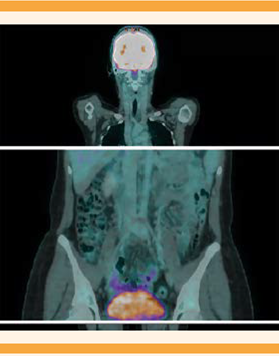
Paciente de 21 años, sin antecedentes familiares de importancia, originaria y residente de Piedras Negras, Coahuila, de ocupación estudiante. Grupo y Rh O+. Antecedente de linfoma de Hodgkin tipo nodular escleroso, EC IIA Bulky, diagnosticado en 2016 y tratada con 8 ciclos de quimioterapia (clorhidrato de doxorrubicina, sulfato de bleomicina, sulfato de vinblastina y dacarbazina) y 20 sesiones de radioterapia, la última en febrero del 2018. Como parte del seguimiento se le practicó una tomografía por emisión de positrones multicorte, sin evidencia de actividad tumoral. El hallazgo radiológico fue de concentración del radiofármaco de manera circunferencial en la aorta, en todo su trayecto, con SUVmax de 2.0, asociado con placas ateromatosas mixtas (Figura 1). Además, engrosamiento circunferencial de la íntima, de localización infrarrenal, que condicionó la disminución de la luz mayor de 95%, antes de su bifurcación (Figuras 2y3). Se trató con ácido acetilsalicílico y pravastatina.
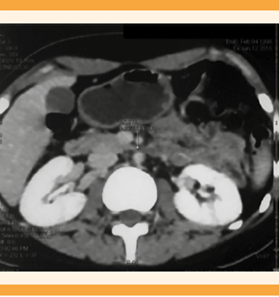
Figura 2 Engrosamiento circunferencial de la íntima de la aorta abdominal infrarrenal. (Flecha con punta blanca).
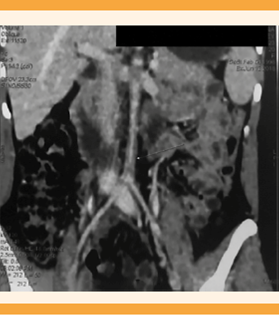
Figura 3 Disminución de la luz de la aorta abdominal mayor de 95% antes de su bifurcación. (Flecha con punta blanca).
Antecedentes quirúrgicos: biopsia paracervical en 2016 y legrado uterino instrumentado en 2017 por aborto incompleto, múltiples transfusiones, niega fracturas. Antecedentes ginecoobstétricos: menarquia a los 12 años, ritmo regular, inicio de vida sexual activa a los 19 años, una pareja sexual, sin método de planificación familiar; dos embarazos, un aborto (2017), fecha de la última menstruación el 25 de enero de 2019, fecha probable de parto 1 de noviembre de 2019.
El control prenatal se llevó a cabo en su unidad de medicina familiar. Se le practicó un ECO 3D en mayo 2019 (Figura 4) que encontró un feto normal para la edad gestacional. Se envió a un hospital de tercer nivel de atención para la finalización del embarazo a las 37 + 3 semanas. A su llegada se integró la historia clínica y le practicó una exploración física completa. Se encontró asintomática y sin daño fetal o hemodinámico. Signos vitales normales. El útero grávido, con feto cefálico dorso anterior, con 145 latidos por minuto con Doppler. Al tacto vaginal, el cuello uterino se encontró posterior, cerrado y duro. Las extremidades inferiores con buena coloración. Los pulsos distales eran simétricos, regulares, de baja amplitud, débiles, sin signos de isquemia. El registro cardiotocográfico fue reactivo. Se decidió inducir el trabajo de parto para evitar los síntomas y signos de la isquemia periférica. No había daño fetal. Se le aplicaron 3 dosis de dinoprostona en gel hasta que alcanzó las condiciones cervicales favorables. Se continuó con oxitocina, y se logró la adecuada dinámica uterina. Se trasladó a la sala de expulsión y, con previa analgesia obstétrica, se atendió el parto con fórceps Salinas II. Se obtuvo un recién nacido vivo sano. Posterior al alumbramiento tuvo atonía uterina que revirtió con 20 UI de oxitocina por vía intravenosa y 0.2 mg de ergonovina por vía intramuscular. Se calculó un sangrado total de 1000 mL. Se trasladó a cuidados intensivos para vigilancia y ahí se inició la tromboprofilaxis con heparina de bajo peso molecular, por el riesgo tromboembólico alto calculado mediante Caprini modificado. Luego de 5 días de internamiento y vigilancia hemodinámica se dio de alta del servicio de Obstetricia, sin complicaciones y se retornó a su unidad de medicina familiar para seguimiento.
DISCUSIÓN
La incidencia y prevalencia exacta del síndrome de Leriche se desconocen porque la mayoría de las pacientes cursan asintomáticos. El cuadro clínico depende del tiempo de evolución y la localización de la lesión; la más habitual es perirrenal (52%), seguida de la infrarrenal (25%), difusa (14%) y suprarrenal (11%).1,2 El cuadro clínico agudo se caracteriza por signos y síntomas de isquemia, sobre todo en las extremidades inferiores. El cuadro crónico está determinado por el grado de aterosclerosis estenosante y de la circulación colateral suficiente para mantener una adecuada perfusión; puede no originar síntomas o ser inespecíficos. Algunas manifestaciones incluyen: claudicación, ausencia de pulso en las arterias femorales, debilidad y entumecimiento de la región lumbar, los glúteos, las caderas y las extremidades inferiores. 2,3
La arteriografía es el patrón de referencia, pero rara vez se practica pues lo habitual es que el diagnóstico sea un hallazgo del eco-Doppler, angio-TAC o angiorresonancia magnética practicados por otras causas. El tratamiento es la revascularización mediante cirugía abierta (trombectomía transfemoral, puente aortofemoral o derivación extraanatómica) o terapia endovascular (trombectomía transfemoral o aórtica con implantación de endoprótesis o stent). 2
En este caso, la paciente tenía el antecedente de haber recibido radioterapia abdominal. Es sabido que la radioterapia es una causa de morbilidad y mortalidad cardiovascular severa, con afectación al pericardio, miocardio, vasculatura coronaria y periférica. La bibliografía de la enfermedad arterial periférica, inducida por radiación, es escasa. Se sabe que puede causar aterosclerosis; de hecho, se ha asociado con aterosclerosis de la arteria renal a la radioterapia para el tratamiento del linfoma Hodgkin, se manifiesta con hipertensión renovascular grave o, incluso, insuficiencia renal aguda en el caso de estenosis de la arteria renal bilateral severa. 4
Se desconocen las complicaciones hemodinámicas materno-fetales relacionadas con las estenosis aórticas y el embarazo. No hay evidencia científica de la mejor vía de finalización del embarazo.
Se llevó a cabo una búsqueda sistemática en PubMed, Science Research, Science direct y Scopus con los Mesh: aortoiliac occlusion disease, pregnancy, delivery, Leriche’s Syndrome. Solo se encontró un artículo de una paciente con un stent por tratamiento de síndrome de Leriche y que finalizó el embarazo sin complicaciones.5 A diferencia de ese artículo, la paciente del caso no había sido tratada quirúrgicamente y la lesión estenótica era importante, quizá afectaba la circulación de los órganos abdominales y pélvicos, incluido el útero. Se desconoce si la perfusión uterina estaba alterada; no obstante, hasta el momento del parto la paciente no tuvo ninguna manifestación.
CONCLUSIÓN
Es importante indagar en los antecedentes de la paciente, principalmente de quienes ya tuvieron alguna neoplasia y recibieron radioterapia abdominal o pélvica. En estas pacientes cabe la posibilidad de estenosis en la arteria aorta que esté afectando el flujo sanguíneo útero placentario. Es posible que en estas pacientes sea adecuado practicar un estudio no invasivo como parte de su control prenatal. Hace falta el reporte de más casos similares para emprender estudios de mayor calidad y determinar las posibles complicaciones que pudieran generarse en las pacientes obstétricas, establecer el seguimiento prenatal y la mejor vía de finalización del embarazo.











 nueva página del texto (beta)
nueva página del texto (beta)