ANTECEDENTES
La elevación de las concentraciones plasmáticas de progesterona en las últimas etapas de la estimulación ovárica es un fenómeno que se observa desde hace varias décadas, aunque no hay una definición clara, ni un punto de corte acordado.1 La frecuencia de esta elevación varía entre los distintos estudios, llegando a alcanzar incluso 24-38%.2,3,4 Sin embargo, en ensayos recientes cifran esta incidencia entre 6.8 y 8.2%.5,6 El origen de esta elevación sigue sin estar claro. Las primeras hipótesis apuntaban a la elevación prematura de la LH o “luteinización prematura”, pero con la supresión hipotalámica al introducir los análogos de la GnRH (agonistas y antagonistas) debía suprimirse este fenómeno. Sin embargo, diversos estudios2,7-10 demuestran que en las fases finales de la estimulación ovárica se incrementan las concentraciones de progesterona, incluso con la LH suprimida.11
Más allá de la causa de esta elevación de progesterona, hay estudios3,4,9,12-18 que encuentran un empeoramiento en los desenlaces del ciclo de fertilización in vitro: disminución en las tasas de implantación, de embarazo en curso, de recién nacido vivo, o aumento en el porcentaje de abortos. Otros autores,2,7,8,19-23 sin embargo, no encuentran estas asociaciones, por lo que la interferencia de la elevación de las concentraciones de progesterona en el ciclo de fertilización in vitro sigue siendo motivo de debate.
La mayoría de quienes analizan la relación entre las concentraciones de progesterona y el ciclo de FIV, lo hacen en el día de la inducción de la ovulación. El valor umbral de progesterona varía entre los diferentes estudios de 0.8 a 2 ng/mL,2,3,12 aunque los estudios más recientes cifran esta concentración en 1.5 ng/mL.6,13,18 Hasta la fecha solo dos estudios16,21 han investigado la repercusión de la elevación de la progesterona en un momento más cercano a la transferencia embrionaria, en el día de la captura ovocitaria o punción folicular. Niu, en 2008,21 investigó la relación entre las concentraciones de progesterona y la cantidad de embriones viables y el desenlace del ciclo: encontró mayor cantidad de ovocitos y de embriones viables con concentraciones de progesterona superiores a 11.7 ng/mL, aunque las tasas de implantación, de embarazo clínico y de embarazo en curso no difieren. Por el contrario Nayak, en 2014,16 encontró peores tasas de embarazo cuando las concentraciones de progesterona excedieron 12 ng/mL en ciclos con antagonistas de GnRH.
Puesto que solo se encontraron dos estudios que analizan la elevación de la progesterona en el momento de la captura ovocitaria, y los resultados son dispares, el objetivo de este estudio fue: evaluar si las concentraciones elevadas de progesterona el día de la captura de ovocitos influyen en el desenlace del ciclo de fertilización in vitro.
MATERIALES Y MÉTODOS
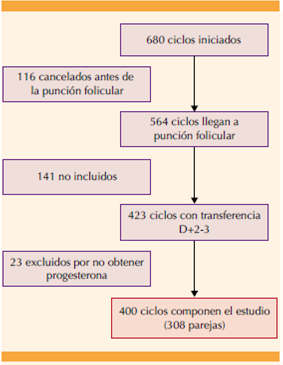
Estudio de cohortes, prospectivo, efectuado en la Unidad de Reproducción del Complejo Hospitalario Universitario de Albacete, entre septiembre de 2014 y marzo de 2017, de ciclos de FIV-ICSI, con protocolo agonista largo o antagonista y con transferencia de embriones en fresco en día 2-3. Criterios de inclusión: mujeres entre 18 y 40 años que recibieron fertilización in vitro con transferencia de embriones en fresco en día 2-3. No se incluyen ciclos con biopsia testicular, ni pacientes en tratamiento con estrógenos, corifolitropina o inducción de la ovulación con agonistas de la GnRH. Criterios de exclusión: pacientes en quienes no se consiguieron las concentraciones de progesterona o que no finalizaron el seguimiento a las semanas 6-7 de embarazo.
Los ciclos de fertilización in vitro se han efectuado en protocolo largo con agonistas de la GnRH (acetato de leuprorelina, Procrin®, administrados a partir de la mitad de la fase lútea previa, y en protocolo de antagonistas de GnRH (Cetrorelix, Cetrotide® introducidos al sexto día de estimulación. El 89.8% (n = 359) de los ciclos se hizo en protocolo con antagonistas de GnRH; el resto de los ciclos con protocolo agonista largo (n = 41). La estimulación ovárica se llevó a cabo mediante la administración de una dosis individualizada de gonadotropinas, con base en las características de las pacientes y la causa de la esterilidad. Los fármacos indicados: folitropina α (Gonal-f®, folitropina β (Puregón®, urofolitropina (Fostipur®, menotropina altamente purificada (Menopur® y folitropina α más lutropina α (Pergoveris®, administrados solos o en combinación. El control del ciclo se realizó con el recuento y medición de los folículos mediante ecografía transvaginal y la medición del estradiol sérico, ajustando las dosis en función de la respuesta. Cuando al menos 3 folículos alcanzan un diámetro medio de 18 mm, se administran 250 µg de hCG-r (Ovitrelle©, realizando la punción folicular a las 34-36 horas. La fecundación se llevó a cabo mediante fertilización in vitro convencional o ICSI. Los embriones se clasifican conforme a los criterios de la Asociación para el Estudio de la Biología de la Reproducción (ASEBIR)24 en tipo A, B, C y D; se consideran de buena calidad los tipos A y B. En todos los casos se efectuó soporte de la fase lútea con la administración vaginal de 600 mg al día de progesterona natural micronizada (Utrogestan®, Progeffik® o la inyección diaria subcutánea de progesterona (Prolutex®, la transferencia embrionaria se efectuó en día 2-3.
El diagnóstico de embarazo se establece mediante la determinación sérica de β-HCG a los 15 días de la punción folicular. Se considera positivo un valor superior a 20 mUI/mL. El embarazo bioquímico se definió como el valor positivo de β-HCG, y el clínico con la coexistencia de al menos un embrión vivo intrauterino en las semanas 6-7 de gestación. La medición de las concentraciones de progesterona se efectúa mediante extracción de sangre venosa periférica el día de la punción folicular; se evalúa con los analizadores automáticos Elecsys 170 (Roche Diagnostics SL, Sant Cugat del Vallès, España) mediante inmunoensayo de electroquimioluminiscencia (ECLIA), con sensibilidad de 0.030 ng/mL, y coeficiente de variación interdía menor de 2.9%.
Para valorar la repercusión de las concentraciones de progesterona en el ciclo de fertilización in vitro se emplea el valor de la progesterona como una variable continua, con distribución no ajustada a la distribución normal, dicotomizada como progesterona normal o alta. Se consideran elevadas las concentraciones superiores al percentil 90. Para determinar la distribución de las concentraciones de progesterona se utilizó la prueba de Kolmogorov-Smirnov; y técnicas no paramétricas para estudiar la relación entre las variables ordinales y numéricas, como la prueba de U Mann-Whitney para dos muestras independientes; y para los casos de más de dos muestras independientes se emplea la prueba de Kruskal-Wallis. Para la comparación entre variables ordinales o continuas se recurre a la tau-b de Kendall y Rho de Spearman. Para la comparación entre variables categóricas se utiliza la prueba de χ2, con la corrección de Fisher. Los cálculos estadísticos se efectúan con el programa SPSS, V23, y se considera significación estadística a los valores de p menores de 0.05.
RESULTADOS
Se estudiaron 400 ciclos, correspondientes a 308 parejas. La edad media de las pacientes fue de 34.7 años, con media de IMC de 24.19 kg/m2. El 96.3% de las pacientes padecía esterilidad primaria, y las causas más frecuentes fueron: factor masculino (40.5%), factor tubárico (25.8%) y reserva ovárica disminuida (19%). En 15.8% de los casos la esterilidad fue de origen desconocido. (Cuadro 1) El análisis de los valores de progesterona reveló que no sigue un patrón de distribución normal, con media de 7.51 ng/mL (± 4.87), mediana de 6.40 ng/mL y percentil 90 de 14 ng/mL. Cuadro 2
Cuadro 1 Características de las pacientes y de los ciclos
| Variables | Media ± DE/porcentaje |
| Edad (años) | 34.75 ± 3.53 |
| IMC (kg/m2 | 24.19 ± 4.73 |
| Nuliparidad | 96.3 |
| Factor masculino | 40.5 |
| Factor tubárico | 25.8 |
| Reserva ovárica disminuida | 19 |
| Esterilidad de origen desconocido | 15.8 |
| FSH basal (mUI/mL) | 7.14 ± 2.07 |
| Estradiol basal (pg/mL) | 46.99 ± 24.69 |
| Recuento de folículos antrales | 11 ± 5.65 |
| Protocolo antagonista | 89.8 |
| Protocolo agonista | 10.2 |
| Tiempo de estimulación (días) | 10.06 ± 1.66 |
| Dosis total de gonadotropinas (UI) | 1762.99 ± 695.3 |
| Folículos puncionados | 11.33 ± 5.63 |
| Ovocitos | 7.58 ± 4.6 |
| Ovocitos MII | 6.10 ± 3.74 |
| Embriones totales | 4.32 ± 2.74 |
| Embriones clase A+B | 0.54 ± 0.84 |
| Tasa de fecundación (%) | 70.1 |
Cuadro 2 Distribución de los valores de progesterona
| Variables | ng/mL |
| Media | 7.511 |
| Mediana | 6.400 |
| Moda | 4.5 |
| Desviación estándar | 4.8732 |
| Rango | |
| Mínimo | 0.9 |
| Máximo | 29.8 |
| p90 | 14 |
En el análisis de las variables de las características de las pacientes y de los ciclos, en función de las concentraciones de progesterona, se encontró que su distribución fue la misma entre las mujeres con factor tubárico, abortos de repetición o esterilidad de origen desconocido. Las mujeres con reserva ovárica disminuida y endometriosis tuvieron menores concentraciones de progesterona y, por el contrario, las pacientes con síndrome de ovario poliquístico tuvieron concentraciones mayores. Cuando la estimulación se realizó con FSHr y FSHu las concentraciones de progesterona fueron significativamente mayores, que cuando se utilizó HMG, aunque hay que tener en cuenta que casi siempre estos fármacos se indican combinados.
Se encontró una correlación positiva entre las concentraciones de progesterona y el recuento de folículos antrales, las concentraciones de estradiol el día de la inducción de la ovulación, la cantidad de folículos puncionados, de embriones totales y de calidad óptima, y de ovocitos obtenidos en metafase II. Por el contrario, se observó asociación inversamente proporcional entre las concentraciones de progesterona, las basales de FSH, la edad de las pacientes y el IMC; todos estos datos fueron significativos.
Tomando como punto de corte el percentil 90 de progesterona, no se encontraron diferencias significativas en la tasa de embarazo bioquímico (40.2% frente al 41%), aunque la tasa de embarazo clínico fue ligeramente menor en el grupo con elevación de la progesterona (33.5 vs 30.8%) y se encontró un porcentaje considerablemente mayor de abortos en este grupo (25.7 vs 43.8%), aunque estos datos no alcanzan el grado de significación. (Cuadro 3) De la misma manera, cuando los embarazos se analizan por subgrupos, en función del protocolo aplicado (agonista-antagonista), tampoco se encontraron diferencias significativas en alguno de los grupos.
DISCUSIÓN
Se analizaron las concentraciones de progesterona en un momento del ciclo que ha sido poco estudiado: el momento de la captura ovocitaria. Los desenlaces de nuestro estudio ponen de manifiesto que las concentraciones de progesterona no se asocian con la tasa de embarazo luego de un ciclo de FIV con transferencia de embriones en fresco en día 2-3, aunque hubo un incremento no significativo de abortos.
Los dos estudios que analizan las repercusiones de las concentraciones de progesterona en este momento16,21 obtienen diferentes resultados para un valor umbral de progesterona similar, de 11.7 y 12 ng/mL, respectivamente. Aunque el valor absoluto de la progesterona es parecido en los dos estudios, Niu21 eligió este punto de corte para predecir tener 4 o más embriones viables. Este nivel es inferior a la media de su población; es decir, elevación de la progesterona. Las diferencias en las características de la población y en las concentraciones de progesterona pueden ser importantes y justificar los distintos resultados.
Al contrario de Nayak16 no se encontraron diferencias en las tasas de embarazo en función de las concentraciones de progesterona el día de la captura de ovocitos, ni tampoco en el grupo de protocolo antagonista, aunque sí se observó una discreta reducción de embarazos clínicos. De igual forma, se encontró un porcentaje significativamente mayor de abortos cuando las concentraciones de progesterona estuvieron elevadas, aunque sin significación estadística. Esto contrasta con lo publicado por otros autores4,10,13,15 que analizan las concentraciones de progesterona el día de la captura de ovocitos y que sí encuentran empeoramiento en el desenlace del ciclo. En los artículos publicados recientemente17,23,25 tampoco se encuentran estos efectos deletéreos. La heterogeneidad entre los distintos estudios, tanto en la selección de las pacientes como en los protocolos y los fármacos indicados, así como en las concentraciones de progesterona indicadas como umbral, puede ser lo que explique los distintos resultados. Otra posibilidad que explicaría que no hayamos demostrado disminución de los embarazos clínicos, en comparación con otros autores, es el momento elegido para definir embarazo clínico o evolutivo, que se analizó en la semana 6-7. Otros autores, como Andersen9 o Barros-Delgadillo4 lo hacen en la semana 11 y 12 respectivamente, o incluso en la 20, como Bosch. 13
En el análisis de las concentraciones de progesterona, en función de la causa de esterilidad, se encontraron menores valores en pacientes con reserva ovárica disminuida y endometriosis, y mayores en pacientes con diagnóstico de síndrome de ovario poliquístico. Nuestros resultados ponen de manifiesto que las concentraciones de progesterona el día de la captura de ovocitos guardan relación con la reserva ovárica y la respuesta esperada a la estimulación. Puesto que existen factores asociados con la elevación de la progesterona, las diferencias poblacionales en cuanto a causas de esterilidad de los distintos estudios podría ser otra de las razones que justificasen los distintos resultados finales. De igual forma, la asociación entre las concentraciones de progesterona con la edad y las concentraciones basales de FSH, remarca la relación entre estos y la reserva ovárica.12,16,23
En nuestro estudio encontramos una correlación positiva entre las concentraciones de progesterona y el recuento basal de folículos antrales, las concentraciones de estradiol el día de la inducción de la ovulación, la cantidad de folículos puncionados y de ovocitos obtenidos, de ovocitos metafase II, y de embriones totales y de calidad óptima. Esto pone de manifiesto que las concentraciones de progesterona al final de la estimulación del ciclo de fertilización in vitro están íntimamente relacionadas con la reserva ovárica y la respuesta a la estimulación. Con base en nuestros resultados, podemos concluir que la elevación de progesterona el día de la punción folicular no interfiere en el número o calidad de los ovocitos, ni de los embriones generados. De interferir en el resultado del ciclo, debería hacerlo a otro nivel. Estos hallazgos también son corroborados por otros autores11,13,16,21 y varios metanálisis.26-2826,28
CONCLUSIONES
La elevación de las concentraciones de progesterona (más de 14 ng/mL) el día de la captura de ovocitos no empeora el desenlace del ciclo de fertilización in vitro en cuanto a tasas de embarazo, aunque se observa una tendencia a la disminución en la tasa de embarazo clínico y mayor cantidad de abortos en el grupo con elevación de las concentraciones de progesterona. De tener un efecto perjudicial en el resultado del ciclo, éste no debe ser por afectación de los ovocitos, ni de los embriones generados. Puesto que hay estudios que sí encuentran un empeoramiento del ciclo será interesante continuar investigando en esta línea, y que cada centro elabore su propio punto de corte, con base en las características de su población.











 nueva página del texto (beta)
nueva página del texto (beta)