Introducción
Las fluctuaciones en los factores físicos tienen un fuerte efecto en la estructura de las comunidades y en la dinámica de los ecosistemas acuáticos (Steele, 1985). Dos de los factores más importantes que afectan la dinámica fitoplanctónica son la temperatura y la luz (Pollingher, 1986). Por un lado, la temperatura influye en el patrón de circulación de los ecosistemas acuáticos y éste a su vez en la dinámica fitoplanctónica; la estratificación térmica de las masas de agua permite al fitoplancton mantener una distribución vertical diferencial mientras que la mezcla vertical lo distribuye a lo largo de la columna de agua y transporta nutrientes desde las capas más profundas y ricas en éstos hasta las capas someras y carentes de los mismos (Tilzer & Goldman, 1978).
Por otro lado, se ha observado una variedad de respuestas del fitoplancton ante la fluctuación de la luz, tales como que la tasa fotosintética aumenta, disminuye o incluso algunas veces no cambia (Litchman, 2000), a diferencia de cuando no existe dicha fluctuación. Se ha observado que diversos regímenes en la variación temporal de la luz pueden estimular a diferentes especies o a diferentes grupos taxonómicos, produciendo cambios en la composición de la comunidad fitoplanctónica (Litchman, 1998).
Los efectos mencionados dependen de la escala de tiempo considerada (Reynolds, 1984); por ejemplo, las variaciones a largo plazo, que pueden estar determinadas por el clima, provocan cambios en la flora fitoplanctónica; las oscilaciones anuales son capaces de producir cambios estacionales en la composición y productividad de las comunidades, los cuales, hasta cierto punto, pueden repetirse en años sucesivos. En una menor escala, las fluctuaciones diarias en el ambiente físico (estructura térmica o radiación), afectan a las poblaciones ya existentes; las variaciones aún menores, provocan cambios en la tasa y dirección del transporte de células, dichas oscilaciones ocurren en metros y minutos. La relevancia de las escalas de tiempo mencionadas depende del objetivo de estudio, sin embargo es importante tomar en cuenta que éstas interactúan inevitablemente y que nunca son mutuamente independientes.
Al analizar un periodo de cuatro años, Adame et al. (2008) encontraron dos patrones temporales en la concentración de la clorofila a (Clor-a) fitoplanctónica en el lago Alchichica: el primero -anticipadociclo anual (estacional) y el segundo -inesperadocon periodicidad bienal. En este último, la concentración de la Clor-a durante la época de circulación y asociado a un florecimiento de diatomeas fue mayor en los años pares (2000 y 2002) y menor en los nones (1999 y 2001). El resto del tiempo, durante el periodo de estratificación del lago, las concentraciones registradas de Clor-a fitoplanctónica fueron menores y similares en todos los años.
Estos mismos autores explican que la ciclicidad bienal parece estar en función de la disponibilidad de sílice y de la relación Si/N. Los meses que preceden a los periodos de circulación más productivos mostraron mayores concentraciones de sílice hipolimnético que los menos productivos.
Sin embargo, con tan solo cuatro años no es factible aseverar la presencia de una ciclicidad bienal (dos ciclos). Por lo anterior, el objetivo de este estudio fue reconocer los patrones temporales de variación en la concentración de Clor-a del lago tropical Alchichica al analizar un periodo de 12 años (1999-2010), así como su relación con la radiación fotosintétricamente activa (PAR) y la temperatura. Lo anterior permitirá contar con un mejor entendimiento de la dinámica temporal a corto y largo plazo de la concentración de la Clor-a fitoplanctónica en los lagos tropicales.
Área de estudio. Alchichica (19° 24.7' N, 97° 24.0' O, 2 350 m s.n.m.) es un lago cráter tropical localizado en Oriental, una cuenca endorreica del extremo oriental del Altiplano Mexicano. El clima de la zona es semiárido con una temperatura ambiental que varía de -5.5 a 30 °C, con un promedio anual de 14.4 °C (García, 1988). La precipitación anual es menor a los 500 mm, mientras que la tasa de evaporación anual es de 1,690 mm (Adame et al., 2008). Carece de afluentes y efluentes superficiales y su principal aporte de agua es a través del manto freático (García, 2010). De acuerdo con Alcocer & Escobar-Briones (2007) , este déficit hídrico aunado a otros factores ha contribuido a la disminución en el nivel del lago a largo plazo. Sin embargo, la fluctuación del nivel del agua es imperceptible en la escala anual aun y cuando se ha visto afectado por fenómenos extremos (p.ej., tormentas tropicales) que han aportado cantidades extraordinarias de agua de forma súbita haciendo subir el nivel del lago mismo que en pocos días vuelve al nivel original (Alcocer & Filonov, 2007).
La forma de Alchichica es casi circular con un diámetro de 1.8 km, un área de 2.3 km2, una profundidad máxima de 62 m y una profundidad promedio de 40.9 m. Tiene un volumen de 94,214,080 m3 de agua salina (8.5 ± 0.2 g L-1) y con pH básico (9.0 ± 0.1), cuyos iones predominantes son sodio, magnesio, cloro y bicarbonato (Vilaclara et al., 1993; Filonov et al., 2006). Es un lago oligotrófico; la capa de mezcla tiene una concentración de nitrógeno inorgánico disuelto que va de 9.8 a 53.2 μg L-1, de fósforo reactivo soluble de 3.1 a 18.6 μg L-1 y la Clor-a está entre 0.2 y 2.2 μg L-1 (Ardiles et al., 2012).
Su régimen térmico corresponde al de un lago monomíctico cálido (Alcocer et al., 2000). La mezcla de toda la columna de agua (época de mezcla o de circulación) sigue un patrón recurrente, regularmente ésta inicia a finales de diciembre o principios de enero y termina en marzo. En los meses de abril y mayo se observa una fase de transición en la cual el lago comienza a estratificarse, de esta forma, de junio a noviembre se presenta la etapa de estratificación en la que existe una termoclina bien definida; finalmente en diciembre, la termoclina comienza a desaparecer y la columna de agua a circular. Durante el periodo de circulación, el oxígeno disuelto (OD) es alto (6.0-8.1 mg L-1) a lo largo de la columna de agua. En cuanto se estratifica, aparecen condiciones anóxicas cerca del fondo que se incrementan hasta ocupar todo el hipolimnion de julio a diciembre (Alcocer et al., 2000).
El ensamble fitoplanctónico de Alchichica está compuesto por 19 especies (Oliva et al., 2001), entre las de mayor talla (≥ 2 μm) están Cyclotella alchichica Oliva, Lugo, Alcocer et Cantoral, C. choctawhatcheena Prasad, Chaetoceros elmorei Boyer y Nodularia spumigena Mertens ex Bornet et Flahault; las de talla menor (< 2 μm) son Monoraphidium minutum (Nägeli) Komárková-Legnerová, Synechocystis aquatilis Sauvageau, Oocystis parva W. et G. S. West y O. submarina Lagerheim.
Adame et al. (2008) reportaron que en Alchichica el fitoplancton grande contribuye con 183 ± 204 mg Clor-a m-2 mientras que el pequeño aporta sólo 37 ± 26 mg Clor-a m-2. Ortega-Mayagoitia et al. (2011) confirmaron lo anterior al encontrar que las especies de talla ≥ 20 μm (diatomeas principalmente) dominan la biomasa fitoplanctónica, mientras que las pequeñas (mayoritariamente clorofitas), aunque muy numerosas, contribuyen con una fracción menor al grado de restringir el desarrollo del zooplancton (Ej. rotíferos).
Materiales y métodos
De 1999 a 2010, con una frecuencia de muestreo mensual, se registraron perfiles verticales de PAR, temperatura y fluorescencia natural de la Clor-a con ayuda de un perfilador de fluorescencia natural marca Biospherical modelo PNF-300. Todos los muestreos se realizaron a la misma hora (12-13 hrs) y en el mismo sitio, ubicado en la porción central y más profunda del lago.
Temperatura y ZMIX. Con el fin de reconocer las etapas principales del régimen térmico del lago, así como identificar la zona o capa de mezcla (ZMIX), se utilizaron los perfiles de temperatura. Adicionalmente, se contó con los perfiles de oxígeno disuelto (no incluidos en el presente trabajo) obtenidos con un equipo de monitoreo de calidad de agua marca Hydrolab modelos DS3 y DS4, para identificar si en el lago, realmente, había circulación de las masas de agua. Se consideró al lago realmente en circulación cuando además de encontrar los perfiles de temperatura verticalmente homogéneos, no se observó una capa anóxica en el fondo; por el contrario, cuando se observó una capa anóxica en el fondo, se consideró que el lago aún no estaba circulando. Lo anterior debido a que la presencia de un perfil térmico homogéneo denota que el lago está propenso a circulación, pero hace falta la fuerza motriz del viento para iniciar la mezcla. Con la finalidad de conocer la tendencia general de la dinámica intranual de la ZMIX se construyó un "año tipo" haciendo el promedio para cada uno de los meses.
PAR y ZEU. Se eliminaron los registros de PAR de los primeros 5 m debido a que en esta zona se presenta una dispersión elevada en intervalos de profundidad muy cortos que afectan el cálculo de la zona eufótica (ZEU), ya que como referencia se emplea la PAR en superficie (SPAR).
Para estimar la SPAR se realizó una extrapolación de los registros por debajo de los cinco metros con un modelo exponencial. Mediante la ecuación de esta curva se obtuvo la SPAR y con base en ella se calculó el 1% para delimitar la ZEU; también se eliminaron los registros de PAR en la porción inferior de la columna de agua con valores menores a 0.1 μE m-2 s-1, ya que debajo de este valor de PAR no es posible llevar a cabo la fotosíntesis. Para conocer la tendencia general de la dinámica intranual de la ZEU se construyó un año tipo haciendo el promedio para cada uno de los meses.
Concentración de Clor-a. La concentración de Clor-a se calculó a partir del flujo de fluorescencia natural Ff y de la irradianza incidente:
Donde:
Ff = Volumen del flujo de fluorescencia natural
Hay dos asunciones ópticas usadas:
1) o ɑc (PAR) = Coeficiente de absorción específico de la Clor-a (absorción normalizada a la concentración de Clor-a), el cual en el software del PNF-300 se asume como una constante con valor de 0.04 m2 mg-1
2)Ø f = quantum yield of fluorescence o producción cuántica de la fluorescencia el cual también se asume como una constante con valor de 0.045 mE emitidos por mE absorbidos.
E° (PAR) = Radiación escalar de la PAR.
Al igual que para la PAR, se omitieron los registros de fluorescencia natural de los cinco metros superficiales ya que los algoritmos empleados por el software del equipo para calcular la concentración de Clor-a a partir de la fluorescencia natural, interpretan que todo el flujo de luz roja que se dirige hacia arriba proviene de la fluorescencia de la Clor-a, sin embargo cerca de la superficie del agua (los primeros cinco metros en aguas transparentes), esta interpretación es incorrecta debido a la dispersión de la longitud de onda roja (Kiefer et al., 1989).
Mediciones realizadas de concentración de Clor-a de los primeros cinco metros obtenidas por la técnica de fluorometría in vitro mediante extracción directa de la Clor-a en acetona, método EPA 445.0 (Arar & Collins, 1997), revelaron que salvo durante los breves periodos en que se dan los florecimientos de diatomeas y cianobacterias, la presencia de fitoplancton en la capa superficial es muy escasa.
Se integró por unidad de área (m2) la concentración de Clor-a en la columna vertical y con esta información se construyó un año tipo, asimismo, se hizo la integración de la Clor-a total para cada año, con el objetivo de conocer la variación interanual de la cantidad total de Clor-a. Las integraciones de Clor-a se realizaron a partir de los cinco metros de profundidad (debido a las razones expuestas anteriormente) y hasta los 50 m de profundidad. Por debajo de los 50 m ya no hay luz (ZEU máxima registrada en todo el periodo fue de 33.57 m) y el hipolimnion es anóxico por lo cual no se lleva a cabo la fotosíntesis. Adame et al. (2008) han mostrado que la Clor-a se encuentra en concentraciones despreciables por debajo de los 50 m.
Para determinar si había una relación entre la concentración de Clor-a con la ZMIX y con la ZEU, se hizo una correlación bivariada de Spearman con ayuda del programa SPSS v21 y, con la finalidad de comprobar la existencia de patrones intra y/o interanuales, se realizó un análisis de series de tiempo mediante la función de autocorrelación (FAC) utilizando el programa MATLAB el cual es una herramienta utilizada para caracterizar la estructuración temporal de un sistema (Turchin, 2003).
Resultados
Patrón térmico y ZMIX. Alchichica es un lago monomíctico cálido, en 2000, 2004 y 2009, la mezcla de toda la columna de agua se dio a finales de diciembre del año anterior, mientras que en 2001 y 2010 inició hasta febrero, en tanto que en 1999, 2002, 2003, 2005, 2006, 2007 y 2008, la circulación empezó en enero (Fig. 1). Por otro lado, la culminación de la circulación fue más homogénea, esta se llevó a cabo en marzo de 1999 a 2006 o en abril de 2007 a 2010. En promedio, el periodo de circulación duró 2.4 ± 0.8 meses y el de estratificación 9.8 ± 0.8 meses. No se detectó ningún patrón o tendencia interanual referente al patrón térmico.
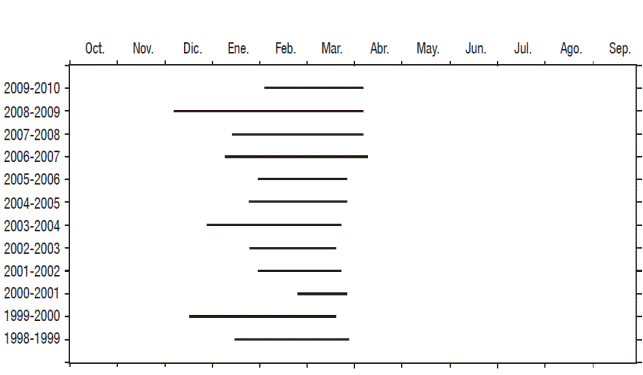
Figura 1 Duración del periodo de mezcla del lago Alchichica, México de 1998 a 2010. (Las líneas negras representan el tiempo en el que se presentó el periodo de mezcla).
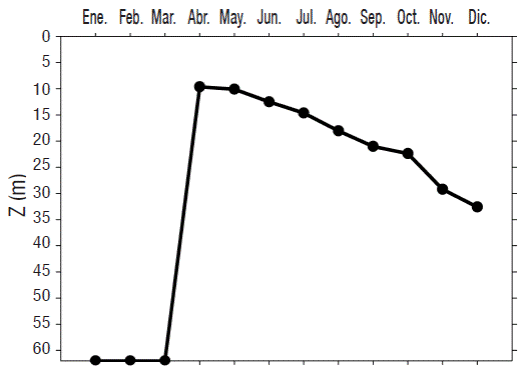
La capa de mezcla (ZMIX) ocupó -generalmentetoda la columna de agua durante los meses de enero, febrero y marzo; posteriormente, durante la transición de mezcla a estratificación, la ZMIX disminuyó para abarcar su menor profundidad (9.6 m) en abril y posteriormente se fue haciendo más profunda a lo largo de la estratificación, hasta alcanzar 32.6 m en diciembre, durante la etapa de transición entre la estratificación y la mezcla (Fig. 2).
PAR y ZEU. El año tipo de la ZEU mostró la presencia de dos épocas significativamente diferentes (p < 0.5): la primera abarcó de enero a marzo durante la época de mezcla, la ZEU fue menor (18 ± 1 m) por lo que se denominó época de aguas turbias; la segunda se presentó de abril a diciembre, durante la época de estratificación, y en ella, la ZEU fue más profunda (23 ± 2 m), por lo cual se denominó época de aguas claras. A lo largo de este segundo periodo, se observó una tendencia general de la Z a aumentar; sin embargo, alrededor del mes de mayo se presentó una disminución en la ZEU (21 ± 3 m), para posteriormente volver a retomar la tendencia hasta que, a fin del año (diciembre), hubo decremento, indicando la proximidad del periodo de circulación. En la mayoría de los casos, la ZEU alcanzó su menor profundidad en febrero (17 ± 2 m) y su máxima en noviembre (26 ± 4 m) (Fig. 3).
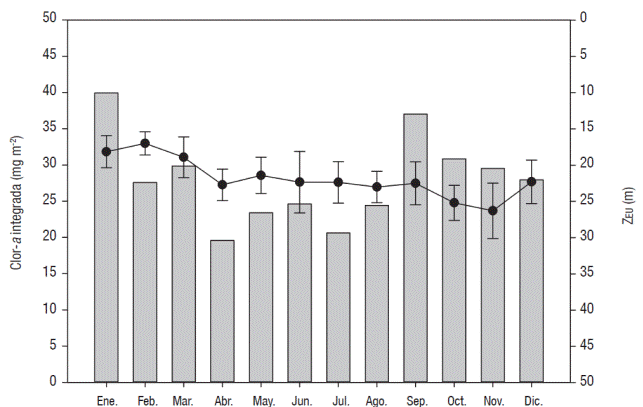
Figura 3 Años tipo de la concentración de Clor-a integrada por área y la ZEU del Lago Alchichica durante el periodo 1999 2010.
Durante el periodo de estudio, la profundidad de la ZEU varió de 15 m durante marzo de 2004, hasta 34 m en noviembre de 1999; el promedio fue de 22 ± 3 m. Aunque el comportamiento estacional entodos los años fue muy similar, la disminución de la ZEU observada a inicios de la estratificación: a) no se registró en 2000, 2002 y 2006 y b) en el resto de los años, el momento preciso de la disminución varió entre abril y junio.
Por otro lado, la profundidad máxima que alcanzó la ZEU en cada año mostró una tendencia gráfica a disminuir (Fig. 4), no así con la profundidad mínima que fue similar a lo largo de todo el periodo.
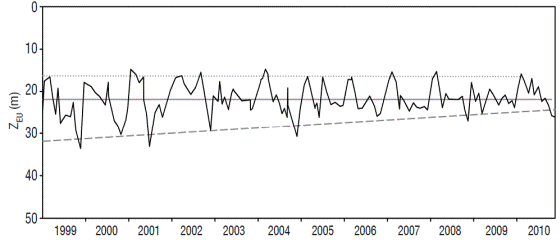
Figura 4: Variación de la ZEU mensualmente en el Lago Alchichica durante los muestreos comprendidos entre 1999 y 2010. La línea continua representa la ZEU promedio y la línea superior (puntos) e inferior (rayas) muestran la tendencia de las profundidades máximas y mínimas respectivamente.
Clor-a. El año tipo de la concentración de Clor-a integrada por unidad de área indicó que el promedio de concentración de Clor-a en toda la columna de agua fue de 28.29 ± 11.54 mg m-2. De enero a marzo se presentó una concentración de Clor-a alta, mayor o cercana al promedio general. Posteriormente, de abril a agosto disminuyó la concentración de Clor-a, aunque se presentó un ligero incremento entre mayo y junio, para posteriormente volver a aumentar desde septiembre y hasta fin de año, una vez más con concentraciones por encima o cercanas al promedio general (Fig. 3). Los meses con la mayor cantidad de Clor-a fueron enero, que corresponde a la época de mezcla y septiembre a la de estratificación, ambos meses tuvieron casi la misma concentración de Clor-a en promedio, con 39.93 ± 15.17 mg m-2 en enero y 37.01 ± 14.88 mg m-2 en septiembre.
A lo largo de todo el periodo de estudio la mayor concentración de Clor-a se registró en septiembre de 2004 (77.44 mg m-2) seguida de enero de 2001 (67.57 mg m-2), mientras que la mínima se encontró en junio de 2001 (13.03 mg m-2) (Fig. 5). El año tipo de la concentración de Clor-a integrada por unidad de área, mostró el comportamiento general de los doce ciclos anuales, sin embargo, al analizar los detalles, se encontraron algunas diferencias que se mencionan a continuación. En 2002, 2003 y 2007 la concentración de Clor-a durante la época de circulación estuvo por debajo de la media, en 2009 el periodo de mezcla empezó desde diciembre de 2008 y justo en este mes se observó una concentración de Clor-a mayor a la media, lo cual no ocurrió de enero a marzo de 2009 (Fig. 5).
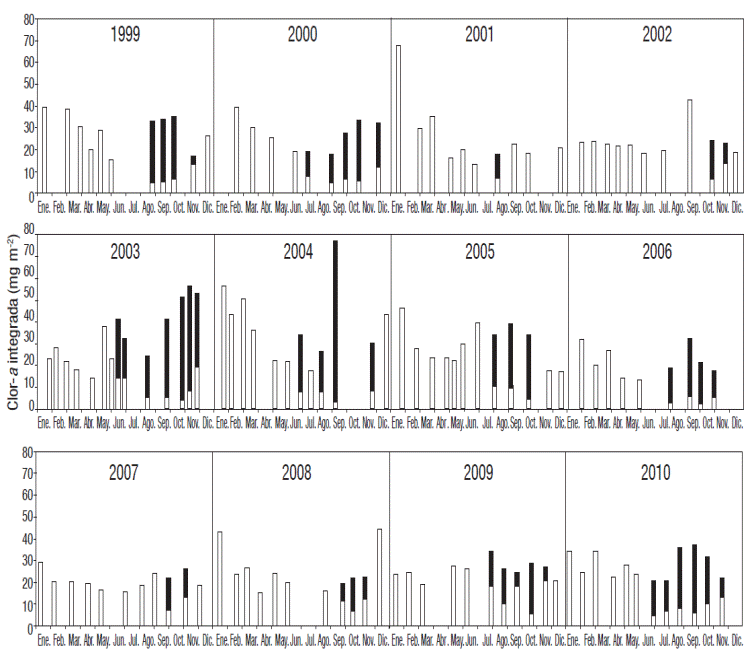
Figura 5 Variación de la Cor -a integrada en la columna de agua del Lado Alchicica a lo largo del periodo de estudio (1999-2010). El aporte DCM (máximo profundo de clorofila) está representado en negro)
Los años cuya concentración entre septiembre y noviembre estuvieron por debajo de la media fueron 2001, 2007 y 2008, mientras que los años en los que no se registró un leve incremento de Clor-a durante mayo o junio fueron 2000, 2002 y de 2006 a 2007 (Fig. 5). La concentración de Clor-a durante la circulación fue generalmente mayor que la de septiembre a noviembre (máximo profundo de clorofila, DCM), excepto en los años de 2002 a 2004 y 2010 (Fig. 5). En 1999, 2003, 2004 y 2005 la concentración de Clor-a integrada por año estuvo por encima de la media; por otro lado, en 2006 se registró la concentración más baja de Clor-a integrada por año (Fig. 6). junio y de nuevo un aumento en los meses de septiembre a diciembre.
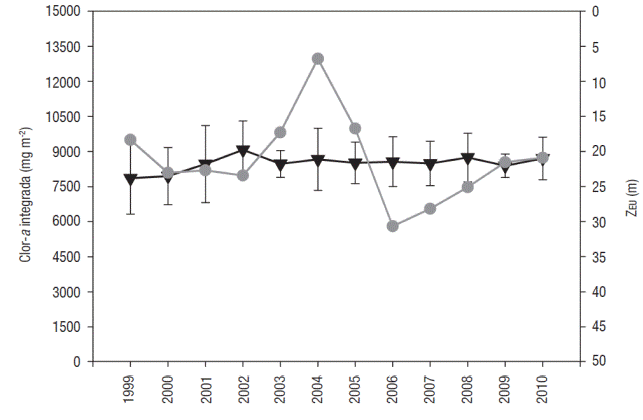
Figura 6 Integración anual de la concentración de Clor-a de toda la columna de agua (●) y promedio anual de la ZEU (▼) en el Lago Alchichica, México. Vol. 25 No. 3 • 2015
En resumen, se encontró un patrón anual (estacional) en la dinámica de la ZEU y de la ZMIX con la de la Clor-a; en cuanto a la dinámica de la ZEU, se registró una menor ZEU durante época de mezcla y una ZEU mayor durante la época de estratificación; en la ZMIX, la capa de mezcla abarcó toda la columna de agua en enero, febrero y mazo, posteriormente tuvo su menor profundidad en abril y se fue haciendo más profunda a lo largo del año; en cuanto a la concentración de Clor-a, se observó una máxima de enero a marzo durante la fase de circulación, posteriormente disminuyó y hubo un incremento ligero durante mayo o junio y de nuevo un aumento en los meses de septiembre a diciembre.
La concentración de Clor-a aumentó cuando la ZMIX fue más profunda (rs = 0.335, p < 0.01) y disminuyó cuando la ZEU presentó sus valores más bajos (rs = -0.313, p < 0.01).
Por otro lado, no se encontraron patrones interanuales para la ZEU, ni para la ZMIX, y tampoco para la Clor-a, sin embargo, la ZEU mostró una tendencia hacia la disminución de la máxima profundidad alcanzada en cada año. El análisis de series de tiempo (Fig. 7) mostró una periodicidad para valores de τ = 12 meses, lo que equivale a un año del periodo estudiado. Este valor sugiere la existencia de ciclos anuales en la concentración de Clor-a. Es probable que la mayor señal se debe al aumento en la concentración de Clor-a, durante la mezcla invernal.
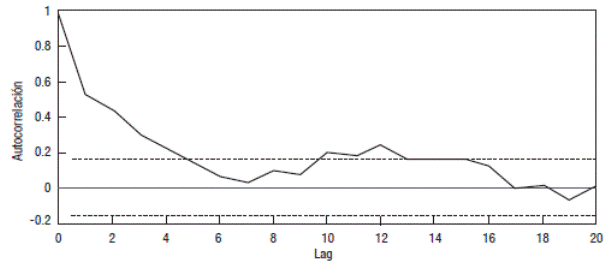
Figura 7 Función de autocorrelación de la serie temporal de concentración de Clor-a durante el periodo 1999 - 2010 en el Lago Alchichica. Las líneas interrumpidas representan los valores a partir de los cuales la autocorrelación es estadísticamente significativa.
Como se observa, tanto las gráficas de Clor-a (Fig. 5) como el análisis de series de tiempo (Fig. 7) mostraron que no hay patrones interanuales ni tendencias a largo plazo en la concentración ni en la distribución de Clor-a; el único patrón que se observó tanto en las gráficas como en el análisis de series de tiempo fue el intranual (i.e., estacional), descrito anteriormente, y que refleja el patrón térmico característico del lago Alchichica, la monomixis cálida.
Discusión
Se observa un patrón estacional claro en la concentración de Clor-a en el que, a lo largo del ciclo anual, se presentan tres periodos con mayor concentración de Clor-a: 1) durante la época de mezcla (enero-marzo), 2) al inicio de la estratificación (mayo y junio) y 3) de septiembre a noviembre, durante la estratificación; el primero y el tercero muestran concentraciones de Clor-a alrededor o por arriba del promedio global. Este comportamiento difiere de lo que se ha observado para otros lagos como el subtropical Kinneret (Israel), en donde las mayores concentraciones de Clor-a se presentan sólo durante el florecimiento de dinoflagelados, que abarca de la mitad del periodo de circulación hasta inicios de la estratificación (Berman et al., 1995). En general este último patrón es típico de lagos tropicales y subtropicales donde el incremento de nutrientes, producto de la mezcla, predomina fomentando el crecimiento fitoplanctónico (Talling, 1993).
En el caso de Alchichica, el primer pico de Clor-a se debe al florecimiento invernal de diatomeas asociado a la circulación y que está dominado por C. alchichicana (Oliva et al., 2006); este se distribuye a lo largo de la columna de agua (Adame et al., 2008; Ardiles et al., 2012). El segundo pico, más pequeño, se observa entre mayo -junio (estratificación temprana) y se debe al florecimiento primaveral de la cianobacteria N. spumigena que se ubica predominantemente cerca de o en la superficie del lago (Oliva et al., 2001; Adame et al., 2008; Oliva et al., 2009). Es importante hacer notar que N. spumigena tiende a acumularse en la superficie del lago en días soleados y sin viento, formando una densa capa de pocos centímetros de espesor. Sin embargo, durante el proceso de limpieza de los datos se eliminaron los primeros cinco metros superficiales, lo cual seguramente llevó a subvalorar el aporte de esta especie durante su florecimiento de finales de abril a principios de junio. El tercer pico se asocia al desarrollo de un máximo profundo de clorofila a (DCM por sus iniciales en inglés), característico de ambientes acuáticos oligotróficos, que se ubica en el metalimnion de agosto a principios de diciembre. El DCM está dominado por las diatomeas C. alchichicana y C. choctawhatcheeana (Oliva et al., 2001; Ardiles et al., 2012).
Los dos picos principales (el primero y el tercero) están asociados al desarrollo de florecimientos de diatomeas. En ambos casos se conjuntan las características que favorecen a este grupo algal: disponibilidad de nutrientes, baja intensidad lumínica, baja temperatura y un mecanismo que les permite mantenerse en la columna de agua. Sin embargo, estas características se reúnen por diferentes razones que explican el porqué de que el primer pico de Clor-a se presente en el invierno y a lo largo de la columna de agua, mientras que el otro pico de Clor-a se observe a fines de verano y principios de otoño en el metalimnion.
El florecimiento de diatomeas se da en el invierno toda vez que se reúnen las condiciones que favorecen el desarrollo de este grupo algal como: mayor turbulencia e incremento en la disponibilidad de nutrientes asociados a la mezcla, así como temperatura baja y menor intensidad de luz. Ramírez-Olvera et al. (2009) encontraron que la concentración de nitrógeno inorgánico disuelto (DIN) y de fósforo reactivo soluble (SRP) es mayor durante la fase de mezcla. Algo similar encontró Pollingher (1986) en el Lago Kinneret, el cual presenta las concentraciones máximas anuales de nitrógeno y fósforo durante el periodo de mezcla.
La elevada concentración de Clor-a registrada de septiembre a noviembre es resultado del desarrollo de un DCM descrito para el lago Alchichica por Oliva et al. (2001), entre otros. Este florecimiento se ve favorecido por la transferencia que hacen las ondas internas de los nutrientes acumulados en el hipolimnion hacia el metalimnion, ya que prácticamente son inexistentes en el epilimnion. En el lago Alchichica se generan ondas internas que alcanzan los 1.4 m de amplitud y un periodo de 3.1 horas (Filonov & Alcocer, 2002) y, como lo menciona Wetzel (2001), en los lagos profundos y estratificados las ondas internas son frecuentemente el único mecanismo que incrementa el intercambio de nutrientes, los cuales quedan disponibles para el fitoplancton. En el metalimnion se conjuntan, entonces, baja temperatura, poca luz, estabilidad de la columna de agua por encontrarse en el gradiente de densidad (termoclina) y presencia de nutrientes.
Por último, el florecimiento de la cianobacteria N. spumigena en el lago Alchichica, se debe a la combinación de condiciones óptimas para su crecimiento, como son: alta radiación solar, escasez de nitrógeno (su capacidad de fijar nitrógeno le confiere una alta competitividad), salinidad de 8.5 a 9 g L-1, la cual se encuentra dentro del rango de máximo crecimiento (5 a 10 g L-1) y, adicionalmente, está cerca de los rangos de crecimiento óptimo de temperatura y pH (Oliva et al., 2009).
El patrón anual de mezcla y estratificación que se presenta en el lago Alchichica (p.ej., monomixis cálida), determina el patrón estacional (anual) de la concentración de Clor-a observado de forma repetitiva a lo largo de los doce años que abarca este estudio. La regularidad del patrón de mezcla se refleja en la regularidad de la dinámica estacional de la biomasa fitoplanctónica, al respecto, Talling (1986) menciona que aunque muchos factores, algunos biológicos, influyen en la estacionalidad del fitoplancton, los cambios periódicos en la estructura hidrográfica de la columna de agua son los que tienen mayor influencia en los lagos profundos de África.
En diversos trabajos se ha observado la relación entre la variación hidrográfica estacional y la estacionalidad fitoplanctónica; por ejemplo, en el Lago Nyasa, Iles (1960) y Harding (1963) encontraron mayor cantidad de fitoplancton durante la estación fría y de mezcla, en tanto que la menor durante la más cálida y estratificada. Coulter (1963) encontró que en el Lago Tangañica se presentan florecimientos de diatomeas asociados a periodos de surgencia inducidas por fuertes vientos; para el mismo lago Dubois, (1958) reportó máximos fitoplanctónicos de la cianobacteria flotadora Anabaena flos-aquae Brébisson ex Bornet et Flauhault, durante septiembre y octubre, después de las principales lluvias cuando la estratificación superficial se restableció. Lewis (1986) registró la mayor biomasa fitoplanctónica en el Lago Valencia, Venezuela durante la primera mitad del periodo de estratificación, debido a la disponibilidad de luz y nutrientes aportados por el periodo anterior de mezcla.
Como se explicó anteriormente, en el lago Alchichica también es claro que existe una estrecha relación entre el patrón anual de mezclaestratificación y la variación estacional de la concentración de Clor-a. Cada año, durante la fase de mezcla se presenta el florecimiento de C. alchichicana debido, principalmente, a la disponibilidad de nutrienes y turbulencia que la mezcla provoca; posteriormente cuando comienza la estratificación, disminuye la turbulencia generada por la mezcla y el nutriente limitante es el nitrógeno (Ramírez-Olvera et al., 2009) así, se desarrolla entonces el florecimiento de la cianobacteria N. spumigena. Por último, a mediados y hacia el fin de la estratificación, cuando el epilimnion carece de nutrientes y la termoclina es profunda, se observa el DCM en el que las diatomeas aprovechan los nutrientes transportados a través del metalimnion por las ondas internas.
Macek et al. (2009) encontraron que a lo largo de cinco ciclos anuales, el picoplancton del lago Alchichica mostró un patrón estacional similar al descrito en el presente estudio y que sigue el ciclo de circulación-estratificación de la monomixis cálida. Durante la circulación invernal y estratificación temprana, se presentan las densidades más elevadas del picoplancton a lo largo de la columna y epilimnion, respectivamente. Los números descienden en la estratificación bien establecida alcanzando densidades mínimas en la estratificación tardía.
La diferencia en magnitud de la concentración de Clor-a entre los florecimientos de cada año, probablemente está vinculada con la variación de los nutrientes la cual, está directamente relacionada, con el patrón de mezcla-estratificación.
Como se mencionó anteriormente, en Alchichica, Adame et al. (2008) observaron un patrón bienal en la concentración de Clor-a, particularmente en la duración e intensidad del florecimiento invernal de diatomeas, con una alternancia entre años con mayor concentración y años con menor. Estos autores lo relacionan con la concentración de sílice disponible ya que las concentraciones en el lago son reducidas y, al parecer, su disponibilidad regula la intensidad y duración de los florecimientos invernales de diatomeas. A pesar de lo anterior, en este trabajo no se evidenció este patrón bienal ni algún otro patrón interanual o tendencia a largo plazo. De la misma manera, Berman et al. (1995) tampoco observaron patrones ni tendencias a largo plazo en el Lago Kinneret, en un periodo de registros de veintidós años.
En conclusión, Alchichica mostró una ciclicidad anual recurrente y predecible asociada a la monomixis cálida con la presencia de tres picos en la concentración de Clor-a: en la circulación invernal, al inicio de la estratificación (de finales de abril a principios de junio) y en la estratificación, de septiembre a noviembre, (finales de verano y principios de otoño). Los dos primeros se asocian con florecimientos fitoplanctónicos (uno invernal de diatomeas y otro primaveral de cianobacterias) y el tercero con el desarrollo de un DCM (de agosto a principios de diciembre). Como se mencionó, el comportamiento estacional anterior se repite año tras año y está asociado con la regularidad del patrón de circulación (monomixis cálida) del lago, lo cual también se confirma con la correlación donde a mayor ZMIX y menor ZEU mayor es la concentración de Clor-a. Sin embargo, a largo plazo, las variaciones que se presentan en este patrón estacional son menores y no se revela ninguna tendencia o patrón interanual. Es probable que las diferencias interanuales sean producto de la disponibilidad de nutrimentos pero, desafortunadamente, no se cuenta con un seguimiento de nutrientes paralelo al de la concentración de Clor-a, como el que se discute en la presente investigación. La única tendencia vislumbrada es gráfica pero no apoyada estadísticamente, es que la ZEU parece tender a disminuir en la máxima profundidad alcanzada año tras año.











 nueva página del texto (beta)
nueva página del texto (beta)