Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de cardiología
versión impresa ISSN 0188-2198
Rev. Mex. Cardiol vol.23 no.2 México abr./jun. 2012
INVESTIGACIÓN CLÍNICA
Homocisteína (HCY), ácido úrico y su relación con c-HDL en pacientes con enfermedad coronaria
Homocysteine (HCY), uric acid and their relationship with HDL in patients with coronary artery disease
Magdalena Contreras-Zárate,* José Ignacio Contreras-Zárate,* Anel Gómez-García,** Jorge Cruz-Balandrán,*** Said Raúl Rodea-Hernández****
*Hospital Mercy Heart de Cardiología, Irapuato, Gto.
**Centro de Investigación Biomédica de Michoacán, IMSS, Morelia, Mich.
*** Unidad de Medicina Familiar 9, IMSS, Pénjamo, Gto.
****Estudiante de Medicina. Universidad Quetzalcóatl, Irapuato, Gto.
Dirección para correspondencia:
Dra. Magdalena Contreras Zárate
Av. de La Reforma Núm. 56-505, Fracc. Gámez,
36650, Irapuato, Gto.
Tel.: 01(462)6251360
E-mail: contreraszarate@hotmail.com
RESUMEN
Introducción: La enfermedad coronaria (EC) es la principal causa de muerte en México. La homocisteína (HCY), ácido úrico (AU) y el colesterol (c-HDL) se conocen como factores independientes de riesgo para enfermedad cardiovascular. Objetivo: Investigar la relación entre HCY, AU y c-HDL en pacientes con enfermedad coronaria. Material y métodos: Estudio transversal comparativo en 75 pacientes con EC, sin diuréticos, alopurinol, ácido fólico, complejo B y sin enfermedad renal o tiroidea. A cada paciente se le colectó muestra venosa para cuantificación de HCY, AU, glucosa y perfil de lípidos. El análisis estadístico se realizó en SPSS V18. Resultados: Edad promedio: 60.96 ± 16.22 años, 58.45% tuvieron diabetes mellitus tipo 2 (DM2) y/o hipertensión arterial sistémica (HTA). Los pacientes se distribuyeron en dos grupos: AU ≥ 7 mg/dL y AU < 7 mg/dL; se encontraron diferencias en HCY, c-HDL, tensión arterial sistólica y diastólica (p < 0.05). AU correlacionó con c-HDL (r = -0.307; p = 0.010) y HCY con c-HDL (r = -0.283; p = 0.019). Por regresión lineal se encontró HCY como factor predictor del AU (coeficiente estandarizado β: 0.294; t: 2.458; p = 0.017) y de c-HDL (coeficiente estandarizado β: 0.269; t: 2.232; p = 0.029). Conclusiones: Existe relación entre AU y HCY con c-HDL. La HCY es factor predictor de hiperuricemia y de baja c-HDL en pacientes con EC. Se recomienda incluir la HCY como determinación de rutina en pacientes de alto riesgo, historia familiar y/o EC prematura.
Palabras clave: Homocisteína, hiperuricemia, enfermedad coronaria.
ABSTRACT
Introduction: Coronary heart disease (CHD) is the main cause of death in Mexico. Homocisteine (HCY), uric acid (UA) and cholesterol (c-HDL) are known independent factors for cardiovascular disease. Objective: To investigate the relationship between HCY, UA and c-HDL in patients with Coronary Heart Disease (CHD). Material and methods: Comparative cross-sectional study in 75 patients with CHD, without diuretics, allopurinol, folic acid, B complex and without kidney or thyroid disease. To each patient was collected a fasting blood sample for quantification of HCY, UA, glucose and lipid profile. The statistical analysis was realized in SPSS V18. Results: Mean age was 60.96 ± 16.22 years. 58.45% had type 2 diabetes and/or hypertension. Patients were divides in 2 groups: UA ≥ 7 mg/dL y UA < 7 mg/dL. We found differences in HCY, c-HDL, systolic and diastolic blood pressure (p < 0.005). The UA correlated with c-HDL(r = -0.307, p = 0.010) and HCY with c-HDL (r = -0.283, p = 0.019). In the linear regression analysis was found to HCY as predictor of UA (standardized coefficient β:0.294, t:2.458, p = 0.017) and c-HDL (standardized coefficient β:0.269, t:2.232, p = 0.029). Conclusions: There is relationship between HCY, UA with c-HDL and c-HDL. HCY is a predictor of hyperuricemia, low c-HDL levels in patients with CHD. It is recommended to include the determination of HCY as routine in patients with a family history of CHD.
Key words: Homocysteine, hyperuricemia, coronary heart disease.
Introducción
La enfermedad coronaria (EC) es la principal causa de muerte en Estados Unidos y en México. Existe fuerte evidencia de que la EC es considerada como un depósito de lípidos que ocluyen los vasos sanguíneos y es una manifestación de una respuesta inflamatoria crónica a daño y/o a infección. Las concentraciones de colesterol, particularmente las lipoproteínas de baja densidad (c-LDL) y alta densidad (c-HDL), se han establecido como factor de riesgo para EC.1
Numerosos estudios han reportado a la hiperhomocisteinemia como factor de riesgo independiente para la enfermedad aterosclerótica que incluye la enfermedad arterial coronaria, la enfermedad cerebrovascular, la enfermedad vascular periférica y el tromboembolismo venoso.2-6 Willinek y colaboradores7 estudiaron la influencia de la HCY en el sistema vascular en individuos sanos asintomáticos, encontrando que las concentraciones de HCY entre valores normales altos (10.7 y 12.4 µmol/L) se asociaron con incremento en el engrosamiento de la íntima media carotídea, por lo que se hace necesario una consideración importante de las cifras aceptadas como normales de HCY.8 La importancia de la HCY en los pacientes con cardiopatía conocida es contradictoria,9,10 pero se presenta con mayor frecuencia una asociación fuerte y constante hacia la causalidad de la hiperhomocisteinemia en este grupo de pacientes.
Por otra parte, la asociación de ácido úrico (AU) y enfermedad cardiovascular se ha reportado en varios estudios epidemiológicos donde se ha relacionado con diferentes condiciones cardiovasculares que incluyen a la EC.11-17 El estudio de Framingham corrobora que las bajas concentraciones de c-HDL es uno de los factores de riesgo coronario más potentes, tanto o más que las cifras altas de c-LDL.18 Algunos de los metabolitos importantes para el desarrollo de EC son el AU y la HCY. El objetivo de este trabajo fue investigar la relación entre HCY, AU y su relación con c-HDL en pacientes con enfermedad coronaria.
Material y métodos
De abril a junio de 2011, se realizó un estudio transversal comparativo en 75 pacientes con EC del Mercy Heart Hospital de Cardiología, en Irapuato, Guanajuato, México. Se incluyeron a pacientes con diagnóstico de enfermedad coronaria, mayores de 40 años y sin prescripción de diuréticos, alopurinol, ácido fólico o complejo B. Se excluyeron a aquéllos con diagnóstico de enfermedad tiroidea o renal. Las variables que se tomaron en cuenta fueron: clínicas: edad, sexo, presión arterial sistólica (PAS) y diastólica (PAD) medidas según el protocolo del JNC VII;19 antropométricas: peso, talla, índice de masa corporal (IMC), circunferencia abdominal (CA); para la medición del peso corporal se realizó en una báscula con estadímetro con bata clínica y sin zapatos; la medición de la talla fue en posición erecta, con la cabeza en un plano horizontal de Francfort (línea imaginaria que une el borde superior del conducto auditivo con la órbita), brazos libres a los costados y las palmas hacia las caderas. Para la CA se midió la distancia media vertical entre el borde costal inferior y el borde superior de la cresta iliaca; para las variables bioquímicas: glucosa, colesterol total, triglicéridos, c-LDL, c-HDL y AU, a cada paciente con un ayuno de al menos 12 h, se le citó en el laboratorio clínico del Hospital Mercy Heart para la colecta de sangre venosa. Las muestras fueron procesadas inmediatamente. La glucosa y el perfil de lípidos se procesaron por métodos enzimáticos colorimétricos en equipo de química clínica Dimension AR/AVL® Clinical Chemistry System, USA, la HCY por inmuno ensayo enzimático de micropartículas, MPIA (Abbott Diagnostics); los coeficientes de variación intra e interensayo fueron menores a 5%. Se determinó hiperuricemia cuando el valor reportado por el laboratorio clínico fuese mayor o igual a 7 mg/dL y las concentraciones bajas de c-HDL en mujeres < 40 mg/dL y en hombres < 35 mg/dL propuestos por el NCEP ATP-III.20 Este trabajo cumplió con las normas éticas correspondientes que determinan la Declaración de Helsinki, el Código de Nüremberg y fue aprobado por el Comité de Ética e Investigación del Hospital Mercy Heart de Cardiología, Irapuato, Gto.
Análisis de datos
Se realizó análisis exploratorio de los datos para observar su distribución mediante la prueba de Kolmogorov-Smirnov con la corrección de la significación de Lilliefors a fin de detectar una distribución gaussiana. Los datos se procesaron en el paquete estadístico para las ciencias sociales (SPSS Ver. 18.0). La estadística descriptiva utilizada fue para las variables continuas en términos de media ± error estándar. Para comparar los grupos con hiperuricemia y ácido úrico normal, se utilizó el estadístico de contraste t-Student para muestras independientes; para la asociación entre las variables se realizó el coeficiente de Pearson. Para buscar cuál de las variables del estudio (HCY, circunferencia de cintura, glucosa, colesterol total, triglicéridos, LDL y HDL) es la más importante para predecir la hiperuricemia (variable dependiente) se utilizó el modelo de regresión lineal por el método de pasos sucesivos. Las cifras estadísticamente significativas son aquéllas para las cuales se asoció a un valor de p < 0.05.
Resultados
De los pacientes con EC en estudio, el 58.45% tuvieron diabetes mellitus tipo 2 (DM2) y/o hipertensión arterial (HTA). Los años de evolución de la HTA fueron 10.51 ± 1.26 años (IC95%: 1-35 años) y de la DM2 de 11.01 ± 1.68 años (IC95%: 1-25 años). Para la HTA 95% tenían medicación con ARA2 en combinación con betabloqueadores y para la DM2 todos tenían tratamiento con metformina. Sólo 6% de los pacientes tenían prescripción con insulina y 6% tomaban estatinas.
El Cuadro I muestra los parámetros clínicos y bioquímicos estudiados en los pacientes con EC. Se observa que el grupo con AU ≥ 7 mg/dL tuvo la PAS, PAD y glucosa más elevadas que en el grupo con AU por debajo de 7 mg/dL, y c-HDL bajos. No se encontraron diferencias estadísticas significativas entre grupos cuando se analizaron por género.

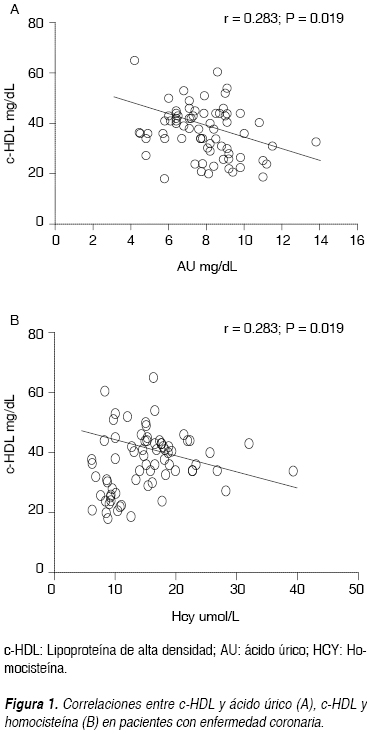
En la figura 1 se muestran las correlaciones negativas entre la HCY y el c-HDL (r = -0.283; p = 0.019) y el ácido úrico con c-HDL (r = -0.307; p = 0.010).
Al realizar los modelos de regresión lineal tomando como variable dependiente al AU, se obtuvo como variable predictora a la HCY [β = 0.294; t = 2.458; p = 0.017] y para seleccionar la variable que más predice las bajas concentraciones de c-HDL resultó ser la HCY [β: 0.269; t = 2.232; p = 0.029].
Discusión
La HCY, el AU y las bajas concentraciones de c-HDL son considerados factores de riesgo para EC. Se conoce que la hiperuricemia suele ir asociada con factores de riesgo cardiovascular ya establecidos (obesidad abdominal, hipertrigliceridemia, bajas concentraciones de c-HDL).21 En este estudio se corrobora que los pacientes con EC e hiperuricemia cursan con niveles más bajos de c-HDL. Es bien conocido que el c-HDL ha sido catalogado como una partícula con una comprobada función antiaterogénica,22 que involucra mecanismos como el transporte del colesterol y una protección cardiovascular no relacionada directamente con la homeostasis del colesterol corporal.23 Xiao y colaboradores24 reportan en sujetos con angiografía coronaria una correlación negativa entre c-HDL y HCY muy semejante a la correlación obtenida en este estudio, lo que nos indica que la HCY inhibe el transporte reverso de colesterol mediante la reducción circulante de c-HDL, teniendo un riesgo importante de agravar la EC.
Soinio y colaboradores25 reportan que en pacientes con EC, la HCY es un factor predictor independiente de enfermedad coronaria. El mecanismo probable donde la HCY y el AU favorecen la EC es que ambas moléculas causan disfunción endotelial por incremento del estrés oxidativo y la disminución de la liberación del óxido nítrico.21,26
En el modelo de regresión lineal, nuestros resultados demuestran que la HCY es un predictor independiente de la hiperuricemia y de las bajas concentraciones de c-HDL en pacientes con EC. El mecanismo por el cual la HCY podría favorecer la hiperuricemia aún no está claro, el punto de unión entre estas dos moléculas probablemente podría ser una excesiva concentración de adenosina (resultante de la degradación de las bases púricas del ADN, ARN, ATP y AMPc) que por una parte esté favoreciendo el incremento en la formación de adenosilmetionina, adenosilhomocisteína y la hiperestimulación de la hidrolasa para que se convierta a HCY, y por otra, a través de la vía de la activación de la xantina oxidasa que cataliza la conversión de xantina a AU (Figura 2), un proceso que conduce a la excesiva formación de radicales libres de oxígeno y nitrógeno que favorecen la formación de la placa de ateroma y con ello el desarrollo de la EC. Se ha demostrado la presencia de la actividad de la xantina oxidasa en miocitos de corazón27 y se le ha considerado como una enzima que juega un papel principal de daño al endotelio vascular; sin embargo, sigue siendo discutida la pregunta: si el AU puede ser usado como un marcador indirecto de actividad de la xantina oxidasa. Una de las limitantes de este estudio fue el no contar con una evaluación nutricia en estos pacientes para conocer su ingesta proteica o su ingesta de vitamina B. Se requieren estudios en células endoteliales para corroborar el mecanismo de acción propuesto anteriormente de la HCY sobre la hiperuricemia, además de estudios clínicos longitudinales con intervenciones tanto farmacológicas y no farmacológicas para poder mejorar la calidad de vida en este tipo de pacientes y retrasar la muerte por enfermedad coronaria.

Durante décadas y décadas se han estudiado múltiples factores de riesgo cardiovascular, se han tratado de modificar con medidas generales, farmacológicas y cambios en estilos de vida; sin embargo; no se ha obtenido un impacto significativo sobre la morbimortalidad en nuestro país. Este estudio lleva la intención de aportar un camino hacia la prevención de este grave problema epidemiológico.
Hasta donde conocemos, es la primera ocasión en que se estudia la influencia de la HCY sobre el AU, y de ambos con los niveles de c-HDL.
Conclusiones
1. En los pacientes con EC se relacionan la HCY con c-HDL y el c-HDL con el AU.
2. La HCY es predictora de hiperuricemia en este tipo de pacientes.
3. La HCY es un factor predictor de hiperuricemia y de bajas concentraciones de c-HDL en pacientes con enfermedad coronaria.
4. Se recomienda incluir la determinación de HCY de rutina en pacientes de alto riesgo, historia familiar y/o enfermedad coronaria prematura.
5. Existe la posibilidad de que el tratamiento con folatos, B2, B6 y B12, coadyuve a retrasar el proceso ateroscleroso en pacientes con factores de riesgo como DM2, dislipidemia e HTA.
Agradecimientos
1. QFB. Felipe G. Reyes Santoyo
2. Dra. Michele Cazares Contreras
3. Dr. Ignacio Carrillo Zamora 4. Estudiante de medicina Cristina Ferrer Pérez
5. Estudiante de medicina Anaclara Michel Chávez
Por sus ideas y colaboración desinteresada.
REFERENCIAS
1. Chilton RJ. Pathophysiology of coronary heart disease. JAMA 2004; 104: S5-S8. [ Links ]
2. Álvarez AC, Leyva-Jiménez R, Gómez-García A. Relación entre la hiperhomocisteinemia y la insuficiencia renal crónica. Ciencia Nicolaita 2005; 40: 77-90. [ Links ]
3. Stampter MJ, Malinow MR, Willett WC et al. A prospective study of plasma homocysteine and risk of myocardial infarction in US physicians. JAMA 1992; 268: 887-889. [ Links ]
4. Clarke R, Daly L, Robinson K, Naughten E et al. Hyperhomocysteinemia: An independent risk factor for vascular disease. N Engl J Med 1991; 324: 1149-1155. [ Links ]
5. Boushey CJ, Beresford SA, Omenn GS, Motulsky AG. A quantitative assessment of plasma homocysteine as a risk factor for vascular disease. JAMA 1995; 274: 1049-1057. [ Links ]
6. Heijer M, Hoster T, Blom JH, Bos MJ et al. Hyperhomocysteinemia as a risk factor for deep-vein thrombosis. N Engl J Med 1996; 334: 759-762. [ Links ]
7. Willinek WA, Ludwing M, Lennarz M, Holler T, Stumpe OK. High-normal serum homocysteine concentrations are associated with an increased risk of early atherosclerosis carotid artery wall lesions in healthy subjects. J Hypertens 2000; 8: 425-430. [ Links ]
8. Niggard O, Vollset SE, Refsum H, Stevensvold I et al. Total plasma homocysteine and cardiovascular risk profile. JAMA 1995; 274: 1526-1533. [ Links ]
9. Verhoef P, Hennekens CH, Allen RH et al. Plasma total Homocysteine and a risk of angina pectoris with subsequent coronary artery bypass surgery. Am J Cardiol 1997; 79: 799-805. [ Links ]
10. Nyggard O, Nordrehaug JE, Refsum H et al. Plasma homocysteine levels and mortality in patients with coronary artery disease. N Engl J Med 1997; 337: 230-235. [ Links ]
11. Ford ES, Li C, Cook S, Choi HK. Serum concentrations of uric acid and the metabolic syndrome among US children and adolescents. Circulation 2007; 115: 2526-2532. [ Links ]
12. Tuttle KR, Short RA, Johnson RJ. Sex differences in uric acid and risk factors for coronary artery disease. Am J Cardiol 2001; 87: 1411-1414. [ Links ]
13. Letho S Niskanen L, Rönnemaa T, Laakso M. Serum uric acid is a strong predictor of stroke in patients with non-insulin-dependent diabetes mellitus. Stroke 1998; 29: 635-639. [ Links ]
14. Schretlen DJ, Inscore AB, Vannorsdall TD et al. Serum uric acid and brain ischemia in normal elderly adults. Neurology 2007; 69: 1418-1423. [ Links ]
15. Roberts JM, Bodnar LM, Lain KY et al. Uric acid is as important as proteinuria in identifying fetal risk in women with gestational hypertension. Hypertension 2005; 46: 1263-1269. [ Links ]
16. Siu YP, Leung KT, Tong MK, Kwan TH. Use of allopurinol in slowing the progression of renal disease through its ability to lower serum uric acid level. Am J Kidney Dis 2006; 47: 51-59. [ Links ]
17. Talaat KM, el-Sheikh AR. The effect of mild hyperuricemia on urinary transforming growth factor beta and the progression of chronic kidney disease. Am J Nephrol 2007; 27: 435-440. [ Links ]
18. Navarro LF. Bases genéticas de la enfermedad coronaria. Rev Esp Cardiol 2002; 55: 413-431. [ Links ]
19. Chobanian AV, Bakris GL, Black HR, Cushman WC, Green LA, Izzo JL; and the National High Blood Pressure Education Program Coordinating Committee. The seventh report of the joint national committee on prevention, detection, evaluation and treatment of high blood pressure. JAMA 2003; 289: 2560-2572. [ Links ]
20. Third Report of the National Cholesterol Education Program (NCEP) Expert Panel on detection Evaluation and treatment of high blood cholesterol in adult (Adult Treatment Panel III) final report. Circulation 2002; 106: 343-421. [ Links ]
21. Feig DI, Kang DH, Johnson RJ. Ácido úrico y riesgo cardiovascular. N Engl J Med 2008; 359: 1811-1821. [ Links ]
22. Cuneo C. Lipoproteínas de alta densidad y enfermedad coronaria. Rev Fed Arg Cardiol 2001; 30: 103-111. [ Links ]
23. Kwiterovich PO Jr. The antiatherogenic role of high-density lipoprotein colesterol. Am J Cardiol 1998; 82: 13Q-21Q. [ Links ]
24. Xiao Y, Zhang Y, Lv X, Su D et al. Relationship between lipid profiles and plasma total homocysteine, cysteine and the risk of coronary artery disease in coronary angiographic subjects. Lipid Health Dis 2011; 10: 137-142. [ Links ]
25. Soinio M, Marniemi J, Laakso M, Letho S, Rönnemaa T. Elevated plasma homocysteine level is an independent predictor of coronary heart disease events in patients with type 2 diabetes mellitus. Ann Intern Med 2004; 140: 94-100. [ Links ]
26. Kannani PM, Sinkey CA, Browning RL, Allaman M, Knapp HR, Haynes WG. Role of oxidant stress in endothelial dysfunction produced by experimental hyperhomocysteinemia in humans. Circulation 1997; 95: 1119-1121. [ Links ]
27. Saavedra WF, Paolocci N, St John ME et al. Imbalance between xanthine oxidase and nitric oxide synthase signaling pathways underlies mechanoenergetic uncoupling in the failing heart. Circ Res 2002; 90: 297-304. [ Links ]














