INTRODUCCIÓN
Los hongos micorrízicos arbusculares (HMA) son habitantes naturales del suelo que viven comúnmente en una simbiosis mutualista con la mayoría de las plantas terrestres, mediante la cual pueden favorecer la absorción de agua y nutrimentos por las plantas (Smith y Read, 2008). Otros beneficios para las plantas incluyen una mayor tolerancia al estrés por trasplante, por déficit hídrico, por la presencia de metales pesados y protección frente a fitopatógenos del suelo (Smith y Read, 2008). Esto ha despertado el interés de conocer la diversidad de especies de HMA en cultivos de importancia en México, como el café (Bertolini et al., 2018; 2020; Posada et al., 2016); asimismo, la inoculación de consorcios nativos de HMA del cafetal ha mostrado efectos positivos en el crecimiento de plántulas de algunas variedades de café y su sobrevivencia al trasplante en campo (Hernández-Acosta et al., 2020; Trejo et al., 2011).
En la región Altos de Chiapas, México se presenta una zona cafetalera que alberga una gran riqueza biocultural para la producción agrícola, llevada a cabo por campesinos indígenas; por ejemplo, el cultivo de café (Coffea arabica L.) orgánico. El cultivo de café orgánico en esta región se realiza en parcelas pequeñas, con sombra de árboles nativos y prácticas de manejo bajo los estándares de la certificación orgánica. Las parcelas de café se encuentran generalmente en colindancia con la milpa, el frijolar y el huerto familiar (Soto-Pinto et al., 2022). Los sistemas agrícolas orgánicos albergan mayor riqueza de HMA que los sistemas agrícolas convencionales, e incluso, más alta que los pastizales (Oehl et al., 2009). La aplicación de abonos orgánicos permite mantener la fertilidad del suelo, promover el manejo sustentable de la tierra (Contreras et al., 2019), mejorar la esporulación y no alterar la riqueza y composición de la comunidad de HMA (Yang et al., 2018). Algunos estudios han mostrado que en los cafetales habita una rica comunidad de HMA. Posada et al. (2016) encontraron 85 especies de HMA en ocho plantaciones de café en Colombia y México. Estos autores indicaron que cafetales con policultivo de árboles de sombra albergan más diversidad de HMA que bosques nativos. Bertolini et al. (2018; 2020) encontraron 20 y 27 especies de HMA en cafetales de la región del Soconusco, Chiapas, México. Trejo et al. (2011) reportaron 10 especies de HMA en plantaciones de café en Veracruz; sin embargo, se desconoce acerca de la diversidad de especies de HMA que es posible encontrar en algún cafetal con manejo orgánico en la región Altos de Chiapas. Este conocimiento, junto con la generación de tecnología que favorezca la propagación de consorcios nativos de HMA, podría ayudar a mejorar la nutrición y el crecimiento de las plantas de café.
Los HMA son simbiontes obligados que requieren la presencia de una planta hospedera para completar su ciclo de vida (Berruti et al., 2016; Ijdo et al., 2011), ésto implica que no pueden ser propagados en medios de cultivo artificiales en laboratorio. Algunos estudios han evaluado la respuesta de plantas hospederas a la inoculación con diferentes especies de HMA, a fin de identificar aquellas que favorecen la esporulación y desarrollan altos niveles de colonización de HMA en sus raíces (Esquivel-Quispe, 2020; Yao et al., 2010). Las plantas hospederas que han mostrado cualidades favorables de esporulación y colonización micorrízica han sido utilizadas como cultivos trampa en estudios de biodiversidad y para la propagación de HMA nativos (Moreira et al., 2007; Oehl et al., 2009). El sistema de propagación que ha sido más empleado debido a la facilidad de su establecimiento se basa en el uso de sustratos, tales como suelo, mezclas de suelo con arena o con abono orgánico (Esquivel-Quispe, 2020; Moreira et al., 2007); no obstante, la propagación de consorcios nativos de HMA es motivo de análisis, ya que factores relacionados con la composición del sustrato y la especie hospedera podrían influir en la propagación de las especies presentes en el inóculo inicial (Aguilar-Ulloa et al., 2016; Berruti et al., 2016; Yang et al., 2018). El presente estudio tuvo como objetivo determinar la diversidad de HMA nativos procedentes de un cafetal de Chiapas, México con manejo orgánico, y evaluar el efecto de la planta hospedera y la composición del sustrato sobre la propagación del consorcio nativo de HMA en condiciones de invernadero. Como hipótesis, se espera que el cafetal orgánico albergue alta diversidad de HMA y que ésta sea eficazmente propagada en el sustrato y la planta hospedera con características favorables para la colonización y esporulación de HMA.
MATERIALES Y MÉTODOS
Diversidad de HMA
El muestreo de HMA se realizó en un cafetal (Coffea arabica L.) orgánico con asociación de árboles de chalum (Inga sp.), naranja (Citrus × sinensis L.), aguacate (Persea americana Mill.) y plátano (Musa sp.), ubicado en la localidad de Chimtic, municipio de Chenalhó, Chiapas, México (16º 56’ 05” N, 92º 35’ 40” O), a una altitud media de 1402 m. El clima es semicálido húmedo con abundantes lluvias en verano, con precipitación media anual de 1740 mm y temperatura media anual entre 18 y 22 °C (Díaz et al., 2000). El tipo de suelo corresponde a Luvisol crómico, con vegetación circundante de bosque mesófilo de montaña y vegetación secundaria arbustiva y herbácea (Plascencia-Vargas et al., 2014). Las prácticas de manejo del cafetal se realizan de acuerdo con los estándares de la producción orgánica y sin aplicación de agroquímicos (SAGARPA, 2013). La parcela pertenece a un productor de la etnia Maya-Tsotsil asociado a la Unión de Productores Orgánicos Beneficio Majomut de S. de P. R. de R. L. El café orgánico está certificado por CERTIMEX.
En febrero de 2021 se realizó un muestreo de suelo y raíces finas mediante la recolecta de 15 submuestras obtenidas en la zona de goteo de la copa de los cafetos, aproximadamente a 90 cm de la base del tallo principal y con una profundidad de 20 cm; posteriormente, las submuestras se mezclaron para formar una muestra compuesta. Las esporas de HMA se extrajeron con la técnica de tamizado húmedo y decantación (Gerdemann y Nicolson, 1963), en combinación con la técnica de gradiente de sacarosa. Se utilizaron cuatro réplicas de 50 g de suelo y se realizó una agitación mecánica para separar las esporas del suelo; posteriormente, se realizó una centrifugación a 2500 rpm en agua, seguida de otra centrifugación a 1200 rpm en solución de sacarosa 60 %. Las esporas se extrajeron y se observaron en un microscopio estereoscópico (Stereove-S5, Velab, McAllen, Texas, EUA) y se agruparon de acuerdo con caracteres morfológicos similares como el color, forma y tamaño. La abundancia de las esporas de HMA se determinó mediante conteo directo y se colocaron en portaobjetos utilizando alcohol polivinílico lactoglicerol (PVLG) para el montaje y tinción con reactivo de Melzer (INVAM, 2021; Schenck y Pérez, 1990). Las muestras fueron observadas con un microscopio óptico compuesto (Motic, BA310, Bogotá, Colombia) con objetivo 100X, con la finalidad de observar los tipos de esporas con base en el color, tamaño, tipo de hifa, ornamentación de la superficie y composición de la pared.
La determinación taxonómica se realizó mediante las descripciones de las especies reportadas en INVAM (2021). La nomenclatura taxonómica que se utilizó fue la propuesta por Schüβler y Walker (2010). Con los datos del número de esporas de las cuatro réplicas de 50 g de suelo de la muestra compuesta y la identidad taxonómica de HMA se obtuvo el índice de diversidad de Shannon-Wiener (H´) mediante la siguiente fórmula: H’= -Σ pi ln pi, siendo pi el número de esporas de un morfotipo dividido entre el total de esporas aisladas (Shannon y Wiener, 1949). Las laminillas de referencia fueron depositadas en el Laboratorio de Microbiología Agrícola, El Colegio de la Frontera Sur (ECOSUR), Unidad San Cristóbal de Las Casas, Chiapas, México. La abundancia se determinó con el total de esporas de HMA en 50 g de suelo y la riqueza con el número de especies de HMA observadas. Para determinar la colonización micorrízica, las raíces fueron aclaradas con KOH y H2O2 10 %, y teñidas con azul tripano en lactoglicerol 0.05 % (Phillips y Hayman, 1970); posteriormente, se observaron en un microscopio óptico compuesto (Motic, BA310, Bogotá, Colombia) con objetivo 100X. El porcentaje de colonización micorrízica se determinó en tres campos visuales equidistantes sobre cada segmento de raíz, y se registró la presencia o ausencia de estructuras micorrízicas como hifas cenocíticas, vesículas, arbúsculos y esporas (Giovannetti y Mosse, 1980). Para obtener el porcentaje de colonización micorrízica se utilizó la fórmula de Sieverding (1983).
Propagación del consorcio de HMA
La evaluación del efecto de la planta trampa y la composición del sustrato sobre la propagación del consorcio de HMA se realizó en condiciones de invernadero en las instalaciones de ECOSUR en San Cristóbal de las Casas, Chiapas, México. Los sustratos utilizados fueron esterilizados tres veces, en días consecutivos, en autoclave eléctrica vertical (Evar, EV-30, México) durante 1 h a 121 ºC y presión de 1.05 kg cm-2. La propagación de los consorcios de HMA se realizó utilizando vasos de unicel de 1 L de capacidad, previamente perforados para garantizar el drenaje, y desinfectados con hipoclorito de sodio 3 %; en seguida, el sustrato esterilizado se colocó hasta la altura del tercio superior del vaso; después, 200 g de la muestra compuesta de suelo obtenida del cafetal que contenía raíces finas del café y esporas del consorcio de HMA se añadieron al sustrato; finalmente, una capa de sustrato esterilizado se colocó como cubierta. Se aplicó riego con agua destilada estéril y se procedió a la siembra de las semillas a 2 cm de profundidad. Las plantas trampa evaluadas fueron café (C. arabica L.), frijol (Phaseolus vulgaris L.), maíz (Zea mays L.) y pasto insurgente (Brachiaria brizantha Trin. Griseb). Antes de la siembra las semillas fueron tratadas con hipoclorito de sodio 0.5 % durante 15 min y lavadas con agua destilada estéril.
Dos tipos de sustratos se utilizaron, sin y con abono orgánico, y se mezclaron con arena de río previamente lavada. El sustrato sin abono consistió en la mezcla de suelo (50 %) y arena de río (50 %), mientras que el sustrato con abono consistió en la mezcla de suelo (25 %), arena de río (50 %) y abono orgánico (25 %). El abono orgánico que se utilizó se obtuvo de una pila de composta con lombrices rojas californianas (Eisenia foetida Sav.). La caracterización física y química de los sustratos y el suelo del cafetal fue realizada de acuerdo con la NOM-012-SEMARNAT-2000 (SEMARNAT, 2002). Se determinó la densidad aparente (método de probeta), textura con hidrómetro de Bouyoucos (Gilson, SA-2, Middleton, Wisconsin, EUA), pH con potenciómetro equipado con electrodo (Orion, Star A215, Thermo Fisher Scientific, Waltham, Massachusetts, EUA) en una suspensión de suelo y agua destilada 1:2 (p/v), materia orgánica por el método de combustión húmeda de Walkley y Black (1934), nitrógeno total mediante microKjeldahl, fósforo disponible por extracción con NaHCO3 0.5 M, pH 8.5 (espectrofotómetro Genesys 180, Thermofisher, Waltham, Massachusetts, EUA); capacidad de intercambio catiónico (CIC) y potasio intercambiable (K) con acetato de amonio 1N a pH 7 (Cuadro 1).
Cuadro 1 Propiedades físicas y químicas del suelo del cafetal y de los sustratos utilizados para la propagación.
| Tipos de sustrato | P (mg kg-1) | MO (%) | pH | NT (%) | K (cmol kg-1) | CIC (cmol kg-1) | Textura | DA (g mL-1) |
|---|---|---|---|---|---|---|---|---|
| SDC | 31.78 | 3.53 | 6.40 | 0.54 | 0.55 | 43.14 | Arc | 0.91 |
| SAO | 3.98 | 2.48 | 8.30 | 0.27 | 0.30 | 18.48 | Fra-Arc | 1.41 |
| SCO | 67.60 | 11.26 | 7.81 | 0.53 | 0.94 | 39.64 | Fra-Arc | 1.14 |
SDC: suelo del cafetal, SAO: sustrato sin abono orgánico, SCO: sustrato con abono orgánico, P: fósforo disponible (Olsen), MO: materia orgánica (Walkley y Black, 1934), NT: nitrógeno total (microKjeldahl), K: potasio intercambiable, CIC: capacidad de intercambio catiónico (acetato de amonio 1N, pH 7), DA: densidad aparente (probeta), Arc: arcilloso, Fra-Arc: franco-arcilloso (SEMARNAT, 2002).
Tratamientos, diseño experimental y análisis estadístico
Se establecieron un total de ocho tratamientos, producto de la combinación de cuatro especies de plantas (café, frijol, maíz y pasto) y dos sustratos (sin y con abono orgánico), en un diseño completamente al azar con cinco repeticiones.
Al final del experimento, 93 días después de la siembra (dds), se evaluó el porcentaje de colonización micorrízica mediante la técnica de Phillips y Hayman (1970) y el número de esporas mediante la técnica de tamizado húmedo y decantación (Gerdemann y Nicolson 1963). Con el paquete estadístico IBM SPSS Statistics 23 se comprobó que los datos cumplieran los supuestos de distribución normal y homogeneidad de varianzas; después, se realizó análisis de varianza (ANOVA) y para la comparación de medias se utilizó la prueba de Tukey con un nivel de significancia de P ≤ 0.05.
RESULTADOS Y DISCUSIÓN
Diversidad de HMA en un cafetal con manejo orgánico
Se registró un valor medio de 139 ± 3.7 esporas/50 g de suelo seco (n = 4), a partir de las cuales se identificaron 18 especies de HMA (Figura 1). Las especies correspondieron a los géneros Acaulospora, Claroideoglomus, Diversispora, Funneliformis, Gigaspora, Glomus, Rhizophagus y Scutellospora. El número de especies identificadas fue similar al que ha sido encontrado en otros cafetales de Chiapas (Bertolini et al., 2018; 2020) y Veracruz, México (Trejo et al., 2011), aunque inferior al encontrado por Posada et al. (2016) en diversos cafetales de Colombia y México, con 81 y 79 especies respectivamente. La riqueza de especies de HMA varía entre cafetales debido a la influencia que tienen la época de muestreo, las condiciones edáficas y las prácticas de manejo en el ciclo de vida, la dinámica de colonización y la esporulación de HMA (Oehl et al., 2009; Ontivero et al., 2020).
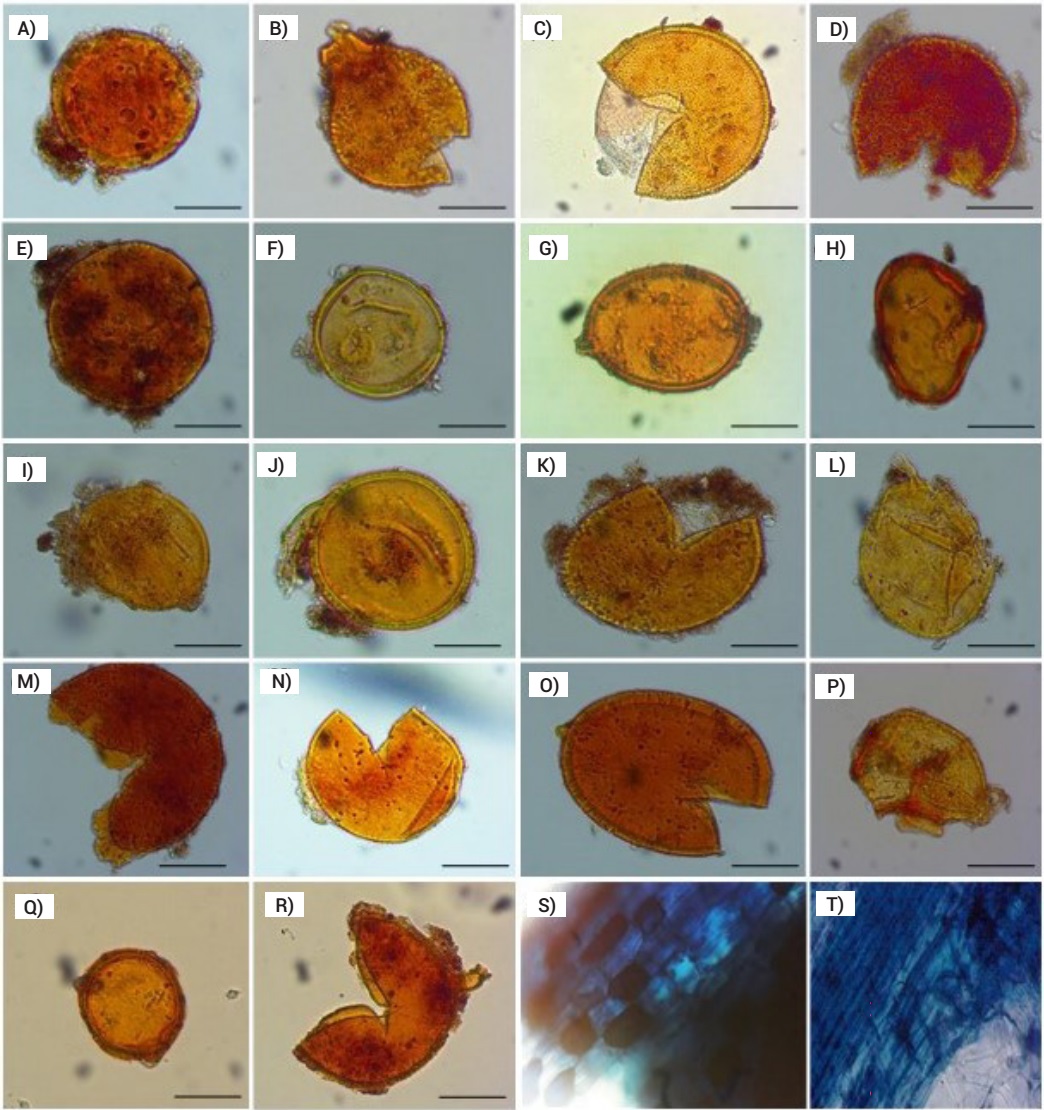
Figura 1. Imágenes de esporas de hongos micorrízicos arbusculares aisladas de la rizósfera de café (Coffea arabica L.) orgánico. A) Acaulospora lacunosa J. B. Morton, B) A. aff. denticulata Sieverd. & S. Toro, C) A. scrobiculata Trappe, D) A. aff. excavata Ingleby & C. Walker, E) A. aff. rehmii Sieverd. & S. Toro, F) A. alpina Oehl & Sieverd., G) Acaulospora sp., H) Glomus sp., I) Claroideoglomus etunicatum C. Walker & Schuessler, J) C. luteum L.J. Kenn., J.C. Stutz & J.B. Morton, K) Claroideoglomus sp., L) C. claroideum C. Walker & Schuessler, M) Scutellospora sp., N) S. calospora C. Walker & F.E. Sanders, O) Funneliformis geosporum C. Walker & Schuessler, P) Diversispora eburnea C. Walker & Schuessler, Q) Rhizophagus intraradices N.C. Schenck & G.S. Sm., R) Gigaspora sp., S) vesículas, T) hifas en raíces de café. Escala: 50 µm.
Con respecto a la diversidad de especies de HMA del cafetal, se encontró un índice de Shannon-Wiener de 2.33, que lo ubica en un nivel alto de biodiversidad. Lo anterior puede estar relacionado con el manejo orgánico de la fertilidad del suelo y la diversidad de árboles de sombra del cafetal, debido a que ambos influyen de manera positiva en la comunidad de HMA (Hernández-Acosta et al., 2021; Posada et al., 2016; Yang et al., 2018). De las especies que fueron identificadas, se encontró que Acaulospora lacunosa y Claroideoglomus luteum fueron frecuentes en las esporas extraídas de la muestra compuesta, mientras que A. scrobiculata, A. aff. excavata, A. alpina, Scutellospora calospora, Diversispora eburnea y Gigaspora sp. fueron menos frecuentes. Los géneros Acaulospora y Claroideoglomus han sido observados con mayor frecuencia en las plantaciones de café (Hernández-Acosta et al., 2021). Las especies del género Acaulospora se han encontrado en suelos ácidos y neutros, con pH entre 5.4 y 7.0 (Oehl et al., 2010).
En este estudio el suelo del cafetal presentó pH de 6.4 y textura arcillosa, que son condiciones favorables para el cultivo de café (Posada et al., 2016), por lo que posiblemente la combinación de características edáficas y prácticas de manejo promovió la diversidad de HMA (Stevens et al., 2020).
Propagación del consorcio de HMA nativos del cafetal
Los tratamientos que contenían la planta de frijol, con y sin abono orgánico, presentaron consorcios de HMA con nueve especies cada uno e índice de diversidad de Shannon-Wiener de 2.03 y 1.89, respectivamente, mientras que en la planta de maíz con y sin abono orgánico, se registraron en cada una siete especies de HMA y un valor Shannon-Wiener de 1.13 y 1.49 (Cuadro 2). En otros estudios también se han encontrado diferencias en la riqueza y diversidad de especies de HMA que son propagadas por plantas trampa, tales como las obtenidas por Moreira et al. (2007) con maíz + cacahuate (Arachis hypogaea L.) y Araucaria angustifolia (Bert.) como plantas trampa en suelo de un bosque de A. angustifolia (Bert.) en Brasil, y por Yao et al. (2010) con trébol (Trifolium repens L.), sorgo (Sorghum bicolor L. Moench) y maíz en suelo de una huerta de cítricos en China.
Cuadro 2 Diversidad de especies de hongos micorrízicos arbusculares (HMA) en cada planta trampa.
| HMA | Café | Frijol | Maíz | Pasto | ||||
|---|---|---|---|---|---|---|---|---|
| SA | CA | SA | CA | SA | CA | SA | CA | |
| Número de especies | 8 | 7 | 9 | 9 | 7 | 7 | 6 | 9 |
| H´ | 1.626 | 1.677 | 1.892 | 2.030 | 1.497 | 1.133 | 1.454 | 1.655 |
H´: índice de diversidad de Shannon-Wiener (1949), SA: sustrato sin abono, CA: sustrato con abono.
Del consorcio nativo de 18 especies de HMA que fueron identificadas en la muestra originalmente recolectada del cafetal se logró la propagación de 13 de ellas. Acaulospora sp., F. geosporum y R. intraradices fueron comunes en todas las plantas trampa, mientras que Scutellospora sp., A. alpina, A. aff. rehmii, C. luteum y C. claroideum se encontraron sólo en alguna de ellas, de manera que A. aff. denticulata, A. aff. excavata, S. calospora y Gigaspora sp. no fueron propagadas en alguna planta trampa (Cuadro 3). La presencia o ausencia de algunas especies de HMA en las diferentes plantas trampa evaluadas se relaciona posiblemente con la dinámica de esporulación de las especies presentes en la muestra del cafetal y con la retroalimentación de la planta hospedera a través de exudados de las raíces sobre la esporulación de la comunidad de HMA (Oehl et al., 2009).
Cuadro 3 . Morfoespecies de hongos micorrízicos arbusculares (HMA) identificadas en los cultivos trampa.
| Morfoespecies de HMA | Café | Frijol | Maíz | Pasto | ||||
|---|---|---|---|---|---|---|---|---|
| SA | CA | SA | CA | SA | CA | SA | CA | |
| 1. A. lacunosa J.B. Morton | X | X | X | X | ||||
| 2. A. scrobiculata Trappe | X | X | X | |||||
| 3. A. aff. rehmii Sieverd. & S. Toro | X | |||||||
| 4. A. alpina Oehl & Sieverd. | X | |||||||
| 5. A. spinosa C. Walker & Trappe | X | |||||||
| 6. Acaulospora sp. | X | X | X | X | X | X | X | X |
| 7. Glomus sp. | X | X | X | X | X | X | ||
| 8. G. multicaule Gerd. & B.K. Bakshi | X | X | ||||||
| 9. C. etunicatum C. Walker & Schuessler | X | X | X | X | X | |||
| 10. C. luteum L.J. Kenn., J.C. Stutz & J.B. Morton | X | |||||||
| 11. Claroideoglomus sp. | X | X | X | X | X | X | ||
| 12. C. claroideum C. Walker & Schuessler | X | |||||||
| 13. Scutellospora sp. | X | |||||||
| 14. F. geosporum C.Walker & Schuessler | X | X | X | X | X | X | X | X |
| 15. F. monosporus Gerd. & Trappe | X | |||||||
| 16. D. eburnea C. Walker & Schuessler | X | |||||||
| 17. R. intraradices N.C. Schenck & G.S. Sm. | X | X | X | X | X | X | X | X |
| 18. R. fasciculatus C. Walker & Schuessler | X | |||||||
| 19. Rhizophagus sp. | X | X | X | |||||
SA: sustrato sin abono orgánico, CA: sustrato con abono orgánico.
En relación con el número de esporas y la colonización micorrízica, se encontraron diferencias altamente significativas (F = 861.9 y 98.8, N = 5, P ≤ 0.01) entre tratamientos, con los valores más altos en maíz en sustrato con abono (134 ± ٢.٩ esporas/50 g de suelo, 70 % de colonización) y los menores en café en sustrato sin abono (45 ± ٢.٥ esporas/50 g de suelo, 18 % de colonización) (Figura 2). La escasa colonización micorrízica que presentó el café posiblemente se debe al crecimiento lento (5.5 ± 0.8 cm de altura) y escaso volumen de la raíz (9.9 ± 3.2 cm3) que presentó al tiempo de fin del experimento. Este resultado coincide con Adriano et al. (2011), quienes encontraron valores de colonización micorrízica en café de 6.6 % al inocular con R. intraradices en etapa de vivero.
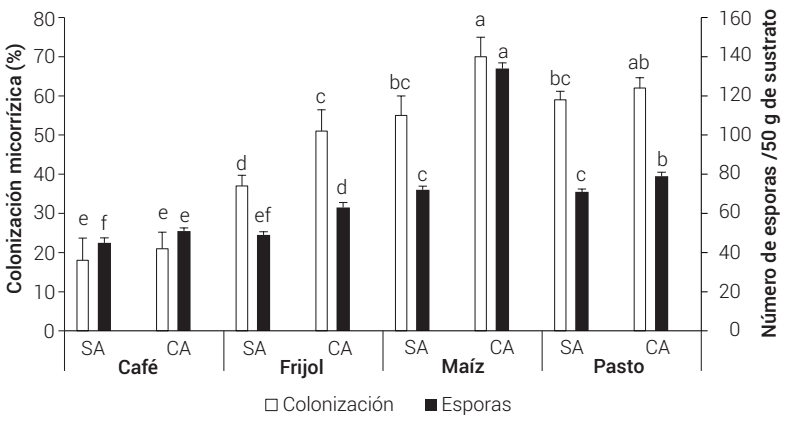
Figura 2 Colonización micorrízica y número de esporas de los cultivos trampa. Letras diferentes en las barras para cada estructura micorrízica indican diferencias estadísticas significativas (Tukey, P ≤ 0.05). SA: sustrato sin abono orgánico, CA: sustrato con abono orgánico.
Por otro lado, los valores altos de porcentaje de colonización y número de esporas obtenido en maíz con abono orgánico se relacionan posiblemente con características propias que le confieren la capacidad de liberar abundantes exudados radicales que son necesarios para sostener la simbiosis micorrízica (Yao et al., 2010), mientras que el efecto positivo de la adición de abono orgánico se debe probablemente al aporte de nutrimentos que son necesarios para el desarrollo de la planta, y de ácidos húmicos que permiten estimular el crecimiento hifal y la esporulación de los HMA (Yang et al., 2018). Estos resultados muestran el potencial de maíz en sustrato con abono orgánico para la propagación de HMA nativos provenientes de cafetos.
En estudios sobre diversidad de HMA se pueden detectar especies dominantes o generalistas que se presentan con mayor frecuencia en los campos de cultivo (Pérez-Luna et al., 2012); de esta manera, los resultados obtenidos indican que Acaulospora sp., F. geosporum y R. intraradices son especies que esporulan tempranamente y se manifiestan como generalistas, ya que fueron encontradas en todas las plantas trampa evaluadas. Hernández-Acosta et al. (2021) mencionaron que Rhizophagus ha sido registrado con mayor frecuencia en la rizosfera de café en seis países de América Latina, y es ecológicamente conocido como generalista. De acuerdo con estos autores, la alta capacidad reproductiva de las especies generalistas favorece su establecimiento y podrían desplazar algunas especies nativas más eficientes; ésto permite destacar que, si bien el maíz con abono orgánico tuvo un mayor número de esporas y colonización micorrízica, el frijol con abono orgánico presentó valores altos de riqueza y diversidad de especies (Cuadro 2), por lo que el frijol se ubica como una planta hospedera con potencial para propagar la diversidad de HMA proveniente de cafetos. Estudios adicionales son necesarios para conocer si la complementación de recursos a través de la asociación de cultivos maíz-frijol podría favorecer la propagación de la diversidad de especies y la intensidad de esporulación del consorcio de HMA nativos del cafetal.
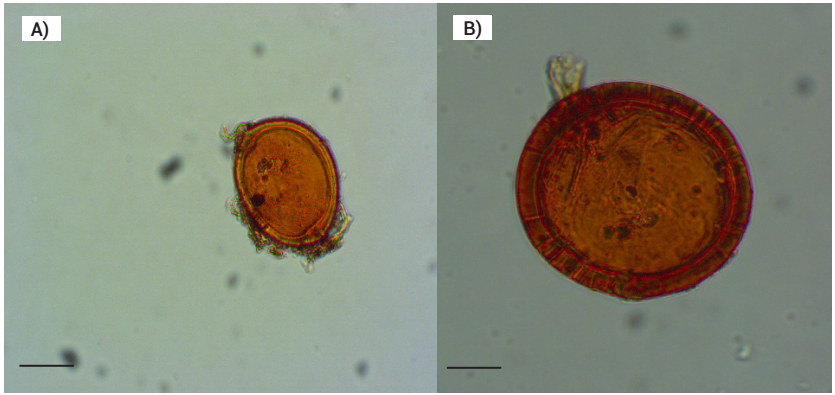
Entre los consorcios de HMA que fueron propagados en las plantas de maíz, frijol y pasto insurgente se detectaron especies que no se encontraban en la muestra inicial del cafetal, tales como A. spinosa C. Walker & Trappe, G. multicaule Gerd. & B.K. Bakshi, F. monosporus Gerd. & Trappe, Rhizophagus sp. y R. fasciculatus C. Walker & Schuessler (Cuadro 3), porque probablemente algunas esporas de la muestra original no presentaron la calidad necesaria para su identificación morfológica, también porque algunas especies de HMA presentes en la muestra de origen se encuentren en su fase somática colonizando raíces del cafeto, con el micelio como fuente de propágulos micorrízicos y, por lo tanto, no se detectan durante el muestreo del suelo, pero al ser propagadas en plantas trampa es posible su detección (Oehl et al., 2009), lo que también depende de las condiciones ambientales, ya que las comunidades de HMA pueden experimentar variación debido a efectos estacionales, dinámica de esporulación y manejo agronómico, con influencia directa en las poblaciones de HMA (Stevens et al., 2020; Trejo et al., 2011). Las especies G. multicaule y F. monosporus han sido reportadas para México (Furrazola et al., 2017), pero no se habían reportado para el estado de Chiapas (Polo-Marcial et al., 2021), por lo que constituyen nuevos registros para este estado. Entre los caracteres diagnósticos, G. multicaule Gerd. & B.K. Barkshi (Figura 3A) forma esporas elipsoides, subglobosas u ocasionalmente triangulares de 149-249 × 124-162 µm de diámetro, con pared de una sola capa (8.6 a 34 µm de espesor) e hifas subyacentes cuyo número varía de 1 a 4 (Gerdemann y Bakshi, 1976; INVAM, 2021); mientras que F. monosporus Gerd. & Trappe (Figura 3B) forma esporas globosas de 150-452 × 169-470 µm de diámetro, con hifas de 8-12 µm de diámetro (Schüβler y Walker, 2010).
CONCLUSIONES
En el suelo rizosférico del cafetal con manejo orgánico se encontraron 18 especies de HMA, entre las cuales el género predominante fue Acaulospora. El número de especies se incrementó a ٢٣ al considerar cinco especies que esporularon en las plantas trampa y que no se encontraron en la muestra inicial. En las plantas trampa se logró la propagación de 18 especies de las 23, entre las cuales Acaulospora sp., F. geosporum y R. intraradices fueron encontradas en todas las plantas trampa, mientras que Scutellospora sp., A. alpina, A. aff. rehmii, C. luteum y C. claroideum se encontraron sólo en alguna de ellas. La propagación se vio favorecida con maíz como cultivo trampa, mientras que el frijol como cultivo trampa presentó mayor diversidad de HMA, ambos en sustrato con abono orgánico. Las especies G. multicaule y F. monosporus que se encontraron en la planta trampa de maíz, constituyen nuevos registros para el estado de Chiapas. El cafetal orgánico presentó alta diversidad de HMA, y las plantas trampa de maíz y frijol en sustrato con abono mostraron potencial para la propagación de HMA nativos provenientes de cafetos.











 nueva página del texto (beta)
nueva página del texto (beta)