Introducción
Echinocactus parryi es una cactácea endémica del municipio de Juárez, Chihuahua, México. Su hábitat ha sido seriamente afectado por el crecimiento urbano, las actividades agrícolas-ganaderas, mineras y la colecta ilegal. Ello ha ocasionado una importante reducción de las poblaciones naturales, por lo que actualmente se considera como especie amenazada (SEMARNAT, 2010). La propagación tradicional de E. parryi presenta restricciones debido a que las semillas tienen barreras físicas y químicas que reducen el porcentaje de germinación. Es bien documentado que el desarrollo de las cactáceas es muy lento, por lo que, el establecimiento de las poblaciones en su ecosistema natural o por métodos de propagación tradicional no son viables (Osuna et al., 2009). Es urgente la búsqueda de alternativas de propagación de la planta madre para su rescate y conservación.
Una técnica con gran potencial para la preservación y multiplicación de especies amenazadas es el cultivo in vitro de tejidos vegetales (Indacochea et al., 2018). Esta metodología permite obtener un alto número de clones en corto tiempo (Ramírez y Salazar, 2016) y en condiciones de luz y temperatura controladas (Emek, 2018). Algunos componentes del medio de cultivo se han modificado obteniendo diferentes resultados. Se ha reportado que el usar el calcio en el medio de cultivo en concentraciones elevadas tiene un efecto en evitar la formación de callo (White y Broadley, 2003) o bien disminuir su inducción cuando se aplica al doble de su concentración de Ca2+ (Mirabbasi y Hosseinpour, 2014). Sin embargo, si es utilizado en exceso puede reducir el potencial del explante para la formación de nuevos brotes, ya que endurece las paredes celulares disminuyendo su flexibilidad (Wyn-Jones y Lunt, 1967). Modificar el pH en el medio de cultivo favorece la formación de brotes (Yaacob et al., 2014) y manipular altas concentraciones de agar afecta el potencial hídrico del medio para minimizar la formación de callo (Scholten y Pierik, 1998).
El objetivo de este trabajo fue estudiar el efecto de los reguladores de crecimiento, Ca2+, pH del medio de cultivo y concentración de agar en la micropropagación de E. parryi. Hasta nuestro conocimiento este es el primer reporte que describe el cultivo in vitro de esta especie.
Materiales y Métodos
Asepsia y germinación de semillas
E. parryi, crece en un suelo regosol (IUSS-WRB, 2015) con pH de 8, conductividad eléctrica de 0.45 dS m-1 a una profundidad de 0 a 15 cm (Figura 1). Las semillas se colectaron al Sur del municipio de Juárez en el mes de Julio de 2017. Posteriormente se trasladaron al laboratorio de biotecnología vegetal ubicado en el Instituto de Ciencias Biomédicas, en Ciudad Juárez, Chihuahua. Las semillas fueron colocadas en bolsas de papel y almacenadas en oscuridad a temperatura ambiente hasta su uso. Se esterilizaron 1200 semillas utilizando cloro comercial al 50% en agitación constante por 30 min. Posteriormente se mantuvieron en agua destilada estéril durante 24 h. Se removió el 50% de la testa usando pinzas y bisturí en condiciones estériles en una campana de flujo laminar. Como grupo control, se utilizaron semillas sin escarificar, esterilizadas bajo las mismas condiciones. La germinación se evaluó cada 48 h durante 15 días.

Las semillas escarificadas, se colocaron en medio comercial de Murashige y Skoog (1962) (Caisson Laboratories() con vitaminas y minerales al 25%, adicionado con 7 g L-1 de agar y 30 g L-1 de azúcar morena; el pH se ajustó a 5.7±0.1 con KOH 1N. Las semillas se mantuvieron en una cámara de crecimiento con fotoperiodo 16 h de luz y 8 h de oscuridad a 25±2 °C. Se consideró como germinación positiva cuando fue visible la emergencia de la radícula.
Inducción de brotes
Para la inducción de nuevos brotes, se utilizaron plántulas de 40 días de cultivo in vitro con una altura de 8 a 12 mm a las cuales se les removió la raíz. Se usó el medio MS completo, conteniendo 30 g L-1 de sacarosa (Caisson Laboratories().
Efecto del Ca2+, agar y pH en la inducción de brotes.Se utilizaron valores normales y modificados de Ca2+, pH y agar del medio de cultivo MS. En el Cuadro 1 se muestran las combinaciones usadas y las claves para cada una de las condiciones del medio de cultivo. La clave presenta los valores del medio de cultivo control (sin modificaciones).
Cuadro 1: Formación de brote-s y porcentaje de callo obtenidos en los explantes de E. parryi durante la interacción entre Ca2+, agar y pH del medio de cultivo a los 120 días.
Table 1: Sprouts formation and callus percentage in explants of E. parryi during the interaction among Ca2+, agar and pH in the culture medium at 120 days.
|
Clave |
Tratamiento |
n |
No. Brotes |
% Callo |
|
Medio de cultivo | ||||
|
1 |
Ca2+ 13.2 µM, pH 5.7 y agar 7 g L-1 |
96 |
0.76 ± 1.16 a † |
24ab |
|
2 |
Ca2+ 26.4 µM, pH 5.7 y agar 7 g L-1 |
96 |
0.54 ± 1.15 ab |
41a |
|
3 |
Ca2+ 13.2 µM, pH 5.7 y agar 10 g L-1 |
96 |
0.24 ± 0.94 b |
24ab |
|
4 |
Ca2+ 26.4µM, pH 5.7 y agar 10 g L-1 |
96 |
0.22 ± 0.73 b |
23ab |
|
5 |
Ca2+13.2 µM, pH 8.0 y agar 7 g L-1 |
96 |
0.14 ± 0.75 b |
37a |
|
6 |
Ca2+26.4 µM, pH 8.0 y agar 7 g L-1 |
96 |
0.09 ± 0.76 b |
12b |
|
7 |
Ca2+13.2 µM, pH 8.0 y agar 10 g L-1 |
96 |
0.05 ± 0.55 c |
6b |
|
8 |
Ca2+26.4 µM, pH 8.0 y agar 10 g L-1 |
96 |
0.04 ± 0.53 c |
33a |
† Letras distintas en la misma columna indican diferencias significativas, según la prueba de Tukey * (P < 0.05).
† Different letters in the same column indicate significant differences, according to the Tukey test * (P < 0.05).
Interacción entre el medio de cultivo y los reguladores de crecimiento en la respuesta morfogenética de E. parryi. Se evaluó el efecto de diferentes dosis de 6-bencilaminopurina BAP (0, 2, 4, 6, 8, y 10 mg L-1) sola o combinada con ácido indol-3-acético (AIA) (0 y 0.5 mg L-1) (Caisson Laboratories() Ca2+, agar y pH en las condiciones descritas anteriormente. El Cuadro 2 muestra las combinaciones probadas.
Cuadro 2: Triple interacción entre el medio de cultivo, concentración de BAP y AIA para la inducción de brotes y formación de callo en E. parryi a los 120 días de cultivo in vitro.
Table 2: Triple interaction among culture medium, BAP and IAA concentrations for sprout induction and callus formation in E. parryi at 120 days of in vitro culture.
Tratamientos |
No. Brotes |
% Callo |
Tratamientos |
No. Brotes |
% Callo |
|||||
Medio de cultivo |
BAP |
AIA |
Medio de cultivo |
BAP |
AIA |
|||||
1 |
0 |
0 |
0cc† |
0g |
5 |
0 |
0 |
0c |
1df |
|
|
1 |
0 |
0.5 |
0.13±0.12b |
0g |
|
5 |
0 |
0.5 |
0c |
12.5f |
|
1 |
2 |
0 |
1.5±0.42ab |
25ef |
|
5 |
2 |
0 |
0c |
0g |
|
1 |
2 |
0.5 |
1.63±0.96ab |
0g |
|
5 |
2 |
0.5 |
2.9±2.3a† |
12.5f |
|
1 |
4 |
0 |
0c |
0g |
|
5 |
4 |
0 |
0c |
0g |
|
1 |
4 |
0.5 |
0.63±0.32b |
25ef |
|
5 |
4 |
0.5 |
0c |
0g |
|
1 |
6 |
0 |
0c |
0g |
|
5 |
6 |
0 |
0c |
37.5def |
|
1 |
6 |
0.5 |
0c |
37def |
|
5 |
6 |
0.5 |
0c |
62.5cd |
|
1 |
8 |
0 |
1.75±0.41ab |
87.5ab |
|
5 |
8 |
0 |
0c |
0.75bc |
|
1 |
8 |
0.5 |
0c |
0g |
|
5 |
8 |
0.5 |
0c |
37.5def |
|
1 |
10 |
0 |
1.63±0.56b |
75bc |
|
5 |
10 |
0 |
0c |
100†a |
|
1 |
10 |
0.5 |
0.63±0.0.42b |
25ef |
|
5 |
10 |
0.5 |
0c |
37.5def |
|
2 |
0 |
0 |
0c |
0g |
|
6 |
0 |
0 |
0c |
0g |
|
2 |
0 |
0.5 |
0c |
37.5def |
|
6 |
0 |
0.5 |
0c |
50de |
|
2 |
2 |
0 |
0.63±0.26b |
25ef |
|
6 |
2 |
0 |
0c |
12.5f |
|
2 |
2 |
0.5 |
0 |
50de |
|
6 |
2 |
0.5 |
0c |
25ef |
|
2 |
4 |
0 |
0.5±0.37b |
25ef |
|
6 |
4 |
0 |
0c |
0g |
|
2 |
4 |
0.5 |
0c |
50de |
6 |
4 |
0.5 |
0.5±0.49b |
12.5f |
|
|
2 |
6 |
0 |
0c |
50de |
|
6 |
6 |
0 |
0.13±0.12b |
37.5def |
|
2 |
6 |
0.5 |
0c |
25ef |
|
6 |
6 |
0.5 |
0c |
12.5 |
|
2 |
8 |
0 |
0.63±0.49b |
75bc |
|
6 |
8 |
0 |
0c |
0g |
|
2 |
8 |
0.5 |
0.25±0.24 |
25ef |
|
6 |
8 |
0.5 |
0.13±0.12b |
0g |
|
2 |
10 |
0 |
0.38±0.5b |
37.5def |
|
6 |
10 |
0 |
0c |
0g |
|
2 |
10 |
0.5 |
0.75±0.49ab |
75bc |
|
6 |
10 |
0.5 |
0c |
0g |
|
3 |
0 |
0 |
0c |
0g |
|
7 |
0 |
0 |
0c |
0g |
|
3 |
0 |
0.5 |
0c |
62cd |
|
7 |
0 |
0.5 |
0c |
12.5f |
|
3 |
2 |
0 |
0.38±0.37b |
50de |
|
7 |
2 |
0 |
0c |
12.5f |
|
3 |
2 |
0.5 |
0c |
0g |
|
7 |
2 |
0.5 |
0c |
0g |
|
3 |
4 |
0 |
0c |
12.5f |
|
7 |
4 |
0 |
0c |
0g |
|
3 |
4 |
0.5 |
0c |
0g |
|
7 |
4 |
0.5 |
0.25±0.24b |
25ef |
3 |
6 |
0 |
1.0±0.56ab |
50de |
7 |
6 |
0 |
0c |
12.5f |
|
|
3 |
6 |
0.5 |
0c |
25ef |
|
7 |
6 |
0.5 |
0c |
12.5f |
|
3 |
8 |
0 |
0c |
25ef |
7 |
8 |
0 |
0c |
0g |
|
3 |
8 |
0.5 |
0c |
12.5f |
7 |
8 |
0.5 |
0c |
0g |
|
3 |
10 |
0 |
0.5±0.49b |
37.5def |
7 |
10 |
0 |
0.25±0.24b |
12.5f |
|
|
3 |
10 |
0.5 |
0c |
12.5f |
|
7 |
10 |
0.5 |
0c |
0g |
4 |
0 |
0 |
0c |
50de |
8 |
0 |
0 |
0c |
37.5def |
|
4 |
0 |
0.5 |
0.88±0.44ab |
50de |
8 |
0 |
0.5 |
0c |
0g |
|
4 |
2 |
0 |
0.13±0.12b |
50de |
8 |
2 |
0 |
0c |
37.5def |
|
|
4 |
2 |
0.5 |
0.380.37b |
0g |
|
8 |
2 |
0.5 |
0c |
62.5cd |
|
4 |
4 |
0 |
0c |
50de |
|
8 |
4 |
0 |
0c |
0g |
|
4 |
4 |
0.5 |
0c |
0g |
|
8 |
4 |
0.5 |
0.50.49b |
25ef |
|
4 |
6 |
0 |
0c |
50de |
|
8 |
6 |
0 |
0c |
62.5cd |
|
4 |
6 |
0.5 |
0c |
0g |
|
8 |
6 |
0.5 |
0c |
25ef |
|
4 |
8 |
0 |
0c |
0 |
|
8 |
8 |
0 |
0c |
0g |
|
4 |
8 |
0.5 |
0.130.12b |
0 |
|
8 |
8 |
0.5 |
0c |
25ef |
|
4 |
10 |
0 |
0.130.12b |
0g |
|
8 |
10 |
0 |
0c |
62.5cd |
|
4 |
10 |
0.5 |
0c |
25ef |
|
8 |
10 |
0.5 |
0c |
62.5cd |
† Letras distintas en la misma columna indican diferencias significativas, según la prueba de Tukey *(P < 0.05).
† Different letters in the same column indicate significant differences, according to the Tukey test * (P < 0.05).
Los medios de cultivo se esterilizaron en autoclave (Terlab() a 121 °C durante 30 min y se vaciaron en frascos Gerber( de 100 mL conteniendo 25 mL del medio. Se colocaron cuatro explantes por frasco en posición invertida (la parte apical en contacto con el medio). Los cultivos se mantuvieron a 25 °C con fotoperiodo (16 h luz / 8 h oscuridad). La formación de brotes nuevos se evaluó a los 120 días de cultivo y la presencia de callo se registró en porcentaje.
Rizogénesis y aclimatación a condiciones de invernadero
Para inducir la formación de raíz, los brotes obtenidos se colocaron en medio MS adicionado con 0.5, 1 y 2 mg L-1 de ácido 2,3,5 tri-iodobenzoico (TIBA). La formación de raíz se evaluó a los 30 días de cultivo.
Los brotes enraizados de aproximadamente 3 cm se extrajeron de los frascos Gerber y se lavaron con agua corriente para eliminar el medio de cultivo de sus raíces. Posteriormente, se transfirieron a vasos de unicel (354.9 mL) que contenían una mezcla de suelo del hábitat de E. parryi (arena) y de sustrato comercial de maceta (Premier() en proporción 2:1. Las plantas se cubrieron con vaso de plástico (295.7 mL) transparente durante una semana para facilitar su aclimatación y se colocaron en invernadero. Transcurrida la semana, se retiró el domo y se continuó regando; después de cinco meses se evaluó el porcentaje de sobrevivencia de las plantas.
Análisis estadístico
Para evaluar la regeneración de brotes nuevos, se realizó un análisis de varianza con arreglo factorial completamente al azar. Factor A: medio de cultivo con tres niveles pH, concentración de Ca2+ y agar, factor B: BAP con 5 niveles 0, 2, 4, 6, 8, y 10 mg L-1 y el factor C: AIA con dos niveles: 0 y 0.5 mg L-1. Se probaron 96 tratamientos con ocho repeticiones para cada uno, originado un total de 768 explantes. Las comparaciones de medias de tratamientos se realizaron a través de la prueba de Tukey con un nivel de significancia P ≤ 0.05 y el programa estadístico SPSS versión 25.
Resultados y Discusión
Germinación de semillas
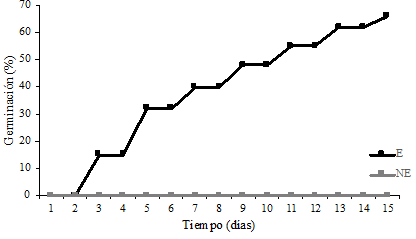
El protocolo de asepsia empleado fue eficiente obteniéndose 90% de semillas asépticas. La germinación de las semillas escarificadas inició al segundo día y a los 15 días alcanzo un máximo de 65% de germinación (Figura 2). Las semillas sin escarificar presentaron indicios de germinación hasta el día 30 (datos no mostrados). Estos resultados indican que el proceso de germinación en E. parryi se aceleró 15 veces al remover el 50% de la testa de la semilla, muy probablemente debido a la rápida entrada de agua y oxígeno al embrión. En la propagación de cactáceas los porcentajes de germinación pueden ser muy variables dependiendo de la especie y las condiciones de cultivo. Por ejemplo, la germinación de Pelecyphora acelliformis fue del 50% (Pérez-Molphe-Balch y Dávila-Figueroa, 2002), en Hylocereus monacanthus del 60% (Montiel-Frausto et al., 2016), en Mammillaria hernandezii del 97%, (Lázaro-Castellanos et al., 2018) y en Mammillaria rhodantha del 99% (Ramírez-González et al., 2019).
Inducción de Brotes
Efecto del Ca2+, agar y pH en la inducción de brotes. En este trabajo se observó que el cambio en las concentraciones de Ca2+, agar, y pH no incrementaron de forma significativa la formación de brotes, pero si influyeron en la formación de callo. En el medio 2, se presentó el mayor porcentaje de callo con 41%, mientras que el medio 7, presentó el porcentaje más bajo con 6%. Estos resultados indican que el aumentar la concentración de Ca2+ del medio de cultivo, no disminuye la formación de callo. Sin embargo, al aumentar el pH y la concentración de agar, la formación de callo disminuye considerablemente (Cuadro 1). El callo se considera indeseable ya que deforma el tejido diferenciado evitando la proliferación de brotes y aumenta la probabilidad de que se genere variación genética (Clayton et al., 1990; Chamorro et al., 2007). El Ca2+ se ha reportado con múltiples usos y funciones, como ser un nutriente esencial para el crecimiento y desarrollo de las plantas (Teardo et al., 2017). El uso de altas concentraciones de Ca2+ en el medio de cultivo, permite que la pared celular se vuelva más rígida evitando que se rompa y se forme callo (Wyn-Jones y Lunt, 1967; Hazarika, 2006). El doble de la concentración de Ca2+ en medios de cultivo, se ha usado para mejorar la calidad y número de brotes en olmo (Mirabbasi y Hosseinpour, 2014) y en las cactáceas Astrophytum myrostigma y Ferocactus glauscecens (Santos-Díaz et al., 2001; Santos-Díaz, 2005). Estas bondades reportadas del calcio no coinciden en fortalecer la pared celular y evitar la formación de callos en E. parryi. En contraste, concentraciones altas de agar influyó en minimizar la presencia de callo en E. parryi, tal como lo afirmaron Scholten y Pierik, (1998); López-Escamilla et al. (2016). Ellos indicaron que las altas dosis de agar, disminuyó el potencial hídrico del medio y redujo la disponibilidad de agua hacia los explantes evitando la hiperhidratación que pudiera deformar el tejido e inducir la formación de callo.
Interacción entre el medio de cultivo y los reguladores de crecimiento en la respuesta morfogenética de E. parryi. Las auxinas y citocininas controlan el crecimiento, y afectan sinérgicamente la división celular y la regeneración in vitro (Arab et al., 2014; Faisal et al., 2018). Al evaluar la interacción del medio de cultivo con BAP y AIA, se observó en el medio de cultivo 5, adicionado con 2 mg L-1 BAP y 0.5 mg L-1 AIA, la mayor formación de brotes con un promedio de 2.9 por explante y un bajo porcentaje de callo (12.5%). Las altas concentraciones de BAP con o sin AIA no favorecieron la brotación (Cuadro 2).
Los resultados indican que se logró triplicar el número de brotes de buena calidad en comparación con la propagación tradicional. En la Figura 3, se muestra el aspecto de brotes bien definidos en comparación con aquellos que generan callo. Si bien, hay especies de cactáceas en las que el número de brotes es mayor como Turbinicarpus pseudomacrochele laussori con 13.6 brotes por explante (Pérez-Molphe-Balch et al., 2012), 22.4 brotes por explante en la especie Mammillaria schiedeana schideana (Soria-Campos et al., 2013) o 24 brotes por explante en Selenicereus grandiflorus (Fontes et al., 2010), existen otras en las que el número de brotes es similar al obtenido en E. parryi. Por ejemplo, 3.3 brotes por explante en Pelecyphora acelliformis (Giusti et al., 2002), 2.5 Melocactus glaucescens (Torres-Silva et al., 2018) o incluso menor, 1.4 en la especie Mammillaria matildae (García-Rubio y Malda-Barrera, 2010). Las diferencias en la respuesta parecen deberse a que cada especie requiere un balance adecuado de auxinas y citocininas para promover el correcto crecimiento y diferenciación celular (Machado y Prioli, 1996; Lema-Ruminska y Kulus, 2014).

Figura 3: Aspecto de brotes de la triple interacción de E. parryi sin o con formación de callo a los 120 días de cultivo in vitro. a) Brotes bien definidos obtenidos en el medio de cultivo 5 con 2 mg L-1 de BAP y 0.5 mg L-1 de AIA y b) Brotes deformados por la abundante presencia de callo generado con el medio de cultivo 2 con 8 mg L-1 de BAP y 0.5 mg L-1 de AIA. Las barras representan 2 cm.
Figure 3: Appearance of E. parryi sprouts with or without callus formation at 120 days of in vitro culture. a) Well-defined sprouts obtained in culture medium 5 with 2 mg L-1 of BAP and 0.5 mg L-1 of AIA. b) Sprouts deformed by the abundant presence of callus in culture medium 2 with 8 mg L-1 of BAP and 0.5 mg L-1 of AIA. Bar scales are 2 cm.
Rizogénesis y aclimatación a condiciones de invernadero
Para el enraizamiento de brotes generados in vitro suele usarse medio de cultivo sin y con reguladores de crecimiento. Por ejemplo, solo con MS se obtuvo 63% de enraizamiento en Stenocereus thurberi (Pérez-Molphe-Balch et al., 2002), 95% en Coryphantha retusa (Ruvalcaba-Ruiz et al., 2010) y 98% en Micranthocereus flaviflorus (Civatti et al., 2017). También se ha reportado el uso de auxinas para favorecer la formación de raíz como en Pelecyphora aselliformis 89% con 1 mg L-1 de ácido indolacético (Pérez-Molphe-Balch y Dávila-Figueroa, 2002), Turbinicarpus ysabelae 96% con 0.5 mg L-1 de ácido indolbutírico (De la Rosa-Carrillo et al., 2012) y Nopalxochia ackermannii 94.21% con 0.5 mg L-1 de ácido 1-naftalenacético (Deng et al., 2018). Sin embargo, en medios de cultivo sin y con auxinas no fue posible inducir la formación de raíz en los brotes regenerados de E. parryi, debido a la formación de callo (datos no mostrados).
Se ha descrito que el uso del TIBA, un inhibidor del transporte polar de auxinas, puede reducir la formación de callo en brotes generados in vitro (Hemmati et al., 2017). Por ello, para inducir la formación de raíz se probaron diferentes concentraciones de TIBA. Se observó la formación de raíz en todas las concentraciones probadas obteniéndose el mayor enraizamiento (91%) con 0.5 mg L-1 de TIBA (Cuadro 3). La Figura 4a muestra el aspecto de los brotes enraizados. El TIBA es un retardante del crecimiento, que evitó la frecuente formación de masa celular en esta etapa de enraizamiento. El TIBA al ser utilizado en bajas concentraciones, en la especie Trichosanthes dioica, promovió mejores resultados de enraizamiento que en los medios libres de reguladores de crecimiento (Singh et al., 2015). Probablemente E. parryi presenta una alta concentración de auxinas endógenas y el TIBA permitió regular su transporte desde los brotes hacia la raíz.
Table 3: Rooting percentage in sprouts of E. parryi at 30 days of in vitro culture.
|
TIBA |
No. brotes |
Enraizamiento |
|
mg L-1 |
% |
|
|
0 |
12 |
41.5b† |
|
0.5 |
12 |
91a |
|
1 |
12 |
83a |
|
2 |
12 |
33b |
† Letras distintas en la misma columna indican diferencias significativas, según la prueba de Tukey * (P < 0.05).
† Different letters in the same column indicate significant differences, according to the Tukey test * (P < 0.05).

Figura 4: Enraizamiento de brotes de E. parryi y aspecto de una planta cultivada en condiciones de invernadero. a) Formación de raíz en medio MS adicionado con 0.5 mg L-1 de TIBA a los 30 días de cultivo in vitro. b) Planta en sustrato de arena y suelo de maceta (2:1) después de 5 meses en condiciones de invernadero. La barra representa 2 cm.
Figure 4: Rooting of sprouts of E. parryi and appearance of a plant grown under greenhouse conditions. a) Root formation in MS medium added with 0.5 mg L-1 of TIBA at 30 days of in vitro culture. b) Plant in sand substrate and potted soil (2:1) after 5 months under greenhouse conditions. Bar is 2 cm.
La adaptación de las plantas generadas a condiciones externas es un paso determinante para que el método de propagación clonal sea efectivo (Soria-Campos et al., 2013). La supervivencia de las plantas a condiciones de invernadero de E. parryi, fue de 58% después de cinco meses (Figura 4b). Estos resultados son similares a los obtenidos en otras especies de cactáceas como, Carnigea gigantea, Pachycereus pringlei, Stenocereus thuberi con 86% de sobrevivencia en promedio (Pérez-Molphe-Balch et al., 2002) y Micranthocereus polyanthus con 67% (Civatti et al., 2017).
Para incrementar el número de brotes y raíces podrían probarse otros reguladores de crecimiento a diferentes concentraciones. Se sugiere analizar el contenido endógeno de hormonas del explante inicial para definir si este factor puede ser el responsable de la alta tasa de formación de callo, tanto en la etapa de multiplicación de brotes como en la inducción de raíces. Explorar el contenido de minerales y otras sustancias químicas, para encontrar el balance óptimo de los reguladores de crecimiento, es recomendable. La regeneración in vitro de E. parryi constituye un avance importante no solo para su propagación y conservación, sino para facilitar estudios en fisiología, bioquímica, biología celular y molecular en condiciones axénicas. De acuerdo con la literatura consultada, este es el primer trabajo que describe el protocolo para la micropropagación de E. parryi, el cual podrá contribuir a su conservación y evitar su riesgo de extinción.
Conclusión
Los resultados obtenidos en la presente investigación mostraron que la modificación del pH 8, concentración de agar y Ca2+, no promovieron un incremento en el número de brotes. Sin embargo, al combinarlos con los reguladores de crecimiento 6-bencilaminopurina (BAP) y ácido indol-3-acético (AIA) fue posible triplicar la formación de brotes bien definidos. Al aumentar el pH y la concentración de agar, la formación de callo disminuyó considerablemente. Se logró un eficiente enraizamiento al usar 2,3,5 tri-iodobenzoico (TIBA), ya que eliminó la presencia del callo en el explante. La supervivencia de las plantas en condiciones de invernadero fue del 58%.











 nueva página del texto (beta)
nueva página del texto (beta)