Introducción
El agua de beber se considera un excelente vehículo para la diseminación de organismos patógenos intestinales, lo que puede originar epidemias (Cotruvo et al., 2004). Los cuerpos de agua superficiales, al igual que los subterráneos normalmente contienen impurezas y diversos microorganismos, incluyendo patógenos (USEPA, 2010). En México, las diarreas asociadas con la ingestión de agua contaminada, se han considerado como la tercera causa de muerte infantil (Aguirre et al., 2007). Los entero-patógenos son organismos nativos del tracto digestivo humano y de muchos animales, que al ser expulsados en las heces, contaminan el suelo y las fuentes de agua superficiales por arrastre de la lluvia, así como las subterráneas, por filtración; los humanos son infectados al ingerir el agua contaminada (Xiao et al., 2001; USEPA, 2004). Los patógenos zoonóticos, dentro de los que se incluyen algunas especies de bacterias como Salmonella, Campylobacter, Escherichia coli O157:H y Yersinia, así como los parásitos Giardia lamblia y Cryptosporidium parvum, infectan igualmente a humanos y animales (Fewtrell y Bartram, 2001; Cotruvo et al., 2004).
El agua de pozos también puede presentar diversos patógenos, incluyendo los parásitos zoonóticos C. parvum y G. lamblia, indicando que el agua del acuífero que los alimenta está contaminada con heces, lo que puede ocurrir generalmente a partir del agua superficial y que al filtrarse tiene acceso al acuífero (Pederson et al., 1997; Entry y Farmer, 2001). Otras fuentes comunes de microorganismos son los basureros y fosas sépticas cercanos a los pozos de extracción de agua doméstica. El transporte de los patógenos es directamente proporcional a la velocidad del agua superficial o subterránea (Perri y Fallon, 1998). El protozoario C. parvum es causante común de epidemias transmitidas por agua, sus efectos son muy severos en pacientes inmunodeficientes; algunos autores han observado que permanece viable por más de seis meses en el agua de ambientes naturales, e incluso resiste el cloro del agua potable para beber, aunque su sobrevivencia disminuye exponencialmente con el tiempo (Robertson et al., 1992). G. lamblia es otro parásito muy común como causante de diarreas en México y este es productor de quistes muy resistentes en el agua, aunque menos que C. parvum y también asociado con epidemias transmitidas por el agua (Le Chevalier et al., 1991).
Diversas investigaciones sobre contaminantes del agua han demostrado que los microorganismos de origen fecal son comunes, tales como las bacterias coliformes totales y Escherichia coli, utilizadas como indicadores de contaminación fecal en agua y alimentos, lo cual significa que su detección es una señal de posible presencia de organismos enteropatógenos (Chávez et al., 2006). Para proteger el agua de consumo humano, tanto de origen superficial como subterráneo, es necesario realizar rutinariamente pruebas de calidad microbiológica y aunque no es posible determinar todos los patógenos intestinales, ni es práctico ni económico, en su lugar se pueden medir indicadores de contaminación fecal fáciles de detectar, ya que junto con ellos es posible la presencia de distintos patógenos (Harwood et al., 2005; Fong et al., 2007). Los ooquistes de Cryptosporidium y Giardia se pueden obtener y contar a partir de muestras de agua, lo cual es de valor como indicadores fecales, incluso del agua clorada, por su resistencia al cloro en las concentraciones permisibles, por lo cual en los Estados Unidos se están implementando normas sanitarias para los sistemas públicos de agua para poder evaluar dichos contaminantes (Mac Kenzie et al., 1994; USEPA, 2010).
En México existe una legislación que regula los sistemas públicos operadores del agua para beber, cuya norma incluye la determinación, en muestras de 100 mL de agua, de bacterias Coliformes totales y E. coli o coliformes fecales, así como la presencia de organismos termo-tolerantes como los géneros citrobacter y enterobacter, es decir, deben estar ausentes cualquiera de ellos (NOM-127-SSA1-1994; NOM-179-SSA1-1998). Sin embargo, todavía no existe la legislación para organismos como Cryptosporidium parvum o Giardia lamblia.
De acuerdo con algunos estudios realizados en la población del Valle de Juárez, Chihuahua, las parasitosis intestinales presentan una alta prevalencia (Flores et al., 2011a). El riego agrícola en la zona es efectuado con aguas residuales obtenidas de las plantas tratadoras, que reciben solo el tratamiento primario, mismo que no elimina totalmente los organismos procedentes de la materia fecal (Di Giovanni et al., 2006). Estas aguas contaminan el suelo irrigado y por arrastre alcanzan corrientes de agua superficiales, sobre todo en épocas de lluvia; así mismo, al filtrarse existe el riesgo de que puedan contaminar el acuífero que alimenta los pozos de uso doméstico en Ciudad Juárez, Chihuahua y sus alrededores.
Por lo anterior, se consideró pertinente investigar algunos de los factores asociados a la presencia de patógenos en el área, tales como los legislados por la norma de calidad de agua (NOM-179-SSA-1998) en la calidad microbiológica del agua de uso doméstico en 14 comunidades del Valle de Juárez, Chihuahua. Esto con el fin de cuantificar el cloro residual, determinar las bacterias coliformes totales como indicadores de contaminación del agua, así como la contaminación fecal causada por presencia Escherichia coli, Cryptosporidium parvum y Giardia lamblia, mismos que representan la posible presencia de otros patógenos intestinales, con riesgo para la salud de la población.
Materiales y métodos
El Valle de Juárez, Chihuahua, México incluye los municipios de Juárez, Guadalupe D. B. y Praxedis G. Guerrero, de los cuales se seleccionaron 14 pueblos donde se obtuvieron muestras de agua de tomas domiciliarias. El período de muestreo y análisis comprendió 18 meses entre Septiembre de 2008 y Febrero de 2010. Las muestras de agua se colectaron de llaves instaladas en el patio de las casas, antes de colectar la muestra en frascos de plástico, de 10 L para Cryptosporidium y Giardia, y 100 mL para coliformes y E. coli, se dejó correr el agua tres minutos, se desinfectó la boca de la llave con alcohol y se flameó para su total desinfección, una vez colectadas las muestras, se transportaron en hieleras para evitar el crecimiento microbiano. La medición de cloro en las muestras de agua se realizó in situ utilizando un colorímetro portátil marca Taylor 9081 que se basa en una técnica colorimétrica en la que el cloro libre reacciona instantáneamente con el reactivo N, N ́-dietil-p- fenilendiamina (DPD) produciendo un color rosa, cuya intensidad es proporcional a la concentración del cloro residual.
La detección y conteo de bacterias coliformes totales y E. coli realizada en los poblados estudiados se realizó mediante 84 muestreos, mientras que para Cryptosporidium y Giardia se utilizaron 38 muestreos, en ambos casos estos variaron de una a dos semanas, lo cual dependió de la disponibilidad de reactivos importados para el análisis de Cryptosporidium y Giardia, de los apoyos de transporte a los pueblos, así como aspectos operativos en el laboratorio. Los pueblos muestreados fueron Loma Blanca (LB-02), San Isidro (SI-03), San Agustín (SA-04), Jesús Carranza (JC-05), Tres Jacales (TJ-06), El Millón (EM-07), Juárez y Reforma (JR-08), Porfirio Parra (PP-09), Guadalupe D.B (GP-11), Praxedis G. Guerrero (PX-14), Colonia Esperanza (CE-15), El Porvenir (PV-20), Vado de Cedillos (VC-22) y San José Paredes (SJ-18) (Figura 1).
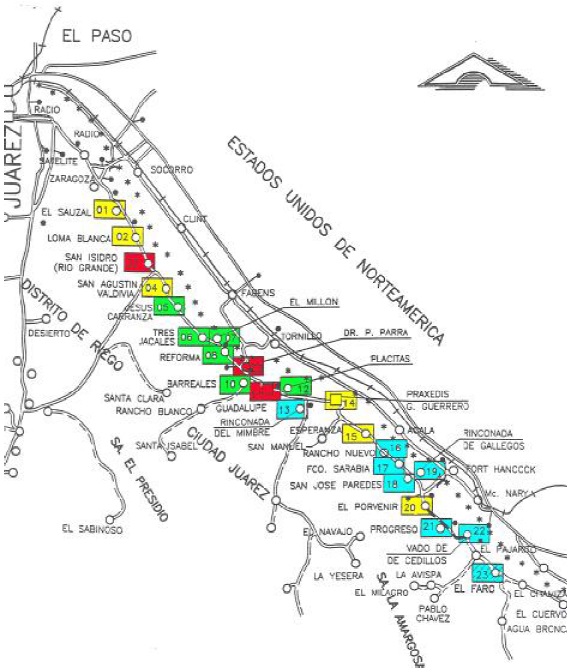
Ubicación geográfica: entre 31° 37' y 31° 07' N y entre 106° 41' y 105° 39' O, altitud de 1120m.
Figura 1 Localización de los pueblos muestreados en el Valle de Juárez, Chihuahua, (Córdoba et al., 2000).
Bolsas estériles WHIRL-PAK se utilizaron para la colecta de 100 mL de agua en cada pueblo muestreado y se trabajaron por cuadruplicado, siguiendo las indicaciones de la NOM-230-SSA1-2002. Antes del análisis bacteriológico, en todas las muestras se inactivó el cloro residual añadiendo 0.1 mL de tiosulfato de sodio al 3%. Cada muestra de 100 mL se pasó a través de un filtro de membrana de celulosa marca Millipore, con poro 0.45 μm y diámetro de 6 cm, con cuadrícula; la membrana se separó y se colocó en una caja de Petri del mismo diámetro, con medio MI y se incubó a 35 oC durante 24 h. Se contaron todas las colonias blancas que corresponden a coliformes totales, así como las colonias azules pertenecientes al coliforme fecal de E. coli,. Se registraron los conteos de colonias de bacterias para cada sitio, efectuando promedios de las cuatro muestras.
Identificación y Conteo de Cryptosporidium parvum y Giardia lamblia
El muestreo de agua para el análisis de Cryptosporidium y Giardia se realizó con recipientes de plástico estériles de 10 L, pero debido al costo elevado de los reactivos utilizados en estos análisis, las 38 muestras incluidas en el estudio se analizaron sin repetición, es decir se utilizó todo el volumen de agua muestreado como lo indica la técnica descrita enseguida. Un mismo poblado fue muestreado más de una vez en diferentes épocas del año. El análisis microbiológico se efectuó dentro de las 24 h siguientes a su recolección. El control fue una muestra de 10 L de agua estéril inoculada con un número conocido de ooquistes de Cryptosporidium o Giardia para asegurar su recuperación en la muestra.
Se desarrolló una técnica con base en el método 1623 propuesto por la Agencia de Protección Ambiental de los Estados Unidos (USEPA, 1999; Kuhn y Oshima, 2001). Cada muestra se concentró haciéndola pasar por un ultrafiltro de cartucho de policarbonato, reusable, con poro de 1 μm de diámetro marca AHP-1010 Microza distribuido por Pall Corp., acoplado a una bomba peristáltica de velocidad controlable, en un sistema cerrado de recirculación. El volumen reducido a 200 mL se colectó y se sometió a centrifugación a 1164 × g, a 4 oC durante 20 min. El sedimento se sometió a la técnica de separación inmunomagnética de anticuerpos Cryptosporidium y Giardia siguiendo las instrucciones del proveedor Virusys Corporation. Los anticuerpos unidos a partículas paramagnéticas reaccionan con los ooquistes de Cryptosporidium, se liberan, y posteriormente se tiñen con anticuerpos específicos marcados con fluoresceína (A100FLK Aqua-Glo G/C Direct Waterborn Inc). Finalmente, se efectuó la identificación y conteo de ooquistes al microscopio de epifluorescencia (LW Scientific), correspondiendo el número a la muestra total de 10 L de agua.
Resultados y discusión
De 84 muestras analizadas para detección y conteo de coliformes totales y fecales, los resultados fueron positivos a coliformes totales en 92.8% de las localidades muestreadas, es decir, en 14 de 15, y solo en el poblado de GB resultó negativa , lo cual es atribuible a que la cloración del agua es más efectiva en esta localidad. En los muestreos dentro de cada localidad, los porcentajes de muestras positivas en promedio variaron de 0 a 71.4% (Figura 2). Al considerar que en cada localidad se repitieron en diferente número los muestreos, de las 84 muestras totales analizadas, 47 resultaron negativas y 37 positivas a coliformes totales. De éstas últimas, 23 muestras resultaron entre 1 y 20 UFC 100 mL-1, siete presentaron de 20 a 50 UFC 100 mL-1, tres entre 100 y 250 UFC 100 mL-1, e igual número de muestras con coliformes totales incontables. Finalmente, solo una resultó entre 50 y 100 UFC 100 mL-1. Mientras que E. coli no fue detectada en todas las muestras del estudio. De las 37 muestras positivas a coliformes totales, 28 presentaron resultados no detectables para cloro libre residual. Solo en una se cuantificó 0.1 mg L-1 y en las ocho restantes no se encontró. Para este mismo parámetro, de 47 muestras en las que no fueron detectados coliformes totales, en 30 de éstas se cuantificó entre 0.1 y 0.5 mg L-1 de cloro libre residual, en 10 no fue detectable y en las siete restantes no fue determinado por carencia del reactivo. Aunque no hubo presencia de la bacteria indicadora de contaminación fecal E. coli, las bacterias coliformes totales en el agua potable indican una alerta de contaminación microbiológica, sin identificar el origen; los porcentajes de positividad dentro de cada localidad variaron desde el 12.5% hasta el 100%, lo cual significa que la contaminación no fue constante en las diferentes fechas ni en las diferentes muestras. Sin embargo, se muestra que hubo fallas en el tratamiento con cloro por parte de las Juntas Rurales de Agua y Saneamiento en cada pueblo, quizá en la falta de higiene de los tinacos que surten cada población o debido a que la red entubada de donde se conectan las tomas de agua domiciliarias haya tenido infiltraciones. La presencia de estos microorganismos es una alerta para mejorar el control de calidad del agua potable, lo cual requiere que se intensifique la vigilancia en la red de distribución y mejorar la efectividad de la cloración.

LB (Loma Blanca), SI (San Isidro), SA(San Agustín),JC (Jesús Carranza), TJ (tres JAcales), EM (El Millón), JR(Juárez y Reforma), PP (Porfirio Parra), GP (Guadalupe D.B.), PX (Prexedis G. Guerrero), CE (Colonia Esperanza), PV (El Porvenir), VC (Vado de Cedillos) y SJ (San José Paredes).
Figura 2 Porcentaje de coliformes totales en las localidades muestreadas en el Valle de Juárez, Chihuahua, durante 2008-2010.
Con relación a los resultados del análisis para la detección de C. parvum y G. lamblia en agua para uso doméstico, se encontró que 19 muestras de 38 (50%) fueron positivas para C. parvum, mientras que 17 de 38 (44.73%) fueron positivas a G. lamblia. En las 13 localidades estudiadas, para estos parásitos, en 12 se detectó la presencia de ellos en alguno de los muestreos, excepto en la comunidad LB donde no hubo presencia, por lo tanto en 92.3% de las localidades existe el problema de C. parvum o G. lamblia (Cuadro 1). Se observa que la presencia de estos parásitos en agua doméstica es un problema generalizado en la región de estudio a través del periodo muestreado. La presencia de los mencionados patógenos fue desde cero hasta 35 ooquistes (Figura 3 y 4), lo que significa que el grado de contaminación fecal no es constante y su posible procedencia puede ser tanto la falta de higiene en los tinacos como del acuífero donde se surten los pozos de cada pueblo.
Cuadro 1 Promedios de ooquistes de Cryptosporidium parvum y Giardia lamblia en las localidades del Valle de Juárez, Chihuahua, durante 2008-2010.
| Localidad | C. parvum | G. Lamblia |
|---|---|---|
| Loma blanca (LB) | 0.0 | 0.0 |
| San Isidro (SI) | 7.3 | 2.0 |
| San Agustín (SA) | 0.3 | 0.0 |
| Jesús Carranza (JC) | 5.0 | 0.3 |
| Tres Jacales (TJ) | 10.5 | 0.0 |
| El Millón (EM) | 12.0 | 0.5 |
| Juárez y Reforma (JR) | 0.0 | 2.0 |
| Porfirio Parra (PP) | 2.3 | 0.8 |
| Barreales (B) | 3.5 | 0.5 |
| Guadalupe (GP) | 1.5 | 0.5 |
| Praxedis (PX) | 2.3 | 1.3 |
| Col. Esperanza (CE) | 4.3 | 14.3 |
| Porvenir (PV) | 9.3 | 5.3 |
| n = 38 |

LB (Loma Blanca), SI (San Isidro), SA (San Agustín), JC (Jesús Carranza), TJ (Tres Jacales), EM (El Millón), JR (Juárez y Reforma), PP (Porfirio Parra), GP (Guadalupe D.B.), PX (Praxedis G. Guerrero), CE (Colonia Esperanza), PV (El Porvenir), VC (Vado de Cedillos) y SJ (San José Paredes).
Figura 3 Valores mínimos y máximos de ooquistes de C. parvum en 10 L de agua en las localidades del Valle de Juárez, Chihuahua. Durante 2008-2010.
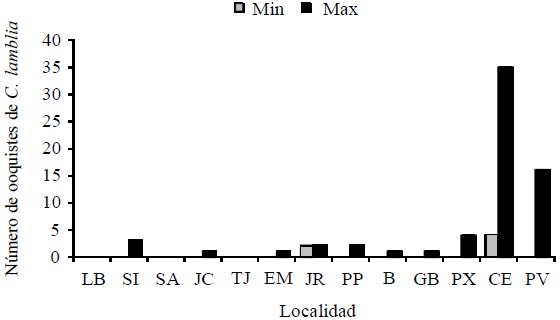
LB (Loma Blanca), SI (San Isidro), SA (San Agustín), JC (Jesús Carranza), TJ (Tres Jacales), EM (El Millón), JR (Juárez y Reforma), PP (Porfirio Parra), GP (Guadalupe D.B.), PX (Praxedis G. Guerrero), CE (Colonia Esperanza), PV (El Porvenir), VC (Vado de Cedillos) y SJ (San José Paredes).
Figura 4 Valores mínimos y máximos de ooquistes de G. lamblia en 10 L de agua en las localidades del Valle de Juárez, Chihuahua, durante 2008-2010.
El número de ooquistes de ambos parásitos varió de 0 a 35 en 10 L de agua para los poblados muestreados, dentro del mismo poblado y entre fechas de muestreo, ya que algunas fueron negativas en un muestreo y después resultaron positivas en otro. Generalmente fueron mayores la cantidades de ooquistes de C. parvum, ya que se detectaron un total de 132 (Figura 3), mientras que de G. lamblia fueron 72 ooquistes (Figura 4) y los promedios de cada patógeno por sitio fue de 6.1±7 y 2.2±4.3, respectivamente. Estos datos confirman lo descrito por algunos autores (Robertson et al., 1992 y USEPA, 1999), en que los ooquistes de C. parvum tiene una vida más prolongada en comparación con los ooquistes de G. lamblia en ambientes acuáticos, llegando a sobrevivir hasta seis meses; además al ser más pequeños pueden infiltrarse con más facilidad a través de los diferentes estratos del suelo y llegar a contaminar a los mantos acuíferos (Harter, 2003).
Es importante indicar que en la región de estudio el agua que abastece los poblados procede de pozos del acuífero subterráneo del Valle de Juárez, Chihuahua, el cual podría tener menos posibilidad de contaminarse que cuando se trata de cuerpos de agua superficiales como lagos y ríos. Sin embargo, dado que es un Distrito de riego con aguas residuales de tratamiento primario donde se han detectado hasta 7000 ooquistes de Cryptosoporidium y 762 de Giardia en 10 L de agua (Di Giovanni et al., 2006), podría existir la posibilidad de filtraciones al acuífero, pero solo mediante análisis del agua en la salida de los pozos y antes de la cloración podría descartarse la posibilidad de que los ooquistes provienen del acuífero. Dado que la cloración del agua durante su potabilización no elimina estos parásitos y fueron observados en el presente estudio de manera íntegra al microscopio, es también importante continuar estudios sobre su viabilidad y efectividad como causantes de enfermedades gastrointestinales, ya que de acuerdo con la legislación Mexicana, la dosis de cloro residual obligada se encuentra entre los límites de 0.2 a 1.5 mg L-1 (NOM-179-SSA1-1998). Así mismo, de acuerdo con la Organización Mundial de la Salud, el límite permisible de cloro es de 2 a 3 mg L-1 y un máximo de 5 mg L-1 (WHO, 1996; Fewtrell y Bartram, 2001; Cotruvo et al., 2004). El agua potabilizada con cloro elimina las bacterias, pero logran sobrevivir por largo tiempo los ooquistes de C. parvum (Peeters et al., 1989). De acuerdo con las legislaciones mencionadas, los ooquistes de C. parvumy G. lamblia requieren para su eliminación inmediata concentraciones de cloro de 50 mg L-1 durante 30 h para reducir el 99.9% de Cryptosporidium a niveles tóxicos para los humanos (CDC, 2010).
El hallazgo de C. parvum en agua doméstica en el presente estudio, se traduce como una alerta de que el agua no es segura para beber en el Valle de Juárez, Chihuahua, ya que los ooquistes de estos parásitos infectan en números que van desde 1 a 10 por 10L de agua, al causar diarreas benignas en sujetos saludables, pero muy graves e incluso mortales, en individuos inmuno deficientes (Delaunay et al., 2000). Por lo que respecta a G. lamblia, Wallis et al. (1996) proponen como límites permisibles entre 3 a 5 quistes por 100 L de agua tratada para beber.
En el presente estudio, la variación en el número de ooquistes de estos parásitos, detectados en los poblados analizados, puede estar influida por la falta de higiene de los tinacos públicos que abastecen cada localidad y que no tienen un servicio de mantenimiento apropiado, así como la red de abastecimiento o quizás el acuífero. El riesgo existente es que la presencia de un patógeno que infecta la población de una región, se reflejará también en una mayor contaminación del ambiente de la misma área, como en este caso por utilizarse aguas residuales en el riego agrícola, así como los basureros y fosas sépticas comunes en la zona de estudio (Flores et al., 2011a). En este estudio, la presencia de ooquistes de Cryptosporidium y Giardia en el 92.3% de las localidades, concuerdan con su alta prevalencia en la población humana del Valle de Juárez, ya que en el periodo 2005 a 2008 se reportaron, por la Secretaría de Salud, 537 casos de padecimientos por infecciones intestinales para una población de 20 000 habitantes (Flores et al., 2011a). Una de las sospechas existentes sobre el origen de los ooquistes de dichos parásitos en agua potable, es que los suelos agrícolas de la región se han regado por más de 30 años con aguas residuales lo que podría generar filtraciones al acuífero principalmente en suelos arenosos que son comunes por la naturaleza de formación de suelos aluviales en la región (Flores et al., 2011b). Otra hipótesis es, que la clase de microorganismos y su estado fisiológico son determinantes, así como la capacidad diferente de cada organismo para sobrevivir fuera del huésped, estos son factores que influyen no solo en la presencia o ausencia de los patógenos, sino en su número (Cox et al., 2005), lo que podría apoyar la explicación de la variación de ooquistes detectados aún en una misma localidad y en diferente muestreo.
Se sugiere para el futuro, realizar estudios complementarios que conduzcan a conocer las fuentes de procedencia de los parásitos analizados en este estudio, así como promover la difusión de estos resultados a todo los niveles gubernamentales, para mostrar la necesidad de desarrollar e implementar métodos más efectivos de potabilización del agua doméstica, que incluyan la separación física de ooquistes de Crytosporidium y Giardia, que aunque podrían ser métodos costosos estarían dando acceso al agua segura en Distritos de riego con aguas residuales en México (Betancourt y Rose, 2004; Harwood et al., 2005). También, las dependencias operadoras del agua doméstica deben asegurarse de que los pozos se ajustan al estado y código de la buena construcción, para poder identificar cualquier fuente de contaminación fecal y tomar las medidas necesarias para corregir el problema (NOM-003-CNA-1996; NOM-004-CNA-1996). El presente estudio sugiere que además del monitoreo de bacterias en agua potable como lo dicta la legislación mexicana, también debería considerarse el análisis de Cryptosporidium y Giardia para conocer la magnitud del problema en nuestro país.
Conclusiones
La cloración del agua de uso doméstico no es efectiva en la mayoría de las localidades del Valle de Juárez, Chihuahua, ya que se detectó que el 92.85% de las muestras de agua de la llave de viviendas, presentaron bacterias coliformes totales, lo cual indicó contaminación y falta de efectividad en la cloración, aunque no se detectó E. coli que indica contaminación fecal. Tanto en las muestras de agua que resultaron positivas como en las negativas, el cloro residual fue nulo o en cantidades menores a la indicada por la legislación mexicana. La presencia de ooquistes de los parásitos C. parvum y G. lamblia en el 92.3% de las localidades en cantidades desde 0 a 35 ooquistes por muestra de 10 L de agua, también son un indicador de contaminación microbiana del agua de uso doméstico, por lo que debe investigarse el origen de estos parásitos en los poblados estudiados, ya que su resistencia a la cloración hace necesario la implementación de métodos de potabilización que incluyan la separación de ooquistes en las muestras de agua, lo cual es costoso pero es necesario para conocer la magnitud del problema en todo el país. En el futuro la investigación debe incluir análisis de muestras de agua de los pozos antes de la cloración, para determinar si los parásitos provienen del acuífero.











 nueva página del texto (beta)
nueva página del texto (beta)


