INTRODUCCIÓN
La producción de limón se realiza en todas las regiones climáticas tropicales y subtropicales del mundo, sobre todo en México, India, Argentina, Irán, Italia, España, Portugal, Estados Unidos, Argentina, Brasil, China, Colombia y Turquía (FAO, 2009). La superficie sembrada en México de limón agrio mexicano [Citrus aurantifolia (Christm) Swingle] es de 15 816 ha, con una producción promedio anual de 157 161.73 Mg (SIAP-SAGARPA, 2010).
El sistema de producción intensivo de huertas comerciales se localiza en 15 estados de México, destacando Guerrero y Oaxaca con superficies sembradas superiores a 1000 ha. En los demás estados el cultivo se localiza en huertos familiares con poca superficie. Ambos sistemas de producción se basan en la fertilización con fuentes nitrogenadas, fosfatadas y potásicas de origen mineral. La renovación de plantas en estos sistemas de producción requiere su propagación en condiciones de vivero, para lograrlo es necesario disponer de sustratos y biofertilizantes con buenos niveles de fertilización, a fin de inducir el rápido y vigoroso desarrollo de la planta.
El uso de soportes orgánicos y microorganismos nativos identificados como PGPR (por sus siglas en inglés de plant growth promoting rhizobacteria) integran un biofertilizante y se postulan para la fertilización orgánica de plantaciones de limón mexicano. Los biofertilizantes son soportes que contienen microorganismos vivos aplicados a la semilla, para la colonización de la rizósfera o en el interior de la planta, que promueven el crecimiento porque aumenta el suministro o disponibilidad de nutrimentos primarios a la planta (Vessey, 2003).
Los biofertilizantes como alternativa nutrimental favorecen el equilibrio del agroecosistema (Reganold et al., 1990), restauran las propiedades físicas, químicas y biológicas del suelo (Abiven y Recous, 2007), reducen la aplicación de fertilizantes sintéticos (Alarcón y Ferrera-Cerrato, 2000), disminuyen los costos de producción y pérdidas de plantas (Sieverding, 1990).
Existen evidencias del efecto benéfico de los biofertilizantes formulados con soportes orgánicos y PGPR (Azospirillum sp, Azotobacter sp y solubilizadoras de P) para aumentar la superficie de exploración de la raíz, el crecimiento, biomasa aérea y raíz de la planta (Vessey, 2003) como lo indican Rajendran y Devaraj. (2004), Aguirre-Medina et al. (2007), Rivera-Cruz et al. (2008) en Casuarina equisetifolia, Theobroma cacao y Musa paradisiaca AAA Simmonds, respectivamente, establecidos en fase de vivero.
El efecto benéficos de los biofertilizantes no se limitan a la etapa de vivero, sino que continúan en el sitio en donde se establece la plantación para su desarrollo y producción. Este efecto se basa en el fortalecimiento del espacio rizosférico el cual va impregnado con el soporte orgánico y las PGPR, esto reduce la mortalidad de la planta después del transplante y disminuyen los requerimientos de fertilización química de origen sintético (Aguirre-Medina et al., 2007). Por lo tanto, se considera que el manejo del suelo con fertilizantes orgánicos en viveros es biológica y socialmente factible si se utilizan los biofertilizantes basados en soportes orgánicos de tipo agrícola y PGPR nativas de regiones citrícolas del sureste de México. El objetivo del presente estudio fue determinar el efecto de tres biofertilizantes, integrados con cáscara de limón, cachaza y estiércol de pollo (pollinaza), que funcionan como soportes de Azospirillum, Azotobacter y solubilizadoras de fosfato, en las propiedades químicas, biológicas del suelo y en el crecimiento de la planta de limón mexicano.
MATERIALES Y MÉTODOS
Suelo Utilizado
El suelo se colectó de los horizontes superficiales Ap1 y Ap2 de un Acrisol vértico cutánico úmbrico, cultivado con plantación comercial de limón persa en el estado de Tabasco, México. Las coordenadas geográficas del sitio de colecta son 17° 43’ 11.17” N y 93° 28’ 43.3” O. El suelo se tamizó en malla de 5 mm de abertura. Las propiedades físico-químicos del suelo fueron; pH, 4.8 (relación suelo-agua 1:2), materia orgánica 3.34% y carbono 5.9% (Walkley y Black, 1934) (Nelson y Sommers, 1982), N total (Nt), 0.11% (micro Kjeldahl) (Page et al., 1982), P (Bray y Kurtz 1), 9.18 mg kg-1 y K disponible, 7.1 mg kg-1 (acetato de amonio 1N) (Norma Oficial Mexicana, 2002).
Preparación de Biofertilizantes
Los biofertilizantes estuvieron constituidos por las formulaciones siguientes. BIO1: cáscara molida de limón + Azospirillum sp +Azotobacter sp + solubilizadoras de fosfatos. BIO2: cachaza + Azospirillum sp + Azotobacter sp + solubilizadoras de fosfatos y BIO3: pollinaza + Azospirillum sp + Azotobacter sp + solubilizadoras de fosfatos. Los tres soportes fueron agrícolas orgánicos de la región citrícola del estado de Tabasco y las tres cepas de bacterias se aislaron de la rizósfera de plantas de limón persa. Estas plantas estaban ubicadas en el mismo sitio de colecta del suelo. Las cepas son dos fijadoras de N de vida libre [Azospirillum sp (MTLS1-20) y Azotobacter sp (MTLS1-110)] y una solubilizadora de fosfato (MTLS2-32). Los soportes (cáscara de limón, cachaza y la pollinaza) fueron secados bajo sombra, molidos y tamizados en malla con abertura de 2 mm, y tratados en autoclave a 1.3 kg cm-1 y 120 °C durante 30 minutos.
El inóculo de las tres bacterias se preparó por separado en matraces de 0.5 L durante 78 h en una incubadora con movimiento oscilatorio a 2.71 g y 28 °C. La cepa de Azotobacter fue cultivada en medio de cultivo líquido Ashby (5 g manitol, 5 g K2HPO4, 0.2 g MgSO47H2O, 0.5 g NaCl, 0.1 g K2SO4, 5 g CaCO3 y 1.0 L de agua destilada, pH 7.0) (Rao, 1999). La cepa de Azospirillum se cultivó en medio líquido agar rojo congo (5 g ácido málico, 0.5 g K2HPO, 0.2 g MgSO4 7H2O, 0.1 g NaCl, 0.5 g extracto de levadura, 0.015 g FeCl3.6H2O, 4.8 g KOH, 15 mL de rojo congo, agar 20 g y 1 L agua destilada, pH 7.0) (Rodríguez, 1982). La cepa solubilizadora de fosfatos se estableció en medio de cultivo Pikovskaya’s (10 g glucosa, 5 g Ca3 (PO4)2, 0.2 g KCl, 0.5 g (NH4)2 SO4, 0.1 g MgSO47H2O, 0.5 g extracto de levadura, 0.002 g MnSO4, pH 7.0) (Rao, 1982). El tamaño inicial de la población de bacterias en el inóculo fue evaluado con el método de cuenta viable por dilución seriada (Madigan et al., 2004), se cuantificaron 36 × 106, 59 × 106 y 89 × 106 UFC mL-1 Azospirillum sp (AZT), Azotobacter sp (AZP) y de bacterias solubilizadoras de fosfatos (BSP), respectivamente. Los tres cultivos con las células bacterianas fueron transferidos a tubos estériles, se centrifugaron a 3828 g a 28 °C. Las células se resuspendieron en agua estéril, se adicionó 280 mL de una suspensión conteniendo 86 × 108 UFC mL-1 a cada 1000 g de soporte orgánico (cáscara de limón, cachaza y pollinaza) dentro de bolsas de polietileno, se incubaron a 28 °C durante 60 días. Los biofertilizantes contenían las siguientes propiedades: BIO1 [pH (3.71:2H2O), CO (40%), Nt (1.2%), P-Bray y Kurtz 1 (1450 mg kg-1), K (0.34 cmol(+) kg-1), AZP (11 × 103 UFC g-1 soporte seco (ss), AZOT (32 × 103 UFC g-1 (ss)] y BSP [(11 × 103 UFC g-1 ss)]. BIO2 [pH (8.41:2 H2O), CO (26.6%), Nt (3.2%), P-Olsen (2086 mg kg-1), K (16.9 cmol(+) kg-1), AZP (25 × 104 UFCg-1 ss), AZT(24×105 UFCg-1 ss) y BSP (12×105 UFC g-1 ss)]. BIO3 [pH (6.31:2 H2O), CO (57.2%), Nt (5.2%), P-Olsen (2869 mg kg-1), K (34.58cmol(+) kg-1), AZP (48 × 105 UFC g-1 ss), AZOT (17 × 105 UFC g-1 ss) y BSP (26 × 105 UFC g-1 ss)].
Establecimiento del Experimento y Variables Evaluadas
El establecimiento del experimento se realizó con los siguientes 10 tratamientos. 1: BIO1-1% (40 g de BIO1 + 3960 g de suelo), 2: BIO1-2% (80 g BIO1 + 3920 g de suelo), 3:BIO1-3% (120 g BIO1 + 3880 g de suelo), 4: BIO2-1% (40 g de BIO2 + 3960 g de suelo), 5: BIO2-2% (80 g BIO2 + 3920 g de suelo), 6:BIO2- 3% (120 g BIO2 + 3880 g de suelo), 7: BIO3-1% (40 g de BIO3 + 3960 g de suelo), 8: BIO3-2% (80 g BIO3 + 3920 g de suelo), 9:BIO3-3% (120 g BIO3 + 3880 g de suelo) y finalmente el tratamiento 10: testigo (0 g BIO + 4000 g de suelo. Cada tratamiento tuvo seis repeticiones, en total fueron 60 unidades experimentales (UE). Cada UE consistió de una bolsa de polietileno color negro con capacidad de 4000 g más la planta de limón mexicano. Las variables evaluadas en la planta fueron altura, diámetro del tallo y biomasa; densidad microbiana y propiedades del suelo.
Crecimiento y Biomasa Vegetal
La altura de la planta (AP) se midió una vez al mes durante 12 meses, desde la base del tallo hasta el primordio foliar, se utilizó una regla graduada en cm. Las plantas fueron cosechadas a los 12 meses después del trasplante. Se separaron las biomasas radical (BR), aérea (BF) y total (BFT), se introdujeron en bolsas de papel, se etiquetaron y se secaron en horno a 72 °C durante 72 h.
Microorganismos en Rizósfera y en Suelo a Distancia
La densidad de bacterias se contó en muestras de suelo rizosférico y suelo a distancia colectados a los 12 meses después del transplante de limón mexicano. Se utilizó la técnica de dilución seriada de 10-1 a 10-5 en 100 μ L de cada una, se inoculó en medios de cultivos específicos (Madigan et al., 2004). Los medios de cultivos fueron sólidos Ashby para Azotobacter sp (Rao, 1999), agar rojo congo para Azospirillum sp en donde se observó la formación de colonias pequeñas secas de color rojo escarlata (Rodríguez, 1982) las cuales fueron cuantificadas y Pikovskaya’s para bacterias solubilizadoras de fosfatos (Rao, 1982).
Determinación de las Propiedades Químicas
Las muestras de suelos colectadas a los 12 meses y los biofertilizantes antes de establecer el experimento se secaron bajo sombra, se tamizaron en mallas de 0.5 y 2 mm de abertura y se realizaron las siguientes determinaciones: pH (relación suelo:agua 1:2), materia orgánica por combustión seca a 450 °C durante 24 h (Nelson y Sommers, 1982), carbono (C) se calculó con el factor de Van Benmelen de 1.724 a partir del contenido de la materia orgánica, nitrógeno total (Nt), fósforo (P-Olsen) y fósforo (P-Bray y Kurtz 1), según las técnica que se especifican en la Norma Oficial Mexicana, (2002).
Análisis de Datos
El análisis de varianza fue determinado para cada variable, la comparación de medias fue mediante la prueba de Tukey (P ≤ 0.05). Se realizó la correlación divariada mediante el coeficiente de Pearson. El análisis estadístico se realizó con el programa estadístico SPSS para windows versión 12 (Camacho, 2006).
RESULTADOS Y DISCUSIÓN
Carbono del Suelo
Los contenidos de carbono (C) aumentaron por el efecto de la adición al suelo de microorganismos integrados a residuos vegetales (cáscara de limón y cachaza) y pollinaza como soportes de PGPR. Los mayores contenidos de C se determinaron en suelos enriquecidos con los biofertilizantes BIO2-3% y BIO3- 3%, los cuales incrementaron en 23.3 y 23.1% respectivamente en comparación con el tratamiento testigo (Cuadro 1). Este mismo comportamiento fue encontrado por Lai et al. ( 2008) al aplicar estiércol de cerdo inoculado con Azospirillum en suelo cultivado con lechuga (Lactuca sativa), que incrementó en 34% el C respecto al testigo después de 40 días del transplante. Asimismo Canali et al. (2004) determinaron 10.5% mayor contenido de C en suelo tratado con estiércol de granja que en el suelo testigo. La investigación efectuada por Eklind (2000) identificó que la cantidad de C resistente a la descomposición durante el proceso de compostaje depende del contenido inicial de lignina, esto puede ser posible por las mayores cantidades de compuestos ligno-celulíticos, que son más resistentes a la degradación microbiana que las deyecciones animales como son los estiércoles (Nahm, 2003).
Cuadro 1 Potencial hidrógeno y contenido nutrimental del suelo bajo diferentes tipos y dosis de biofertilizantes (BIO1, BIO2 y BIO3), 12 meses después del trasplante de limón mexicano (Citrus aurantifolia).

† Cifras con mismas letras dentro de cada columna son estadísticamente iguales (Tukey, P ≤ 0.05, a > b) (n = 6). BIO1 = biofertilizante 1, conteniendo cáscara de limón, consorcio de bacterias (Azospirillum, Azotobacter y solubilizadoras de fosfato). BIO2 = biofertilizante 2, conteniendo cachaza y consorcio de bacterias del BIO1. BIO3 = biofertilizante 3, conteniendo estiércol de pollo y consorcio de bacterias del BIO1. Nt = nitrógeno total. C = carbono. P = fósforo disponible. K = potasio disponible.
Potencial Hidrógeno, Nitrógeno, Fósforo y Potasio en Suelo
Los valores del pH en suelo con el biofertilizante BIO1 fueron similares al del testigo pero estadísticamente diferentes al de los suelos donde se emplearon los biofertilizantes BIO2 y BIO3 (Cuadro 1). El incremento en los suelos del pH por efecto de la inoculación con biofertilizante se explica por la adición de cationes básicos contenidos en los soportes orgánicos de las PGPR (Cavallaro et al., 1993). El BIO2 incorporado en suelo aumentó 1.07 unidades el valor del pH, esto puede estar relacionado con la composición del soporte vegetal (cachaza) rico en cationes por el procesamiento de los jugos en elP-Bray y Kurtz1P-Bray y Kurtz1 en los ingenios azucareros. Al respecto, Redel et al. (2006) y Moyin-Jesu (2007) encontraron incrementos de los valores del pH por efecto de soportes vegetales en suelo cultivado con trigo (Triticum) comparados con suelos sin residuos vegetales. Efectos similares fueron observados (Melero et al., 2007) en trigo (Triticum), girasol (Helianthus) y lenteja (Lens) en condiciones de campo en suelos con composta de residuos animales comparados con suelos sin composta. Nuestros resultados muestran que el BIO3 indujo el aumento del pH en dos unidades, posiblemente fue originado por la composición química de la pollinaza.
El nitrógeno total presentó diferencias significativas entre medias de los 10 tratamientos evaluados (Cuadro 1). Los mayores contenidos de N total (0.483%) se determinaron en suelo tratado con el BIO3 en dosis de 3% (Cuadro 1), fueron mayor 2.2 veces respecto al tratamiento testigo. Estos resultados coinciden con los reportados por Canali et al. (2004) en suelo adicionado con estiércol de granja. Esta respuesta puede asociarse con los hallazgos de Nahm (2003) quien afirma que el N orgánico de la pollinaza tiene mayores contenidos de N lábil procedente de las heces y orina, y que de acuerdo con Shriver et al. (2003) son originados por los altos contenidos protéicos de la dieta de los animales que contribuyen en la liberación de N.
Los contenidos de P y K disponibles en suelo testigo fueron 15.5 mg kg-1 y 7.17 cmol(+)kg-1, respectivamente (Cuadro 1). Estos contenidos se incrementaron de manera significativa por la adición del biofertilizante (BIO3) con respecto al suelo testigo; en cambio, los contenidos fueron igual de bajos que el suelo testigo comparado con los suelos enmendados con el BIO1. La disminución de ambos nutrimentos se correlacionó en forma positiva y altamente significativa con el pH (Cuadro 2). Al respecto, Porta et al. (1999) mencionan que a valores inferiores de 5.5 existe poca disponibilidad de nutrimentos en suelo debido a la baja descomposición de la materia orgánica y por la escasa densidad de bacterias y hongos. No se encontró relación entre los contenidos de P disponible en suelo con la densidad de BSP. La misma ausencia de relación ocurrió entre el contenido de K, la densidad de Azotobacter y Azospirillum, aunque se observó relación significativa con BSP (Cuadro 1).
Cuadro 2 Correlación entre variables del suelo y características de la planta en la aplicación de tres tipos de biofertilizantes (BIO1, BIO2 y BIO3), 12 meses después del trasplante de limón mexicano (Citrus aurantifolia).

* Correlación significativa con nivel de 0.05. ** Correlación altamente significativa con nivel de 0.01. AP = altura de planta. DP = diámetro de tallo. BR = biomasa de raíz. BF = biomasa foliar. BT = biomasa total de planta. AZP = Azospirillum. AZT = Azotobacter. BSP = solubilizadoras de fosfatos.
Nziguheba et al. (2000), Redel et al. (2006), Melero et al. (2007) y Moyin-Jesu (2007) encontraron que el P y K disponibles en suelo se incrementaron al adicionar compostas de residuos vegetales y también con la incorporación de estiércol animal. Los resultados de esta investigación muestran la misma respuesta, los contenidos de ambos elementos aumentaron según la dosis de BIO2 adicionada al suelo, pero el aumento fue mayor al adicionar BIO3. El BIO2-3% acumuló en el suelo 34.16 mg kg-1 de P y 8.20 cmol(+) kg-1 de K disponibles (Cuadro 2). La concentración aumentó por el efecto del BIO3 con 3% de pollinaza, 88.76 mg kg-1 de P y 13.51 cmol(+) kg-1 de K, fueron 5.7 y 1.9 veces mayores que los contenidos del suelo testigo. Esta respuesta, según el tipo y dosis de biofertilizante inoculado, se relacionó de manera altamente significativa con los valores del pH del suelo (Cuadro 2). Se identificó que en suelos con pH entre 5.8 a 6.8 (mediana y ligeramente ácidos) se encontraron los mayores contenidos de P y K, lo cual coincide con Porta et al. (1999), quienes afirman que los nutrimentos del suelo son disponibles en suelos cuando el pH es medianamente ácido a neutro.
Población de Bacterias y Efecto Rizósfera
Las mayores densidades de Azospirillum (138 × 103 UFC g-1 suelo rizosférico), de Azotobacter (42 × 103 UFC g-1) y de bacterias solubilizadoras de fosfatos (1118 × 103 UFC g-1) en rizósfera de plantas de limón mexicano, se localizó en el suelo tratado con pollinaza (BIO3-1%) como soporte de bacterias (Cuadro 3). El aumento de Azospirillum con respecto al suelo sin enmendación (testigo) fue de 17.3 veces, en Azotobacter 41 veces y en las bacterias solubilizadoras de fosfatos 140 veces. Dosis de 3% de BIO3 (soporte pollinaza) causó efecto negativo, inhibió severamente la densidad de los tres tipos de poblaciones de bacterias, incluso fue inferior que las poblaciones del suelo testigo. El efecto tóxico de la adicción de 2 y 3%, que ocurrió en la densidad de bacterias posiblemente fue originado por los altos contenidos de N total (0.483%) en pollinaza.
Cuadro 3 Población de bacterias (103 UFC g-1 suelo o rizósfera seca) y efecto rizósfera en limón mexicano (Citrus aurantifolia) enmendado con tres biofertilizantes, 12 meses después del trasplante.

† Cifras con mismas letras dentro de la rizosfera y de cada bacteria son estadísticamente iguales (Tukey, P ≤ 0.05, a > b, n = 6). RZO = rizósfera. S = suelo a distancia. ER = efecto rizósfera.
El efecto rizósfera fue localizado en limón mexicano plantado en suelo sometido a nueve tratamientos integrados por tipos y dosis de biofertilizantes (Cuadro 3). Su localización es un indicador de la importancia del volumen de suelos alrededor de la raíz, en donde según Singh et al. (2006) existe la disponibilidad de carbono y concentraciones de nutrimentos generados por las plantas durante la fotosíntesis. Los microorganismos colonizan el espacio rizosférico e intervienen en los ciclos de nutrimentos para incrementan la habilidad de la planta en la absorción de nutrimentos desde el suelo.
La correlación de la población de Azospirillum con los contenidos de C, N total y P disponible fue altamente significativa con niveles de 0.01 (0.46, 0.55 y 0.47 respectivamente), pero no con K disponible (Cuadro 2). Azotobacter y las bacterias solubilizadoras de fosfatos tuvieron relación significativa sólo con la cantidad de N total. Investigaciones realizadas por Ravikumar et al. (2004) muestran que los contenidos de N tienen alta correlación significativa con la población de bacterias totales heterótrofas (r = 0.95) y con Azotobacter (r = 0.80).
El efecto rizósfera fue observado en nueve de los 10 tratamientos evaluados (Cuadro 3). El suelo enmendado con el BIO3-1% que contenía pollinaza promovió el tamaño de las poblaciones de las bacterias inoculadas, estadísticamente fue el mejor soporte. En la mayor densidad de bacterias Azospirillum, Azotobacter y solubilizadoras de fosfatos en rizósfera de limón mexicano, parece ser que influyeron dos causas. Una es que en la rizósfera se acumulan los exudados, que incluyen azúcares, ácidos orgánicos, aminoácidos, iones inorgánicos, oxígeno, dióxido de carbono, iones de bicarbonatos, enzimas, sideróforos, hormonas y vitaminas que son fuente de carbono y energía para los microorganismos (Uren, 2001; Gobat et al., 2004). La segunda posible causa fue la aplicación de los soportes orgánicos contenidos en los biofertilizantes, aumentaron la materia orgánica como fuente de energía y el aporte de nutrimentos mediante la liberación de nitrógeno, potasio, calcio y magnesio (Redel et al., 2006). El BIO3-3% inhibió el crecimiento de la planta, al parecer la pollinaza causó efecto fitotóxico, la planta creció poco desde el trasplante (el día 1) hasta el día 150, creció menos de la mitad que la planta del suelo testigo. Al día 180 la planta se secó en su totalidad, por lo tanto no se determinó el efecto rizósfera (Cuadro 3).
Crecimiento de Planta y Biomasa Vegetal
Las medias de la altura de la planta un mes después del trasplante no tuvieron diferencias estadísticas significativas pero si se identificaron diferencias a partir de los tres meses (Cuadro 4). A los seis meses fue notorio el efecto de la adaptación de la raíz de la planta a los soportes orgánicos que contienen los biofertilizantes, el crecimiento de la planta fue mayor en suelo con BIO2 (cachaza) en dosis de 2% comparados con el crecimiento de la planta en suelo sin biofertilizante. Esta respuesta coincide con los resultados de Okumoto (2003) que afirma que la descomposición del material orgánico sucede durante un periodo de tres a seis meses, la materia orgánica pierde energía y produce gran cantidad de calor, N amoniacal y CO2, que son residuos de la oxidación de la materia orgánica. Estos productos de la descomposición se incorporan en el ambiente y con ello la energía liberada, forma un producto mineralizado con poca energía acumulada que no incrementa la temperatura, y por lo tanto existe un ambiente favorable para el crecimiento de la planta. El BIO3-1% de pollinaza promovió el mayor crecimiento de la planta de limón mexicano a los nueve meses hasta el término de la prueba (12 meses). El efecto positivo de 1% de BIO3 medido a los 12 meses fue 114% mayor altura de la planta respecto a la que creció en suelo testigo (Cuadro 4). Resultados obtenidos por Jeyabal y Kuppuswamy (2001) al aplicar biofertilizante integrado con estiércol de granja + Azospirillum, aumentó un máximo de 15% la altura de la planta de arroz (Oriza sativa) respecto al adicionar solo estiércol de granja. Datos recientes (Tabrizi et al., 2008) confirman que la altura de la planta de hisopo (Hyssopus officinalis) aumentó por el efecto de la inoculación de las bacterias Azotobacter, Azospirillum y Pseudomonas fluorescens solubilizadoras de P en sustrato enriquecido con estiércol de ganado bovino.
Cuadro 4 Comparación de medias en la altura de planta de limón mexicano inoculadas con diferentes tipos y dosis de biofertilizante.
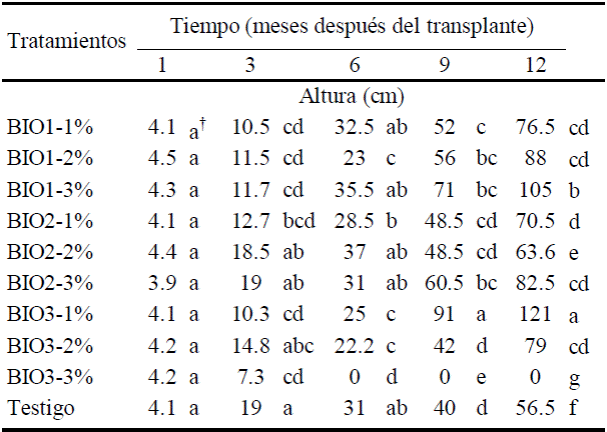
† Cifras con mismas letras dentro de cada tiempo son estadísticamente iguales (Tukey, P ≤ 0.05, a > b, n = 6).
El suelo tratado con el BIO3-2% originó disminución de 34.7% de altura pero al aumentar la dosis a 3% laplanta se secó a partir de los seis meses después del trasplante (Cuadro 4). Según Wu y Ma (2002) y Wang et al. (2004) las causas de la reducción del crecimiento vegetal por el efecto de la fertilización orgánica puede ser originada por la presencia de compuestos fitotóxicos por la inapropiada estabilización de la materia orgánica, así como también por la cantidad de fertilizante orgánico aplicado (Cooperband et al., 2003).
El diámetro del tallo en plantas de vivero de limón mexicano fue importante porque es utilizado de referencia para determinar el momento de realizar el injerto. Los resultados obtenidos muestran que a los 12 meses después del trasplante existen diferencias significativas de las medias de los diámetros de las plantas evaluadas (Cuadro 5). El biofertilizante BIO3 con 1% promovió el mayor diámetro con 10.6 cm, fue 83% mayor que el diámetro de planta que creció en suelo testigo. Tabrizi et al. (2008) también encontraron que el diámetro del tallo de la planta de hisopo (Hyssopus officinalis) fue mayor cuando utilizaron estiércol de ganado bovino inoculado con las bacterias Azotobacter, Azospirillum y con bacterias Pseudomonas fluorescens solubilizadoras de P.
Cuadro 5 Diámetro del tallo y biomasa seca de la planta de limón mexicano a los 12 meses después de la siembra e inoculados con biofertilizantes.

† Cifras con mismas letras dentro de cada columna son estadísticamente iguales (Tukey, P ≤ 0.05, a > b, n = 6).
Con relación a la biomasa, la mayor cantidad de materia seca a los 12 meses fue promovida por el mismo biofertilizante BIO3 al 1%. El BIO1 y BIO2 con tres dosis, aunque con un poco de menor biomasa seca producida, también tienen potencial, dado que las plantas formaron mayor biomasa que las plantas del suelo testigo. Otras investigaciones (Redel et al., 2006) identificaron incrementos significativos hasta 60% del rendimiento de materia seca de planta de trigo (Triticum) en suelos enmendados con residuos orgánicos.
Al relacionar los contenidos de CO, Nt, P y K disponibles y pH del suelo con la altura de la planta, el diámetro del tallo, biomasas radical, aérea y total de la planta, se encontró correlación significativas entre las variable (Cuadro 2). Es probable que la respuesta se deba a la existencia de una mayor disponibilidad de nutrimentos del biofertilizante para la planta, aunque el BIO3-3% causó efecto fitotóxico en la planta, que se manifestó en menor crecimiento o en la muerte de la planta. Se encontraron correlaciones altamente significativas entre las densidades poblacionales de AZT y con BSP (Cuadro 2).
CONCLUSIONES
Los biofertilizantes aplicados al suelo donde crecen plantas de limón mexicano en vivero favorecieron de manera selectiva los contenidos de CO, Ntotal, P, K, densidad de Azospirillum, Azotobacter y bacterias solubilizadoras de fosfato en suelo, así como también en el crecimiento vegetal, en formación de biomasa vegetal. Pollinaza en dosis de 1%, como acarreador de bacterias reguladoras de crecimiento vegetal, favoreció el desarrollo de la planta y en las dosis de 2 y 3% causaron efectos inhibitorios y letales. El biofertilizante promovió efecto positivo en la rizósfera en cuanto a la densidad de Azospirillum, Azotobacter y bacterias solubilizadoras de fosfatos, inoculadas con diferentes dosis y tipos de biofertilizantes y con planta de limón mexicano, lo anterior sugiere por la correlación significativa con N total, que son factores favorables para el desarrollo de la planta de limón mexicano en vivero. La altura de la planta y diámetro de tallo tuvieron correlación con Ntotal, pero la biomasa seca no mostró correlación con el pH, N total, P y K.











 nueva página del texto (beta)
nueva página del texto (beta)


