ANTECEDENTES
El género Rickettsia está formado por diferentes especies de bacterias gramnegativas, a su vez forma parte de la familia Rickettsiaceae (junto a Coxiella, Ehrlichia y Bartonella). Su genoma es circular, con una longitud que va de 1.1 a 1.6 Mb, se dividen por fisión binaria.1-6 Aunque se consideran clásicamente dentro del grupo de bacterias gramnegativas, generalmente se tiñen mal mediante esta tinción, y pueden manifestarse con la tinción de Giménez, Giemsa y naranja de acridina.7 En su pared celular poseen lipopolisa-cárido y peptidoglicano, además de diferentes proteínas mayores de superficie, entre las que destacan la OmpA (190 kDa), que se encuentra fundamentalmente en las rickettsias del grupo de las fiebres manchadas, y la OmpB (135 kDa), que está en todas las especies de Rickettsia. Estas proteínas de superficie son importantes dianas para la inmunidad humoral y también se utilizan para la serotipificación. El lipopolisa-cárido de rickettsias contiene zonas altamente antigénicas que son responsables de las reacciones cruzadas observadas entre las diferentes especies de Rickettsia.8 Desde el punto de vista taxonómico, las rickettsias forman parte del filo α-proteobacterias, en el cual se incluyen a su vez las familias Rickettsiaceae y Anaplasmataceae.
Clasificación
La familia Rickettsiacea incluye dos géneros, el ya mencionado Rickettsia y el Orientia.7 Actualmente, gracias a avances filogenéticos, el género Rickettsia se divide en cuatro grupos:
a. Grupo de las fiebres manchadas (R. ric-kettsii, R. conorii y R. parkeri, entre otras).
b. Grupo del tifus (R. prowazekii y R. typhi).
c. Grupo transicional (R. akari, R. australis y R. felis).
d. Grupo ancestral (R. belliiy R. canadensis).9
Existen otras bacterias similares como R. tsutsu-gamushi, la cual posteriormente se reclasificó en el ya mencionado género Orientia. Otro agente antes considerado parte de las rickettsias es Co-xiella burneti, causante de la fiebre Q, aunque gracias a técnicas moleculares y taxonómicas fue excluida de este género. Estas enfermedades requieren ciertos vectores que facilitan su trasmisión, de forma específica, de artrópodos hematófagos, como las garrapatas en las fiebres manchadas, las pulgas en el tifus murino y piojos en el tifus epidémico.1-9
Patogenia
La patogenia es muy similar en todas las rickettsiosis, de forma general se produce invasión de diferentes células, aunque tienen afinidad por las células endoteliales, en las cuales liberan diferentes citocinas, generando vasculitis de pequeño vaso e infiltrados linfohistiocitarios perivasculares. Las rickettsias inducen su propia fagocitosis al encontrarse dentro del citosol, escapan del fagosoma y proliferan por fisión binaria simple, posteriormente son expulsadas por fagocitosis para infectar a otras células. El cuadro clínico se caracteriza por fiebre de inicio agudo, síntomas inespecíficos, como malestar general, cefalea, mialgias, artralgias, y en algunas ocasiones, manifestaciones de tipo exantemático en la piel. En los casos más graves, suele producirse afectación pulmonar (edema, neumonía intersticial, síndrome de dificultad respiratoria del adulto), cerebral (meningoencefalitis, convulsiones, déficit neurológico), insuficiencia renal aguda y choque hipovolémico; por lo que su pronóstico es variable, desde el alivio espontáneo hasta la muerte en caso de no recibir tratamiento.1
El diagnóstico de las rickettsiosis trasmitidas por garrapatas sigue basándose fundamentalmente en la sospecha clínica y en la detección de anti cuerpos mediante técnicas de serología como la inmunofluorescencia indirecta (IFI).7 Por lo mencionado anteriormente, se podría llegar a pensar que las enfermedades tíficas son ocasionadas únicamente por rickettsias, aunque existen otros padecimientos, como la fiebre tifoidea, que no son trasmitidos por una bacteria de este género. El término "tifo" se deriva del griego typhus, que significa estupor; a continuación se describen algunas enfermedades tíficas.
Tifus endémico o murino
El tifus murino tiene distribución mundial, aunque predomina en climas templados y tropicales, donde se encuentran sus principales reservorios. Su propagación ocurre principalmente tras desastres como inundaciones y huracanes y se relaciona con problemas socioeconómicos como: pobreza, guerras, hacinamiento; también afecta con más frecuencia a recolectores de basura, viajeros y refugiados en algunas zonas del mundo.10 El tifus endémico tiene un patrón temporal característico, ya que predomina durante el verano y el principio del otoño. Esta enfermedad aparece en todos los grupos de edad, la afección infantil es relativamente común; además, no se han encontrado diferencias significativas en cuanto al sexo.5-6,9,11-14 De acuerdo con la Dirección General de Epidemiología de México, en nuestro país se han notificado más de 300 casos entre 2010 y 2014, más de la mitad de ellos en los estados del norte del país. La mayor incidencia se da en los estados de Sinaloa, Baja California Sur, Nuevo León y Sonora, tal como puede apreciarse en el Cuadro 1.

Fuente: realizado a partir de los anuarios de morbilidad 2010-2014 de la SUIVE/DGE.
Cuadro 1 Entidades federativas de México con mayor incidencia de tifo endémico entre 2010 y 2014
Causa y patogenia
Rickettsia typhi es el agente causal del tifus endémico o murino; esta enfermedad es trasmitida por la pulga Xenopsylla cheopis, la pulga de la rata, aunque también los piojos y los ácaros son potenciales vectores (Figura 1). Las rickettsias se multiplican en todos los órganos de sus huéspedes invertebrados, infectando las porciones proximales del tubo digestivo de los vectores, por medio de las cuales pueden trasmitir la en fermedad a sus huéspedes vertebrados durante su alimentación.
Rattus norvegicus y Rattus rattus (rata negra) se consideran reservorios, aunque otros huéspedes vertebrados pueden servir como reservorio (ratón, musaraña, gato, perro). La pulga de la rata y la rata no sufren enfermedad por R. typhi, pero permanecen infectantes de por vida. La trasmisión de la enfermedad a los humanos (y a otras ratas) tiene lugar de tres formas diferentes. La más frecuente es la autoinoculación a partir de las heces de las pulgas en la zona de la picadura, debido a que ésta es pruriginosa y provoca rascado. Otras formas son la trasmisión directa por la picadura y la inhalación de heces de pulga contaminadas. Tras la infección hay inmunidad permanente. El periodo de incubación es de 8 a 16 días.13
A partir del sitio por donde ingresan, las rickett-sias se diseminan por vía linfática y hemática hasta las células endoteliales, que constituyen su principal célula diana. La lesión endotelial es el elemento clave de esta enfermedad, las rickettsias se adhieren a las células endoteliales mediante sus proteínas externas de membrana (outer membrane proteins, OMP) A y B. Inmediatamente penetran en las células endoteliales a través de un mecanismo de fagocitosis inducida, esto para evitar al sistema inmunitario humoral. En este punto se observa que son englobadas en una vacuola de fagocitosis; antes de que se produzca la fusión lisosoma-fagosoma acceden al citoplasma gracias a una fosfolipasa A2 producida por las propias bacterias. En el citosol, realizan un proceso de división celular por fisión binaria, utilizando las fuentes energéticas del hospedador. Finalmente, la bacteria produce proteínas capaces de lisar la membrana, como tlyA, tlyC, pldA y pat-1, las cuales le facilitan la invasión de nuevas células,10 de esta manera se produce aumento de la permeabilidad vascular, hemorragias petequiales, formación de microtrombos, acumulación de leucocitos de tipo mononuclear, y ocasionalmente obstrucción vascular y microinfartos. Las lesiones vasculíticas pueden afectar a casi todos los órganos, incluidos piel, pulmón, hígado, riñón, miocardio, músculo, meninges y encéfalo. Se observa también tumefacción del endotelio de capilares, pequeñas arterias y vénulas, posteriormente hay infiltrados perivasculares de linfocitos, macrófagos, mastocitos y células plasmáticas.
Fisiopatologia
La mayor parte de las manifestaciones del tifus endémico dependen de la endotelitis; se dan tres procesos fisiopatológicos interrelacionados:
1. Alteración de la permeabilidad capilar, con lo que se promueve la salida de líquido hacia los tejidos.
2. Alteración en el funcionamiento normal de los órganos (sobre todo el sistema nervioso central y el pulmón).
3. Activación local de la coagulación.
La respuesta inmunitaria a R. typhi incluye la producción de anticuerpos contra proteínas externas de membrana y respuesta celular mediada por linfocitos T (LT) citotóxicos y natural killer (NK).13
Manifestaciones clínicas. Por lo general, son similares a las del tifus epidémico, aunque tienden a ser menos intensas. Inicia con un periodo prodrómico que dura uno a tres días, con síntomas como cefalea, mioartralgias, astenia y náusea.1-12 En la bibliografía clásica se describe la tríada constituida por fiebre, cefalea y exantema, aunque cabe destacar que no es específica, diversas enfermedades pueden inducir esta tríada, incluyendo otras enfermedades rickettsiales, dengue y chikunguña. El exantema aparece al final de la primera semana en buena proporción de los casos, es de tipo maculopapular en el tronco y después se disemina periféricamente a las extremidades, sin afectar las palmas, las plantas ni la cara; su evolución y distribución es variable, y en 10% de los casos se acompaña de petequias. Puede ocurrir también hepato y esplenomegalia. Entre los datos de laboratorio, se puede encontrar anemia, leucopenia, leucocitosis, neutrofilia, trombocitopenia, aumento de la velocidad de sedimentación globular, elevación del tiempo de tromboplastina, incremento de azoados en 86% (de forma característica se observa nefritis intersticial multifocal perivascular), hiponatremia, elevación de creatincinasa, hipertransaminasemia en 75%, aumento de gamma glutamil transpeptidasa. De forma menos frecuente se aprecia patrón colestásico, hipoalbuminemia e hipergammaglobulinemia; en pocas ocasiones hay ictericia, principalmente en pacientes alcohólicos o con deficiencia de la glucosa 6 fosfato deshidrogenasa, talasemias u otras hemoglobinopatías. El líquido cefalorraquídeo tiende a mantenerse normal, aun cuando existen alteraciones del sistema nervioso central, a veces ocurre pleocitosis o hiperproteinorraquia.15 Pueden manifestarse cuadros muy agresivos como fiebre ictericohemorrágica. Se comunicó el caso de un hombre de 22 años, bisexual, alcohólico, promiscuo, en contacto con perros, con cuadro de un mes con pérdida ponderal de 9 kg, náusea, vómito, lipotimia, diarrea, ictericia severa, coluria, acolia, fiebre, dolor abdominal, astenia, adinamia, malestar general, hepatoesplenomegalia, elevación de enzimas hepáticas y bilirrubinas y sin respuesta al tratamiento de elección con doxiciclina.16 Otra forma de manifestación muy importante es la neumonía, en la que el paciente tiene tos, hemoptisis, fiebre y disnea; radiográficamente, 25% muestra patrón alveolar con o sin derrame pleural que suele ser mínimo y se atribuye a aumento de permeabilidad vascular e inflama ción alveolar.17 Las complicaciones son raras, en general se considera benigno, aunque puede ocasionar sordera, afección neurológica (convulsiones, ataxia, estupor), insuficiencia respiratoria y renal, miocarditis, artritis, tromboembolia pulmonar, endocarditis, lesión retiniana, meningoencefalitis, parotiditis, pleuropericarditis, pseudooclusión intestinal, rotura esplénica, necrosis distal de dedos, lóbulos de orejas y genitales.7,17 Las complicaciones órgano especí ficas (neumonitis, hepatitis, meningoencefalitis, insuficiencia renal) ocurren en menos de 10%, y los casos graves (choque resistente, dificultad respiratoria, insuficiencia multiorgánica, diátesis hemorrágica o afectación neurológica grave) en menos de 5%; la mortalidad mundial es de 0 a 1%.7
Diagnóstico
El método diagnóstico más utilizado en las rickettsiosis son las pruebas serológicas. Los anticuerpos se detectan 10 días después del inicio de los síntomas, y tienen pico entre las 3 y 4 semanas,7 por ello el tratamiento antibiótico debe iniciarse ante la sospecha sin esperar confirmación. Entre las técnicas serológicas usadas se encuentran la fijación del complemento, microaglutinación, ELISA, etcétera. La inmunofluorescencia indirecta (IFI) es la técnica más utilizada para su diagnóstico debido a que la producción de anticuerpos en un paciente afectado de rickettsiosis puede tardar varias semanas. Se debe obtener suero en el momento agudo de la enfermedad y en la fase de convalecencia (con un mínimo de dos semanas del inicio de la enfermedad). Dado que la prevalencia de anticuerpos en la población sana puede ser elevada en áreas endémicas, una sola titulación no debe considerarse, por sí sola, diagnóstico de infección activa; por ello la confirmación del diagnóstico de rickettsiosis requiere seroconversión (pasar de la ausencia de anticuerpos contra la enfermedad a la existencia de los mismos) o serorrefuerzo (aumento mínimo de cuatro veces el título entre el primer suero y el de convalecencia). En el contexto de un síndrome clínico compatible con rickettsiosis, la determinación de anticuerpos de tipo IgM puede ser muy suge-rente de este padecimiento; aunque también se debe considerar que la detección de anticuerpos de tipo IgM puede ser un falso positivo por la presencia de factores reumatoides tipo IgM y otras múltiples reacciones cruzadas.1,7 Además, se tiene el inconveniente de que no permite diferenciar a la especie específica causante del cuadro clínico. Los valores de referencia para el diagnóstico de tifo endémico se han establecido en concentraciones de IgM >32 o IgG >128, o como ya se mencionó, una elevación de cuatro veces el valor inicial. En el Laboratorio Estatal de Salud Pública del Estado de México, considerado de referencia para los autores, se envían 2.5 mL de suero en un plazo no mayor de 8 horas a partir de la sospecha, entre cuyas características se incluye que no debe ser lipémico, hemolizado o contaminado, con temperatura de 2 a 8°C, y el resultado se reporta a las tres semanas, de acuerdo con la NOM (Norma Oficial Mexicana) 032-SSA-2010 "Para vigilancia epidemiológica, prevención y control de enfermedades trasmitidas por vector".
Diagnóstico diferencial
Dada la inespecificidad de los síntomas que ocasiona esta enfermedad el diagnóstico diferencial es amplio, por lo que se debe considerar en este apartado a otras rickettsiosis, síndrome de choque tóxico, meningococcemia, fiebre tifoidea, sífilis secundaria, leptospirosis, viriasis exantemáticas, síndrome mononucleósico atípico, enfermedad de Kawasaki, dengue, fiebre tifoidea, malaria, leptospirosis, infección por enterovirus, arenavirus y hantavirus.
Tratamiento
Al tratarse de un organismo intracelular obligado, la susceptibilidad a antibióticos es difícil. El tratamiento de elección son tetraciclinas como la doxiciclina, a dosis de 100 mg cada 12 horas por 7 a 14 días; en personas que pesan menos de 45 kg se administran 0.9 mg/kg/día divididos en dos tomas. El tratamiento alternativo es cloranfenicol 50 mg/kg/día dividido en cuatro tomas, máximo 2 g. La defervescencia se observa en 2.89 días con doxiciclina, 4.23 con ciprofloxacino y 4 con cloranfenicol. La doxiciclina está contraindicada en el embarazo ya que produce anormalidades dentales antes de las 16 semanas de gestación, fotosensibilidad, intolerancia gástrica, hepatotoxicidad y pancreatitis.
Tifus epidémico
Se manifiesta principalmente como brotes o en epidemias, y se favorece su trasmisión en situaciones de hambruna, hacinamiento, desastres naturales y guerras. Es común en Sudamérica, África y Asia. Ocurre en temporada de frío, cuando las personas utilizan ropa gruesa, viven en hacinamiento e inadecuadas condiciones sanitarias que inducen la proliferación de piojos. En México se han reportado más de 5,000 casos entre 2010 y 2014, de los que 90% se notificaron en 2010, de acuerdo con la Dirección General de Epidemiología. Las entidades donde más casos se observaron fueron Nuevo León, Michoacán, Baja California Sur, Sinaloa y Sonora, como se describe en el Cuadro 2.

Fuente: realizado a partir de los anuarios de morbilidad 2010-2014 de la SUIVE/DGE.
Cuadro 2 Entidades federativas de México con mayor incidencia de tifo epidémico entre 2010 y 2014
Etiologia y patogenia
El tifo epidémico es ocasionado por R. prowa-zekii, que se trasmite mediante el piojo corporal (Pediculus humanus corporis), que se infecta al alimentarse de una persona rickettsiémica, que posteriormente lo trasmitirá a otras personas (Figura 2).
Para su trasmisión se requiere un estrecho contacto personal o con ropa en la que se encuentre el piojo. Las rickettsias se multiplican dentro del epitelio intestinal y se liberan con las heces; la infección es trasmitida por contaminación en la zona de la mordida con las heces del piojo. El piojo infectado fallece a las dos o tres semanas por obstrucción del tubo digestivo y, al contrario que R. typhi, no trasmite las rickettsias a su descendencia, lo que confiere a esta enfermedad su carácter epidémico. La persona infectada mantendrá de por vida algunas rickettsias, que pueden replicarse posteriormente en situaciones concretas (inmuno-depresión, inanición, etc.).13,18,19
Manifestaciones clinicas
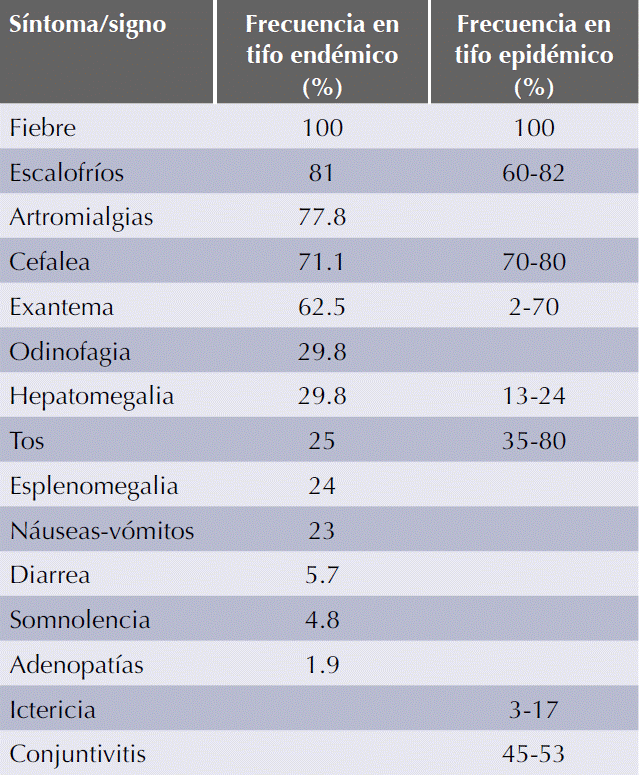
Los síntomas y signos son variados y dependen del órgano afectado, comienzan de forma abrupta tras un periodo de incubación de una semana, manifestándose con fiebre elevada mantenida, cefalea y artromialgias. El exantema suele aparecer en torno al quinto día en las áreas axilares y el tronco para después extenderse a las extremidades, es maculopapular confluente (raramente purpúrico) y no afecta las palmas ni las plantas. Otras manifestaciones clínicas encontradas son tos, calosfríos, anorexia, vómito, dolor abdominal, crisis convulsivas, ataxia, fotofobia, hepatoesplenomegalia, ictericia, conjuntivitis, confusión, entre otras. Entre las complicaciones más frecuentes se encuentran la neumonitis y las complicaciones neurológicas (meningoencefalitis y coma). La recuperación en casos no complicados se produce en torno a los 14 días. La mortalidad puede llegar a 40%. El Cuadro 3 muestra una tabla comparativa de las manifestaciones clínicas del tifo endémico y el epidémico.
Diagnóstico
El diagnóstico de las rickettsiosis es serológico. La inmunofluorescencia indirecta es la prueba diagnóstica de elección, en la que se considera diagnóstica la titulación >1:64 con elevación posterior cuatro veces su valor inicial o títulos superiores a 1:256 en agudo. La técnica de Western Inmunoblot se utiliza para confirmar casos selectos cuando la inmunofluorescencia indirecta no es concluyente.
Tratamiento
El tratamiento de elección es doxiciclina a dosis de 100 mg cada 12 horas, o tetraciclina 25-50 pg/kg/día dividida en cuatro tomas, el cual se debe mantener durante al menos tres días después de la desaparición de los síntomas. Se recomienda como alternativa el cloranfenicol a dosis de 60-75 pg/kg/día dividida en cuatro tomas durante el mismo periodo que los anteriores, igualmente se considera a la ciprofloxacina una alternativa terapéutica.
Rickettsiosis tipo fiebres manchadas de las Montañas Rocosas
Es una infección producida por Rickettsia rickettsii, cocobacilo polimorfo perteneciente a la familia Rieckettsiaceae. Gramnegativo, intracelular obligado. La enfermedad es llamada así por haber sido descrita por primera vez en las Montañas Rocosas de Estados Unidos, y se ha reportado en Canadá, México, Costa Rica, Panamá, Colombia, Brasil y Argentina, recibiendo distintos nombres según su ubicación geográfica, como fiebre manchada brasileña y fiebre de Tobia en Colombia.11
Ciclo natural de Rickettsia rickettsii
La fiebre manchada de las Montañas Rocosas es una zoonosis y las garrapatas su principal reservorio, las cuales varían en distintas zonas geográficas; Dermacentor andersoni, la garrapata de la madera de las Montañas Rocosas, y Dermacentor variabilis, la garrapata del perro, son los principales vectores. El ciclo de vida de las garrapatas tiene tres etapas: larvas que salen de huevos, ninfas que se desarrollan a partir de larvas y los adultos. Cada una de estas formas permanece unida al huésped, alimentándose de su sangre por unos pocos días. R. rickettsii puede estar en cualquiera de las tres etapas del ciclo de vida de las garrapatas, incluso en los huevos. Puede trasmitirse en las formas inmaduras a las adultas (trasmisión transestado) y de una garrapata a su descendencia (trasmisión transovárica). Estos mecanismos le permiten a la bacteria sobrevivir en la naturaleza por periodos prolongados y le confieren mayor longevidad y resistencia al medio ambiente, pero la infección afecta negativamente a la garrapata huésped. Otro aspecto importante es el llamado fenóme no de interferencia, que afecta la distribución de la rickettsias en las garrapatas y consiste en que una vez que la garrapata se infecta con una especie de Rickettsia queda protegida contra otras. Este fenómeno causado por competencia entre las bacterias por el microambiente del parásito previene la adquisición y trasmisión de más especies de rickettsias.11 Los principales reservorios naturales de las garrapatas vectores de R. rickettsii son mamíferos pequeños, ganado y particularmente perros que suelen recuperarse espontáneamente de una infección rickettsial.11
Epidemiología
Se consideran factores de riesgo la cacería con contacto con zarigüeyas, ardillas voladoras, tlacuaches y venados de cola blanca parasitados con garrapatas. Rara vez los enfermos recuerdan picaduras o prurito, y por tanto la inoculación por el vector pasa inadvertida. También se consideran factores de riesgo: edad avanzada, retraso de 5 días de inicio de antibióticos, alcoholismo, depresión, déficit de glucosa 6 fosfato deshidrogenasa, hemoglobinopatías, enfermedad renal crónica, hipoalbuminemia, hipocalemia y administración de trimetoprim sulfametoxazol.13
Patogenia
Cuando R. rickettsii ingresa al huésped después de ser inyectada desde las glándulas salivales de la garrapata durante su alimentación, lo hace por los vasos linfáticos y sanguíneos hasta alcanzar las células endoteliales.11 Después de entrar en la célula, la bacteria se propaga de una célula a otra al atravesar las membranas celulares sin causar daño por reclutamiento y polimerización de filamentos de actina de la célula huésped. La rápida expansión intercelular explica por qué rara vez la bacteria se acumula en una única célula.11 La bacteria infecta las células endoteliales de los vasos de pequeño y mediano tamaño causando vasculitis, que es el mecanismo de la mayor parte de las manifestaciones clínicas, y conduce a microhemorragias, aumento de permeabilidad vascular, edema, activación de los mecanismos humorales con inflamación y la cascada de coagulación.
Manifestaciones clínicas
El periodo de incubación va de dos días a dos semanas. Inicia con cefalea, calosfríos, fiebre bifásica que dura dos a tres semanas, mialgias, náusea y vómito.11,14,20
Se forma una úlcera o escara en el sitio del inóculo (mancha negra o tache noir) debido a reproducción de bacterias en el interior de células endoteliales con necrosis en dermis, epidermis y edema perivascular.11,14
La tríada clásica consiste en fiebre, cefalea y exantema, los cuales a menudo inician súbitamente. Esta tríada rara vez aparece en las primeras fases de la infección, incluso puede no ocurrir. La proporción de pacientes con la tríada aumenta de menos de 5% en los primeros tres días a 60-70% en la segunda semana de la exposición. La fiebre y la cefalea casi siempre están presentes.11,14,20 El exantema puede estar ausente en fases tempranas (de 14% el primer día a 49% al tercer día), en la mayoría de los casos se desarrolla entre el tercer y quinto días. Como la base fisiopatológica de la erupción es la vasculitis de pequeños vasos, a medida que ésta empeora, el brote cutáneo también. En las primeras fases la erupción es macular no pruriginosa; más tarde se vuelve papular y en raras ocasiones aparecen hemorragias e incluso áreas de necrosis o gangrena cutánea. La progresión centrípeta desde muñecas y tobillos hacia el tronco se produce en una minoría de casos. La afectación palmo-plantar es característica, pero puede estar ausente o aparecer en las últimas fases de la enfermedad. Puede haber daño genital. En 10% de los casos no hay exantema, lo que dificulta el diagnóstico.14,20
Como la vasculitis es generalizada hay síntomas sistémicos, malestar, fotofobia, mialgias y artralgias.11 Las manifestaciones gastrointestinales incluyen vómito, dolor abdominal y diarrea, lo que puede incluso confundirse con colecistitis o apendicitis.11 Se han reportado casos de choque séptico, insuficiencia renal y síndrome ictérico con hepatoesplenomegalia asociado con exantema maculopapular y petequias.20
En el sistema nervioso central también hay alteraciones, puede haber focalización, crisis convulsivas, confusión, meningismo, meningoencefalitis e hiperreflexia, y en el corazón, pericarditis y miocarditis. Puede ocurrir insuficiencia respiratoria y cardiaca, elevando la presión en cuña de la arteria pulmonar con ecocardiograma normal que sugiera edema pulmonar no cardiogénico. Puede haber infarto agudo de miocardio, arritmias y bloqueo cardiaco; así como tos, disnea, inyección conjuntival, papiledema, hemorragias retinianas, insuficiencia renal aguda y gangrena digital.
Los estudios de laboratorio demuestran hiperazoemia, trombocitopenia por secuestro y destrucción en la microcirculación, y elevación de transaminasas; el conteo de leucocitos puede ser normal, alto o bajo; hay hiponatremia por síndrome de secreción inadecuada de hormona antidiurética o vasopresina. El líquido cefalorraquídeo indica pleocitosis linfocitaria e hiperproteinorraquia. En el electroencefalograma se encuentran alteraciones corticales no focales.11 Son marcadores de gravedad la hiperazoemia y la elevación de enzimas musculares como creatincinasa.
Diagnóstico
Las manifestaciones son inespecíficas; se basa en las características clínicas y condiciones epidemiológicas. Es un diferencial en fiebre de origen desconocido en regiones endémicas. Se confunde con infección viral, meningococcemia, sarampión, leptospirosis, mononucleosis, infección estreptocócica y reacciones medicamentosas, dengue y chikunguña. Las pruebas serológicas son el método más práctico y específico para confirmar, pero los títulos diagnósticos aparecen en 7 a 10 días.11 De las pruebas serológicas disponibles, la inmunofluorescencia indirecta es el mejor método y está ampliamente disponible. La sensibilidad es baja en los primeros 10 a 12 días y aumenta a 94% cuando se hace en la fase de convalecencia 14 a 21 días después. Se debe tener en cuenta que el tratamiento temprano puede bloquear o suprimir la aparición de anticuerpos en la convalecencia. Requiere títulos de al menos 1:64. La inmunofluorescencia no puede distinguir entre los diferentes miembros de las familias de Rickettsia. La prueba de Weil-Felix que detecta anticuerpos de reacción cruzada contra los antí-genos de Proteus vulgaris (OX2 y OX19) es poco sensible y específica. Los hemocultivos son muy sensibles y específicos, sólo disponibles en investigación.11 Las pruebas de inmunofluorescencia directa o inmunoperoxidasa pueden realizarse en especímenes tisulares fijados en formol. La sensibilidad de la inmunofluorescencia directa para detectar R. rickettsii en biopsias de piel es de 70%, aproximadamente, con especificidad de 100%; sin embargo, estas pruebas tampoco están ampliamente disponibles y debido a que no cuentan con suficiente sensibilidad, un resultado negativo no se puede utilizar para excluir el diagnóstico. La amplificación del ADN por PCR ha facilitado el diagnóstico en casos agudos utilizando varios protocolos que varían en espe cificidad y sensibilidad. Algunos problemas de la prueba es que sólo está disponible en los Centros para el Control y Prevención de Enfermedades de Estados Unidos y laboratorios de investigación, no está estandarizada y su sensibilidad y especificidad varían entre ensayos. El tratamiento con doxiciclina puede disminuir la sensibilidad de la PCR. A pesar de esto, es el método más útil para detectar el agente causal en la fiebre manchada, especialmente en muestras de tejido, debido al escaso número de rickettsias que circula en sangre. La PCR amplifica los genes que codifican las proteínas de membrana externa de las rickettsias y la proteína antigénica conocida como 17kDa con resultados positivos.11,20
Tratamiento
El antibiótico es esencial para prevenir complicaciones y muerte, por tanto, debe iniciarse aún sin confirmar el diagnóstico, ya que el retraso en el inicio del tratamiento empírico se asocia con mayor riesgo de mortalidad. El inicio antes de cinco días disminuye la mortalidad 6.5 vs 23% con tratamiento después de cinco días. El tratamiento empírico se justifica en residentes o viajeros a zonas endémicas con síntomas sugerentes. La doxiciclina es el tratamiento de elección, exceptuando a los alérgicos y embarazadas, la decisión es riesgo/beneficio. La alternativa en el embarazo es el cloranfenicol 50 mg/kg/día fraccionado en cuatro dosis. La doxiciclina puede prescribirse en embarazo a término porque el riesgo de daño al producto es mínimo y la única alternativa, el cloranfenicol, causa el síndrome del niño gris. Es una alternativa segura en el primer y segundo trimestres porque en esas etapas la doxiciclina tiene efectos secundarios en el tejido óseo fetal y el desarrollo dental. La doxiciclina en niños se asocia con manchas dentales, es elección en este grupo de edad. Aunque es bacteriostática, los estudios in vitro y en modelos animales sugieren que el cloranfenicol es menos efectivo. La dosis recomendada de doxiciclina es 100 mg c/12 horas y la duración óptima del tratamiento no está bien establecida, en general debe continuarse al menos tres días después de la disminución de los síntomas. La mayoría se cura con 5 a 7 días de antibióticos y casi todos mejoran en los primeros dos o tres días, aunque en insuficiencia multiorgánica pueden tardar más tiempo. Otros autores sugieren un tratamiento total de 7 a 10 días.11,21
La enfermedad clínicamente leve puede tratarse de manera ambulatoria. Cuando es más grave o el paciente no tolera la terapia oral, debe hospitalizarse. La enfermedad grave se vincula con alteración del estado mental u otros signos y síntomas neurológicos, azoemia, trombocitopenia grave e inestabilidad vascular. En estudios epidemiológicos se han encontrado factores que se relacionan con mayor riesgo de resultados adversos, como el sexo masculino, edad mayor a 40 años, deficiencia de glucosa 6 fosfato deshidrogenasa, síntomas neurológicos e insuficiencia renal y hepática.22-25
Otros tipos de fiebres manchadas por agentes distintos a Rickettsia rickettsii
Fiebre macular o manchada del Mediterráneo
Por Rickettsia conorii, descrita en Túnez en 1920. Se ha encontrado en África subsahariana, India, Mar Negro y el Mediterráneo. Es trasmitida por garrapatas que afectan roedores salvajes y perros. Aparece en el tronco, las extremidades y la cara. Causa un cuadro clínico similar a la fiebre manchada de las Montañas Rocosas por Rickettsia rickettsii pero más leve. Los pacientes manifiestan escara. La mortalidad es de 2.5%.14Rickettsia conorii israelensis causa la fiebre manchada israelí. Rickettsia conorii caspia causa la fiebre de Astracán.
Otros tipos de tifus
Tifus por garrapatas asiáticas
Rickettsiosis concomitante con linfangitis. Aparece en Siberia y Mongolia, por ello también se le llama tifus por garrapatas siberianas. Los reservorios son roedores y perros. Rickettsia sibirica es el agente causal; fue aislada de la garrapata Hyalomma asiática, recogida en el área de Alashian de Mongolia en 1991. Desde entonces esta cepa emergente se ha detectado en otras especies de Hyalomma como H. truncatum y H. excavatum en diferentes zonas del mundo.
Tifus de las garrapatas de Queensland
Se identificó en 1946 en Australia oriental. El agente causal es R. australis y es trasmitida por Ixodes holocyclus. El periodo de incubación varía de cuatro a siete días, con intervalo de 3 a 18 días. La picadura puede convertirse en una lesión ulcerada y necrosada. Es de inicio súbito; causa fiebre elevada, cefalea, mialgias, erupción maculopapular o vesicular o purpúrica. A menudo se halla costra y linfadenopatía. Hay síntomas de afección del sistema nervioso central. Dura de 6 a 10 días sin tratamiento.26,27
Se detectó una enfermedad similar en la isla Flinders (Tasmania) por R. honei.











 nueva página del texto (beta)
nueva página del texto (beta)