Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Ciencias marinas
versión impresa ISSN 0185-3880
Cienc. mar vol.49 Ensenada ene./dic. 2023 Epub 08-Mar-2024
https://doi.org/10.7773/cm.y2023.3404
Artículos
El bueno y el mejor, muestreando peces de pozas intermareales tropicales: una comparación entre el censo visual vs. el método de vaciado
1UDP Ciencias Neotropicales, 01101 San Salvador, El Salvador.
2Fundación Naturaleza El Salvador, 01101 San Salvador, El Salvador.
3Department of Environment and Genetics, Centre for Freshwater Ecosystems, School of Agriculture, Biomedicine and Environment, La Trobe University, Albury/Wodonga Campus, 3690 Wodonga, VIC, Australia.
4Museo de Historia Natural de El Salvador, 01101 San Salvador, El Salvador.
5Australian Institute of Marine Science, PMB No 3, 4810 Queensland, Australia.
Se han aplicado numerosos métodos de muestreo para estudiar los peces en pozas de marea. La información generada para contrastar el desempeño y la idoneidad de estos métodos es limitada, lo cual dificulta la comparación entre estudios. Comparamos el desempeño del método de vaciado y censo visual en 10 pozas de marea para cuantificar la abundancia, riqueza de especies y la estructura de los ensamblajes de peces en sistemas de pozas intermareales considerando las categorías de residencia de los peces, el volumen de las pozas y la rugosidad del sustrato. El muestreo se realizó en 13 ocasiones para el conjunto completo de 10 pozas entre junio y diciembre de 2018. Cada poza fue muestreada utilizando primero el censo visual y luego el vaciado de la misma. Un evento de muestreo fue definido como el proceso de llevar a cabo ambos métodos de muestreo, visual y vaciado de la poza, en una poza. En total, 1,749 individuos de 14 especies fueron detectados con el método de vaciado, mientras que 438 individuos de 8 especies fueron detectados con los censos visuales. El método de vaciado detectó mayores abundancias y riqueza de especies de peces residentes, oportunistas y transitorios en comparación con los censos visuales. La detección de individuos y especies se asoció positivamente con el volumen de las pozas y negativamente con la rugosidad del sustrato para ambos métodos. En 32 eventos de muestreo, el método de vaciado detectó peces donde los censos visuales registraron ausencia de peces (falsos negativos) lo que permitió corregir los registros. Para el método de vaciado, los peces residentes dominaron la comunidad de peces, mientras que, para el método de muestreo del censo visual, los peces residentes y oportunistas contribuyeron de manera similar a la comunidad.
Palabras clave: peces; métodos de muestreo; etología; complejidad de hábitat; sesgo
Numerous sampling methods have been applied to study intertidal rock pool fishes. There is limited information comparing the performance and suitability of such methods, which complicates comparisons between studies. We compared the performance of the bailing and visual census methods in 10 rock pools to quantify abundance, species richness, and structure of fish assemblages in rock pool intertidal systems considering fish residency affinities, rock pool volume, and substratum rugosity. Sampling was conducted 13 times across the complete set of 10 rock pools from June to December, 2018. Each of the pools was sampled with a visual census and then the bailing method. A sampling event was defined as the process of conducting both a visual and a bailing survey in a single rock pool. In total, 1,749 individuals of 14 species were detected using the bailing method, whereas 438 individuals of 8 species were recorded via visual census. The bailing method yielded higher abundance and species richness of resident, opportunist, and transient fish than the visual census. The detection of individuals and species showed a positive association with rock pool volume and negative association with substratum rugosity for both methods. In 32 sampling events, the bailing method detected fish correcting reports of fish absence (false negatives) recorded with the visual census. For the bailing method, resident fishes dominated the fish assemblage, whereas, for the visual census, resident and opportunist fishes contributed similarly to the community.
Key words: fish; sampling methods; ethology; habitat complexity; bias
Introducción
La estimación exacta de la diversidad es esencial para entender las dinámicas y los atributos de las comunidades ecológicas. Los ecosistemas intermareales son ambientes estructuralmente complejos y hábitats altamente dinámicos (Daniel y Boyden 1975, Barreiros et al. 2004, Castellanos-Galindo et al. 2005). En las pozas intermareales, la cuantificación de la abundancia y riqueza de especies es generalmente alcanzada mediante la aplicación de métodos invasivos y no invasivos como el vaciado de la poza y el uso de sustancias químicas que ayudan a recolectar peces (Gibson 1999, Wilding et al. 2001, Almada y Faria 2004, White y Brown 2013). Las ventajas de los métodos invasivos incluyen una estimación exacta y directa de la abundancia y de las características morfométricas, así como la oportunidad potencial de recolectar especímenes para analizarlos en el laboratorio. Los métodos invasivos también proveen una identificación a nivel de especies más precisa cuando taxones morfológicamente similares o especies raras están presentes en los sitios de muestreo (Moring 1970, Griffiths 2005, Malard et al. 2016). Los inconvenientes de los métodos invasivos son la perturbación y modificación del hábitat, el estrés por el forcejeo de los individuos, los potenciales cambios conductuales en organismos objetivo, la mortalidad y los cambios en la estructura de los ensamblajes de los organismos que no son objetivo (Moring 1970, Almada y Faria 2004, Griffiths 2005). El impacto de los métodos invasivos podría aumentar con la combinación de métodos como el vaciado y químicos anestésicos en organismos objetivos, generando efectos indeseados en la investigación y los objetivos de conservación (Faria y Almada 1999, Almada y Faria 2004, Harasti et al. 2014). Estos impactos pueden ser minimizados aplicando técnicas no invasivas como el censo visual o las grabaciones de video (Gibson 1999, Wong et al. 2019). Sin embargo, se sabe poco sobre el desempeño y las ventajas y desventajas entre los métodos invasivos y no invasivos en el muestreo de peces de pozas intermareales.
El censo visual tiene varias ventajas deseadas cuando se encuentran especies amenazadas, en peligro o particularmente sensibles a la manipulación en el área de estudio (Wilding et al. 2001, Godinho y Lotufo 2010, Davis et al. 2018, Arndt y Fricke 2019). Sin embargo, los censos visuales pueden verse impactados por la complejidad estructural en el hábitat de estudio, los sesgos del observador (la habilidad de los investigadores para identificar y contabilizar individuos con exactitud), la visibilidad reducida y las respuestas de los peces hacia la presencia del investigador (Brock 1982, Willis 2001, Galvan et al. 2009, Irigoyen et al. 2013, Bellwood et al. 2020). Generalmente, se espera que el censo visual subestime la abundancia y riqueza, particularmente, de las especies crípticas (Brock 1982, Griffiths 2005, Colton y Swearer 2010, Alzate et al. 2014). En ecosistemas abiertos, otro inconveniente menos común relacionado con el censo visual es el doble conteo de los organismos que genera sobreestimación de la abundancia (Ward-Paige et al. 2010). En las pozas intermareales, la magnitud del error de la doble contabilización y otros sesgos potenticiales durante la ejecucción de censos visuales aún no se ha evaluado.
En ciertas ocasiones, los métodos invasivos han registrado valores más altos de abundancia de peces comparados con los censos visuales, pero valores similares en cuanto a riqueza de especies (Griffiths 2005). A pesar de que las técnicas de muestreo invasivas y no invasivas pueden producir resultados comparables en abundancia, riqueza de especies o en métricas de biodiversidad, no cuantifican los diferentes ensamblajes taxonómicos (Colton y Swearer 2010). Estas diferencias entre métodos se han documentado en muchos ecosistemas marinos (Brock 1982, Ackerman y Bellwood 2002, Colton y Swearer 2010, Bellwood et al. 2020) incluyendo pozas intermareales (Davis et al. 2018).
Usar diferentes técnicas de muestreo limita la capacidad de comparar estudios porque no hay información para corregir las diferencias entre los estimadores de abundancia y riqueza de especies entre métodos (Castellanos-Galindo et al. 2014, González-Murcia et al. 2016, Andrades et al. 2018). De acuerdo con nuestro conocimiento previo, ninguna evaluación ha comparado técnicas de muestreo para peces de pozas intermareales en el Pacífico Oriental Tropical.
Los aspectos etológicos de los peces pueden influenciar el desempeño de diferentes técnicas de muestreo (MacNeil et al. 2008, Colton y Swearer 2010). Las características de las especies tales como el comportamiento críptico, tamaño de los individuos, coloración (camuflaje, mimetismo y coloración aposemática) o comportamiento solitario y gregario incrementan los sesgos en el censo visual (Colton y Swearer 2010). Además, las variables de hábitat tales como el volumen de la poza y la rugosidad pueden interactuar e impactar la detección de peces. Pozas más grandes y estructuralmente complejas pueden albergar ensamblajes de peces más diversos que pozas pequeñas (Mahon y Mahon 1994, Barreiros et al. 2004, Cunha et al. 2007, González-Murcia et al. 2020). La búsqueda de especies en hábitats grandes y diversos puede, sin embargo, reducir la detección o captura de peces y generar la subestimación de abundancia y riqueza de especies de peces (Brock 1982, Willis 2001). La influencia de aspectos etológicos, volumen de la poza y rugosidad del sustrato entre métodos de muestreo para el estudio de peces intermareales aún no se ha descrito por completo. Entender las debilidades y fortalezas de los métodos de muestreo puede ayudar a detectar vacíos que necesitan ser evaluados y considerados en estudios posteriores para peces intermareales.
La dinámica compleja en sistemas intermareales usualmente requiere la aplicación de diferentes técnicas de muestreo a costa de que su uso puede debilitar comparaciones cuantitativas. Determinar la consistencia de diferentes métodos para obtener métricas ecológicas fundamentales como la abundancia, la riqueza de especies y la diversidad es de interés para propósitos de conservación e investigación. Nuestro objetivo fue comparar la abundancia, riqueza de especies y la estructura del ensamblaje de los peces de pozas intermareales que se obtienen con los métodos de muestreo de vaciado y censo visual. Adicionalmente, nuestro objetivo fue comparar el impacto que el comportamiento de los peces, el volumen de la poza y la rugosidad del sustrato de la poza tienen en la detección de peces con los 2 métodos. Predijimos que con el vaciado de las pozas se podrían detectar mayores abundancias y riquezas de especies que con los censos visuales, y que aquellos ensamblajes registrados por medio del censo visual se diferenciarían de aquellos registrados usando el método de vaciado. Esperábamos que las diferencias en la detección de peces entre los métodos iban a estar relacionadas con el comportamiento de los peces. Además, presumíamos que el volumen de la poza y la rugosidad del sustrato afectaría negativamente la ejecución de ambos métodos de muestreo y que su influencia sería exacerbada en los censos visuales.
Materiales y métodos
Área de estudio y diseño de muestreo
El Zonte es un área con múltiples costas rocosas pequeñas, localizada en Chiltiupán, La Libertad, El Salvador. Las mareas semidiurnas oscilaron desde -20 a 230 cm (MARN 2018); se estimaron las alturas intermareales de 10 pozas seleccionadas aleatoriamente con el calendario y el tiempo de emersión de las pozas durante la marea baja (Fig. 1). La elevación de las pozas sobre la marea baja fue de 43-96 cm. Para las 10 pozas seleccionadas, el muestreo (periodo de muestreo) se realizó 13 veces desde junio a diciembre de 2018. Cada poza fue muestreada primero con el censo visual y luego con el método de vaciado. Un evento de muestreo se definió como el proceso de llevar a cabo ambos métodos en una poza. Para el censo visual, el observador se aproximó a la poza, realizó una búsqueda por 15 minutos y registró el número de individuos por especie. El método de vaciado se realizó con una bomba achicadora sumergible, con una batería con capacidad de 12v y una capacidad máxima de 3,700 galones por hora (~17 m3) (Griffiths 2003a, b; González-Murcia et al. 2016; Wong et al. 2019; González-Murcia et al. 2020), y con mangueras y baldes para realizar un vaciado manual para acelerar el proceso. Ambas metodologías fueron empleadas siguiendo el mismo protocolo aún cuando no se detectaron peces en el censo visual para descartar falsos negativos y contrastar la correspondencia de los métodos. El censo visual siempre precedía al método de vaciado de las pozas, y los métodos de muestreo (tratamientos) no fueron aleatoriamente asignados ya que el método de vaciado es invasivo y puede tener impactos perjudiciales sobre los peces, lo que puede influenciar los resultados del censo visual. La captura de peces se realizó mediante la búsqueda en grietas y debajo de rocas y algas foliosas. Los peces fueron identificados, mantenidos en baldes y regresados a las pozas después del muestreo. Las mismas pozas fueron muestreadas los siguientes 2 días, con ambos métodos. En cada campaña de muestreo algunos especímenes fueron recolectados y depositados en la colección del Museo de Historia Natural de El Salvador (MUHNES) bajo los números de colección de MUHNES 40-1034 a MUHNES 40-1054 (Tabla S1). El muestreo fue ejecutado solo una vez en junio y 2 veces al mes desde julio a diciembre.

Figura 1 Área de muestreo de las pozas intermareales en Centroamérica (a), El Salvador (b), El Zonte, La Libertad (c), con ejemplos de especies residentes, Bathygobius ramosus (d); oportunistas, Abudefduf concolor (e) y transeúntes, Halichoeres sp. (f). Fotografías: Saúl González-Murcia.
Cada especie de peces fue clasificada de acuerdo con su uso de la poza intermareal. Las categorías de residencia fueron las siguientes: residentes permanentes, oportunistas y transeúntes (Griffiths 2003a, b). Similarmente, de acuerdo con las afinidades de comportamiento, cada especie fue categorizada como solitaria, gregaria, críptica y territorial (Griffiths 2003a, b). Las categorías de residencia y afinidades comportamentales están relacionadas ya que los residentes permanentes tienden a ser solitarios y crípticos (Gibson y Yoshiyama 1999, White y Brown 2013). Asimismo, los oportunistas tienden a ser gregarios y forman cardúmenes o son solitarios y nadan en la columna de agua cerca de la superficie, mientras que los transeúntes podrían mostrar cualquier tipo de afinidad comportamental. Para comparar cómo el comportamiento de los peces podría impactar la detección de los peces entre los métodos, se utilizaron las categorías de residencia en las pozas; esta clasificación tiene categorías mutuamente excluyentes y fue considerada como el mejor indicador para la detección de peces por método de muestreo (ver análisis de datos).
Atributos físicos, características estructurales y rugosidad del sustrato de las pozas intermareales
Antes de recolectar los peces, 3 medidas de ancho (W), longitud (L), profundidad (D) y una de perímetro (P) fueron registradas para cada poza. El volumen fue estimado mediante la siguiente fórmula:
donde V es el volumen de la poza intermareal, SA es el área de la superficie de la poza intermareal, que se estimó con los promedios del ancho (W) y la longitud (L) [SA= W ×L], y D es la profundidad promedio de la poza. El volumen de las pozas intermareales osciló desde 0.01 m3 a 2.79 m3 (Tabla 1). La rugosidad del sustrato de la poza intermareal fue calculada dividiendo la distancia lineal (DL) entre 2 puntos de la poza por la distancia entre los mismos 2 puntos considerando todas las irregularidades de la superficie (RD) entre estos puntos. Aplicamos la siguiente fórmula para generar un porcentaje que indicó de baja (0%) a alta (100%) rugosidad de sustrato de las pozas (Tabla 1):
Tabla 1 Métricas de profundidad (m), ancho (m), largo (m), área superficial (m2), volumen (m3), rugosidad del sustrato (%) y altura de la poza (m), medidas en 10 pozas intermareales. Error estándar (SE). El volumen de las pozas fue estimado utilizando la siguiente fórmula: V = SA × D; donde SA es el área de la superficie de la poza (W × L), estimada por el promedio del ancho (W) y largo (L), y D es la profundidad promedio de la poza; no se reportan SE para los valores de volumen.
| Pool | Depth (m) ± SE | Width (m) ± SE | Length (m) ± SE | Surface area (m2) | Volume (m3) | Substratum rugosity (%) | Height (m) |
| 1 | 0.26 ± 0.17 | 0.73 ± 0.05 | 1.30 ± 0.17 | 0.95 | 0.25 | 1 | 0.96 |
| 2 | 0.23 ± 0.07 | 0.52 ± 0.05 | 0.79 ± 0.04 | 0.41 | 0.10 | 9 | 0.94 |
| 3 | 0.73 ± 0.16 | 2.12 ± 0.54 | 1.81 ± 0.39 | 3.84 | 2.79 | 5 | 0.54 |
| 4 | 0.50 ± 0.02 | 0.57 ± 0.11 | 0.88 ± 0.09 | 0.50 | 0.25 | 9 | 0.66 |
| 5 | 0.28 ± 0.08 | 1.80 ± 0.54 | 2.98 ± 0.52 | 5.35 | 1.52 | 1 | 0.43 |
| 6 | 0.18 ± 0.13 | 1.57 ± 0.36 | 1.3.7 ± 0.11 | 2.16 | 0.38 | 19 | 0.74 |
| 7 | 0.08 ± 0.02 | 0.08 ± 0.05 | 1.30 ± 0.24 | 0.60 | 0.05 | 0 | 0.74 |
| 8 | 0.65 ± 0.03 | 0.65 ± 0.03 | 0.78 ± 0.10 | 0.33 | 0.22 | 15 | 0.43 |
| 9 | 0.06 ± 0.02 | 0.45 ± 0.05 | 0.55 ± 0.05 | 0.25 | 0.01 | 7 | 0.96 |
| 10 | 0.07 ± 0.03 | 0.17 ± 0.08 | 0.79 ± 0.15 | 0.14 | 0.01 | 9 | 0.89 |
Análisis de datos
Las diferencias en las abundancias y riqueza de especies de peces por cada método fueron analizadas usando modelos multiniveles basados en un enfoque Bayesiano (McElreath 2016) con el paquete rstan (Stan Development Team 2020). Los modelos incluyeron la abundancia de peces como variable respuesta y los efectos de la población del método de muestreo, la categoría de residencia de los peces (indicador de afinidades de comportamiento), el volumen de las pozas y el porcentaje de rugosidad más la interacción entre el método de muestreo y la categoría de residencia de los peces. Los efectos variantes como código de las pozas (1-10) y periodo de muestreo (1-13) fueron incluidos para considerar la dependencia de las estructuras impuestas por el diseño del modelo jerárquico. Los modelos fueron ajustados usando una distribución binomial negativa para considerar la sobredispersión. El muestreo del método de Montecarlo basado en cadenas de Markov (MCMC, por sus siglas en inglés) fue ejecutado en 5 cadenas y 20,000 iteraciones por cadena y un calentamiento de 2,000 por cada cadena. La disminución fue ajustada a 8, y las probabilidades a priori para el intercepto fueron ajustadas a normal (0,10) y pendiente normal (0,1). Las probabilidades a priori para los efectos variante fueron ajustados a (0,1) y el parámetro de dispersión fue (0.01, 0.01). Las pruebas diagnósticas del MCMC sugieren que, para cada modelo, las cadenas estuvieron bien mezcladas y concurrieron en una probabilidad posterior estable (todos los valores Rhat < 1.05). Los patrones en los residuos fueron evaluados con pruebas de normalidad, dispersión y varianza con el paquete DHARMA (Hartig 2021). Para contrastar los niveles de variables explicativas, se utilizaron los intervalos de compatibilidad de mayor probabilidad (HPCI, por sus siglas en inglés) como medida de incertidumbre. El excedente del valor P fue usado como métrica para la ocurrencia de un evento dado y representa la probabilidad de que un cierto valor será excedido en una situación predefinida (McElreath 2016). El volumen de las pozas de 0.1, 0.5, 1.5 y 2.5 m3 y los valores de rugosidad del sustrato de 1%, 10% y 19% fueron usados como puntos de referencia para contrastar las tendencias en abundancias y riqueza de especies estimadas con los modelos. Los modelos para los subconjuntos de peces residentes, oportunistas y transeúntes fueron construidos usando los métodos de muestreo, el volumen y la rugosidad como efecto poblacional y el código de la poza (1-10) y del periodo de muestreo (1-13) como efectos variantes para determinar cambios en la detección para cada grupo (Tabla S2-S7).
Los cambios en la estructura del ensamblaje y la distinción taxonómica relacionada a los métodos de muestreo fueron evaluadas usando un análisis de escalamiento multidimensional no-métrico (NMDS, por sus siglas en inglés) (Quinn y Keough 2002). La abundancia de los peces se transformó mediante raíz cuadrada y usó para generar una matriz de disimilitud, calculada con la medida de distancia de Bray-Curtis. Una “variable de especie ficticia” que contenía el valor 1 se incorporó para reducir las dificultades en la estimación de la distancia (Clarke et al. 2006). El NMDS se construyó con la función monoMDS (escalamiento no métrico multidimensional con una solución estable de inicios aleatorios, ejes de escalamiento y puntajes de especies) fijando el número de inicios a 999 iteraciones y basando el estrés en regresión monotónica (no lineal). La correspondencia entre la distancia de ordenación y la disimilitud observada se evaluó a través de un diagnóstico de estrés, pruebas de bondad de ajuste y R-cuadrado. Estos análisis se ejecutaron con el paquete Vegan (Oksanen et al. 2022).
Las diferencias en la estructura del ensamblaje de los peces detectada entre los métodos de muestreo se pusieron a prueba a través de análisis de varianza de permutación múltiples que generan un valor de R 2 (efecto del tamaño), el cual representa el porcentaje de variación explicado por la categoría suplementaria, y un valor P, que determina la significancia estadística (Oksanen et al. 2022). La correlación de las especies con los métodos de muestreo se obtuvo con la función envfit considerando solo las especies con P < 0.05 (R Core Team 2019). Adicionalmente, la contribución de las especies para las diferencias detectadas entre los métodos de muestreo se evaluó mediante análisis de especies indicadoras (De Cáceres et al. 2010). En el análisis, el método de muestreo se fijó como criterio de clasificación para comparar los patrones observados de la distribución de especies. El coeficiente de asociación de phi fue corregido para grupos de tamaños desiguales generando un valor r.g. Seleccionamos las especies de peces influyentes con valores r.g. > 0.6 y P < 0.05 (De Cáceres y Legendre 2009). Todos los análisis se realizaron en el programa estadístico R (R Core Team 2019).
Resultados
Patrones generales en los ensamblajes de peces entre los métodos de muestreo
Detectamos más individuos y especies con el método de vaciado de las pozas que con el método del censo visual (Fig. 2). Detectamos un total de 1,749 individuos de 14 especies con el vaciado de las pozas y 438 individuos de 8 especies con censos visuales. En total, el método de vaciado detectó casi 4 veces más peces y el doble de especies que las detectadas con el método de censo visual. La abundancia por especies obtenida con el método de vaciado fue mayor que la abundancia registrada con los censos visuales para todas las especies, excepto para Mugil curema Valenciennes, 1836 (Fig. 2). Las 6 especies adicionales que fueron detectadas solo con la técnica de vaciado de la poza (Gobiesox daedaleus Briggs, 1951; Ophioblennius steindachneri Jordan y Evermann, 1898; Paraclinus beebei, Hubbs 1952; Paraclinus monophthalmus [Günther, 1861], Rypticus nigripinnis Gill, 1861 y Tomicodon sp1 Brisout de Barneville, 1846) son especies residentes con comportamiento críptico. El método de vaciado de las pozas no solo detectó más peces y especies que el censo visual, también corrigió registros erróneos de ausencia (falsos negativos) de peces en las pozas que se obtuvieron con el censo visual cuando los peces se detectaron subsecuentemente con el método de vaciado de pozas. Los falsos negativos se registraron con los censos visuales en 32 eventos de muestreo en diferentes periodos de muestreo y pozas, entre junio y diciembre para las 10 pozas intermareales muestreadas.
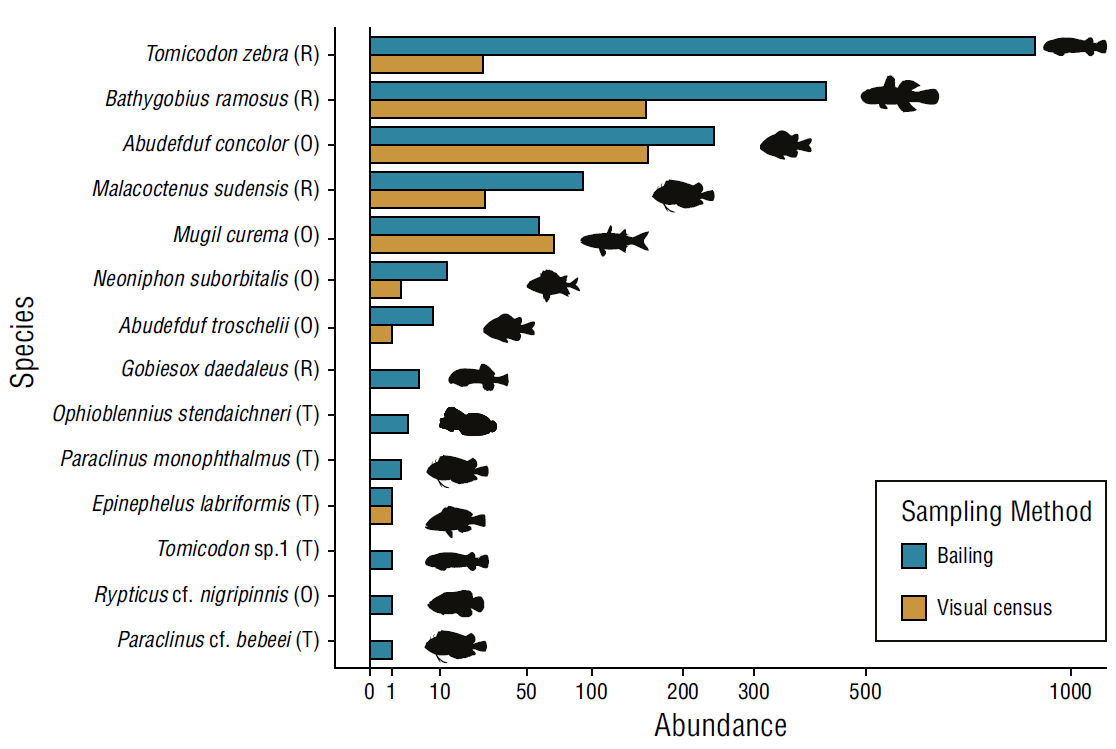
Figura 2 Abundancia total por las abundancias de peces registradas usando el vaciado y el censo visual en las pozas intermareales de El Zonte, 2018. La escala en el eje X se transformó a la raíz cuadrada para ayudar en la visualización de los valores de abundancia entre 0 y 100 y abundancias mayores que 100. Las letras próximas a los nombres de las especies se refieren a las categorías de residencia: (R) residentes, (O) oportunistas y (T) transeúntes.
Abundancia de peces entre los métodos de muestreo, las categorías de residencia de los peces, el volumen de las pozas y la rugosidad del sustrato
El método de muestreo, categorías de residencia, volumen de las pozas y rugosidad colectivamente explicaron el 67% (R 2 = 0.67) de la variabilidad en la abundancia de los peces (Tabla 2). Las covariables pozas y eventos de muestreo explicaron 6% y 4% de la variabilidad, respectivamente. El modelo que incluyó las covariables de la poza y el evento de muestreo explicó el 77% de la variabilidad en abundancia. Se detectó mayor abundancia de peces residentes (ExceedenceP = 1.00), oportunistas (ExceedenceP = 0.98) y transeúntes (ExceedenceP = 0.99) con el método de vaciado en comparación con el censo visual (Tablas 3, 4). El método de vaciado de la poza logró detectar casi 4 veces más peces residentes, 1.5 veces más peces oportunistas y casi 8 veces más individuos transeúntes que el censo visual (Tabla 4, Fig. 3a). Pese a mayores abundancias detectadas con el vaciado de las pozas, las diferencias estadísticas no fueron apoyadas para peces oportunistas y transeúntes (Tabla 4).
Tabla 2 Abundancia de los peces asociada al método de muestreo, categoría de residencia, volumen de agua de la poza, rugosidad y efectos variantes de los eventos de muestreo e identificación de las pozas para todas las especies (R 2 = 67%). Abundancia promedio calculada con el modelado (Estimate), error estándar (SE), intervalos de compatibilidad de la más alta probabilidad 95% (HPCI), evidencia de la autocorrelación durante la generación de la probabilidad posterior (Rhat) y los valores Ȓ ≤ 1.05 indican bajas posibilidades de autocorrelación en el muestreo del tamaño efectivo de la muestra (ESS); ESS es una métrica para medir la cantidad por la que la autocorrelación en las muestras incrementa la incertidumbre en comparación con una muestra independiente.
| Term | Estimate | SE | Lower HPCI | Upper HPCI | Rhat | ESS |
| Intercept | 1.510 | 0.14 | 1.220 | 1.770 | 0.99 | 10,696 |
| Visual census | -1.580 | 0.17 | -1.930 | -1.230 | 1 | 11,396 |
| Opportunist | -1.450 | 0.18 | -1.810 | -1.100 | 1 | 10,585 |
| Transient | -4.740 | 0.33 | -5.400 | -4.100 | 1 | 11,675 |
| Volume | 0.086 | 0.01 | 0.060 | 0.120 | 1 | 11,049 |
| Rugosity | -0.070 | 0.02 | -0.126 | -0.025 | 0.99 | 11,069 |
| Visual census: opportunist | 1.150 | 0.25 | 0.661 | 1.650 | 0.99 | 11,000 |
| Visual census: transient | -0.590 | 0.68 | -2.020 | 0.664 | 0.99 | 11,205 |
| Reciprocal dispersion | 0.870 | 0.11 | 0.650 | 1.090 | 0.99 | 10,212 |
| Sigma rock pools: sampling event | 0.460 | 0.40 | 0 | 1.190 | 1 | 1,738 |
| Sigma rock pools identity | 0.470 | 0.40 | 0 | 1.190 | 1 | 1,797 |
| Mean_PPD | 2.890 | 0.47 | 2.070 | 3.870 | 0.99 | 11,281 |
| Log-posterior | 0.001 | 15.39 | 0.001 | -0.003 | 0.99 | 10,023 |
Tabla 3 Abundancia promedio de los peces por método y categorías de residencia. Intervalos de compatibilidad de la más alta probabilidad de 95% (HPCI). Siempre que los rangos del HPCI entre categorías no traslapen, diferencias significativas en las abundancias son apoyadas.
| Sampling method and residency category | Estimate | Lower HPCI | Upper HPCI |
| Bailing and resident | 4.5000 | 3.3000 | 5.8800 |
| Visual census and resident | 0.9200 | 0.6300 | 1.2600 |
| Bailing and opportunist | 1.0400 | 0.7100 | 1.4400 |
| Visual census and opportunist | 0.6800 | 0.4700 | 0.9600 |
| Bailing and transient | 0.0300 | 0.0100 | 0.0600 |
| Visual census and transient | 0.0040 | 0.0004 | 0.0100 |
Tabla 4 Contraste de la abundancia de los peces de diferentes categorías de residencia capturados usando los métodos de vaciado y el censo visual. Los contrastes entre los niveles de variables explicativas usando el 95% de intervalos de confianza de intervalos de compatibilidad de la más alta probabilidad (HPCI) y el excedente del valor P, el cual es la probabilidad de que cierto valor será excedido en una situación predefinida y representa métrica para la ocurrencia de un evento dado.
| Sampling method and residency category | Estimate | Lower HPCI | Upper HPCI | Exceedance P |
| Bailing and resident/visual census and resident | 4.850 | 3.307 | 6.75 | 1 |
| Bailing and opportunist/visual census and opportunist | 1.526 | 0.998 | 2.12 | 0.988 |
| Bailing and transient/visual census and transient | 8.764 | 1.446 | 28.93 | 0.990 |

Figura 3 Abundancia promedio y riqueza de especies de los peces por categoría de residencia (ver Materiales y Métodos) (a, d), volumen de las pozas (b, e) y rugosidad del sustrato de las pozas (c, f) registrada usando el vaciado y el censo visual en las pozas de El Zonte, 2018. Bigotes y áreas sombreadas representan el 95% de intervalos de confianza de intervalos de compatibilidad de la más alta probabilidad (HPCI).
El volumen de las pozas tuvo una correlación positiva con mayores abundancias de peces en ambos métodos. En promedio el método de vaciado detectó más peces que el censo visual cuando el volumen de las pozas incrementó (Fig. 3b). Estas diferencias en abundancia de peces entre métodos de muestreo fueron más evidentes en pozas más grandes, donde se detectaron más peces con dicho método (Tabla 5). El impacto del volumen de las pozas en la detección de peces entre los 2 métodos de muestreo se mantuvo para todas las categorías de residencia de los peces. El vaciado de las pozas constantemente detectó ~4 veces más residentes, ~1.5 veces más oportunistas y ~3 veces más peces transeúntes en todos los volúmenes de las pozas (desde 0.01 m3 a 2.79 m3) comparado con el censo visual (Tablas S2, S3).
Tabla 5 Promedio de abundancia de peces detectada por método, volumen para pozas de 0.1 m3, 0.5 m3, 1.5 m3 y 2.5 m3 y valores de rugosidad del sustrato de 1%, 10% y 19%. Intervalos de compatibilidad de la más alta probabilidad de 95% (HPCI). Siempre que los rangos del HPCI entre categorías no traslapen, diferencias significativas en las abundancias son apoyados.
| Contrast | Estimate | Lower HPCI | Upper HPCI |
| Volume and method | |||
| Volume 0.1 m3 | |||
| Bailing | 0.39 | 0.27 | 0.54 |
| Visual census | 0.09 | 0.05 | 0.15 |
| Volume 0.5 m3 | |||
| Bailing | 0.55 | 0.40 | 0.74 |
| Visual census | 0.13 | 0.07 | 0.20 |
| Volume 1.5 m3 | |||
| Bailing | 1.37 | 0.91 | 1.93 |
| Visual census | 0.33 | 0.17 | 0.54 |
| Volume 2.5 m3 | |||
| Bailing | 3.37 | 1.71 | 5.51 |
| Visual census | 0.77 | 0.31 | 1.38 |
| Rugosity and method | |||
| Rugosity 1% | |||
| Bailing | 0.87 | 0.56 | 1.27 |
| Visual census | 0.21 | 0.11 | 0.35 |
| Rugosity 10% | |||
| Bailing | 0.43 | 0.29 | 0.60 |
| Visual census | 0.10 | 0.05 | 0.17 |
| Rugosity 19% | |||
| Bailing | 0.20 | 0.08 | 0.39 |
| Visual census | 0.05 | 0.01 | 0.10 |
La detección de los peces disminuyó con el incremento de la rugosidad del sustrato para ambos métodos (Fig. 3c). En las pozas con bajos niveles de rugosidad del sustrato (1%) el método de vaciado detectó ~1 especie en promedio, pero las posibilidades de detectar al menos un individuo disminuyeron drásticamente en áreas con mayor complejidad (19% ~0.43). El censo visual tuvo un desempeño pobre en áreas con baja rugosidad del sustrato (1%) y la detección de peces declinó abruptamente en pozas con 20% de rugosidad (Tabla 5). La reducción en la detección de peces debido a la rugosidad del sustrato se asoció con las categorías de residencia de los peces. En pozas con baja (1%) a alta rugosidad (19%) el método del vaciado de las pozas detectó ~4 veces más residentes, ~1.5 veces más oportunistas y ~3 veces más peces transeúntes comparados con el censo visual (Tablas S2, S4).
Riqueza de especies de peces entre los métodos de muestreo, las categorías de residencia, el volumen de las pozas y la rugosidad del sustrato
El método de muestreo, el comportamiento de los peces, el volumen de las pozas y la rugosidad afectaron la detección de especies de peces y explicaron el 64% (R 2 = 0.64) de la variabilidad en la riqueza de especies (Tabla 6). Las pozas y los periodos de muestreo explicaron el 4.8% y 3.6%, respectivamente. Cuando se incluyeron las variables poza y periodo de muestreo en el modelo, se explicó el 72% de la variabilidad en la riqueza de especies. El método de vaciado detectó más especies de peces residentes (P = 1.00), oportunistas (P = 0.95) y transeúntes (P = 0.99) que los censos visuales (Fig. 3c). Asimismo, el método de vaciado de las pozas detectó en promedio casi el doble de las especies de peces residentes, 1.37 veces más especies oportunistas y casi 5 veces más especies transeúntes que los censos visuales (Fig. 3d) (Tablas 5-9). Sin embargo, no se observaron diferencias estadísticamente significativas en detección de peces entre los métodos de muestreo para las especies oportunistas y transeúntes.
Tabla 6 Riqueza de especies de peces asociada al método de muestreo, categoría de residencia, volumen de agua de las pozas, rugosidad y efectos de variación del evento de muestreo e identificación de las pozas para todas las especies. Abundancias promedio calculadas con el modelo (Estimate), error estándar (SE), intervalos de compatibilidad de la más alta probabilidad de 95% (HPCI), evidencia de la autocorrelación durante la generación de la probabilidad posterior (Rhat) y los valores de Ȓ ≤ 1.05 indican bajas probabilidades de autocorrelación en el muestreo del tamaño efectivo de la muestra (ESS); ESS es una métrica para medir la cantidad por la que la autocorrelación en las muestras incrementa la incertidumbre en comparación con una muestra independiente.
| Term | Estimate | SE | Lower HPCI | Upper HPCI | Rhat | ESS |
| Intercept | 0.0545 | 0.0900 | -0.1338 | 0.2440 | 0.99 | 11,151 |
| Visual census | -0.7091 | 0.1446 | -0.9959 | -0.4307 | 0.99 | 11,494 |
| Opportunist | -0.7240 | 0.1453 | -1.0148 | -0.4493 | 0.99 | 11,196 |
| Transient | -3.0030 | 0.3324 | -3.6718 | -2.3800 | 0.99 | 11,298 |
| Volume | 0.0342 | 0.0067 | 0.0170 | 0.0433 | 1 | 10,886 |
| Rugosity | -0.0517 | 0.0149 | -0.0800 | -0.0214 | 1 | 11,102 |
| Visual census: opportunist | 0.3899 | 0.2256 | -0.0406 | 0.8434 | 0.99 | 11,234 |
| Visual census: transient | -0.8329 | 0.6476 | -2.1050 | 0.3985 | 0.99 | 10,867 |
| Reciprocal dispersion | 7.5500 | 1.9700 | 4.3700 | 11.7500 | 0.99 | 10,825 |
| Sigma rock pools: sampling event | 0.0478 | 0.0620 | 0.04 × 10-7 | 0.1843 | 0.99 | 8,535 |
| Sigma rock pools identity | 0.0450 | 0.0622 | 0. 01 × 10-7 | 0.1857 | 0.99 | 9,468 |
| Mean_PPD | 0.4890 | 0.0379 | 0.4172 | 0.5635 | 1 | 10,949 |
| Log-posterior | -936.9909 | 14.4208 | -936.617 | -908.67267 | 1.000018 | 10,978 |
Tabla 7 Promedio de riqueza de especies de peces por método y categorías de residencia. Intervalos de compatibilidad de la más alta probabilidad de 95% (HPCI). Siempre que los rangos del HPCI entre las categorías no traslapen, diferencias significativas en la abundancia son apoyadas.
| Sampling method and residency category | Estimate | Lower HPCI | Upper HPCI |
| Bailing and resident | 1.0561 | 0.8567 | 1.2536 |
| Visual census and resident | 0.5196 | 0.3949 | 0.6507 |
| Bailing and opportunist | 0.5120 | 0.3909 | 0.6447 |
| Visual census and opportunist | 0.3709 | 0.2683 | 0.4790 |
| Bailing and transient | 0.0525 | 0.0235 | 0.0904 |
| Visual census and transient | 0.0112 | 0.0013 | 0.0281 |
Tabla 8 Contraste de la riqueza de especies de peces de diferentes categorías de residencia usando los métodos de vaciado y el censo visual. Los contrastes entre los niveles de variables explicativas usando el 95% de intervalos de confianza de intervalos de compatibilidad de la más alta probabilidad (HPCI) y el excedente del valor P, el cual es la probabilidad de que cierto valor será excedido en una situación predefinida; este fue usado como métrica para la ocurrencia de un evento dado.
| Sampling method and residency category | Estimate | Lower HPCI | Upper HPCI | Exceedance P |
| Bailing and resident/visual census and resident | 2.03 | 1.501 | 2.66 | 1 |
| Bailing and opportunist/visual census and opportunist | 1.38 | 0.936 | 1.92 | 0.96 |
| Bailing and transient/visual census and transient | 4.67 | 0.968 | 14.70 | 0.99 |
Tabla 9 Promedio de la riqueza de especies de peces detectada por método, volumen por pozas intermareales de 0.1 m3, 0.5 m3, 1.5 m3, 2.5 m3 y valores de rugosidad de 1%, 10% y 19%. Intervalos de compatibilidad de la más alta probabilidad de 95% (HPCI). Siempre que los rangos del HPCI entre las categorías no traslapen, se respaldan diferencias significativas en la abundancia.
| Contrast | Estimate | Lower HPCI | Upper HPCI |
| Sampling method | |||
| Bailing | 0.57 | 0.48 | 0.65 |
| Visual census | 0.32 | 0.26 | 0.38 |
| Volume and method | |||
| Volume 0.1 m3 | |||
| Bailing | 0.48 | 0.39 | 0.57 |
| Visual census | 0.27 | 0.21 | 0.33 |
| Volume 0.5 m3 | |||
| Bailing | 0.54 | 0.46 | 0.63 |
| Visual census | 0.30 | 0.24 | 0.36 |
| Volume 1.5 m3 | |||
| Bailing | 0.73 | 0.59 | 0.87 |
| Visual census | 0.41 | 0.32 | 0.50 |
| Volume 2.5 m3 | |||
| Bailing | 0.98 | 0.72 | 1.27 |
| Visual census | 0.55 | 0.39 | 0.73 |
| Rugosity and method | |||
| Rugosity 1% | |||
| Bailing | 0.77 | 0.62 | 0.92 |
| Visual census | 0.43 | 0.34 | 0.53 |
| Rugosity 10% | |||
| Bailing | 0.48 | 0.40 | 0.57 |
| Visual census | 0.27 | 0.21 | 0.33 |
| Rugosity 19% | |||
| Bailing | 0.30 | 0.19 | 0.42 |
| Visual census | 0.17 | 0.11 | 0.24 |
El método de vaciado y el censo visual detectaron más peces en pozas más grandes. En promedio el método de vaciado detectó más especies que el censo visual cuando el volumen de las pozas incrementó (Fig. 3e). Estas diferencias fueron más evidentes en pozas más grandes donde se detectaron más peces con el método de vaciado que con los censos visuales. En pozas con volumen de 0.5 m3 o menos, la diferencia en la detección de peces entre los métodos fue pequeña, pero en pozas con volumen de 2.5 m3, el método de vaciado detectó ~2 especies de peces, mientras que el censo visual detectó ~1 (Fig. 3e, Tabla 9). Las tendencias generales en la detección de especies relacionadas con el volumen se mantuvieron en todas las categorías de residencia de peces. El método de vaciado detectó ~2 especies más de peces residentes, ~1.3 especies más de oportunistas y ~3 especies más de transeúntes que el censo visual (Tabla S5, S6).
El número de especies detectadas con los métodos de vaciado y censo visual disminuyó cuando la rugosidad del sustrato incrementó. Sin embargo, el método del vaciado fue consistentemente más eficiente en la detección de peces que el censo visual. En pozas con valores de rugosidad de 5%, la detección de peces fue ~2 veces más alta con el método de vaciado que con el censo visual. Esta tendencia fue constante y en pozas con 19% de rugosidad, la detección de las especies de peces fue casi ~0.66 veces más baja, para ambos métodos. Pese a esto, el método de vaciado de las pozas tuvo un mejor desempeño que el censo visual (Fig. 3f, Tabla 9). El declive en las especies de peces en cuanto a la rugosidad del sustrato se asoció también a las categorías de residencia. El número de especies adicionales detectado cuando se llevó a cabo el vaciado de pozas fue de ~2 para especies residentes, ~1.3 para oportunistas y ~3 para especies transeúntes comparado al censo visual (Tabla S5, S7).
Estructura de los ensamblajes de peces y composición taxonómica detectada entre métodos de muestreo
Se detectaron diferentes composiciones de comunidades con el análisis de varianza permutacional multivariado aplicado a los ensamblajes de peces registrados con el método de vaciado y el censo visual (Fig. 4, Adonis = 9.0476, g.l. = 1, P < 0.001). Los censos visuales detectaron ensamblajes de peces con contribuciones similares de especies residentes y oportunistas. Por otro lado, el método de vaciado detectó ensamblajes de peces con mayores contribuciones de especies residentes que son dominantes en términos de abundancia (Fig. 4). Las especies que caracterizaron los ensamblajes fueron las especies residentes Bathygobius ramosus (r 2 = 0.61, P < 0.01), Tomicodon zebra (r.g = 0.61, P < 0.01) y Malacoctenus sudensis (r 2 = 0.34, P < 0.01), las cuales se detectaron en altas abundancias usando el método de vaciado, y las especies oportunistas Abudefduf concolor (r 2 = 0.28, P < 0.01) y M. curema (r 2 = 0.55, P < 0.01), las cuales fueron detectadas igualmente con los censos visuales y el método de vaciado. El análisis de especies indicadoras detectó que los residentes B. ramosus (r.g = 0.17, P < 0.05) y T. zebra (r.g = 0.20, P < 0.01) fueron especies típicas que parecen ser detectadas principalmente por el método del vaciado.
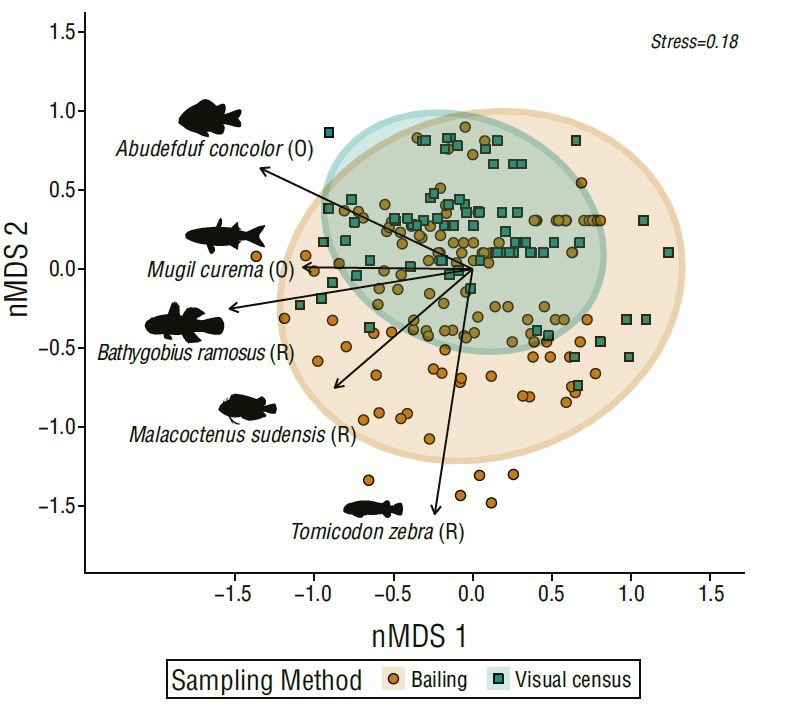
Figura 4 Ensamblajes de los peces detectados con el vaciado y el censo visual en 10 pozas intermareales muestreadas 13 veces entre junio y diciembre de 2018 en El Zonte, El Salvador, basados en un escalamiento dimensional no-métrico (nMDS). Datos de la abundancia total fueron transformados a raíz cuadrada y las disimilitudes están basadas en el índice de similitud de Bray-Curtis, las elipses muestran el 95% de intervalos de confianza. Residentes (R), oportunistas (O).
Discusión
Los métodos de muestreo generaron diferentes estimadores de abundancia, riqueza de especies y composición y estructura de ensamblajes. El método de vaciado consistentemente detectó más especies e individuos que el censo visual. El censo visual subestimó grandemente la abundancia y riqueza de especies de peces y detectó 75% menos individuos de peces y 40% menos especies comparado con el vaciado de las pozas. El censo visual ha dejado de ser tan utilizado como método de muestreo ya que consistentemente subestima la abundancia y riqueza de especies (Christensen y Winterbottom 1981, Brock 1982, Ackerman y Bellwood 2000, Alzate et al. 2014). La magnitud de las diferencias indica que el 50% de los individuos y el 40% de las especies son pasadas por alto aún con los métodos de censo visual más exhaustivos (Ackerman y Bellwood 2000). Griffiths (2005) detectó diferencias con mayores magnitudes en los sistemas de pozas intermareales con 80-87% menos abundancia y 50-66% menor riqueza de especies con el censo visual que el vaciado de pozas, asimismo Wong et al. (2019) detectaron 70% menor abundancia y 33% menos especies con el censo visual que con el vaciado de las pozas. Estas deficiencias del censo visual demandan una reconsideración de la aplicación del censo visual en el muestreo de peces de pozas intermareales.
El censo visual frecuentemente falló en la detección de peces que posteriormente se registraron durante el vaciado de las pozas, lo cual generó un resultado de falso negativo para los censos visuales (registros de ausencias cuando si había presencia de peces). No obstante, el método del vaciado no fue infalible y en muy pocos casos, como en el de M. curema, los peces fueron detectados en el censo visual, pero no con el método de vaciado. Esto podría deberse a que los peces se esconden en grietas durante la ejecución del método del vaciado. En algunos casos, los peces se mantienen escondidos o quedan atrapados en las grietas cuando la poza se está vaciando y su detección o captura es ineficaz. Por otra parte, este resultado podría representar el sesgo de conteo doble porque M. curema tiende a formar pequeños cardúmenes y el uso del censo visual en esta especie podría sobreestimar la abundancia (Ward-Paige et al. 2010). Pese a estos inconvenientes, la detección de peces con el método de vaciado fue alta comparada con los censos visuales, por lo que el método de vaciado de las pozas es una mejor técnica para muestrear ensamblajes de peces intermareales.
El vaciado de las pozas detectó casi 4 veces más peces residentes que los censos visuales. Cuando se aplicó el censo visual, los peces residentes se sub-representaron constantemente en todos los niveles de volumen y rugosidad de sustrato de las pozas. Las inconsistencias en la detección de los peces entre ambos métodos también generaron discrepancias en los ensamblajes registrados entre ambos métodos. La contribución similar de especies residentes y oportunistas en los ensamblajes descrita con el censo visual evidenció la debilidad de la detección de especies residentes con este método. El comportamiento de los peces puede afectar la detección durante el muestreo, y nuestros resultados indican que el censo visual está sesgado hacia peces oportunistas que regularmente presentan características fácilmente observables. Se ha reconocido que las características etológicas son el aspecto más influyente en la detección de peces durante el censo visual (MacNeil et al. 2008, Colton y Swearer 2010) y los peces residentes en los sistemas intermareales no son la excepción.
La detección de especies crípticas ha sido la debilidad de los métodos de muestreo en ambientes marinos (Brock 1982, Ackerman y Bellwood 2000, Godinho y Lotufo 2010, Davis et al. 2018). Las especies nocturnas no solamente son inactivas, sino que se esconden durante el censo visual diurno lo que causa un declive abrupto en las probabilidades de su detección, especialmente cuando se aplica el método de censo visual. Las diferencias entre el método de vaciado y el censo visual fueron menos marcadas para peces oportunistas y transeúntes. Por tanto, el censo visual podría ser adecuado para estudiar y cuantificar la diversidad de peces diurnamente activos para especies oportunistas y transeúntes y quizás ser aplicado como una técnica complementaria en lugar de un método independiente. El uso del censo visual en hábitats de pozas intermareales debería ser ejecutado con precaución ya que nuestros resultados coinciden con hallazgos previos (Christensen y Winterbottom 1981, Griffiths 2005, Wong et al. 2019); los estimados del censo visual fueron imprecisos, sesgados hacia peces oportunistas y transeúntes y menos confiables que el método de vaciado de las pozas.
Ambos métodos detectaron menos especies e individuos en pozas con mayor rugosidad, pero el muestreo de vaciado de pozas produjo mejores resultados que el censo visual. El grado en el que la rugosidad afecta la detección de peces puede estar enlazado al comportamiento de los peces, ya que los peces residentes crípticos se pueden refugiar en madrigueras cuando los observadores están presentes y durante el proceso de vaciado, mientras que los oportunistas y transeúntes son menos dados a esconderse en madrigueras que los residentes. Los cambios en la rugosidad proveen más refugios y microhábitats que pueden permitir mayores abundancias y más especies de peces (Davis 2000, Griffiths et al. 2006, González-Murcia et al. 2020). Desafortunadamente para propósitos de muestreo, la rugosidad del sustrato reduce la precisión del muestreo porque las áreas de alto relieve del sustrato proveen mayores refugios, principalmente para peces crípticos, lo que complica la detección de los individuos (Brock 1982). En algunos sistemas, severas subestimaciones de hasta 82% menor riqueza de especies y 73% de abundancia se han atribuido a la complejidad de hábitat (Willis 2001). Conjuntamente, la mayor complejidad de hábitat puede incrementar la probabilidad de identificar, contar y cuantificar peces erróneamente y de subestimar especies objetivo (Brock 1982).
El vaciado de las pozas intermareales por sí solo parece ser lo suficientemente efectivo para el muestreo de peces intermareales reduciendo el sesgo hacia especies oportunistas y transeúntes. Este método ofrece muchas ventajas y provee oportunidades para recolectar más información de las especies objetivo. Los ictiocidas pueden ser usados, pero podrían tener impactos perjudiciales en sistemas cerrados como las pozas. El censo visual subestima la abundancia y riqueza de especies y produce estimaciones arriesgadas; no obstante, podría ser usado cuando otros métodos de muestreo no sean adecuados. Los censos visuales pueden pasar por alto individuos grandes de especies sigilosas e infrarrepresentar clases de tamaño en peces de pozas intermareales (Griffiths 2005, Griffiths et al. 2006). Consecuentemente, los datos generados con el censo visual de peces de pozas intermareales se deben analizar cautelosamente.
El Zonte es un área con baja diversidad de peces intermareales (González-Murcia et al. 2020) y otras áreas intermareales tienen mayores abundancias y riqueza de especies residentes, oportunistas y transeúntes (González-Murcia et al. 2012, González-Murcia et al. 2016). Sospechamos que las fallas del censo visual podrían ser agravadas en áreas intermareales con mayor diversidad. Las tecnologías emergentes pueden mejorar o suplementar la exactitud del censo visual (Colton y Swearer 2010, Dorman et al. 2012, Harasti et al. 2015, Davis et al. 2018). Sin embargo, estas técnicas alternativas no son infalibles a los inconvenientes del censo visual (Colton y Swearer 2010, Davis et al. 2018). La eficacia de estos métodos en áreas intermareales del Pacífico Oriental Tropical necesita ser evaluada y validada. Las funciones del modelado han sido usadas para corregir las diferencias entre los métodos de muestreo (Christensen y Winterbottom 1981). Debido a la alta variabilidad dentro de los sistemas intermareales, consideramos que el modelado, la extrapolación y la predicción de abundancia y ocurrencia de especies debe ser realizado con prudencia.
En conclusión, contrastamos los métodos de vaciado y el censo visual en las pozas intermareales con respecto a su exactitud en la detección de peces intermareales de diferentes categorías de residencia y bajo diferentes niveles de volumen de pozas y rugosidad del sustrato. Con el método de vaciado se obtuvieron registros mayores de abundancia y de riqueza de especies en pozas con diferentes niveles de volumen y rugosidad comparado con el censo visual. El método de vaciado de las pozas detectó certeramente peces que no fueron detectados en las pozas con el censo visual, lo cual redujo la tasa de falsos negativos. Los peces residentes que tienen comportamiento solitario y críptico fueron el grupo más subestimado usando el censo visual que resultó en descripciones de ensamblajes completamente diferentes. Demostramos que el método de vaciado genera mayores estimadores de biodiversidad en términos de abundancia y riqueza de especies en hábitats intermareales. Por lo tanto, comparado con el censo visual, el método de vaciado es claramente una alternativa más certera para estudios científicos. La información obtenida con el censo visual para el análisis exploratorio o como metodología para establecer líneas de base o proveer información en inventarios de biodiversidad debe ser analizado con cautela. Para los estimadores que provienen de censos visuales, se deben reconocer las advertencias previamente discutidas y se deben establecer las características físicas de las pozas para entender el enfoque de los estimadores de biodiversidad. Esperamos que estos resultados hagan reflexionar sobre los resultados generados por diferentes metodologías de muestreo en sistemas de pozas intermareales y provean perspectivas en la idoneidad de las técnicas de muestreo para lograr objetivos de investigación o de conservación.
Agradecimientos
Esta investigación fue parcialmente financiada por el Museo de Historia Natural de El Salvador y la Fundación Naturaleza El Salvador. Agradecemos a Julio Delgado por su apoyo en logística y a E. Rauda, J. Benavides, D. Laínez, E. Novoa, A.M. Rivera, C. Rodríguez y D. Lobos por su asistencia en campo. A E. Echeverría por su apoyo en gestión y a E. González y E. Menéndez por el apoyo técnico y mantenimiento de equipo. A M. Murcia-Orellana por el apoyo a SGM. En memoria de S. González-Rosales cuyas ideas, contribuciones y entusiasmo dejaron un fuerte legado en SGM. Esta investigación se llevó a cabo bajo el permiso de colecta MARN-DEV-GVS-AIMA-104-2018 del Ministerio de Medio Ambiente y Recursos Naturales (MARN) de El Salvador.
REFERENCIAS
Ackerman JL, Bellwood DR 2000. Reef fish assemblages: a re-evaluation using enclosed rotenone stations. Mar Ecol Prog Ser. 206:227-237. https://doi:10.3354/meps206227 [ Links ]
Ackerman JL, Bellwood DR. 2002. Comparative efficiency of clove oil and rotenone for sampling tropical reef fish assemblages. J Fish Biol. 60:893-901. https://doi.org/10.1111/j.1095-8649.2002.tb02416.x [ Links ]
Almada VC, Faria C. 2004. Temporal variation of rocky intertidal resident fish assemblages - patterns and possible mechanisms with a note on sampling protocols. Rev Fish Biol Fisher. 14:239-250. https://doi.org/10.1007/s11160-004-6750-7 [ Links ]
Alzate A, Zapata FA, Giraldo A. 2014. A comparison of visual and collection-based methods for assessing community structure of coral reef fishes in the Tropical Eastern Pacific. Rev Biol Trop. 62(S1):359-371. https://doi.org/10.15517/rbt.v62i0.16361 [ Links ]
Andrades R, Machado FS, Reis-Filho JA, Macieira RM, Giarrizzo T. 2018. Intertidal Biogeographic Subprovinces: local and regional factors shaping fish assemblages. Front Mar Sci. 5:412. https://doi.org/10.3389/fmars.2018.00412 [ Links ]
Arndt E, Fricke R. 2019. Intertidal fishes of Mauritius with special reference to shallow tidepools. Biodivers Data J. 7:e36754. https://doi.org/10.3897/BDJ.7.e36754 [ Links ]
Barreiros JP, Bertoncini Á, Machado L, Hostim-Silva M, Santos RS. 2004. Diversity and seasonal changes in the ichthyofauna of rocky tidal pools from Praia Vermelha and São Roque, Santa Catarina. Braz Arch Biol Technol. 47(2):291-299. https://doi.org/10.1590/S1516-89132004000200017 [ Links ]
Bellwood DR, Hemingson CR, Tebbett SB. 2020. Subconscious biases in coral reef fish studies. BioScience.70(7):621-627. https://doi.org/10.1093/biosci/biaa062 [ Links ]
Brock RE. 1982. A critique of the visual census method for assessing coral reef fish Populations. Bull Mar Sci. 32(1):269-276. https://www.ingentaconnect.com/content/umrsmas/bullmar/1982/00000032/00000001/art00019?crawler=true. [ Links ]
Castellanos-Galindo GA, Giraldo A, Rubio EA. 2005. Community structure of an assemblage of tidepool fishes on a tropical eastern Pacific rocky shore, Colombia. J Fish Biol . 67(2):392-408. https://doi.org/10.1111/j.0022-1112.2005.00735.x [ Links ]
Castellanos-Galindo GA, Giraldo A, Zapata FA. 2014. Tidepool fish assemblages of Gorgona Island, Colombian Pacific coast: a local and regional comparison. Rev Biol Trop . 62(S1):373-390. https://doi.org/10.15517/RBT.V62I0.16362 [ Links ]
Christensen MS, Winterbottom R. 1981. A correction factor for, and its application to, visual censuses of littoral fish. S Afr J Zool. 16(2):73-79. https://doi.org/10.1080/02541858.1981.11447736 [ Links ]
Clarke KR, Somerfield PJ, Chapman MG. 2006. On resemblance measures for ecological studies, including taxonomic dissimilarities and a zero-adjusted Bray-Curtis coefficient for denuded assemblages. J Exp Mar Biol Ecol. 330(1):55-80. https://doi.org/10.1016/j.jembe.2005.12.017 [ Links ]
Colton MA, Swearer SE. 2010. A comparison of two survey methods: differences between underwater visual census and baited remote underwater video. Mar Ecol Prog Ser . 400:19-36. https://doi.org/10.3354/meps08377 [ Links ]
Cunha FEA, Monteiro-Neto C, Nottingham MC. 2007. Temporal and spatial variations in tidepool fish assemblages of the northeast coast of Brazil. Biota Neotrop. 7(1):bn03307012007. https://doi.org/10.1590/S1676-06032007000100016 [ Links ]
Daniel, MJ, Boyden, CR 1975. Diurnal variations in physico-chemical conditions within intertidal rockpools. Fld Stud. 4:161-176. [ Links ]
Davis JLD. 2000. Spatial and seasonal patterns of habitat partitioning in a guild of southern California tidepool fishes. Mar Ecol Prog Ser . 196:253-268. https://doi.org/10.3354/meps196253 [ Links ]
Davis TR, Larkin MF, Harasti D. 2018. Application of non-destructive methods for assessing rock pool fish assemblages on Lord Howe Island, Australia. Reg Stud Mar Sci. 24:251-259. https://doi.org/10.1016/j.rsma.2018.09.002 [ Links ]
De Cáceres M, Legendre P. 2009. Associations between species and groups of sites: indices and statistical inference. Ecology. 90(12):3566-3574. https://doi.org/10.1890/08-1823.1 [ Links ]
De Cáceres M, Legendre P, Moretti M. 2010. Improving indicator species analysis by combining groups of sites. Oikos. 119(10):1674-1684. https://doi.org/10.1111/j.1600-0706.2010.18334.x [ Links ]
Dorman SR, Harvey ES, Newman SJ. 2012. Bait effects in sampling coral reef fish assemblages with stereo-BRUVs. PLoS One. 7:e41538. https://doi.org/10.1371/journal.pone.0041538 [ Links ]
Faria C, Almada V. 1999. Variation and resilience of rocky intertidal fish in western Portugal. Mar Ecol Prog Ser . 184:197-203. https://doi.org/10.3354/meps184197 [ Links ]
Galvan DE, Venerus LA, Irigoyen AJ. 2009. The reef-fish fauna of the Northern Patagonian Gulfs, Argentina, South-western Atlantic. Open Fish Sci J. 2(1):90-98. http://doi.org/10.2174/1874401X00902010090 [ Links ]
Gibson RN. 1999. Methods for studying intertidal fishes. In: Horn MH Martin KLM, Chotkowski MA (eds.), Biology of intertidal fishes: Life in two Worlds. San Diego (CA): Academic Press. p. 7-25. [ Links ]
Gibson RN, Yoshiyama RM. 1999. Intertidal fish communities. In: Horn MH, Martin KLM, Chotkowski MA (eds.), Biology of intertidal fishes: Life in two Worlds. San Diego (CA): Academic Press . p. 264-296. [ Links ]
Godinho WO, Lotufo TMC. 2010. Local v. microhabitat influences on the fish fauna of tidal pools in north-east Brazil. J Fish Biol . 76(3):487-501. https://doi.org/10.1111/j.1095-8649.2009.02501.x [ Links ]
González-Murcia S, Marín-Martínez C, Ayala-Bocos A. 2012. Intertidal rock pool icthyofauna of El Pital, La Libertad, El Salvador. Check List. 8(6):1216-1219. https://doi.org/10.15560/8.6.1216 [ Links ]
González-Murcia S, Chicas Batres F, Lovo MH. 2016. Community structure and height distribution of intertidal rock poolfish in Los Cóbanos, El Salvador. Pan-Am J Aquat Sci. 11(3):227-242; [accessed 2023 January 24]. https://panamjas.org/pdf_artigos/PANAMJAS_11(3)_227-242.pdf. [ Links ]
González-Murcia S, Erdmann S, Alvarado-Larios R. 2020. Is this rock pool suitable habitat? Fish diversity in intertidal rock pools of El Zonte, El Salvador. Rev Mex Biodivers. 91:e913099. https://doi.org/10.22201/ib.20078706e.2020.91.3099 [ Links ]
Griffiths RA. 2005a. Sampling rare or elusive species. In: Thompson WL (ed.) Concepts, designs and techniques for estimating population parameters. Washington (DC, USA): Island Press. 32(4):374. https://doi.org/10.1017/S0376892906262921 [ Links ]
Griffiths SP. 2003a. Rockpool ichthyofaunas of temperate Australia: species composition, residency and biogeographic patterns. Estuarine, Coastal Shelf Sci. 58(1):173-186. https://doi.org/10.1016/S0272-7714(03)00073-8 [ Links ]
Griffiths SP, West RJ, Davis AR. 2003b. Effects of intertidal elevation on the rockpool ichthyofaunas of temperate Australia. Environ Biol Fishes. 68:197-204. https://doi.org/10.1023/B:EBFI.0000003870.76842.d0 [ Links ]
Griffiths SP. 2005b. The use of clove oil as an anaesthetic and method for sampling intertidal rockpool fishes. J Fish Biol . 57(6):1453-1464. https://doi.org/10.1111/j.1095-8649.2000.tb02224.x [ Links ]
Griffiths SP, Davis AR, West RJ. 2006. Role of habitat complexity in structuring temperate rockpool ichthyofaunas. Mar Ecol Prog Ser . 313:227-239. https://doi.org/10.3354/meps313227 [ Links ]
Harasti D, Gallen C, Malcolm H, Tegart P, Hughes B. 2014. Where are the little ones: distribution and abundance of the threatened serranid Epinephelus daemelii (Günther, 1876) in intertidal habitats in New South Wales, Australia. J Appl Ichthyol. 30(5):1007-1015. https://doi.org/10.1111/jai.12446 [ Links ]
Harasti D, Malcolm H, Gallen C, Coleman MA, Jordan A, Knott NA. 2015. Appropriate set times to represent patterns of rocky reef fishes using baited video. J Exp Mar Biol Ecol . 463:173-180. http://dx.doi.org/10.1016/j.jembe.2014.12.003 [ Links ]
Hartig F. 2021. DHARMa: Residual Diagnostics for Hierarchical (Multi-Level/Mixed) Regression Models. Viena (Austria): The Comprehensive R Archive Network; [accessed 2021 Dec 8]. https://cran.r-project.org/web/packages/DHARMa/vignettes/DHARMa.html. [ Links ]
Irigoyen AJ, Galván DE, Venerus LA, Parma AM. 2013. Variability in abundance of temperate reef fishes estimated by visual census. PLoS One . 8(4):e61072. https://doi.org/10.1371/journal.pone.0061072 [ Links ]
MacNeil MA, Graham NAJ, Conroy MJ, Fonnesbeck CJ, Polunin NVC, Rushton SP, Chabanet P, McClanahan TR. 2008. Detection heterogeneity in underwater visual-census data. J Fish Biol . 73(7):1748-1763. https://doi.org/10.1111/j.1095-8649.2008.02067.x [ Links ]
Mahon R, Mahon SD. 1994. Structure and resilience of a tidepool fish assemblage at Barbados. Environ Biol Fish. 41:171-190. https://doi.org/10.1007/BF02197843 [ Links ]
Malard LA, McGuigan K, Riginos C. 2016. Site fidelity, size, and morphology may differ by tidal position for an intertidal fish, Bathygobius cocosensis (Perciformes-Gobiidae), in Eastern Australia. PeerJ. 4:e2263. https://doi.org/10.7717/peerj.2263 [ Links ]
McElreath R. 2016. Statistical rethinking: a Bayesian course with examples in R and Stan. London: CRC Press. 469 p. [ Links ]
[MARN] Ministerio de Medio Ambiente y Recursos Naturales. 2018. Almanaque astronómico y marino 2018. El Salvador (Centro América): Dirección General del Observatorio Ambiental, Ministerio de Medio Ambiente y Recursos Naturales (MARN). 71 p. [ Links ]
Moring JR. 1970. Use of the anesthetic quinaldine for handling Pacific coast intertidal fishes. Trans Amer Fish Soc. 99(4):802-805. https://doi.org/10.1577/1548-8659(1970)99<802:UOTAQF>2.0.CO;2 [ Links ]
Oksanen J, Simpson G, Blanchet F, Kindt R, Legendre P, Minchin P, O'Hara R, Solymos P, Stevens M, Szoecs E, et al. 2022. Vegan: Community Ecology Package. R package version 2.6-4. https://CRAN.R-project.org/package=vegan. [ Links ]
Quinn G, Keough M. 2002. Experimental design and data analysis for biologists. Cambridge: Cambridge University Press. 553 p. https://doi.org/10.1017/CBO9780511806384 [ Links ]
R Core Team. 2019. R: A language and environment for statistical computing. Vienna (Austria): R Foundation for Statistical Computing; [accessed 2023 December 8]. https://www.R-project.org/. [ Links ]
Stan Development Team. 2020. Package “rstan”, RStan: the R Interface to Stan. R Package version 2.21.2; [accessed 2023 December 8]. http://mc-stan.org/. [ Links ]
Ward-Paige C, Mills Flemming J, Lotze HK. 2010. Overestimating fish counts by non-instantaneous visual censuses: consequences for population and community descriptions. PLoS One . 5(7):e11722. https://doi.org/10.1371/journal.pone.0011722 [ Links ]
White GE, Brown C. 2013. Site fidelity and homing behaviour in intertidal fishes. Mar Biol. 160:1365-1372. https://doi.org/10.1007/s00227-013-2188-6 [ Links ]
Wilding TA, Gibson RN, Sayer MDJ. 2001. Procedural Guideline No. 4-4 Sampling fish in rockpools. Scotland (UK): UK Marine Sacs Project. Marine Monitoring Handbook. p. 363-368. [ Links ]
Willis T. 2001. Visual census methods underestimate density and diversity of cryptic reef fishes. J Fish Biol . 59(5):1408-1411. https://doi.org/10.1111/j.1095-8649.2001.tb00202.x [ Links ]
Wong MYL, Gordon P, Paijmans KC, Rees MJ. 2019. Finding rockpool fishes: a quantitative comparison of non-invasive and invasive methods for assessing abundance, species richness and assemblage structure. Environ Biol Fishes . 102:81-94. https://doi.org/10.1007/s10641-019-0846-3 [ Links ]
Supplementary material
Tabla S1 Lista de especímenes recolectados depositados en el Museo de Historia Natural de El Salvador (MUHNES).
| Catalogue number | Order (Nelson 2016) | Family | Scientific name |
| 40-1022 | MUGILIFORMES | Mugilidae | Mugil curema |
| 40-1023 | BERYCIFORMES | Holocentridae | Neoniphon suborbitalis |
| 40-1024 | PERCIFORMES | Blenniidae | Ophioblennius steindachneri |
| 40-1034 | GOBIIFORMES | Pomacentridae | Abudefduf troschelii |
| 40-1035 | HOLOCENTRIFORMES | Holocentridae | Neoniphon suborbitalis |
| 40-1036 | MUGILIFORMES | Mugilidae | Mugil curema |
| 40-1037 | BLENIIFORMES | Labrisomidae | Paraclinus beebei |
| 40-1038 | GOBIIFORMES | Gobiesocidae | Tomicodon zebra |
| 40-1039 | GOBIIFORMES | Gobiesocidae | Tomicodon zebra |
| 40-1040 | GOBIIFORMES | Gobiesocidae | Gobiesox daedaleus |
| 40-1041 | GOBIIFORMES | Gobiesocidae | Tomicodon zebra |
| 40-1042 | GOBIIFORMES | Gobiesocidae | Tomicodon zebra |
| 40-1043 | GOBIIFORMES | Gobiesocidae | Tomicodon zebra |
| 40-1044 | PERCIFORMES | Labridae | Halichoeres notospilus |
| 40-1045 | PERCIFORMES | Serranidae | Epinephelus labriformis |
| 40-1046 | BLENIIFORMES | Labrisomidae | Malacoctenus sudensis |
| 40-1047 | PERCIFORMES | Serranidae | Rypticus nigripinnis |
| 40-1048 | GOBIIFORMES | Gobiesocidae | Tomicodon zebra |
| 40-1049 | BLENIIFORMES | Blenniidae | Ophioblennius steindachneri |
| 40-1050 | GOBIIFORMES | Gobiidae | Bathygobius ramosus |
| 40-1051 | PERCIFORMES | Serranidae | Epinephelus labriformis |
| 40-1052 | BLENIIFORMES | Blenniidae | Ophioblennius steindachneri |
| 40-1053 | HOLOCENTRIFORMES | Holocentridae | Neoniphon suborbitalis |
| 40-1054 | PERCIFORMES | Labrisomidae | Paraclinus monophthalmus |
Tabla S2 Relación de la abundancia de los peces y los predictores del método de muestreo, volumen de agua de la poza, rugosidad y los factores aleatorios del evento de muestreo y la identificación de las pozas para subconjuntos de especies clasificados como residentes, oportunistas y transeúntes. Intervalos de compatibilidad de la más alta probabilidad de 95% (HPCI), autocorrelación de las evidencias durante la generación de la probabilidad posterior (Rhat) donde los valores de Ȓ ≤ 1.05 indican bajas oportunidades de autocorrelación en el muestreo del tamaño efectivo de la muestra (ESS); ESS es una métrica para medir la cantidad por la que la autocorrelación en las muestras incrementa la incertidumbre en comparación con una muestra independiente.
| Term*/Behavior subgroups | Estimate | SE | Lower HPCI | Upper HPCI | Rhat | ESS |
| Abundance resident species | ||||||
| Intercept (bailing census) | 1.68 | 0.13 | 1.43 | 1.92 | 1.00 | 10,062 |
| Visual census | -1.45 | 0.18 | -1.81 | -1.11 | 1.00 | 11,088 |
| Volume | 0.08 | 0.01 | 0.06 | 0.11 | 1.00 | 10,889 |
| Rugosity | -0.05 | 0.02 | -0.10 | -0.01 | 1.00 | 10,975 |
| Reciprocal dispersion | 0.88 | 0.23 | 0.60 | 1.38 | 1.00 | 6,271 |
| Sigma rock pools: sampling event | 0.05 | 0.13 | 0.00 | 0.37 | 1.00 | 6,674 |
| Sigma rock pool identity | 0.05 | 0.13 | 0.00 | 0.38 | 1.00 | 6,920 |
| Mean_PPD | 5.90 | 1.19 | 3.98 | 8.47 | 1.00 | 10,875 |
| Log-posterior | -1,327.00 | 20.86 | -1,366.02 | -1,284.18 | 1.00 | 7,579 |
| Abundance opportunist species | ||||||
| Intercept (bailing census) | -0.68 | 0.14 | -0.96 | -0.42 | 1.00 | 11,377 |
| Visual census | -0.29 | 0.20 | -0.69 | 0.08 | 1.00 | 11,251 |
| Volume | 0.03 | 0.01 | 0.01 | 0.05 | 1.00 | 11,083 |
| Rugosity | -0.07 | 0.02 | -0.11 | -0.02 | 1.00 | 11,166 |
| Reciprocal dispersion | 2.65 | 1.11 | 1.09 | 5.07 | 1.00 | 11,228 |
| Sigma rock pools: sampling event | 0.02 | 0.06 | 0.00 | 0.15 | 1.00 | 10,816 |
| Sigma rock pool identity | 0.02 | 0.05 | 0.00 | 0.14 | 1.00 | 11,135 |
| Mean_PPD | 0.51 | 0.07 | 0.38 | 0.66 | 1.00 | 11,312 |
| Log-posterior | -985.87 | 16.66 | -1,018.97 | -953.72 | 1.00 | 11,259 |
| Abundance transient species | ||||||
| Intercept (bailing census) | -8.89 | 3.43 | -16.32 | -3.87 | 1.00 | 11,268 |
| Visual census | -0.92 | 0.72 | -2.31 | 0.51 | 1.00 | 10,945 |
| Volume | 0.27 | 0.12 | 0.10 | 0.54 | 1.00 | 11,220 |
| Rugosity | -0.60 | 0.47 | -1.60 | 0.14 | 1.00 | 1,143 |
| Reciprocal dispersion | 0.75 | 0.70 | 0.07 | 2.32 | 1.00 | 11,156 |
| Sigma rock pools: sampling event | 0.09 | 0.83 | 0.00 | 1.59 | 1.00 | 10,386 |
| Sigma rock pool identity | 0.09 | 0.85 | 0.00 | 1.67 | 1.00 | 11,127 |
| Mean_PPD | 0.03 | 0.03 | 0.00 | 0.07 | 1.00 | 11,088 |
| Log-posterior | -773.31 | 16.61 | -805.96 | -741.56 | 1.00 | 10,594 |
Tabla S3 Estimadores de la abundancia de los peces para subconjuntos de especies clasificadas como residentes, oportunistas y transeúntes comparados para subconjuntos de volumen en las pozas (0.1, 0.5, 1.5, 2.5 m3) y método de muestreo. Intervalos de compatibilidad de la más alta probabilidad de 95% (HPCI). Siempre que los rangos del HPCI entre las categorías no traslapen, se respaldan diferencias significativas en la abundancia.
| Contrast | Estimate | Lower HPCI | Upper HPCI |
| Resident: volume/sampling:method | |||
| Volume 0.1 m3 | |||
| Bailing | 3.68 | 2.75 | 4.74 |
| Visual census | 0.86 | 0.59 | 1.15 |
| Volume 0.5 m3 | |||
| Bailing | 5.17 | 3.97 | 6.54 |
| Visual census | 1.21 | 0.84 | 1.62 |
| Volume 1.5 m3 | |||
| Bailing | 12.07 | 8.63 | 16.08 |
| Visual census | 2.82 | 1.78 | 3.99 |
| Volume 2.5 m3 | |||
| Bailing | 28.07 | 16.40 | 42.32 |
| Visual census | 6.55 | 3.45 | 10.54 |
| Opportunist: volume/sampling:method | |||
| Volume 0.1 m3 | |||
| Bailing | 1.35 | 0.82 | 2.02 |
| Visual census | 0.90 | 0.55 | 1.39 |
| Volume 0.5 m3 | |||
| Bailing | 1.83 | 1.17 | 2.64 |
| Visual census | 0.90 | 0.77 | 1.79 |
| Volume 1.5 m3 | |||
| Bailing | 3.85 | 2.00 | 6.84 |
| Visual census | 2.57 | 1.28 | 4.39 |
| Volume 2.5 m3 | |||
| Bailing | 8.12 | 2.18 | 19.33 |
| Visual census | 5.38 | 1.67 | 12.92 |
| Transients: volume/sampling:method | |||
| Volume 0.1 m3 | |||
| Bailing | 0.00 | 0.00 | 0.00 |
| Visual census | 0.00 | 0.00 | 0.00 |
| Volume 0.5 m3 | |||
| Bailing | 0.00 | 0.00 | 0.01 |
| Visual census | 0.00 | 0.00 | 0.00 |
| Volume 1.5 m3 | |||
| Bailing | 0.00 | 0.00 | 0.04 |
| Visual census | 0.00 | 0.00 | 0.01 |
| Volume 2.5 m3 | |||
| Bailing | 0.04 | 0.00 | 0.27 |
| Visual census | 0.01 | 0.00 | 0.10 |
Tabla S4 Estimadores de la abundancia de los peces para subconjuntos de especies clasificadas como residentes, oportunistas y transeúntes comparados para subconjuntos de la rugosidad del sustrato de las pozas (1%, 10%, 19%) y el método de muestreo. Intervalos de compatibilidad de la más alta probabilidad de 95% (HPCI). Siempre que los rangos del HPCI entre las categorías no traslapen, se respaldan diferencias significativas en la abundancia.
| Contrast | Estimate | Lower HPCI | Upper HPCI |
| Resident: rugosity/sampling:method | |||
| Rugosity 1% | |||
| Bailing | 7.32 | 5.15 | 9.96 |
| Visual census | 1.71 | 1.16 | 2.41 |
| Rugosity 10% | |||
| Bailing | 4.51 | 3.23 | 5.89 |
| Visual census | 1.06 | 0.67 | 1.45 |
| Rugosity 19% | |||
| Bailing | 2.77 | 1.35 | 4.61 |
| Visual census | 0.65 | 0.27 | 1.12 |
| Opportunist: rugosity/sampling:method | |||
| Rugosity 1% | |||
| Bailing | 2.84 | 1.64 | 4.47 |
| Visual census | 1.90 | 1.07 | 3.01 |
| Rugosity 10% | |||
| Bailing | 1.48 | 0.87 | 2.23 |
| Visual census | 0.99 | 0.60 | 1.55 |
| Rugosity 19% | |||
| Bailing | 0.77 | 0.26 | 1.57 |
| Visual census | 0.52 | 0.17 | 1.05 |
| Transients: rugosity/sampling:method | |||
| Rugosity 1% | |||
| Bailing | 0.00 | 0.00 | 0.03 |
| Visual census | 0.00 | 0.00 | 0.01 |
| Rugosity 10% | |||
| Bailing | 0.00 | 0.00 | 0.01 |
| Visual census | 0.00 | 0.00 | 0.00 |
| Rugosity 19% | |||
| Bailing | 0.00 | 0.00 | 0.01 |
| Visual census | 0.00 | 0.00 | 0.00 |
Tabla S5 Relación de la riqueza de especies de peces y los predictores del método de muestreo, volumen de agua de la poza, y rugosidad y los factores aleatorios del evento de muestreo y la identificación de las pozas para subconjuntos de especies clasificadas como residentes, oportunistas y transeúntes. Intervalos de compatibilidad de la más alta probabilidad de 95% (HPCI), evidencias de la autocorrelación durante la generación de la probabilidad posterior (Rhat) donde los valores de Ȓ ≤ 1.05 indican bajas oportunidades de autocorrelación en el muestreo del tamaño efectivo de la muestra (ESS); ESS es una métrica para medir la cantidad por la que la autocorrelación en las muestras incrementa la incertidumbre en comparación con una muestra independiente.
| Term*/behavior subgroups | Estimate | SE | Lower HPCI | Upper HPCI | Rhat | ESS |
| Richness resident species | ||||||
| Intercept (bailing census) | 1.68 | 0.13 | 1.43 | 1.92 | 1.00 | 10,062 |
| Visual census | -1.45 | 0.18 | -1.81 | -1.11 | 1.00 | 11,088 |
| Volume | 0.08 | 0.01 | 0.06 | 0.11 | 1.00 | 10,889 |
| Rugosity | -0.05 | 0.02 | -0.10 | -0.01 | 1.00 | 10,975 |
| Reciprocal dispersion | 0.88 | 0.23 | 0.60 | 1.38 | 1.00 | 6,271 |
| Sigma rock pools: sampling event | 0.05 | 0.13 | 0.00 | 0.37 | 1.00 | 6,674 |
| Sigma rock pool identity | 0.05 | 0.13 | 0.00 | 0.38 | 1.00 | 6,920 |
| Mean_PPD | 5.90 | 1.19 | 3.98 | 8.47 | 1.00 | 10,875 |
| Log-posterior | -1,327.00 | 20.86 | -1,366.02 | -1,284.18 | 1.00 | 7,579 |
| Richness opportunist species | ||||||
| Intercept (bailing census) | -0.68 | 0.14 | -0.96 | -0.42 | 1.00 | 11,377 |
| Visual census | -0.29 | 0.20 | -0.69 | 0.08 | 1.00 | 11,251 |
| Volume | 0.03 | 0.01 | 0.01 | 0.05 | 1.00 | 11,083 |
| Rugosity | -0.07 | 0.02 | -0.11 | -0.02 | 1.00 | 11,166 |
| Reciprocal dispersion | 2.65 | 1.11 | 1.09 | 5.07 | 1.00 | 11,228 |
| Sigma rock pools: sampling event | 0.02 | 0.06 | 0.00 | 0.15 | 1.00 | 10,816 |
| Sigma rock pool identity | 0.02 | 0.05 | 0.00 | 0.14 | 1.00 | 11,135 |
| Mean_PPD | 0.51 | 0.07 | 0.38 | 0.66 | 1.00 | 11,312 |
| Log-posterior | -985.87 | 16.66 | -1,018.97 | -953.72 | 1.00 | 11,259 |
| Richness transient species | ||||||
| Intercept (bailing census) | -8.89 | 3.43 | -16.32 | -3.87 | 1.00 | 11,268 |
| Visual census | -0.92 | 0.72 | -2.31 | 0.51 | 1.00 | 10,945 |
| Volume | 0.27 | 0.12 | 0.10 | 0.54 | 1.00 | 11,220 |
| Rugosity | -0.60 | 0.47 | -1.60 | 0.14 | 1.00 | 1,143 |
| Reciprocal dispersion | 0.75 | 0.70 | 0.07 | 2.32 | 1.00 | 11,156 |
| Sigma rock pools: sampling event | 0.09 | 0.83 | 0.00 | 1.59 | 1.00 | 10,386 |
| Sigma rock pool identity | 0.09 | 0.85 | 0.00 | 1.67 | 1.00 | 11,127 |
| Mean_PPD | 0.03 | 0.03 | 0.00 | 0.07 | 1.00 | 11,088 |
| Log-posterior | -773.31 | 16.61 | -805.96 | -741.56 | 1.00 | 10,594 |
Tabla S6 Estimadores de la riqueza de especies de peces para subconjuntos de especies clasificadas como residentes, oportunistas y transeúntes comparados para los subconjuntos del volumen de la poza (0.1, 0.5, 1.5, 2.5 m3) y método de muestreo. Intervalos de compatibilidad de la más alta probabilidad de 95% (HPCI). Siempre que los rangos del HPCI entre las categorías no traslapen, se respaldan diferencias significativas en riqueza de especies.
| Contrast | Estimate | Lower HPCI | Upper HPCI |
| Resident: volume/sampling:method | |||
| Volume 0.1 m3 | |||
| Bailing | 1.02 | 0.83 | 1.23 |
| Visual census | 0.50 | 0.38 | 0.63 |
| Volume 0.5 m3 | |||
| Bailing | 1.14 | 0.94 | 1.34 |
| Visual census | 0.56 | 0.42 | 0.69 |
| Volume 1.5 m3 | |||
| Bailing | 1.47 | 1.19 | 1.80 |
| Visual census | 0.72 | 0.54 | 0.92 |
| Volume 2.5 m3 | |||
| Bailing | 1.91 | 1.37 | 2.54 |
| Visual census | 0.94 | 0.64 | 1.29 |
| Opportunist: volume/sampling:method | |||
| Volume 0.1 m3 | |||
| Bailing | 0.45 | 0.32 | 0.59 |
| Visual census | 0.34 | 0.23 | 0.45 |
| Volume 0.5 m3 | |||
| Bailing | 0.50 | 0.37 | 0.65 |
| Visual census | 0.38 | 0.27 | 0.50 |
| Volume 1.5 m3 | |||
| Bailing | 0.66 | 0.47 | 0.88 |
| Visual census | 0.50 | 0.34 | 0.68 |
| Volume 2.5 m3 | |||
| Bailing | 0.87 | 0.51 | 1.31 |
| Visual census | 0.65 | 0.38 | 1.01 |
| Transients: volume/sampling:method | |||
| Volume 0.1 m3 | |||
| Bailing | 0.00 | 0.00 | 0.00 |
| Visual census | 0.00 | 0.00 | 0.00 |
| Volume 0.5 m3 | |||
| Bailing | 0.00 | 0.00 | 0.01 |
| Visual census | 0.00 | 0.00 | 0.00 |
| Volume 1.5 m3 | |||
| Bailing | 0.00 | 0.00 | 0.03 |
| Visual census | 0.00 | 0.00 | 0.01 |
| Volume 2.5 m3 | |||
| Bailing | 0.03 | 0.00 | 0.18 |
| Visual census | 0.01 | 0.00 | 0.08 |
Tabla S7 Estimadores de la riqueza de especies para subconjuntos de especies clasificadas como residentes, oportunistas y transeúntes comparados para los subconjuntos de la rugosidad del sustrato de las pozas (1%, 10%, 19%) y método de muestreo. Intervalos de compatibilidad de la más alta probabilidad de 95% (HPCI). Siempre que los rangos del HPCI entre las categorías no traslapen, se respaldan diferencias significativas en la riqueza de especies.
| Substratum rugosity and method | Estimate | Lower HPCI | Upper HPCI |
| Resident: rugosity/sampling:method | |||
| Rugosity 1% | |||
| Bailing | 1.48 | 1.15 | 1.87 |
| Visual census | 0.72 | 0.53 | 0.95 |
| Rugosity 10% | |||
| Bailing | 1.00 | 0.78 | 1.22 |
| Visual census | 0.49 | 0.36 | 0.63 |
| Rugosity 19% | |||
| Bailing | 0.67 | 0.38 | 1.00 |
| Visual census | 0.33 | 0.18 | 0.50 |
| Opportunist: rugosity/sampling:method | |||
| Rugosity 1% | |||
| Bailing | 0.74 | 0.50 | 0.55 |
| Visual census | 0.56 | 0.37 | 0.78 |
| Rugosity 10% | |||
| Bailing | 0.41 | 0.28 | 0.55 |
| Visual census | 0.31 | 0.21 | 0.43 |
| Rugosity 19% | |||
| Bailing | 0.23 | 0.10 | 0.40 |
| Visual census | 0.17 | 0.07 | 0.30 |
| Transients: rugosity/sampling:method | |||
| Rugosity 1% | |||
| Bailing | 0.00 | 0.00 | 0.03 |
| Visual census | 0.00 | 0.00 | 0.01 |
| Rugosity 10% | |||
| Bailing | 0.00 | 0.00 | 0.01 |
| Visual census | 0.00 | 0.00 | 0.00 |
| Rugosity 19% | |||
| Bailing | 0.00 | 0.00 | 0.00 |
| Visual census | 0.00 | 0.00 | 0.00 |
Recibido: 30 de Enero de 2023; Aprobado: 21 de Julio de 2023; Publicado: 19 de Diciembre de 2023











 texto en
texto en 



