Introducción
El término genérico tilapia se utiliza para describir a varios géneros y especies de peces de la familia Cichlidae, dentro de los cuales Oreochromis es de importancia para fines de acuacultura. Se cree que las tilapias evolucionaron de un ancestro marino y diversas variedades de tilapia son eurihalinas, por lo cual muestran capacidad para tolerar y adaptarse a diferentes condiciones de salinidad (El-Sayed 2006). Algunas consecuencias del cambio climático global como el aumento en la temperatura, la reducción del régimen de lluvias y la competencia por el agua dulce entre los sectores agrícolas y urbanos han promovido estudios para cultivar tilapia en ambientes estuarinos y costeros (Prunet y Bornancin 1989, Romana-Eguia y Eguia 1999, Mena-Herrera et al. 2002, El-Sayed 2006, Fraga et al. 2012). A nivel mundial, el cultivo de tilapia es el segundo más importante dentro de los cultivos de peces y se le considera como el cultivo con mayor potencial de crecimiento en la acuacultura en el siglo XXI (Fitzsimmons 2010). Lo anterior se relaciona con características zootécnicas para la tilapia, como alta rusticidad, aceptación de una variedad amplia de alimentos, alta conversión alimenticia y capacidad de reproducción a lo largo del año (Lupchinski et al. 2011). El interés por el cultivo de tilapia en agua de mar en zonas áridas y sobre todo cerca de la costa se desarrolló para proveer una fuente alternativa de proteína para alimentación humana (Cabrera et al. 2001). Estos peces son herbívoros y omnívoros, lo cual favorece el uso de ingredientes de origen vegetal en los cultivos ya que presentan una alta digestibilidad de proteínas, carbohidratos y energía (Shiau y Huang 1989, Davies et al. 2011). Además, muestran una actividad lipogénica alta, la cual se asocia con la capacidad catabólica para metabolizar carbohidratos (Qiang et al. 2014). En regiones donde la disponibilidad de recursos y cuerpos de agua dulce para uso acuícola es limitada, el cultivo de tilapia en ambientes marinos es de interés desde el punto de vista científico y comercial (Pang 2005/06, El-Sayed 2006), ya que la demanda en el mercado es cada vez más creciente.
Las especies de tilapia como Oreochromis aureus, Oreochromis spilurus e híbridos cultivadas en agua de mar pueden presentar tasas de crecimiento y conversión alimenticia comparables a las de tilapias cultivadas en agua dulce (Cruz et al. 1990, Martínez-Contreras 2003). Los resultados de un cultivo intensivo de tilapia hibrida (Oreochromis niloticus × O. aureus) en jaulas flotantes en la Laguna de Barra de Navidad (costa de Jalisco, México) indican que el cultivo de este híbrido en agua de mar para fines comerciales puede ser factible (Martínez-Contreras 2003). Aunque existen diversos estudios comparativos sobre el cultivo de especies de tilapia e híbridos en agua de mar y agua dulce (Iwama et al. 1997, Mena-Herrera et al. 2002, Kamal y Mair 2005, Cnaani y Hulata 2011), no se ha desarrollado un trabajo para evaluar a detalle la eficiencia y el desempeño de la tilapia roja híbrida Oreochromis mossambicus × O. aureus. El presente estudio se desarrolló con el propósito de determinar los índices de crecimiento, la supervivencia y la relación metabólica oxigeno:nitrógeno (O:N) como indicadora del sustrato energético en el híbrido de tilapia O. mossambicus × O. aureus cultivado en agua de mar y en agua dulce.
Materiales y métodos
Se obtuvo un lote de 3000 juveniles de tilapia híbrida roja (O. mossambicus × O. aureus) procedente del Centro Acuícola de Zacatepec, Morelos, México (Comisión Nacional de Pesca). Los peces ya masculinizados fueron transportados en avión al laboratorio de acuacultura de la UABC. La mitad de los organismos fue sujeta a una aclimatación de agua dulce a agua de mar, mediante incrementos de 5 de salinidad por día hasta alcanzar una concentración final de 34.5. Posteriormente, se seleccionaron peces aclimatados y no aclimatados con un peso similar (promedio 24.9 ± 0.2 g) y se distribuyeron en grupos de 50 organismos en dos sistemas de cultivo, cada uno con cuatro estanques de fibra de vidrio con capacidad individual de 500 L. Cada estanque constituyó la unidad experimental. Cada sistema de cultivo estuvo conectado a un biofiltro acoplado a un sistema de recirculación con un estanque reservorio para renovar el 5% del volumen de agua por día. La temperatura en los sistemas fue controlada a 28.0 ± 1 °C mediante el uso un calentador (6500 W) en cada estanque reservorio. Los parámetros de la calidad del agua (amonio, nitritos, nitratos, carbonatos y pH) en cada sistema de cultivo fueron evaluados dos veces por semana mediante el uso de un kit comercial (Aquarium Pharmaceutical, Inc., Canada). Los peces fueron alimentados hasta la saciedad aparente cuatro veces al día durante 90 días. La dieta fue formulada con base en sus requerimientos para contener 40.2% de proteína cruda y 8.5% de grasa cruda (Tabla 1). El crecimiento en peso en cada unidad experimental se evaluó cada 30 días.
Tabla 1: Ingredientes (g/100 g dieta) y composición proximal
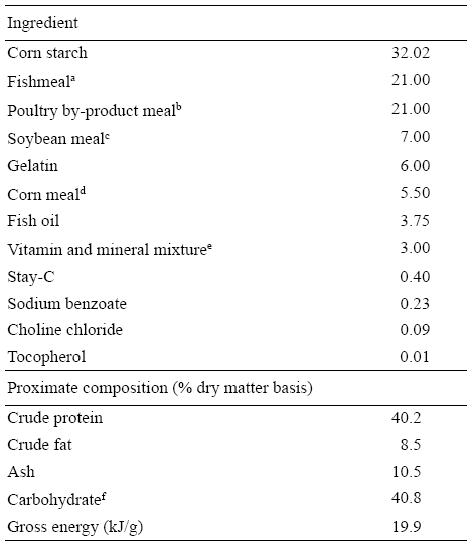
a Tuna meal: 60% crude protein, 6.9% crude fat.
b Pet food grade: 65% crude protein, 12% crude fat.
c 42% crude protein, 1.0% crude fat.
d 8% crude protein, 3.9% crude fat.
e Donated by DSM, Guadalajara, Mexico.
f Calculated by difference as nitrogen free extract + fiber.
Se determinaron los siguientes índices biológicos: coeficiente térmico de crecimiento (de acuerdo con Jobling 2003) = 1000 × ((peso final1/3 - peso inicial1/3)/Σ (días × temperatura)); relación de eficiencia proteínica = aumento de peso corporal/proteína consumida; ingestión de alimento = alimento consumido × 100/[peso final + peso inicial]/2)/días; eficiencia de conversión alimenticia = aumento de peso corporal/alimento consumido; y tasa de conversión alimenticia = alimento consumido/aumento de peso corporal.
Los coeficientes de digestibilidad aparente de nutrientes del alimento se evaluaron mediante la determinación del contenido de cenizas insolubles en ácido en el alimento y en las heces de acuerdo con el método de Tejada (1992) modificado por Montaño-Vargas et al. (2002). El análisis proximal de la dieta experimental y de las heces se realizó de acuerdo con métodos estándar (AOAC 1995). El extracto libre de nitrógeno se determinó por diferencia (Jobling 2001).
Al final del estudio se analizó en cámaras respirométricas el consumo de oxígeno y excreción de amonio en un pez de cada tratamiento y unidad experimental, elegido al azar y en estado postpandrial según lo reportado por Barreto-Curiel (2012). La relación atómica O:N se calculó de acuerdo con Handa et al. (2013) como sigue: O:N = ([oxígeno consumido]/ 16)/([amonio excretado]/14).
Para estimar las posibles diferencias significativas entre los índices biológicos y los parámetros de la respirometría en los tratamientos experimentales, se utilizó la prueba t de Student para muestras independientes. Las diferencias fueron consideradas estadísticamente significativas si P < 0.05. Los análisis estadísticos se realizaron con el programa SigmaStat 3.5 (Systat Software, Inc., Chicago, IL, EUA).
Resultados
Al término de los 90 días del ensayo, la supervivencia en ambos tratamientos experimentales fue de 99.5% (Tabla 2). No hubieron diferencias significativas (P > 0.05) en el incremento en peso y la tasa de conversión alimenticia entre los peces cultivados en agua de mar y en agua dulce (Tabla 2). Así mismo, la relación de eficiencia proteínica, la ingestión del alimento, la eficiencia de conversión y la tasa de conversión alimenticia no presentaron diferencias significativas entre los tratamientos de cultivo. Los peces cultivados en agua de mar presentaron los mayores valores de digestibilidad de la materia seca, proteína, lípidos y carbohidratos del alimento formulado. El consumo de oxígeno, la excreción de amonio y la relación metabólica O:N no presentaron diferencia significativa (P > 0.05) entre ambas condiciones de cultivo (Tabla 3).
Tabla 2: Índices biológicos de los juveniles híbridos de tilapia roja (Oreochromis mossambicus x Oreochromis aureus) después de haber sido alimentados durante 90 días en agua de mar y en agua dulce (media ± desviación stándar).
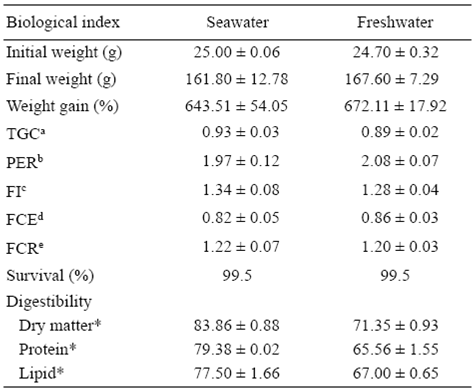
a TGC = thermal growth coefficient.
b PER = protein efficiency ratio.
c FI = feed intake.
d FCE = feed conversion efficiency.
e FCR = feed conversion ratio.
* Means in the same row are significantly different (P < 0.05).
Discusión
Todas las especies de tilapia son de origen dulceacuícola pero su capacidad eurihalina permite que varias especies e híbridos puedan adaptarse y desarrollarse en aguas salobres y en agua de mar (Kamal y Mair 2005). En el presente estudio el cultivo de la tilapia hibrida roja (O. mossambicus × O. aureus) en agua de mar y en agua dulce no mostró diferencias significativas en el desempeño tanto en crecimiento en peso como en los índices biológicos evaluados al término de 90 días. Este comportamiento en el crecimiento es similar al determinado en alevines del híbrido O. mossambicus × O. niloticus cultivados en agua de mar y en agua dulce y alimentados ad libitum con alimento comercial peletizado durante ocho semanas (Martínez-Contreras 2003). El híbrido de O. mossambicus × O. aureus presenta una alta tolerancia a la salinidad, lo cual le permite crecer en forma normal en agua de mar (El-Sayed 2006). Respecto al híbrido de O. mossambicus × O. niloticus, se ha reportado una correlación significativamente positiva en el aumento relativo del peso con el incremento en la salinidad (Kamal y Mair 2005), tendencia que no se determinó en el híbrido de nuestro estudio. En la tilapia roja de Florida (O. mossambicus × O. urolepis hornorum) el incremento de la salinidad del medio promueve un mayor consumo de alimento (Watanabe et al. 1988), comportamiento que no se presentó en este estudio ya que la ingestión de alimento no difirió significativamente entre los tratamientos en agua de mar y en agua dulce.
En el caso de peces eurihalinos como la tilapia, se presume que su cultivo en agua de mar, debido a la osmore-gulación, puede afectar la actividad de sus enzimas digestivas e influir en la eficiencia y la tasa de conversión alimenticia (Rubio et al. 2005, Ridha 2015); sin embargo, esto no se denotó en el periodo de estudio. Se ha sugerido que el crecimiento de peces en ambientes salinos está asociado con la osmoregulación y la expresión de proteínas como la transferina (Rengmark y Lingaas 2007), la capacidad para adaptar la ingesta de alimento a la condiciones de salinidad del medio, la tasa metabólica y los factores endocrinos (Prunet y Bornancin 1988, Boeuf y Payan 2001). En nuestro estudio los valores de la digestibilidad del alimento, proteínas y lípidos presentaron diferencias con relación al medio de cultivo. Con relación al efecto de la salinidad sobre cambios en la actividad enzimática digestiva y la digestibilidad de nutrientes en peces (Moutou et al. 2004, Rubio et al. 2005), se ha reportado que en el hibrido O. mossambicus × O. niloticus la actividad de tripsina y a-amilasa se incrementa con la salinidad (Sandoval-Muy et al. 2012). Lo anterior se asocia a una posible activación de zimógenos en el lumen intestinal (Moutou et al. 2004). En un estudio reciente (en preparación) sobre caracterización de lipasas en nuestro laboratorio se determinó que en la lobina rayada (Morone saxatilis), especie anádroma, la lipasa incrementa su actividad en presencia de NaCl; esto es algo que no ocurre con el atún aleta azul (Thunnus orientalis) y la totoaba (Totoaba macdonaldi) que son peces meramente catádromos. Estudios posteriores sobre la interacción de la salinidad en la digestibilidad de macronutrientes y energía de la dieta en la tilapia hibrida roja permitirán optimizar su nutrición y cultivo en ambientes salinos.
La relación O:N es un indicador del sustrato principal que es utilizado por los organismos vía aeróbica para obtener energía, donde valores de 3 a 16 se asocian con el catabolismo de proteínas, valores de 16 a 60 se relacionan con el uso combinado de proteínas y lípidos como sustratos, y valores mayores que 60 se asocian con el predominio de lípidos como fuente de energía (Langenbuch y Pörtner 2002, Tseng y Hwang 2008). En este estudio los valores O:N obtenidos para la tilapia híbrida roja cultivada en agua de mar y en agua dulce sugieren un catabolismo combinado de proteínas y lípidos como sustratos de energía en ambos medios, lo cual denota que la diferencia de salinidad no presentó un efecto significativo en el tipo de sustrato metabólico utilizado como fuente principal de energía. Este comportamiento es semejante al registrado para Sphoeroides annulatus. Esta especie fue sometida a una variación de salinidad de 31 y no se observó una diferencia significativa en la relación atómica O:N y en su principal fuente de energía metabólica (Pérez-Robles et al. 2012).
La tilapia hibrida roja (O. mossambicus × O. aureus) es considerada que tiene alto potencial para su cultivo en ambiente marino, por su tolerancia a alta salinidad, adaptación al confinamiento con supervivencia elevada y crecimiento acelerado, así como por características sensoriales atractivas como la coloración similar a la del pargo y el buen sabor de su carne (Fraga et al. 2012). Los resultados del presente estudio indican que es factible cultivar esta especie híbrida en agua de mar con un desempeño en crecimiento similar al que se obtiene en agua dulce. Lo anterior denota la capacidad de la tilapia híbrida roja para adaptarse y desarrollarse en el medio marino, lo cual puede contribuir a ampliar su forma de producción.











 texto en
texto en 



