Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de fitopatología
versión On-line ISSN 2007-8080versión impresa ISSN 0185-3309
Rev. mex. fitopatol vol.41 no.1 Texcoco ene. 2023 Epub 11-Ago-2023
https://doi.org/10.18781/r.mex.fit.2207-3
Notas Fitopatológicas
Mezcla de extracto alcohólico de clavo (Sysygium aromaticum) y ajo (Allium sativum) en el control de la Sigatoka negra en plátano ‵Macho′
1 Instituto de Biociencias, Universidad Autónoma de Chiapas. Boulevard Príncipe Akishino S/N Col. Solidaridad 2000, Tapachula Chiapas, CP. 30798, México.
Bajo condiciones de campo se evaluó la incidencia y severidad de Sigatoka Negra (SN) en plátano ‵Macho′, asperjado con la mezcla del extracto alcohólico de clavo (36 µgclavo mL-1) - ajo (150 µgajo mL-1). Tres tratamientos fueron establecidos: aplicación cada 7 días (T1), cada 14 días (T2) y sin mezcla o control (T3). Las plantas utilizadas tenían 3 meses de edad y el trabajo concluyó, posteriormente, a los 238 días. La incidencia y severidad de la SN, el número total de hojas, la hoja más joven sin SN y el tiempo a florecimiento se determinaron cada 14 día. En relación al T3, las plantas del T1 tuvieron 20.5 y 25.3% menos incidencia y severidad de SN y, las del T2, 11.4 y 22.6% menos. El número de hojas totales fue 9.3, 8.8 y 8.5 y la hoja más joven con SN fue 7.2, 6.4 y 5.6 para T1, T2 y T3, respectivamente. Los días a florecimiento fueron 140 para T1 y 182 para T2. Los resultados muestran el potencial de la mezcla de los extractos alcohólicos de ajo y clavo como alternativa para el control de la SN.
Palabras clave: Pseudocercospora fijiensis; incidencia; severidad; extractos de plantas
The incidence and severity of the Black Sigatoka (BS) was assessed in plantain plants “Macho” variety, sprayed with a mixture of alcoholic extracts of clove (36 µgclove mL-1) and garlic (150 µggarlic mL-1) under field conditions. Three treatments were evaluated: foliar application every 7 days (T1), every 14 days (T2) and without extracts or control (T3). Initially, the experimental plants were 3 months-old and the experiment concluded 238 days later. Every 14 days the incidence and severity of BS, the total number of leaves, the youngest leaf without symptoms and the time to flowering were measured. In relation to the plants of T3, the weighted average incidence and severity of BS were lower by 20.5 and 25.3% for T1 and 11.4 and 22.6% for T2, respectively. The average of total leaves was, 9.3, 8.8 and 8.5 and the youngest leaf with disease symptoms were 7.2, 6.4 and 5.6 for T1, T2 and T3, respectively. The days to flowering after the beginning of the experiment were 140 for T1 and 182 for T2. The results show the potential of using the alcoholic extracts of garlic and clove as an alternative for the control of the BS.
Keywords Pseudocercospora fijiensis; incidence; severity; plant extracts
La Sigatoka Negra (SN) es una enfermedad provocada por el hongo Pseudocercospora fijiensis. Esta enfermedad está presente en las plantaciones de plátano y banano de todo el mundo y puede causar la perdida total de la cosecha (Marín et al., 2003). La reducción del área fotosintética es la razón por la cual P. fijiensis resulta tan dañino (Hidalgo et al., 2006).
El control convencional de la SN se basa en prácticas culturales y en la aplicación de fungicidas químicos. La primera consiste, primordialmente, en cortar periódicamente las secciones de hojas con presencia de lesiones avanzadas de la enfermedad, concluyendo con la eliminación total de la hoja. La segunda se realiza mediante la aplicación alternada, o en mezcla, de fungicidas protectores y sistémicos (Orozco-Santos et al., 2008). Estos últimos, aunque eficaces, son contaminantes del ambiente (Geissen et al., 2010) y cada vez se utilizan con más frecuencia (Martínez y Guzmán, 2010). Por esta última razón el control de SN representa entre el 35 - 45% del costo de producción del fruto (Garrido-Ramírez et al., 2011).
Una alternativa de control de SN es el uso de productos biológicos, entre los que se encuentran tanto microorganismos antagónicos y sus metabolitos, como extractos de plantas (Okigbo y Emoghene, 2003). En laboratorio, los extractos de Commelina difusa (canutillo), Momordica charantia (melón amargo), Pavonia spp. (flor de tigre), Plenax sp., Piper hispidum (cigarrillo), Pelargonium peltatum (geranio hiedra), Sida rhombifolia (escobilla), Sysygium aromaticum (clavo) y Topobea discolor (amarraboyo), inhibieron la germinación de esporas y el crecimiento de la colonia de P. fijiensis (Mosquera et al., 2009; Riveros y Arciniegas, 2003).
A escala de casa sombra Vargas et al. (2009) evaluaron los extractos etanólicos de hojas de Heliotropium indicum (cola de mico), Lippia origanoides (orégano de México), Ricinus communis (higuerilla) y sus combinaciones, en plantas de plátano “Hartón” de tres meses de edad infectadas con P. fijiensis, encontrando que el menor valor del promedio ponderado de la infección, y la mayor posición de la hoja más joven enferma se obtuvo con H. indicum + R. communis, y el mayor número total de hojas se observó́ en el tratamiento con H. indicum + L. origanoides + R. communis. En banano clon Gran Enano de tres meses de edad e inoculados con conidios de P. fijiensis, Morales et al. (2011), encontraron que la aspersión cada 15 días de los extractos acuoso de cundeamor (Motorbike charantia), salvia (Salvia officinalis) y caña santa (Cymbopogon citratus) tuvieron una respuesta similar al tratamiento con Mancozeb.
Asimismo, la combinación de extracto alcohólicos de clavo (S. aromaticum) y ajo (Allium sativum), en concentraciones de 36 µg mL-1 y 150 µg mL-1, respectivamente, redujeron hasta 41% el desarrollo de la colonia de P. fijiensis (Adriano-Anaya et al., 2018). Por lo anterior el objetivo de este trabajo fue evaluar la incidencia y severidad de Sigatoka Negra en plantas de plátano ‵Macho′, asperjadas con la mezcla del extracto alcohólico de clavo - ajo, bajo condiciones de campo.
El trabajo se realizó en la Estancia Agroecológica “AYOL” de Tapachula, Chiapas (14°49’44.7”N 92°17’48.5”W; 76 msnm; clima cálido húmedo con abundantes lluvias en verano), durante el periodo de septiembre del 2018 a mayo del 2019. Las plantas empleadas fueron hijuelos tipo “espada” de plátano ‵Macho′ de tres meses de edad (1.0-1.2 m de altura) sembradas en parcelas de 100 m2 (20 plantas por surco y tres surcos) con distancias de 1.5 m entre plantas y 2.0 m entre surcos. Todas las plantas fueron fertilizadas bimestralmente con compost (25 kg planta-1) y semanalmente con biol (4 L planta-1). Los brotes (hijuelos) no útiles se eliminaron cada dos meses y la flora acompañante fue sometida a poda mecánica cada 28 días. Cuando así fue requerido, las plantas fueron hidratadas con agua de pozo.
Para establecer el efecto de la aplicación de la mezcla de los extractos de ajo (150 µg mL-1) y de clavo (36 µg mL-1) se establecieron tres tratamientos (parcelas) en función de la frecuencia de aplicación: Tratamiento 1 (T1) aplicación cada 7 días, Tratamiento 2 (T2) aplicación cada 14 días y Tratamiento 3 (T3), o control, aplicación de una solución de alcohol en agua. Todas las soluciones utilizaron jabón comercial como adherente. La aplicación de los tratamientos (aspersor manual Truper de 5 L) fue realizada entre las 07:30 h a 08:30 h en el haz y el envés de las hojas hasta punto de rocío.
El extracto de ajo se preparó triturando 45 g del material, el cual posteriormente fue sometido a extracción por reflujo (seis ciclos) con 200 mL de etanol al 60% a temperatura de 80 °C en un equipo Soxhlet. El extracto se almacenó en recipiente de vidrio opaco y se mantuvo a temperatura ambiente hasta su empleo (máximo un mes). El extracto de clavo se preparó triturando 100 g del aromático el cual, posteriormente fue homogeneizado en 1 L de etanol (96%) contenido en un recipiente opaco. El homogeneizado se mantuvo a temperatura ambiente por 28 días, durante los cuales fue agitado, manualmente, cada tercer día. Al concluir el tiempo de extracción, el homogeneizado se filtró (Wathman no 1) y se dejó a temperatura ambiente hasta su uso (máximo dos meses). La concentración de solidos solubles totales de cada extracto se determinó, mediante evaporación (70 °C) de 10 mL, en una termo-balanza (Oahus BL-MB23).
Cada 14 días, y antes de aplicar la mezcla de extractos, en todas las plantas se determinó el número total de hojas (HT), el promedio ponderado de incidencia de SN (ISN), el promedio ponderado de la severidad de SN (SSN), la hoja más joven libre de síntomas de SN (HMJ0) y el tiempo a florecimiento. En hojas con síntomas de SN el grado (G) de severidad fue determinado con la escala de Stover modificada por Gauhl (1989); cuando la hoja mostró grado y o 6 (G5-6), se eliminó de la planta. El ISN fue calculado mediante el cociente entre las hojas con síntomas de SN dividido entre las hojas totales [ISN = (HSSN) (HT)-1]. El SSN fue calculada mediante la sumatoria de la multiplicación del número de hojas (Nn) por el grado de la enfermedad (G0-6) dividida entre 100 [SSN = ∑ [(G0H0) + (G1H1) + … (G6H6)] (100)-1]. Todos los datos fueron sometidos al análisis de varianza y donde se encontró diferencias se aplicó la prueba de Duncan a p> 0.05, empleando el programa InfoStat Profesional Ver. 2018.Tomando en consideración que las plantas de plátano ya no emiten hojas después del florecimiento, los resultados de las variables analizadas fueron descritos y discutidos con dicho marco de referencia.
En la Figura 1, se muestra la dinámica del florecimiento de las plantas de plátano ‘Macho’ empleadas en los diferentes tratamientos de este trabajo. Como se puede observar las plantas del T1 iniciaron el florecimiento a los 140 días después de iniciado el trabajo (DDIT), las del T2 a los 182 días, y ninguna planta del T3 emitió flor durante el periodo de estudio. La cantidad máxima de plantas florecidas (~80%) en T1 y T2 fue alcanzado, respectivamente, a los 196 y 224 DDIT. La observada inducción del florecimiento de las plantas (Figura 1) asperjadas con los extractos de clavo y ajo, puede estar relacionada con los componentes de dichos extractos, ya que ninguna de las plantas del tratamiento control floreció durante el tiempo del trabajo. Así mismo, los resultados de florecimiento orientan a pensar que es necesario alcanzar una concentración crítica para la inducción ya que las plantas asperjadas cada 14 días se “retrasaron” 42 días respecto a las plantas asperjadas cada 7 días. La inducción del florecimiento por el asperjado de extractos de plantas es un fenómeno no reportado en la literatura cuando se han empleado extractos de plantas para el control de la SN (Vargas et al., 2009; Thangavelu et al., 2013; Kumakech et al., 2017) y la posible razón pudiera ser que en general los extractos fueron asperjados con menor frecuencia a la empleada en este trabajo.
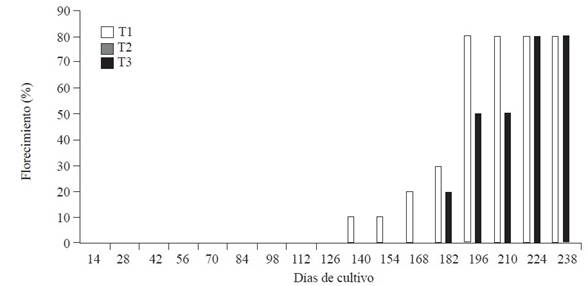
Figura 1 Dinámica de florecimiento de plantas de plátano “Macho” sometidas a los tratamientos de control de Sigatoka Negra con una mezcla de extractos de clavo y ajo. T1: mezcla aplicada cada 7 días, T2: mezcla aplicada cada 14 días y T3: plantas control.
Durante todo el tiempo del estudio, las plantas de T1 y T2 tuvieron, respecto a T3, mayor cantidad de HT, situación que se repite cuando se comparan las HT hasta antes del inicio del florecimiento y después de iniciado dicho proceso (Cuadro 1). Las diferencias encontradas fueron estadísticamente significativas (Duncan a=0.05; EE =0.17, 0.15 y 0.12 para T1, T2 y T3, respectivamente). La significativa diferencia entre los tratamientos puede asociarse al daño provocado por la enfermedad, ya que siempre fueron eliminadas las hojas con G6. Por lo tanto, cuantas más hojas en la planta, mayor sanidad de la plantación.
Cuadro 1 Promedio de hojas totales en plantas de plátano “Macho” cultivado con control de Sigatoka Negra basado en una mezcla de extracto alcohólico de ajo y clavo aplicada cada 7 días (1), 14 días (2) y plantas control (3).
| Tratamiento | Todo el tiempo | 126 días después de iniciado el trabajo | Después de iniciado el florecimiento |
|---|---|---|---|
| 1 | 9.25 A | 8.01 AB | 10.63 A |
| 2 | 8.78 B | 8.30 A | 9.34 B |
| 3 | 8.54 C | 7.75 B | 8.54 C |
Por su parte el ISN (Cuadro 2) en las plantas con aplicación de la mezcla de extractos cada 7 días (T1) y con aplicación de extractos cada 14 días, fue 20.5 y 13.0% menor respecto a las plantas donde no se aplicaron dichos extractos (T3). Las diferencias encontradas fueron estadísticamente significativas (Duncan a=0.05; EE = 0.01, 0.01 y 0.01 para T1, T2 y T3). La reducción en la ISN, en estudios de campo, escasamente es reportada, sin embargo, Kumakech et al. (2017) encontraron 34.8% de disminución en el número de lesiones en vitroplantas de plátanos de las variedades Mpologoma, Mbwazirume y Kibuzi asperjadas con extracto acuoso de Azadirachta indica.
Cuadro 2 Promedio ponderado de la incidencia de Sigatoka Negra en plantas de plátano “Macho” tratadas con una mezcla de extracto alcohólico de ajo y clavo aplicada cada 7 días (1), 14 días (2) y plantas control (3).
| Tratamiento | Todo el tiempo | 126 días después de iniciado el trabajo | Después de iniciado el florecimiento |
|---|---|---|---|
| 1 | 0.35 C | 0.36 C | 0.35 C |
| 2 | 0.39 B | 0.40 B | 0.40 B |
| 3 | 0.44 A | 0.46 A | 0.44 A |
Por otro lado, el SSN en las plantas del T3 fue 25.3 y 11.6% mayor respecto a las plantas con frecuencia de aplicación de 7 y 14 días respectivamente (Cuadro 3). Las diferencias encontradas fueron estadísticamente significativas (Duncan a=0.05; EE = 0.02, 0.03 y 0.03 para T1, T2 y T3). La reducción de SSN observada fue inferior a lo reportado por Deshmukh et al. (2018), quienes encontraron promedios de reducción de 72.8% utilizando extractos acuosos de Datura ferox (toloache), Azadirachta indica (neem), Parthenium hyster (yerba de asma) y Allium sativum (ajo) y a lo reportado por Thangavelu et al. (2013) quienes encontraron 55% de reducción con extracto acuoso de hojas de zimmu (Allium cepa x Allium sativum), ambos en plantas de banano clon Gran Enano. Sin embargo, estos últimos trabajos fueron realizados bajo condiciones de casa sombra donde el contacto con la “atmósfera” de conidios de P. fijiensis es limitado. Así mismo, los resultados de SSN, con la aplicación de los extractos de ajo y clavo de este trabajo (0.45 - 0.98), fueron mejores a los reportados por Vargas et al. (2009) quienes emplearon extractos etanólicos de hojas secas de Ricinus communis (higuerilla), Heliotropium indicum (heliotropo indio) y Lippia origanoides (oregano de monte) en plátano Musa AAB cv. Hartón, y cuyos valores estuvieron entre 1.84 - 3.15.
Cuadro 3 Promedio ponderado de la severidad de Sigatoka Negra en plantas de plátano “Macho” tratadas con una mezcla de extracto alcohólico de ajo y clavo aplicada cada 7 días (1), 14 días (2) y plantas control (3).
| Tratamiento | Todo el tiempo | 126 días después de iniciado el trabajo | Después de iniciado el florecimiento |
|---|---|---|---|
| 1 | 0.71 C | 0.74 C | 0.67 C |
| 2 | 0.84 B | 0.85 B | 0.78 B |
| 3 | 0.95 A | 0.97 A | 0.95 A |
Finalmente, los valores de la HMJ0 se muestran en el Cuadro 4. Durante todo el tiempo que duró el trabajo las plantas del T1 tuvieron, en promedio, 1.57 hojas más sanas que las plantas control (T3) es decir, los síntomas de SN fueron observables en hojas de mayor edad (hojas más “bajas”). La cantidad de hojas libres de síntomas de SN en las plantas donde se aplicó la mezcla de los extractos de ajo y clavo se incrementó, respecto a las plantas control, después de iniciado el florecimiento. Las diferencias encontradas fueron estadísticamente significativas (Duncan a=0.05; EE = 0.15, 0.14 y 0.11 para T1, T2 y T3).
Cuadro 4 Promedio de la hoja más joven libre de síntomas de Sigatoka Negra en plantas de plátano “Macho” tratadas con una mezcla de extracto alcohólico de ajo y clavo aplicada cada 7 días (1), 14 días (2) y plantas control (3).
| Tratamiento | Todo el tiempo | 126 días después de iniciado el trabajo | Después de iniciado el florecimiento |
|---|---|---|---|
| 1 | 7.16 A | 6.29 A | 8.00 A |
| 2 | 6.38 B | 5.86 B | 7.33 B |
| 3 | 5.59 C | 5.16 C | 5.70 C |
La HMJ0 en las plantas control de este trabajo fue similar a lo reportado por Torrado-Jaime y Castaño-Zapata (2018) para plátano de las variedades Dominico Hartón, África, FHIA 20 y FHIA 21 y menor que lo reportado por Thangavelu et al. (2013) para banano clon ‘Gran Enano’ (hoja más joven enferma 7.6). Sin embargo, la HMJ0 en las plantas con aplicación de la mezcla de los extractos cada 7 días y cada 14 días (Cuadro 4), fue mejor a lo reportado por Vargas et al. (2009) quienes reportaron la hoja más joven sin síntomas de SN entre 1.42 y 3.75 cuando asperjaron en plantas de plátano (Musa AAB cv. Hartón) extractos etanólicos de hojas de R. communis, H. indicum y L. origanoides; aunque menor a lo reportado por Thangavelu et al. (2013) para banano clon ‵Gran Enano′ asperjado con extracto de zimmu.
En conclusión, la aplicación cada 7 o 14 días de la combinación de extractos alcohólicos de clavo y ajo (36 y 150 µg mL-1) tuvo la capacidad para controlar la SN e inducir el florecimiento en plátano “Macho”, bajo condiciones de campo.
Cited literature
Adriano-Anaya ML, Mejía-Ortiz J, Ovando-Medina I, Albores-Flores V y Salvador-Figueroa M. 2018. Efecto de extractos alcohólicos de ajo (Allium sativum) y clavo (Syzygium aromaticum) en el desarrollo de Mycosphaerella fijiensis Morelet. Revista Mexicana de Fitopatología 36: 379-393. https://doi.org/10.18781/R.MEX.FIT.1805-2 [ Links ]
Deshmukh R, Dhutraj SV and Damodhar VP. 2018. Field evaluation of bio-control agent and phyto-extract against intensity of Sigatoka leaf spot and yield of banana cv. Ardhapuri. International Journal of Current Microbiology and Applied Sciences. Special Issue-6: 101- 104. ISSN 2319-7706. https://www.ijcmas.com [ Links ]
Garrido-Ramírez ER, Hernández-Gómez E y Noriega-Cantú DH. 2011. Manual de producción de banano para la región del Soconusco. Estrategias para el manejo de la Sigatoka Negra. Folleto Para Productores N° 10. Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias. Centro de Investigación Regional Pacífico Sur. Campo Experimental Centro de Chiapas, Ocozocoautla de Espinosa, Chiapas, México. 35p. [ Links ]
Gauhl F. 1989. Untersuchunge zurepidemiologie un okoloigie de Schuwargen sigatoka krankheit (Mycosphaerella fijiensis Morelet) an kockbonanen (Musa sp.) in Costa Rica. Thesis. Univ. Gottingen (West Germany), 128 p. [ Links ]
Geissen V, Ramos FQ, de JB-BP, Diaz-Gonzalez G, Bello-Mendoza R, Huerta-Lwanga E and Ruiz-Suarez LE. 2010. Soil and water pollution in a banana production region in tropical Mexico. Bulletin of Environmental Contamination and Toxicology. 85:407-413. https://doi.org/10.1007/s00128-010-0077-y [ Links ]
Hidalgo M, Tapia A, Rodríguez W y Serrano E. 2006. Efecto de la Sigatoka Negra (Mycosphaerella fijiensis) sobre la fotosíntesis y transpiración foliar del banano (Musa sp. AAA, cv. Valery). Agronomía Costarricense 30: 35-41. ISSN 0377-9424. https://revistas.ucr.ac.cr [ Links ]
Kumakech A, Jørgensen H JL, Collinge DB, Edema R y Okori P. 2017. Azadirachta indica reduces Black Sigatoka in east African highland banana by direct antimicrobial effects against Mycosphaerella fijiensis without inducing resistance. Journal of Agricultural Science 9: 61-76. https://doi.org/10.5539/jas.v9n4p61. [ Links ]
Marín DH, Romero RA, Guzmán M and Sutton TB. 2003. Black sigatoka: an increasing threat to banana cultivation. Plant Disease 87:208-222. https://doi.org/10.1094/PDIS.2003.87.3.208 [ Links ]
Martínez I y Guzmán M. 2010. Sensibilidad de Mycosphaerella fijiensis a fungicidas. Pags. 227-238. In: Informe Anual 2009, Dirección de Investigaciones CORBANA (Corporación Bananera Nacional, CR). San José, CR. [ Links ]
Morales LM, Ullauri MA y Rojas X. 2011. Evaluación del efecto de extractos vegetales como alternativa de manejo a la Sigatoka Negra en el cultivar Gran Enano (AAA). Centro Agrícola 38(2): 77-84. http://cagricola.uclv.edu.cu. [ Links ]
Mosquera OP, Echeverry LM y Niño J. 2009. Evaluación de la actividad antifúngica de extractos vegetales sobre el hongo Mycospharella fijiensis Morelet. Scientia et Technica 41: 232 - 236. ISSN 0122-1701. http://www.redalyc.org/articulo.oa?id=84916680041 [ Links ]
Okigbo RN y Emoghene AO. 2003 Antifungal activity of leaf extracts of some plant species on Mycosphaerella fijiensis Morelet, the causal organism of Black Sigatoka disease in banana (Musa acuminata). Nigerian Journal of Plant Protection. 20: 101-110. https://www.scirp.org [ Links ]
Orozco-Santos M, Orozco-Romero J, Pérez-Zamora O, Manzo-Sánchez G, Farías-Larios J y da Silva-Morales W. 2008. Prácticas culturales para el manejo de la sigatoka negra en bananos y plátanos. Tropical Plant Pathology 33:189-196. https://doi.org/10.1590/S1982-56762008000300003 [ Links ]
Riveros AS y Arciniegas AM. 2003. Productos naturales como biofungicidas e inductores de resistencia para el manejo de la Sigatoka negra. Pags. 31-32. In: Manejo convencional y alternativo de la Sigatoka negra, nematodos y otras plagas asociadas al cultivo de Musáceas. Actas del Taller Manejo convencional y alternativo de la Sigatoka negra, nematodos y otras plagas asociadas al cultivo de Musáceas. INIBAP, Montpellier. Guayaquil, EC. [ Links ]
Thangavelu R, Ganga Devi P, Gopi M and Mustaffa MM. 2013. Management of Eumusae leaf spot disease of banana caused by Mycosphaerella eumusae with Zimmu (Allium sativum x Allium cepa) leaf extract. Crop Protection 46: 100-105. https://doi.org/10.1016/j.cropro.2012.12.022 [ Links ]
Torrado-Jaime M y Castaño-Zapata J. 2018. Incidencia y severidad de las sigatokas negra (Mycosphaerella fijiensis Morelet) y amarilla (Mycosphaerella musicola Leach et Mulder) del plátano según los estados fenológicos. Agronomía Colombiana 26: 435-442. ISSN 0120-9965. http://www.scielo.org.co/ [ Links ]
Vargas JL, Rodríguez D, Sanabria ME y Hernández J. 2009. Efecto de tres extractos vegetales sobre la Sigatoka negra del plátano (Musa AAB cv. Hartón). Revista UDO Agrícola. 9: 182-190. https://www.researchgate.net/publication/47372025 [ Links ]
Recibido: 04 de Julio de 2022; Aprobado: 14 de Diciembre de 2022











 texto en
texto en 


