Dentro del complejo de enfermedades que atacan al cultivo de café, la roya (Hemileia vastatrix Berk. and Broome) es de las de mayor importancia económica, puede ocasionar pérdidas de producción superiores a 50% (Haddad et al., 2009; Suresh et al., 2012). El brote más perjudicial de roya en Centroamérica ocurrió en el ciclo 2012-2013, cuando las pérdidas estimadas fueron superiores a US$499 millones, razón por la cual varios países consideraron el hecho como una emergencia nacional (Promecafe e IICA, 2013).
Cuando un organismo micoparásito se encuentra regulando a un fitopatógeno de manera natural, debe ser aislado y evaluado como agente de control (Campbell, 1990). Tal es el caso del hongo, con apariencia algodonosa, que frecuentemente aparece parasitando a la roya del café y el cual es citado como Lecanicillium lecanii Zimm. (Monzón, 1992; Canjura et al., 2002; Vandermeer et al., 2009; Rivillas, 2015; Pérez, 2015). Recientemente se ha demostrado que, en cafetales de la región de Turrialba, Cartago, Costa Rica, el principal enemigo natural de H. vastatrix es el hongo Simplicillium Gams and Zare (García, 2018), taxón relacionado con Lecanicillium (Zare y Gams, 2001). Así pues, una vez realizada la correcta identificación es necesario la evaluación in vitro para seleccionar cepas de mayor virulencia hacia H. vastatrix.
Estudios previos han demostrado que el control biológico de H. vastatrix puede ser una técnica factible y ambientalmente segura para el control de la enfermedad; Monzón (1992) al evaluar Verticillium Nees para el control de la roya a nivel de laboratorio demostró que la germinación de uredosporas se ve reducida. Vélez y Rosillo (1995), también con aplicaciones de una cepa de V. lecanii (= Lecanicillium) registraron un retraso en el periodo de incubación de H. vastatrix y en la reducción de la incidencia total de la enfermedad por planta. Por su parte, Haddad et al., (2009) documentaron el uso de bacterias como una técnica promisoria para el control biológico de H. vastatrix.
Actualmente, el manejo de la roya en Costa Rica está enfocado en el uso de fungicidas protectantes (a base de cobre) y fungicidas sistémicos pertenecientes a la familia de los triazoles principalmente (los efectos indeseables de estas acciones de manejo son bien conocidos), además de prácticas culturales como la poda, el manejo de la sombra y el uso de variedades resistentes (Avelino et al., 2004; Barquero, 2013). Si bien el uso de variedades resistentes es una práctica promisoria para mitigar la enfermedad, la variedad genética de la roya disminuye el tiempo de resistencia inicial (Gouveia et al., 2005). Como contraparte, existen enemigos naturales de H. vastatrix que regulan su incidencia y severidad (Guharay et al., 2001); como por ejemplo, los hongos L. lecanii y Cladosporium hemileiae (=Digitopodium hemileiae Steyaert). También es común encontrar larvas de Mycodiplosis Rüb. alimentándose de pústulas de roya (Virginio Filho, 2017). Desafortunadamente la información sobre prácticas de control biológico aplicado para controlar la roya del café en Costa Rica es limitada.
El estudio tuvo por objetivo aislar y comparar cepas locales y comerciales de Simplicillium y Lecanicillium contra la roya del café.
Materiales y métodos
Aislamiento e identificación de cepas locales y comerciales. El estudio comprendió ocho cepas de hongos, cinco fueron aisladas de pústulas de roya en la zona cafetalera de Turrialba, Cartago, Costa Rica en las localidades de San Juan Norte (SJ), Jabillos (JV), Aquiares (AQ), Santa Rosa (SR) y CATIE (EC); también, se incluyó una variante de esta última cepa después de haber sido conservada durante un mes por el método de papel filtro (Morales, 2008), con la finalidad de observar pérdida de virulencia debida al sometimiento de deshidratación al final del proceso (codificada como EC1). Las parcelas donde se hicieron las colectas se encuentran entre los 600 a 950 msnm, la temperatura promedio registrada en el área de estudio durante los últimos años ha sido de 22.4 °C y 90.6% de humedad relativa. Todas las parcelas estaban plantadas con café arábica variedad Caturra con una densidad de 5000 plantas/ha bajo sombra
Las tres cepas restantes (INA, C1 y C2) corresponden a productos recomendados para combatir la roya en cafetales de Costa Rica. INA proviene de un centro de capacitación y transferencia de tecnología, esta cepa se reproduce de manera artesanal utilizando como sustrato arroz. C1 también fue producida con el mismo sustrato, pero a diferencia del anterior, esta contaba con empaque y etiquetado para su venta. C2 es un producto comercial cuya formulación era polvo humectable.
Colonias monospóricas de las diferentes cepas fueron enviadas al Laboratorio de Biología Molecular de la Corporación Bananera Nacional de Costa Rica (Corbana). Para la secuenciación de las muestras se realizó la extracción del material genético según el protocolo descrito por Kuske et al. (1998) con modificaciones hechas por Corbana, seguido de una amplificación de la región ITS. Los iniciadores utilizados para dicha amplificación fueron ITS1 e ITS4; la corroboración de la amplificación se hizo en un gel al 1% de agarosa. El producto de la amplificación se envió a la empresa Macrogen Inc. para su purificación y secuenciación. Una vez generadas las secuencias se editaron con el programa BioEdit y se compararon en la base de datos de NCBI (National Center for Biotechnology Information). Los organismos identificados para cada producto se enlistan en el Cuadro 1. Las cepas se encuentran resguardadas en el Laboratorio de Control Microbial del Centro Agronómico Tropical de Investigación y Enseñanza (CATIE).
Cuadro 1 Organismos identificados en cepas locales y co merciales.
| Cepa | Organismos coincidentes NCBI |
|---|---|
| EC | Simplicillium lanosoniveum |
| AQ | Simplicillium lanosoniveum |
| SR | Simplicillium lanosoniveum |
| SJ | Simplicillium lanosoniveum |
| JV | Simplicillium lanosoniveum |
| INA | Simplicillium lanosoniveum |
| C1 | Lecanicillium attenuatum |
| C2y | Lecanicillium sp. |
y Identificación hecha en base a las claves taxonómicas pro puestas por Zare y Gams (2001) / y Identification performed based on the taxonomic codes proposed by Zare and Gams (2001).
Colecta de pústulas de roya y preparación de discos de hoja. Inicialmente se hicieron colectas de hojas de café variedad Caturra completamente desarrolladas y con presencia de pústulas de roya en sus diferentes estados de desarrollo y sin presencia de hongos micoparásitos; posteriormente las hojas fueron llevadas a laboratorio en donde con la ayuda de un sacabocado de 1.8 cm de diámetro, se extrajeron discos de hoja conteniendo pústulas de roya con lesiones recién esporuladas de color naranja intenso (estado intermedio) y lesiones completamente desarrolladas con apariencia naranja pálido (estado avanzado). Una vez hechos los discos de hoja se colocaron en placas multipozos CELLSTAR(R) de seis cavidades donde previamente a cada cavidad se le agregaron 5 mL de agua destilada estéril (ADE) y sobre esta un disco de Foam de 2.5 cm de diámetro. Finalmente, los discos de hoja quedaron sobre los discos de Foam flotando en ADE (Figura 1). Previamente se inocularon con una suspensión de esporas de las diferentes cepas como se describe en el siguiente apartado.

Figura 1 Discos de hoja con pústulas de roya en estado avanzado e inoculados con la cepa CATIE: A) dos días después de la inoculación; B) tres días después de la inoculación y C) cuatro días después de la inoculación.
Método y dosis de aplicación. Cajas Petri con colonias monospóricas de 15 días de edad de las diferentes cepas fueron inundadas con ADE, seguido de un raspado con una espátula Drigalsky hasta separar completamente el micelio del medio de cultivo. El sobrenadante obtenido fue recuperado en viales de vidrio, los cuales se colocaron en baño ultrasonido por tres minutos y luego se agitó en un vortex durante un minuto. Posteriormente se hizo un filtrado para separar conidios de micelio. Después, se hicieron diluciones seriadas en ADE mas TweenR 80 a 0.1% hasta obtener concentraciones que permitieran un conteo de esporas con la cámara Neubauer. Una vez determinado el número de conidios contenido en la suspensión inicial, se ajustó a una concentración final de 1x107 conidios/mL.
La cepa C2 venía en una presentación de polvo humectable, mientras que INA y C1 fueron producidas en arroz, de modo que para la estimación de la concentración de esporas primero se tomó un gramo de producto que fue suspendido en 10 mL de ADE, después se hizo una filtración para eliminar inertes de mayor tamaño; posteriormente se hicieron diluciones seriadas, conteo en cámara Neubauer y por último se ajustó a la misma dosis de las cepas locales en base al porcentaje de viabilidad de cada producto.
La inoculación de conidios sobre los discos de hoja con roya fue realizada con la ayuda de un atomizador DeVilbiss Modelo 15-RD. Se aplicó un volumen de 0.27 mL de la concentración final.
Una vez hecha la aplicación, se dejó pasar el tiempo necesario para que estos perdieran la humedad obtenida durante la inoculación para luego ser puestos en las placas multipozos como se describe en el apartado anterior.
Medición de la variable respuesta. La variable medida fue el porcentaje de colonización de las cepas sobre las pústulas de H. vastatrix. Las mediciones se hicieron cada 24 horas hasta siete días después de la inoculación. Para la estimación del porcentaje diario de colonización fue necesario tomar fotografías diarias individuales a cada disco de hoja (Figura 1) para después hacer un procesamiento con el cambio de colores utilizando el programa ImageJ 1.47v (Rasband, 2016). Inicialmente, se seleccionó y midió el área ocupada por la lesión de roya. Después, se ajustó el umbral de color de manera tal que la coloración blanquecina debida a la colonización de Simplicillium sobre las pústulas quedará claramente definida. Finalmente, el porcentaje de colonización se calculó dividiendo el área cubierta por Simplicillium entre el área total de la lesión y el resultado multiplicado por 100.
Diseño y análisis estadístico. El experimento tuvo 10 repeticiones cada una de las cuales consistió de dos placas multipozos. Cada placa contenía seis discos de un mismo estado de desarrollo de la roya (intermedio o avanzado); cinco de estos discos fueron inoculados, cada uno con una cepa diferente, de manera tal que un sexto disco fue usado como testigo sin inoculación. El análisis fue hecho mediante Modelos Lineales Generales y Mixtos con el paquete estadístico Infostat (Di Rienzo et al., 2016). Se ajustaron curvas de crecimiento utilizando modelos no lineales mixtos; el modelo que describió mejor las curvas de crecimiento fue elegido utilizando los criterios AIC y BIC. Finalmente, se hizo un ANOVA y prueba de separación de medias (LSD=0.05) para los coeficientes Beta (incremento en porcentaje de colonización).
Resultados
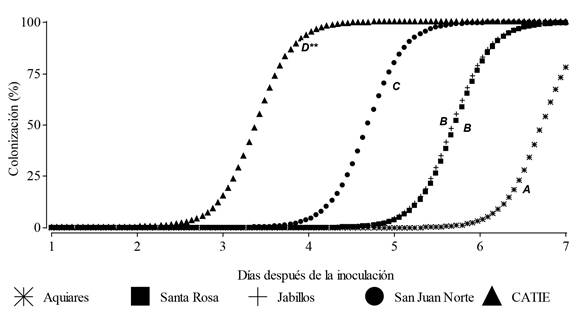
Bioensayos de cepas locales contra H. vastatrix. El análisis estadístico muestra una diferencia altamente significativa entre las cepas evaluadas (F4,81=44.58, p˂ 0.0001). El avance en porcentaje de colonización de cepas tuvo un comportamiento similar en ambas etapas evaluadas; es decir, no se observó diferencia estadística para estado de desarrollo de la roya (F1,81=2.73, p=0.1025). La cepa EC mostró ser la más efectiva, al colonizar en menor tiempo las pústulas de roya, seguida de la cepa SJ; en tercer lugar en grado de efectividad estuvieron las cepas SR y JV, cuyos valores no difirieron estadísticamente (LSD=0.05). La cepa AQ mostró un menor desempeño respecto a las demás (Figura 2).
Bioensayos de cepas comerciales contra H. vastatrix. Al hacer la comparación de cepas comerciales y la mejor cepa local seleccionada en el ensayo anterior, se observó una diferencia estadística altamente significativa (F4,81=76.55, p˂0.0001). Al igual que en el experimento anterior, la variable evaluada no difirió estadísticamente en los estados de desarrollo de pústulas de roya (F1,81=5.06, p=0.0272. Los porcentajes más altos de colonización en menor tiempo se dieron en la cepa EC, esta misma cepa (EC1), después de ser almacenada mediante el método de papel filtro, no sufrió pérdida de virulencia. En segundo lugar de eficacia estuvo INA y, finalmente, y con un desempeño muy pobre las cepas comerciales C2 y C1 (Figura 3).
Discusión
Estos son los primeros resultados que anteponen y miden el efecto de Simplicillium como el principal agente de control biológico de H. vastatrix en Costa Rica. La mayoría de publicaciones referidas al control biológico de roya del cafeto son enfocadas al uso de Lecanicillium como controlador biológico (Esques et al., 1991; Monzón, 1992; Rivas et al., 1996; Canjura et al., 2002; Vandermeer et al., 2009; Jackson et al., 2012; Rivillas, 2015; Pérez, 2015). Esto debido en parte a que algunos estudios relacionados fueron hechos previo a la división del género Verticillium hecha por Zare y Gams (2001) y en otros casos no se cuenta con la identificación taxonómica o molecular de la cepa aislada y se llega a asumir que se trata de Lecanicillium por las características morfológicas que ambos géneros comparten (Lim et al., 2014). Estudios hechos en la misma región donde se aisló la cepa CATIE mencionan que Lecanicillium puede llegar a parasitar de manera natural pústulas de roya en niveles cercanos a 9% de manera natural en plantaciones de café bajo sombra (Pico 2014). Por su parte, Canjura et al., (2002) evaluaron diferentes cepas de Verticillium aisladas en la misma región aplicadas en plantas en invernadero, no encontrando diferencias en la incidencia de pústulas de roya, estos autores registraron un parasitismo natural de 10.5%. Monzón (1992) encontró que aplicaciones de Verticillium pueden reducir la germinación de uredosporas en 60%. Otros estudios han demostrado que la presencia de Verticillium psalliotae sobre hojas de café, disminuye la severidad de daño ocasionado por la roya. También, la germinación de uredosporas fue afectada de manera significativa cuando estás fueron puestas en contacto con conidios del micoparásito (Mahfud et al., 2006).

**Medias con misma letra no difieren estadísticamente (LSD=0.05)
(C2: comercial; C1: comercial; INA: artesanal; EC1: CATIE almacenada; EC: CATIE)
Figura 3 Eficacia de cepas comerciales en la colonización de pústulas de H. vastatrix
Los resultados aquí obtenidos indican un mayor grado de especificidad de los aislamientos locales, los cuales corresponden a S. lanosoniveum en comparación de las cepas comerciales evaluadas. Una observación relevante es que la cepa INA, la cual se obtuvo del Instituto Nacional de Aprendizaje de Costa Rica, según los análisis para su identificación corresponde al género Simplicillium, al igual que las cepas locales; esta cepa fue segunda en eficacia después de EC y EC1, lo cual viene a reforzar lo anteriormente dicho. Se infiere lo anterior ya que la cepa C1 (L. attenuatum) y la cepa C2 (Lecanicillium sp.) no fueron capaces de colonizar completamente, incluso no lograron alcanzar un 50%. Nuestros resultados coinciden con estudios similares hechos en México por Gómez et al., (2017), quienes después de aislar y evaluar el efecto de control de diferentes cepas de hongos micoparásitos en pústulas de roya, determinaron que el hongo Simplicillium ofrece un 88.86 % de parasitismo en 120 h después de la inoculación, mientras que Lecanicillium en este mismo tiempo alcanzó 68.1 %.
Es importante señalar que las cepas comerciales C1 y C2 presentaron valores bajos de pureza y viabilidad (datos no presentados) y aún cuando la dosis se ajustó acorde a ello, es probable también la pérdida de virulencia debida al proceso de producción y formulación, por lo que es necesaria una evaluación constante de la calidad de los biofungicidas destinados al manejo de H. vastatrix en Costa Rica. Además de las pruebas de pureza, concentración y viabilidad, los formuladores de bioplaguicidas deben contar con pruebas rutinarias de efectividad hacia el organismo objetivo, sobre todo al final del proceso de formulación.
En base a lo expuesto anteriormente, es conveniente que antes de introducir cepas de micoparásitos para el manejo de H. vastatrix, se exploren las cepas locales presentes, o en su caso se haga uso de productos a base de Simplicillium y no se asuma como hasta el momento que Lecanicillium es el principal regulador natural de H. vastatrix en Costa Rica, dicha asunción puede ser un factor determinante en el fracaso de los programas de control biológico contra la roya.
Aunado a lo anterior, es aconsejable evaluar fungicidas que puedan presentar cierto grado de selectividad hacia Simplicillium con la finalidad de favorecer el control biológico por conservación, o en su caso seleccionar cepas resistentes a los fungicidas comúnmente usados para el combate de H. vastartrix en Costa Rica.
Adicional al principal objetivo del estudio, se demuestra que el método de conservación de papel filtro no demerita la patogenicidad de Simplicillium hacia H. vastatrix, el uso de éste método ha demostrado ser eficiente en conservar hongos entomopatógenos y fitopatógenos por más de cinco años sin afectar su capacidad patogénica (Morales, 2008); aun y cuando la cepa EC tenía solo un mes de almacenada al evaluarla, se destaca la capacidad de esta de soportar la desecación final del proceso sin ser afectada, y se recupera fácilmente del papel filtro para de nuevo ser utilizada.
Conclusiones
Los resultados obtenidos demuestran que las cepas locales de S. lanosoniveum son más eficaces que productos comerciales a base de Lecanicillium en colonizar pústulas de roya. Simplicillium presenta un alto grado de especificidad hacia H. vastatrix, por lo que para la zona de estudio es recomendable que compañías formuladoras de biofungicidas para el combate de esta enfermedad, se enfoquen en cepas locales de Simplicillium antes de formular productos con otros géneros.











 texto en
texto en