Introducción
El síndrome de insuficiencia respiratoria aguda (SIRA) tiene una alta tasa de mortalidad (de 35 a 46%).1,2 El SIRA severo, con PaO2/FiO2 de 80 mmHg y sin respuesta a ventilación mecánica (VM) convencional, requiere soporte extracorpóreo (ECMO, del inglés extracorporeal membrane oxygenation) como terapia de rescate.1,3 La terapia ECMO proporciona oxigenación y ventilación,2 lo que permite que los pulmones descansen y se recuperen de la insuficiencia respiratoria al tiempo que minimiza la lesión pulmonar inducida por el ventilador (VILI).1-3
La ventilación con ultraprotección pulmonar es una estrategia que logra presiones en las vías respiratorias y volumen tidal (Vt) más bajos que el estándar actual. Esta maniobra establece varios parámetros: volumen corriente bajo (0.5-6 mL/kg/min), PEEP (del inglés, positive end-expiratory pressure) alta (de 10 a 15 cmH2O), presión meseta baja (< 25 cmH2O),1,2 frecuencia respiratoria limitada,2,3 tiempo inspiratorio de uno a dos segundos, presión inspiratoria baja (< 15 cmH2O) y FiO2 inferior a 60%.2,3
Es factible ajustar la configuración del ventilador en función de las mediciones de la presión transpulmonar (PtP), lo que puede mejorar la oxigenación y reducir la VILI secundaria a presiones y volúmenes altos durante la inspiración y presiones y volúmenes bajos durante la espiración.1-3 Sin embargo, existen pocos estudios sobre ECMO donde se determina el impacto del ajuste de la PEEP, según la Ptp.3 La medición de la presión transpulmonar se basa en la manometría esofágica. El objetivo de este trabajo es presentar un caso de medición de PtP con balón esofágico logrando controlar la VILI en un paciente con SIRA severo.
Presentación del caso
Masculino mexicano de 34 años con antecedente de tabaquismo y abuso de cocaína, sin antecedente de vacuna contra el SARS-CoV-2, desarrolló astenia, hipertermia y tos seca en febrero de 2022. Primero tratado de forma ambulatoria (paracetamol, oxígeno suplementario, antibióticos, anticoagulante, esteroides, tocilizumab y broncodilatador inhalado), su cuadro clínico empeoró a los 35 días del inicio de los síntomas e ingresó a la unidad de cuidados intensivos con saturación arterial de 60% y prueba confirmatoria de COVID-19. Se realizó manejo avanzado de vía aérea, con posterior maniobra de reclutamiento y titulación de PEEP por distensibilidad. Sin embargo, no se lograron los objetivos de protección pulmonar. Debido a SIRA severo, se colocó en posición prona y se inició terapia con antibióticos por sospecha de neumonía bacteriana.
A pesar de los ajustes farmacológicos (analgesia, sedación y bloqueo neuromuscular), su mala tolerancia a la PEEP y la persistencia de hipoxemia refractaria (PaO2/FiO2 64.9 mmHg), se consideró candidato a ECMO venovenosa (VV-ECMO). Con SOFA de 10 puntos, 50% de mortalidad, MuLBSTA score 12 puntos, 15.99% mortalidad a 90 días, RESP score seis puntos, clasificación de riesgo I y supervivencia hospitalaria de 92%. Se colocó un balón esofágico y se establecieron ajustes de ventilación con ultraprotección pulmonar. Debido al alto requerimiento de sedación intravenosa, se administró sedación inhalatoria con sevoflurano para lograr una sedación profunda (índice biespectral 34-47) y sincronía paciente-ventilador. El día nueve se observó asincronía paciente-ventilador por falso disparo secundario por singulto (Figura 1), por lo que se inició con inhibidores de la bomba de protones y se ajustó sedoanalgesia. El día 17 se redujo el soporte de ECMO y se ajustaron parámetros de VM, logrando metas de protección pulmonar. Los esfuerzos ineficaces se determinaron utilizando el balón esofágico. El día 19 la resolución del SIRA permitió la retirada de ECMO y el mantenimiento de metas de protección pulmonar; sin embargo, con deterioro 48 horas después debido a una neumonía asociada al ventilador. Se realizó procedimiento de titulación con soporte de balón esofágico y tomografía por impedancia eléctrica, con adecuada resolución a las 72 horas. El día 25 se inició rehabilitación posterior a retiro de bloqueo neuromuscular y sedación con retiro progresivo de analgesia. El día 27 se efectuó traqueostomía, permitiendo progresión ventilatoria el día 32, según protocolo TIPS. Se realizó una prueba de deglución positiva el día 42, seguida de una decanulación de traqueotomía exitosa el día 44 (Figura 2).
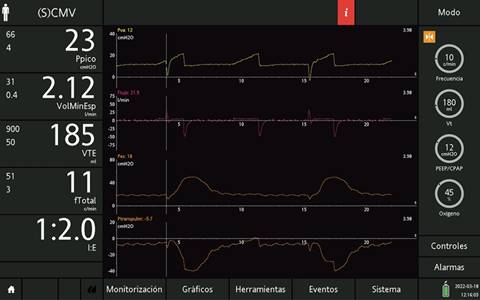
Figura 1: Pantalla del ventilador Hamilton que muestra las curvas de la presión transpulmonar y presión esofágica con parámetros de ultraprotección y presencia de falso gatillo secundario a hipo.

Figura 2: Se presentan datos relevantes en la evolución del paciente. El día 27 mostró disfunción de balón esofágico sin posibilidad de colocarlo por epistaxis. PEEP = positive end-expiratory pressure. Ptpl = presión transpulmonar inspiratoria. PtpE = presión transpulmonar espiratoria. FR = frecuencia respiratoria.
Discusión
El SIRA tiene una alta tasa de mortalidad (de 35 a 46%).1,2 La mortalidad y los días con ventilador aumentan con la gravedad.2 El SIRA se caracteriza por una alteración grave del intercambio gaseoso. La hipoxemia se debe principalmente al cortocircuito intrapulmonar, mientras que el aumento del espacio muerto alveolar explica la alteración del aclaramiento de CO2. Los pacientes con SIRA grave, con una PaFi inferior a 80 mmHg, sin respuesta a la ventilación mecánica convencional se consideran candidatos a VV-ECMO como terapia de rescate.1,3 La razón es que el intercambio de gases extracorpóreo permite el uso de configuraciones de ventilador de protección pulmonar, lo que minimiza la lesión pulmonar inducida por el ventilador (VILI).1-3 Si bien ninguna de las guías (REVA, CESAR, ELSO o EOLIA)2,3 ha definido aún la configuración de ultraprotección en el ventilador, no se ha llegado a un acuerdo sobre su beneficio.1-3 Los pacientes con SIRA grave tienen mayor probabilidad de presentar VILI. Los mecanismos predominantes por los cuales ocurre la VILI incluyen sobredistensión alveolar (volutrauma), barotrauma, atelectotrauma e inflamación (biotrauma).1-3 Las estrategias de ventilación con protección pulmonar son el estándar de atención actual para pacientes con SIRA que proporcionan los requisitos de ventilación adecuados y minimizan la VILI. Las metas de ultraprotección pulmonar incluyen los siguientes ajustes: volumen corriente bajo (0.5-6 mL/kg/min), PEEP alta (de 10 a 15 cmH2O), limitación de presión meseta (< 25 cmH2O),1,2 frecuencia respiratoria limitada,2,3 tiempo inspiratorio de uno a dos segundos, presión inspiratoria < 15 cmH2O y FiO2 por debajo de 60%, lo ideal es 30%.2,3
La estrategia óptima para evaluar y prevenir VILI en el SIRA es controvertida. En pacientes con SIRA grave con soporte de VV-ECMO la estrategia óptima de ventilación mecánica no está clara.
La medición de la PtP se basa en la manometría esofágica. Las fuerzas dañinas que causan la sobredistensión alveolar se correlacionan directamente con el PtP inspiratorio máximo, y el traumatismo por colapso y reapertura alveolar recurrente se relaciona con el PtP espiratorio final mínimo.4 Por lo tanto, el conocimiento del PtP al final de la inspiración y al final de la espiración, en lugar de sólo la presión de las vías respiratorias, podría permitir personalizar la configuración del ventilador mecánico para cada paciente y así minimizar ambas causas de la VILI. El uso del balón esofágico es una estrategia adecuada para evaluar la función pulmonar con un abordaje personalizado.3
Grasso et al.5 midieron la PtP en pacientes con SIRA grave y aumentaron la PEEP hasta que la PtP fue de 25 cmH2O. De los pacientes, 50% respondieron a un aumento en la presión de las vías respiratorias y no requirieron VV-ECMO.
En 2019 Zee et al.6 describieron ocho pacientes con SIRA grave e indicación de VV-ECMO, según el ensayo EOLIA. Estimaron la PtP con un catéter con balón esofágico y apuntaron a una PTP ≤ 25 cmH2O. El concepto de pulmón abierto guiado por PTP dio como resultado un aumento en la relación PaO2/FiO2 y ninguno de los pacientes requirió VV-ECMO, con una reducción en la mortalidad de 11%.6
En un ensayo controlado aleatorio prospectivo de un solo centro en pacientes con VV-ECMO, 104 pacientes fueron asignados al azar al grupo de ventilación guiada por presión transpulmonar o estrategia de reposo pulmonar.1 La proporción de pacientes que se retiraron con éxito de VV-ECMO en el grupo guiado por presión transpulmonar fue significativamente mayor que en el grupo de reposo pulmonar (71.2 frente a 48.0%; p = 0,017).1
La limitación de los volúmenes corrientes para mantener la PtP al final de la inspiración por debajo de 25 cmH2O ha demostrado una mejora en la oxigenación y la distensibilidad; por otra parte, la PtP al final de la espiración entre 0 y 10 cmH2O evita la atelectasia.7 Como estrategia para mantener la ventilación convectiva para la eliminación del nitrógeno alveolar y evitar el colapso alveolar durante la ECMO se debe combinar un nivel alto de PEEP con un volumen corriente muy bajo.8,9 Esto estabiliza la morfología pulmonar mejorando la función pulmonar y limitando el impacto hemodinámico.1,3 Sin embargo, aún es una estrategia incierta en ECMO.1 En nuestro paciente, el ajuste de la configuración del ventilador en función de las mediciones de presión transpulmonar mediante manometría esofágica evitó la lesión pulmonar inducida por el ventilador y permitió la identificación temprana de asincronía, lo que permitió el destete exitoso de VV-ECMO.
Conclusiones
Una estrategia de ventilación que utiliza presiones esofágicas para estimar la presión transpulmonar mejora significativamente la oxigenación, la distensibilidad y minimiza la VILI. Presentamos un caso exitoso de un paciente con SIRA severo en VV-ECMO y monitoreo de la presión transpulmonar con el uso de catéteres con balón esofágico que permiten encontrar un valor de PEEP que podría mantener la oxigenación, mientras previene la lesión pulmonar debido al colapso alveolar repetido o sobredistensión.











 nueva página del texto (beta)
nueva página del texto (beta)


