Antecedentes
En el ámbito global, el cáncer colorrectal (CCR) constituye la tercera causa más común de tumores malignos después del cáncer de mama y de pulmón; además, ocupa el segundo lugar entre los tumores de mayor mortalidad de cualquier edad y en ambos sexos representa la cuarta causa de muerte más común en Latinoamérica.1-3 Se estima que su carga global aumentará hasta 60 % para 2030, lo que representará más de 2.2 billones de nuevos casos y 1.1 millón de muertes. Tan solo en 2012, se reportaron 1.4 millones de nuevos casos y 700 000 muertes.1-3
La distribución de esta neoplasia varía en los países, sin embargo, dos tercios de casos ocurren en países con mayor ingreso económico y alto índice de desarrollo humano, con una mayor incidencia en adultos jóvenes en Australia, Canadá y Estados Unidos,1-3 si bien es común en varios países de ingresos bajos y medios (índice de desarrollo humano bajo).1-3 Uno de los principales factores de riesgo es la edad mayor de 50 años.3
En América, es el segundo cáncer más frecuente en mujeres y el tercero más común en hombres, con las tasas de incidencia más altas en Argentina, Chile y Uruguay, así como en el Caribe.1-3 Tiene una mortalidad muy alta en la población de Filipinas, Lituania y Bielorrusia con 5.7, 3.4 y 1.8 promedio de cambio porcentual anual.1-3 Representa una incidencia de 140 000 casos en ambos sexos. 1-3 Sus tasas se han incrementado en la mayoría de los países latinoamericanos en ambos sexos, excepto en Argentina y Uruguay. En contraste, las tendencias de mortalidad por cáncer colorrectal disminuyeron sustancialmente en Estados Unidos y España. Su incremento se relaciona con los cambios de vida, dieta, inactividad física, alto consumo de carne roja y procesada y sobrepeso, los cuales constituyen factores de riesgo. En América, la prevalencia aumenta en adultos con obesidad, particularmente en Argentina, Uruguay y algunas subregiones de Brasil.1-3
En población mexicana, CCR tiene una tasa de incidencia de 11.6 y una tasa de mortalidad de seis por cada 100 000 habitantes; se ubica en el tercer lugar de acuerdo con su frecuencia.3 En Mérida, México, los tumores del tracto digestivo representan 20 % del total de casos; en el período 2015-2018, particularmente el cáncer colorrectal constituyó 7 % de los casos, con una incidencia estandarizada de 9.7/100 000 en hombres y 8.2/100 000 en mujeres.3,4
Cabe considerar que CCR es una causa frecuente de urgencia quirúrgica. En este sentido, en una serie de 247 pacientes operados por CCR en un centro de referencia de tercer nivel de la Ciudad de México se encontraron los siguientes factores de riesgo asociados a la cirugía:
Falta de antecedentes familiares de cáncer (razón de momios [RM] = 4.95).
Ser habitante de zonas rurales (RM = 3.7).
CCR en etapas avanzadas (RM = 5.06).5
Ciertamente, la mortalidad por este cáncer es alta en México, mayormente en los estados del norte del país; tan solo en el periodo 1998-2018, la tasa aumentó anualmente 1.3 % en mujeres y 2.7 % en hombres. Lo anterior se relaciona con la mayor urbanización y la afiliación a servicios de salud que no cubre rutinariamente su detección oportuna.6
Epidemiología genética y molecular en el CCR
Desde el punto de vista de la genética, el CCR se considera una enfermedad multifactorial determinada por factores de riesgo genéticos, ambientales y de estilo de vida. Aun cuando los factores genéticos tienen una gran influencia, se ha observado que la mayoría de los casos de CCR es de tipo esporádico y se desarrolla a lo largo de varios años, lo que sugiere que ocurre a través de la vía secuencia adenoma-carcinoma al cabo de un período de 10 años.7-9 Se calcula que 80 % de los casos de CCR es esporádico y 20 %, familiar-hereditario.
Respecto a la raza y la etnia, en Estados Unidos los afroamericanos tienen un mayor riesgo en comparación con los caucásicos y los hispanos.9 Las mutaciones más frecuentes fueron las encontradas en los genes relacionados con la vía de la β-catenina, como Wnt y E-cadherina.10,11 Sin embargo, el CCR a nivel molecular representa un modelo de heterogeneidad genética, ya que se desarrolla a partir de diferentes alteraciones, no solo genéticas si no también epigenéticas, que implican diferentes vías moleculares. Entre los genes más estudiados a nivel mutacional en CCR están p53 y TGFB1, así como las vías de señalizacion Wnt/β-catenina, Delta Notch, el factor relacionado con el factor nuclear eritroide 2 y la proteína 1 similar a Kelch, los cuales participan en la apoptosis, necrosis y autofagia.12,13
Factores de riesgo socioambientales y determinantes para CCR
El CCR de tipo esporádico se relaciona principalmente con factores ambientales y estilo de vida, dentro de los cuales se encuentran la actividad física, obesidad/síndrome metabólico, alimentación, así como la ingesta de sustancias como alcohol o tabaco y la contaminación (Figura 1).14,15

Figura 1 Factores de riesgo que pueden incrementar el desarrollo de CCR esporádico. Se esquematiza cómo participan la actividad física, la obesidad, el síndrome metabólico, la alimentación, el consumo de alcohol y tabaco en el desarrollo de CCR, al aumentar la adiposidad, la inflamación crónica, la resistencia a la insulina, el consumo de grasas saturadas y el procesamiento a hidrocarburos aromáticos. La disbiosis por consumo de alcohol y su metabolito, el acetaldehído, incrementan las ROS. El consumo de tabaco origina que se alojen sustancias cancerígenas. En el caso del ejercicio se ha reportado que, si bien se producen ROS, el proceso de "hormesis" induce una respuesta adaptativa que activa vías de señalización que promueven factores transcripcionales (Nrf2, NF-κB, PGC-1α) que aumentan las enzimas antioxidantes, lo cual reduce el daño oxidativo.
Obesidad, diabetes, actividad física y alimentación
La obesidad y la diabetes tipo 2 se relacionan con la hiperinsulinemia crónica, la cual promueve la iniciación y progresión del cáncer a través de PIK3, mTOR, MAPK, Wnt y factor de crecimiento similar a la insulina libre 1 (IGF1), los cuales son activados por la insulina estimulando la apoptosis, la proliferación celular, el crecimiento y la supervivencia celular.16
Por otra parte, se ha reportado que el exceso de adiposidad puede aumentar hasta en 60 % el riesgo de desarrollar CCR, por ejemplo, el aumento de 10 cm en la circunferencia de cintura se asoció a un incremento de 4 % de riesgo. La grasa abdominal está compuesta por tejido adiposo subcutáneo y tejido adiposo visceral; este último secreta más adipocinas proinflamatorias (TNF-α, IL-6 y la proteína C reactiva) que el primero y disminuye la secreción de adiponectina, además de estar relacionado con el infiltrado de macrófagos. Estos procesos se han relacionado, además, con el desarrollo de alteraciones sistémicas como la inflamación y la resistencia a la insulina, la cual incide en el incremento de la activación de IGF1 y en la vía de señalización de insulina-IGF1, la cual se ha relacionado con procesos de carcinogénesis colorrectal debido a que influye en el aumento de la proliferación celular y disminución de la apoptosis.17,18
Carnes rojas y procesadas
Un incremento en la ingesta de estas se asocia a mayor riesgo de CCR; algunos estudios sugieren que el riesgo podría aumentar 17 % por cada porción adicional de 100 g de carne roja consumida diariamente. Por cada porción de 50 g de carne procesada, el riesgo aumenta 18 % debido a los conservadores (nitratos y nitritos), azufre, grasas saturadas y sustancias químicas producidas durante la cocción de estos (hidrocarburos aromáticos policíclicos).19
Alcohol
El consumo de alcohol se ha relacionado con CCR; se ha demostrado que una ingesta diaria de 10 g de etanol incrementa 7 % la predisposición. El efecto carcinogénico está relacionado con cambios en la microbiota y la disbiosis, al disminuir la concentración de bacteroidetes y firmicutes e incrementar las proteobacterias y actinobacterias. Estos cambios alteran el crecimiento bacteriano intestinal y los productos secretados (endotoxinas), lo cual provoca inflamación sistémica, diabetes y resistencia a la insulina.20,21
Por otra parte, durante el metabolismo del alcohol se producen especies reactivas de oxígeno (ROS, reactive oxygen species), las cuales pueden oxidar el ADN, proteínas, lípidos y acetaldehído (clasificado como probable carcinógeno), que se acumulan produciendo daño hepático mediante la generación de ROS, peróxido de hidrógeno, superóxidos y radical hidroxilo. Es su metabolismo por la enzima CYP2E1 lo que genera daño en el ADN nuclear y mitocondrial, mediante la lipoperoxidación, reduciendo la utilización de oxígeno y ocasionando muerte celular asociada a disminución de la actividad de la glutatión S transferasa.21
Tabaco
El tabaquismo (un cigarrillo por día) se ha considerado un factor de riesgo para el incremento de la mortalidad del CCR, con un riesgo de 15 %. Los exfumadores mantuvieron un riesgo elevado 25 años después de dejar de fumar. Entre las sustancias carcinogénicas del tabaco se identifican nitrosaminas, alquitrán, monóxido de carbono, hidrocarburos, amoníaco y cadmio.22
Actividad física
La falta de actividad física se relaciona con sobrepeso y obesidad, y el mecanismo por el cual estos conducen a CCR es la resistencia a la insulina, el aumento de glucosa, la hiperinsulinemia, el incremento de interleucinas y adipocitocinas, que promueven la proliferación celular y supresión de la apoptosis.23 El otro mecanismo es mediante el estrés oxidativo que genera cambios en la señalización celular por modificaciones en el balance redox, el cual lleva a pérdida de la respuesta adaptativa, que enciende los factores transcripcionales Nrf2, NF-ĸB y el cofactor de transcripción 1a del receptor activado por el proliferador de peroxisomas (PGC-1α), activando a GSK3.24
Otros factores de riesgo epidemiológicos
Los pacientes con enfermedad inflamatoria intestinal como colitis ulcerativa o enfermedad de Crohn tienen riesgo incrementado de CCR, lo cual depende del tiempo de duración de la enfermedad; los pacientes con más de 10 años de evolución tienen 2 % de riesgo de desarrollo; en los que tienen entre 20 y 30 años aumenta a 8 y 18 %.25 Por otra parte las mutaciones del gen supresor de tumor BCRA1 incrementan el riesgo de desarrollar CCR.26
Vía Wnt/β-catenina y cáncer colorrectal
La vía de señalización Wnt/β-catenina está relacionada con la regulación de la homeostasis celular, mantenimiento en la autorrenovación celular durante la embriogénesis y en la edad adulta. Se relaciona con la proliferación epitelial, diferenciación y activación inicial de las células madre intestinales para el mantenimiento de las criptas colónicas. Aproximadamente 90 % de los tumores de colon tiene una mutación en los genes de APC y Wnt/β-catenina.27
La β-catenina es un factor de transcripción que participa en la vía de señalización Wnt; en ausencia de ligandos está inactiva y es fosforilada en los aminoácidos Ser45, Ser37, Ser33 y Thr41 por el complejo formado por APC, axina, CK1α y GSK3β, lo que ocasiona la degradación de β-catenina en el proteosoma (Figura 2). La β-catenina se une al proteasoma con β-TrCP, que forma un complejo con Skp1/Cullin para unir ubiquitina con los residuos Ser33 y Ser37 fosforiladas y el dominio de la hélice β que contiene repeticiones de β-transducina (β-TrCP). La fosforilación es un proceso secuencial, inicialmente Ser45 es fosforilada por CK1α y esto estimula la fosforilación de Thr41 por la glucógeno sintasa quinasa-3 (GSK3). Finalmente, se fosforilan Ser37 y Ser33 por GSK3 para generar el sitio de unión a β-TrCP.28-30
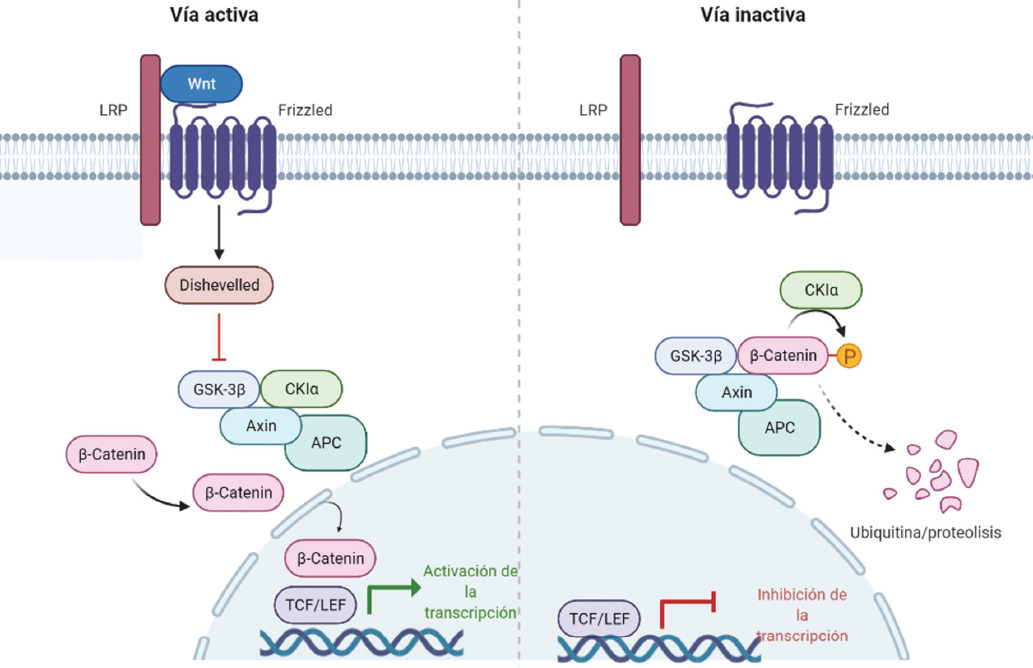
Figura 2 Representación esquemática de la vía de señalización Wnt/β-catenina. Imagen propia elaborada con BioRender.
En cambio, en presencia de ligandos, la β-catenina/Wnt forma un complejo con Dsh, axina, Frizzled y una proteína relacionada con el receptor de LDL5/6 (LRP5/6). Esta interacción promueve la translocación de axina en la membrana plasmática y la ruptura del complejo de destrucción (APC/GSK3/CK1α), inhibiendo así la degradación de β-catenina. En consecuencia, β-catenina se acumula y se dirige al núcleo donde se une a proteínas activadoras de la familia TCF/LEF e inducen la transcripción de varios genes blanco relacionados con la proliferación celular.31
En el núcleo, la β-catenina actúa como un coactivador transcripcional mediante la formación de complejos con las proteínas nucleares TCF/LEF (factor de células T/factor potenciador linfoide es un grupo de genes que codifican factores de transcripción). Los genes diana de TCF y LEF identificados incluyen JUN, MYC, CCND1, ABCB1, MMP7, AXIN2, BIRC5, entre otros. Al complejo TCR, LEF y β-catenina se unen transducina/Groucho, CBP/p300, Smads, la cinasa parecida a NEMO (modulador esencial de NFkB), Chibby, entre otras, para modular la actividad transcripcional. La acumulación de β-catenina nuclear en el citoplasma lleva a una proliferación celular descontrolada. Por lo tanto, la acumulación de β-catenina nuclear puede ser un biomarcador asociado a invasión, metástasis y mal pronóstico del CCR.32,33
Reprogramación metabólica en CCR
Se ha demostrado que el CCR involucra varios cambios genéticos que impulsan su inicio y desarrollo, además de que se ha identificado la influencia de diferentes vías metabólicas que podrían tener una influencia en el inicio del CCR y su progresión a través de la secuencia adenoma-carcinoma, entre ellos impulsores genéticos como alteraciones en APC, KRAS, TP3 o PIK3CA (84 %), MLH-1 y MSH2 y la polimerasa épsilon (POLE, 3 %, vía ultramutada). Estas mutaciones dan lugar a cambios en la proteína APC, que a su vez provoca degradación directa de la β-catenina con señales anormales en la vía Wnt, destacando la activación de la vía Wnt, vía primordial que involucra proliferación celular, inducción de EMT, angiogénesis, migración y supervivencia celular en el CCR. Se ha propuesto que numerosas características del metabolismo de las células madre son parecidas a las identificadas en las células cancerosas, por eso se ha sugerido que gran parte de los cánceres epiteliales se originan a partir de la transformación de las células madre tisulares, por lo cual tiene sentido que sea un evento temprano durante la tumorigénesis.33
Una vía por la cual se establece la rápida renovación del epitelio colónico es la impulsada por el ciclo activo de las células madre intestinales Lgr5+, que dan lugar a células secretoras y enterocitos que generan todas las células epiteliales intestinales.26 Se ha postulado que las células madre intestinales Lgr5+ podrían ser altamente glucolíticas, además, se ha planteado que las mitocondrias en esas células pueden oxidar otros sustratos, incluidos los ácidos grasos; cabe señalar que, independientemente de su naturaleza glucolíticas, la modulación del metabolismo de la glucosa determina la autorrenovación y proliferación de las células madre intestinales.34
Además del metabolismo de la glucosa, los lípidos también se relacionan con la regulación de la actividad y la tumorigénesis de las células madre intestinales. En ratones se ha observado que una dieta prolongada alta en grasas condiciona un aumento en el número y el potencial de autorrenovación de las células madre intestinales Lgr5+, lo cual se lleva a cabo mediante la activación de PPAR-δ en estas células, que a su vez conduce a la regulación positiva de diferentes genes diana de β-catenina, cuyo resultado es la formación de adenomas.27,28 Wnt condiciona al incremento del metabolismo de la glucosa, al regular directamente la transcripción de la piruvato deshidrogenasa quinasa 1 (PDK1) y el transportador de lactato, MCT-1 (SLC16A1), provocando que el piruvato se desvíe de las mitocondrias y se convierta en lactato, además de una secreción mejorada por el transportador de monocarboxilato 1 (MCT-1), promoviendo la angiogénesis en los tumores.35
Recientemente se ha demostrado que la activación de la vía Wnt se relaciona con una dieta rica en grasas para promover la tumorigénesis intestinal. La combinación de mutaciones en el gen APC y una dieta rica en grasas alteran el perfil de los ácidos biliares intestinales, inducen proliferación y daño del ADN en las células madre cancerosas Lgr5+ y favorecen la progresión de adenoma a adenocarcinoma. Un estudio independiente mostró que las células metastásicas de CCR en el hígado regulan al alza la aldolasa B, que promueve el metabolismo de la fructosa para impulsar la glucólisis, la gluconeogénesis y la vía de la pentosa fosfato para apoyar la proliferación celular.35-38
Otro hallazgo importante fue el reportado en el estudio de Wang et al., en el cual se encontró que las células con CCR activan la oxidación de ácidos grasos mitocondriales a través de la sobreexpresión de CPT1A; el aumento de esa oxidación era un mecanismo clave para hacer frente a los niveles elevados de ROS inducidos por el desprendimiento de la matriz, inhibiendo así la anoikis (muerte celular impuesta por la pérdida de adhesión a la matriz extracelular). La activación de la oxidación de ácidos grasos mitocondriales sostuvo la síntesis de NADPH para así sostener la producción de glutatión reducido.39
El CCR está relacionado con la dieta, el metabolismo y la actividad de las células madre intestinales, por lo cual se establece que un cambio en nuestros hábitos alimentarios podría reducir o aumentar el riesgo de desarrollarlo e, incluso, mejorar la respuesta a los diversos tratamientos. Diversos estudios recientes parecen respaldar esta hipótesis, por ejemplo, se ha demostrado que una restricción calórica de entre 20 y 40 % promueve la actividad de las células madre intestinales mediante la regulación negativa de la actividad de mTORC1 en el nicho de células de Paneth. En otro estudio se demostró que la dieta alta en grasas promueve la tumorigénesis intestinal al aumentar la cantidad de células iniciadoras de tumores; la dieta prolongada alta en grasas aumenta el número de las células madre intestinales y confiere a los progenitores intestinales de actividad de células madre, lo que aumenta el número de células que podrían sufrir una transformación oncogénica para iniciar tumores.39-44
Detección temprana de CCR
dado el problema global que representa el ccr, es importante la detección temprana en personas con factores de riesgo. existen pruebas paraclínicas, como la detección oculta de sangre en heces o la inmunohistoquímica fecal, sin embargo, son más sensibles la colonoscopia, rectosigmoidoscopia y la prueba de adn en heces o mt-sdna que identifica adn anormal proveniente del cáncer o de pólipos adenomatosos. esta última es una frontera en el diagnóstico, además de que tiene una precisión diagnóstica aceptable para el diagnóstico de ccr y adenomas avanzados, si bien su sensibilidad y especificidad son más bajas que la colonoscopia. en este sentido, se requieren más estudios epidemiológicos para la validación de esta prueba en méxico.45
Dado el problema global que representa el CCR, es importante la detección temprana en personas con factores de riesgo. Existen pruebas paraclínicas, como la detección oculta de sangre en heces o la inmunohistoquímica fecal, sin embargo, son más sensibles la colonoscopia, rectosigmoidoscopia y la prueba de ADN en heces o MT-sDNA que identifica ADN anormal proveniente del cáncer o de pólipos adenomatosos. Esta última es una frontera en el diagnóstico, además de que tiene una precisión diagnóstica aceptable para el diagnóstico de CCR y adenomas avanzados, si bien su sensibilidad y especificidad son más bajas que la colonoscopia. En este sentido, se requieren más estudios epidemiológicos para la validación de esta prueba en México.45
Conclusiones
La principal recomendación para evitar el desarrollo del CCR es reducir los factores de riesgo mencionados, aumentar el consumo de frutas, verduras y granos en la dieta, realizar ejercicio de forma rutinaria, lo que controlará y mantendrá el peso, además de limitar el consumo del alcohol y dejar de fumar. Estos factores de riesgo se pueden modificar, sin embargo, los antecedentes familiares y la presencia de un síndrome hereditario aumentan el riesgo, por lo que se sugiere la realización de exámenes periódicos para detectar CCR, en los que se utilicen marcadores bioquímicos y moleculares predictores del desarrollo de esta enfermedad.











 nueva página del texto (beta)
nueva página del texto (beta)


