Introducción
Con el advenimiento de la nanotecnología, se ha alimentado la visión de obtener una tecnología lo suficientemente avanzada para hacerla indistinguible de la ficción, la cual ha encontrado su desarrollo en cientos de productos de aplicaciones industriales, incluyendo los “chips” de computadoras, automóviles, implementos deportivos, ropa, medicinas, cosméticos y suplementos dietéticos, entre muchos otros. Sin embargo, algunos científicos ya han empezado a cuestionar el balance ecológico de la naciente nanorrevolución. Estamos todavía en el umbral de lo posible, una llamada a la “nanoescala” ambientalmente segura. En este sentido, la preocupación por el medio ambiente y la salud pública ha dado lugar a un beneficioso proceso en las áreas de investigación y desarrollo: la nanotecnología verde. Un nuevo enfoque para la fabricación de estos productos, encontrando metodologías respetuosas del ambiente y más seguras para todos los seres vivos, con viabilidad comercial sostenible.
En general, la síntesis de materiales a escala nanométrica comienza mediante la preparación de suspensiones precursoras, con un exceso de aditivos orgánicos y diferentes solventes que se requieren para dirigir el proceso de cristalización bajo condiciones hidrotérmicas (Sifontes et al., 2011; Kalarical et al., 2008; Sifontes et al., 2013; Talavera et al., 2013; Paraschiv et al., 2010, Visinescu et al., 2012). Desafortunadamente, estas condiciones de formulación para la síntesis de los materiales nanocristalinos requieren de reactivos costosos y gran consumo de energía. Usualmente, las sustancias químicas sin reaccionar, provenientes de las soluciones precursoras, son desechadas, dando como resultado la eliminación de materiales con efectos ambientales negativos. Es por ello que, debido a la creciente necesidad de desarrollar tecnologías ambientalmente amigables para las síntesis de materiales, hoy en día se plantean nuevas rutas en su preparación, donde se establezca una conexión entre la biotecnología y la nanotecnología. A través de muchos diferentes métodos sintéticos, continúa la búsqueda de biomateriales adecuados para la biosíntesis de las nanopartículas. En esta revisión se mencionan algunos avances interesantes.
Síntesis de nanopartículas empleando polisacáridos: empleo de quitosano como plantilla biológica
El uso de materiales obtenidos de la naturaleza ha permitido el aprovechamiento de diferentes biomoléculas formadas por los organismos vivos, que han sido el resultado de millones de años de evolución (Plascencia-Villa et al., 2011). Mediante el empleo de algunas de ellas, particularmente las de tipo polisacárido, como celulosa, quitosano, alginato y almidón, se logran sintetizar partículas altamente cristalinas, de diferentes morfologías y composición, cuyos tamaños de cristal suelen ser inferiores a los 100 nm (Sifontes et al., 2011; Kalarical et al., 2008; Ramimoghadam et al., 2013; Visinescu et al., 2012; Paraschiv et al., 2010; Liu et al., 2012). La incorporación de estas moléculas en las metodologías verdes, frecuentemente ha sido dirigida como agente “estabilizador o protector”, que evita la aglomeración durante el proceso de formación, o para modificar las características superficiales de las nanopartículas (Pompe et al., 2013). En general, en el mecanismo de formación de las nanopartículas, los precursores actúan como centros de nucleación dando lugar a la formación de clusters cuyo crecimiento continuará a medida que se sigan agregando los átomos, formándose así, partículas de mayor tamaño y formas poliédricas más complejas (Sifontes et al., 2010). No obstante, es necesario estabilizar las partículas mediante la envoltura de moléculas o “agentes” estabilizadores (polímeros, generalmente) que se adsorben en su superficie, inhibiendo, de esta manera, el proceso de aglomeración o sinterización (Sifontes et al., 2010).
Un caso interesante, en referencia a la utilización de estos polisacáridos, es descrito por el quitosano, polielectrolito, que puede utilizarse en condiciones similares a la de los tensoactivos catiónicos. Las propiedades fisicoquímicas del quitosano ofrecen una fuente de diferentes estructuras químicas en solución, las cuales pueden facilitar el diseño de nuevos materiales porosos a escala nanométrica (Sifontes et al., 2011; Kalarical et al., 2008). El quitosano se obtiene por desacetilación de la quitina. El segundo polisacárido natural más abundante en la tierra, después de la celulosa, se encuentra presente en el exoesqueleto de artrópodos y zooplancton marino, formando parte de la pared celular de algunas familias de hongos y levaduras, además en las alas de algunos insectos (Pompe et al., 2013; Sifontes et al., 2011; Kalarical et al., 2008). El quitosano se ha descrito como un polímero catiónico lineal, biodegradable, no tóxico, de alto peso molecular, de fácil aplicación y ambientalmente amigable. Entre sus aplicaciones se destacan la biomedicina, biotecnología, medicina, tratamiento de aguas industriales, floculación y coagulación de proteínas y aminoácidos; además, posee propiedades antifúngicas y antibacteriales (Sifontes et al., 2011; Kalarical et al., 2008; Caldera et al., 2009).
La propiedades químicas del quitosano, como el contenido de grupos amino e hidroxilo reactivos y la capacidad de formar complejos quelato con muchos iones de metales de transición, hacen muy provechosa su utilización en la preparación de óxidos metálicos a escala nanométrica (Sifontes et al., 2011; Kalarical et al., 2008), facilitando así la síntesis de partículas altamente cristalinas en órdenes de magnitud inferiores a los 100 nm (Sifontes et al., 2011). De particular interés, se puede mencionar la síntesis de óxido de cerio nanocristalino (Figura 1), en la cual se han obtenido partículas cuyos diámetros son inferiores a los 10 nm (Sifontes et al., 2011) (Figura 2), colocándolo como un interesante material inorgánico con potenciales aplicaciones biológicas. Aunque las nanopartículas de cerio han sido estudiadas para numerosas aplicaciones en ciencia e ingeniería, recientemente se ha demostrado que poseen propiedades antioxidantes, las cuales le permiten actuar contra el daño celular inducido por radiación, el estrés oxidativo e inflamación (Asati et al., 2009). Adicionalmente, se puede mencionar que los compuestos híbridos de óxidos de metales y quitosano (NPs- Qui) han atraído mucho interés para el desarrollo de biosensores, agentes de contraste para las imágenes magneto resonantes (MRI) y agentes antibacterianos (Kumar et al., 2004; Caldera et al., 2009).
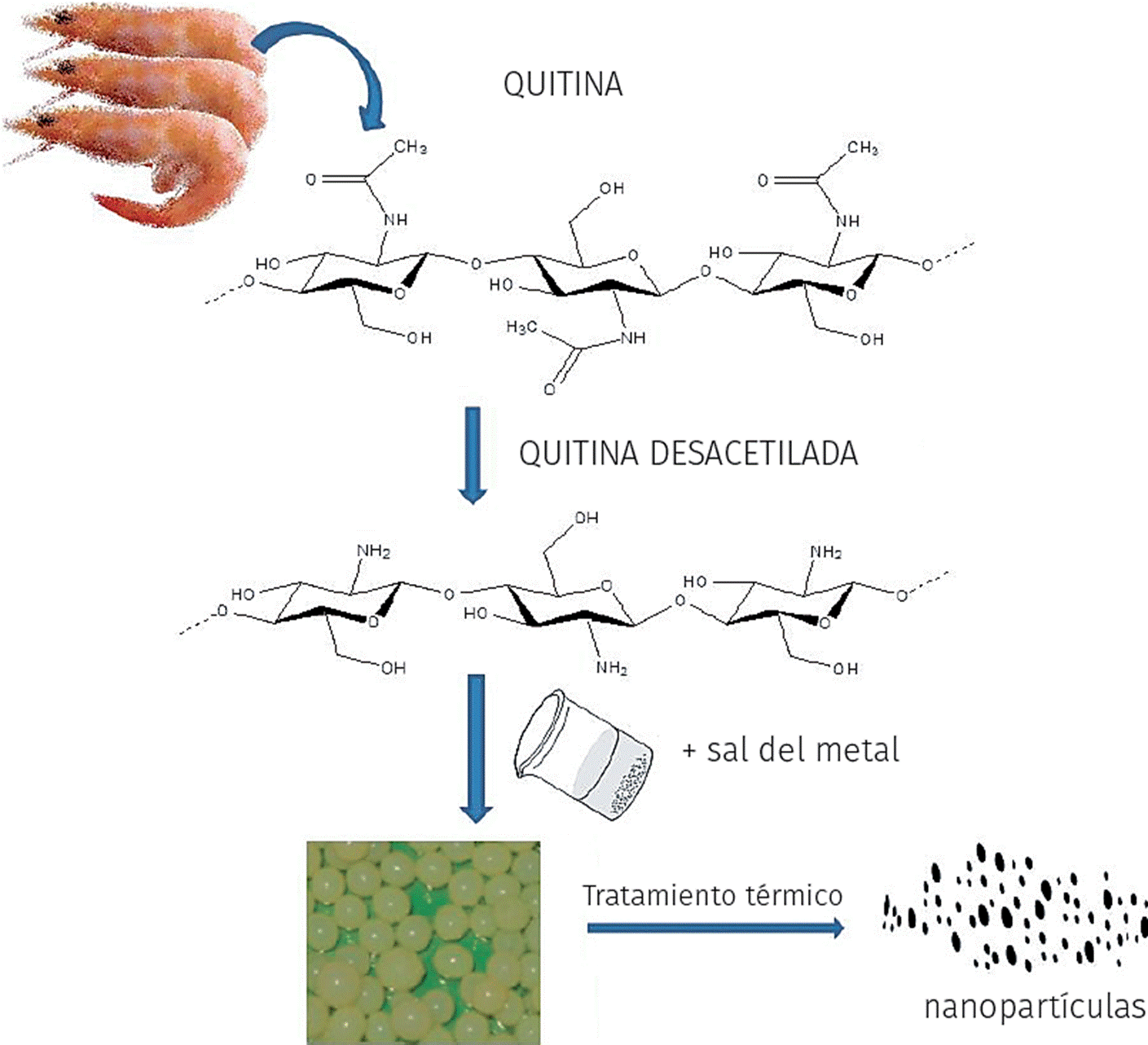
Fuente: Elaboración de la autora.
Figura 1 Esquema sobre la utilización de quitosano en la síntesis de nanopartículas de cerio.

Fuente: Imágenes obtenidas por la autora y su grupo de investigación.
Figura 2 Micrografía SEM (a,b) del material híbrido preparado con quitosano y sales de óxido de cerio; c) micrografía SEM del óxido sintetizado, obtenido mediante tratamiento térmico; d) imagen de las nanopartículas de óxido de cerio obtenidas por HRTEM (microscopía de transmisión de alta resolución).
Síntesis de nanomateriales empleando microrganismos: pared celular de levaduras
Recientemente, las células microbianas han sido propuestas como un medio económico, ambientalmente amigable, para dirigir la deposición y ensamblaje de nanopartículas inorgánicas y nanoestructuras (Sifontes et al., 2013). Sus versátiles funciones biológicas, alta biodegradabilidad y baja toxicidad, en comparación con los surfactantes sintetizados químicamente, ofrecen hoy en día una importante alternativa en el campo de la síntesis de nanomateriales.
Las células de los microrganismos, vivas o muertas, son capaces de dirigir la síntesis y montaje de materiales inorgánicos cristalinos a partir de las biomoléculas activas presentes en sus membranas celulares. Los méritos específicos de esta ruta de síntesis son atribuidos en gran parte a la existencia de grupos funcionales (OH−, CHO− y COO−, entre otros) presentes en la pared celular de las células microbianas (Sifontes et al., 2013) (Figura 3).
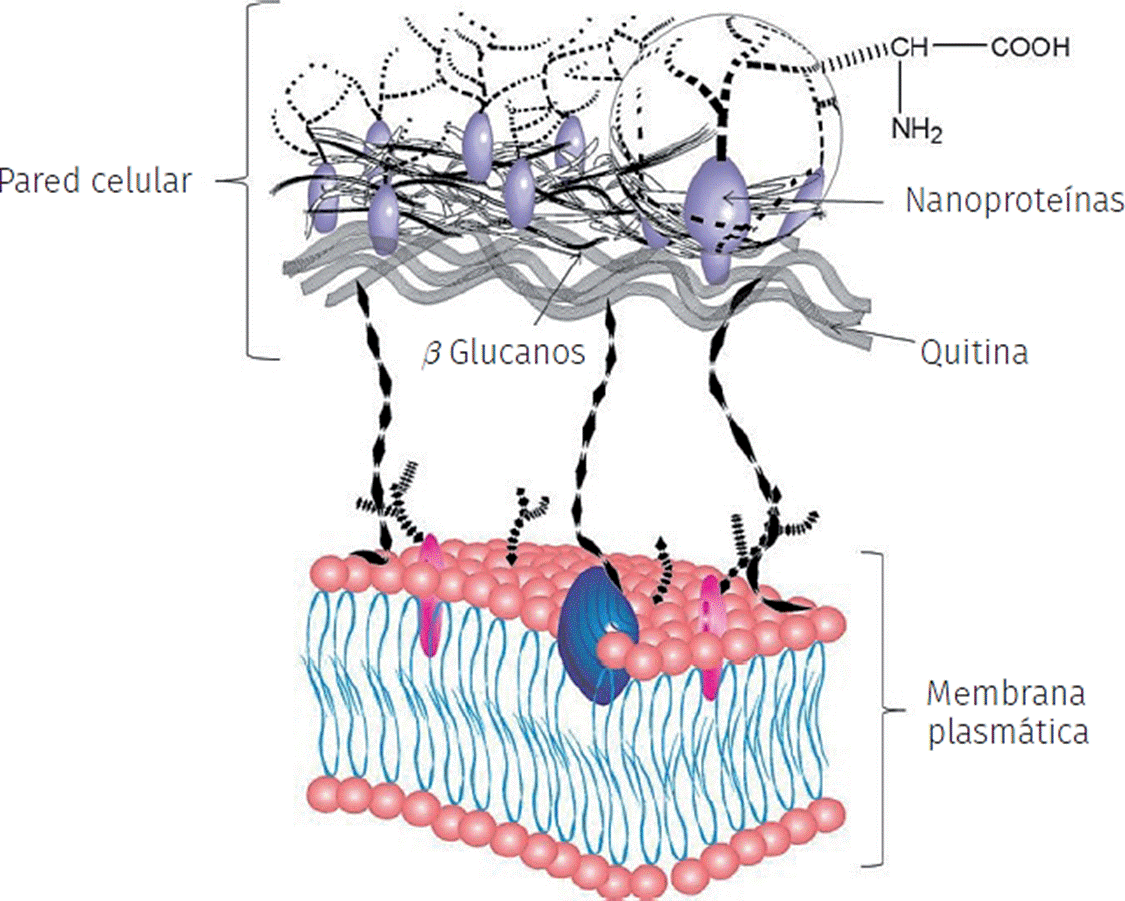
Fuente: Elaboración de la autora.
Figura 3 Modelo de la estructura de la pared celular de las levaduras.
Estos simples procedimientos de síntesis se basan en la interacción entre el grupo funcional de la pared celular y los precursores metálicos (Figura 4). La superficie de los microrganismos adquiere una carga eléctrica en el ambiente acuoso, debido a la ionización de los grupos químicos superficiales, tales como grupos amino y carboxilato (Sifontes et al., 2013; Pompe et al., 2013). Generalmente, la carga negativa predomina, sobre todo en superficies de la célula bacteriana y la levadura. Subsecuentemente, la superficie de la célula, en contacto directo con el ambiente o lecho de síntesis, permite a estos grupos cargados interactuar con los iones o moléculas del respectivo precursor metálico presente en el medio exterior (Sifontes et al., 2013; Pompe et al., 2013) (Figura 4).
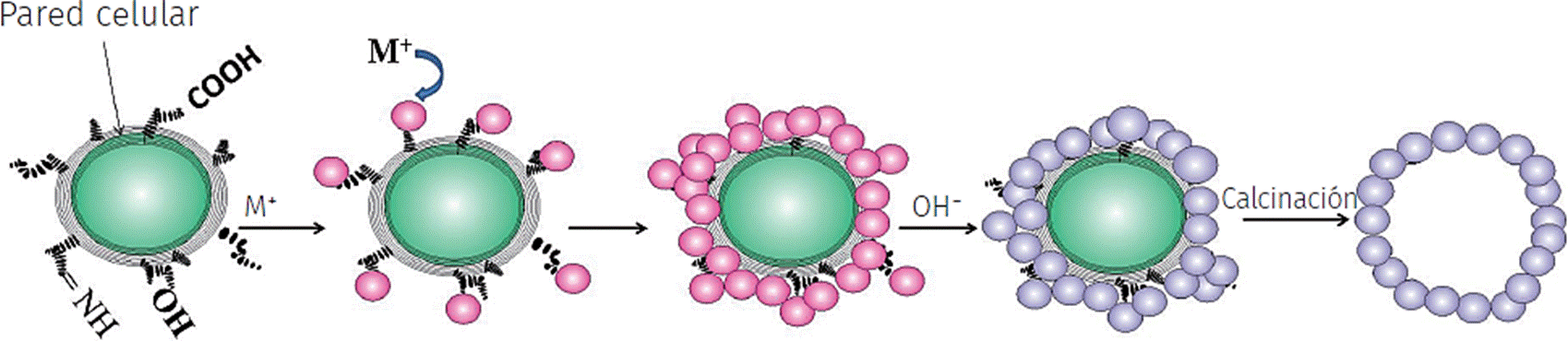
Fuente: Elaboración de la autora, modificado de Bai et al., 2011.
Figura 4 Modelo esquemático de una biosíntesis de óxidos metálicos empleando células de levadura.
Posteriormente, estas interacciones facilitarán la formación de estructuras inorgánicas que eventualmente serán obtenidas mediante la aplicación de un tratamiento térmico para eliminar el material biológico (Figura 4). Bajo este esquema, en todo este proceso, la levadura puede actuar como una plantilla para dirigir la síntesis de estructuras inorgánicas con una morfología de microesferas huecas (Bai et al., 2011). No obstante, también otros procesos pueden ocurrir en el ambiente químico, los cuales sí permitirían la obtención de materiales a la escala nanométrica. Como referencia, se puede mencionar la precipitación de compuestos inorgánicos sobre estructuras orgánicas presentes en la pared celular, tales como proteínas y polisacáridos. Es importante destacar, que las rutas para una mineralización inducida biológicamente pueden implicar el empleo del espacio intracelular o el espacio epicelular cercano a la pared celular. También pudiera ocurrir mediante la interacción con sustancias poliméricas extracelulares. En algunas ocasiones, la reacción química para la formación del mineral puede ser activada mediante la presencia de una enzima (Pompe et al., 2013). A diferencia de ello, en otros productos de investigación, es mencionado con frecuencia el uso de la biomasa de las levaduras, sólo como una fuente de proteínas, la cuales actúan en la formación y estabilización de las nanopartículas metálicas (Mourato et al., 2011).
Son numerosos los artículos científicos que refieren la formación de nanopartículas, basándose en la capacidad que posee la pared celular de las levaduras para enlazar cationes metálicos, dirigidos a través de coordinación o puntos de atracción electrostática (Sifontes et al., 2013). Sin embargo, recientemente se demostró que este fenómeno no es exclusivo para ciertas especies inorgánicas. Estos sistemas también poseen la capacidad de lograr atraer aniones metálicos y dirigir la formación de nanoestructuras (Talavera et al., 2013; Sifontes et al., 2013).
¿Cuál es la explicación?
Se le atribuye al cultivo y tratamiento de secado empleados en la preparación del microrganismo utilizado en la biosíntesis. Generalmente, las células de levadura para la venta comercial son sometidas a un fuerte proceso de deshidratación, el cual puede generar cambios temporales y reversibles en su metabolismo, acompañado de modificaciones de las estructuras de la superficie celular, incluyendo la pared celular (Talavera et al., 2013; Sifontes et al., 2013). Esto incluye alteraciones en la carga de la superficie celular y la formación de conglomerados de células grandes, conduciendo a un aumento de su afinidad por especies químicas con carga negativa, esto como respuesta a las diferentes tensiones externas. Un ejemplo de ello, es el trabajo de Vergnault et al. (2007), quienes demuestran que la levadura comercial Saccharomyces cerevisiae puede presentar diferencias en sus características y propiedades, en función de los distintos tratamientos de secado y otras condiciones de procesamiento al que están sometidas. La levadura instantánea, por ejemplo, presenta un carácter hidrofílico y propiedades que le permiten desempeñarse como donador de electrones. Por el contrario, la levadura no instantánea, exhibe un comportamiento aceptor de electrones con una naturaleza fuertemente hidrofóbica. En este sentido, la síntesis de pentóxido de vanadio a escala nanométrica (Figura 5), atribuida al producto de las interacciones de los iones (V₂O₇)⁴‒ y los grupos funcionales de la pared celular de la S. cerevisiae, es un claro ejemplo de la interesante complejidad de estos sistemas (Talavera et al., 2013). Los parámetros que controlan la precipitación, tales como pH y fuerza iónica, son determinados no sólo por las condiciones del ambiente químico del lecho de síntesis, sino también por los procesos metabólicos de la célula, vinculados con el transporte activo de agua, iones y electrones a través de la pared celular (Pompe et al., 2013).

Fuente: Imágenes obtenidas por la autora y su grupo de investigación.
Figura 5 Imagen TEM: a) vanadio-células de levadura; b) agregado de nanopartículas de pentóxido de vanadio, obtenidos a 500 °C.
En adición a lo mencionado anteriormente, es importante señalar que la pared celular bacteriana posee una cantidad de estructuras superficiales las cuales pueden actuar diferentemente, favoreciendo la fijación de precursores y actuando como centros de nucleación (Merroun et al., 2005). Un ejemplo de ello ha sido observado en las células de Bacillus sphaericus JG-A1 y su sorprendente capacidad para enlazar metales pesados. Esta propiedad es atribuida a la presencia de una capa superficial proteínica ordenada y altamente cristalina conocida como capa S (S-layer). Se compone de proteínas idénticas o subunidades de las glicoproteínas, y cubren completamente la superficie de la célula durante todas las etapas de crecimiento y división bacteriana (Merroun et al., 2005).
Síntesis de nanomateriales empleando extractos vegetales: el caso de la Stevia rebaudiana
Generalmente, la utilización de los métodos químicos para la producción de nanopartículas suelen ser altamente contaminantes y peligrosos para el ambiente. Frecuentemente, se produce la aglomeración de las nanopartículas generadas conduciendo a la formación de cúmulos de grandes tamaños y baja monodispersidad. Algunas de estas metodologías recurren a la utilización de agentes específicos que evitan la agregación, estabilizando el tamaño de las partículas coloidales del metal. El uso de tales agentes hace que estos sistemas sean complicados y poco amigables con el ambiente. Muchos de los procesos biológicos empleados como síntesis alternativas se efectúan usando microrganismos por vías intracelulares, lo cual hace que en ocasiones, el aislamiento de las nanopartículas sea difícil. El cultivo de cepas puras de estas especies es costoso, tedioso y requiere de un mantenimiento cuidadoso de las condiciones de esterilidad.
Actualmente, el método biosintético utilizando extractos de plantas ha recibido más atención que los métodos físicos, químicos y aquellos que implican el uso de bacterias u hongos, donde se requiere mantener un ambiente aséptico. La posibilidad de utilizar extractos de plantas para la síntesis de metales en estado cerovalente, a escala nanométrica, fue reportado inicialmente por Gardea-Torresdey et al. (2002). Más tarde, se estudió ampliamente la biorreducción de varios metales a nanomateriales de diferentes morfologías capaces de satisfacer las necesidades de diversas aplicaciones industriales, sin el requerimiento de ningún aditivo o agente protector que evite la agregación o el uso de plantillas de tipo surfactantes. Estos procesos son fácilmente escalables y pueden ser menos costosos en comparación con los métodos basados en procesos microbianos. Es importante mencionar que estas metodologías de síntesis “verde”, son útiles, no sólo debido a su reducido impacto sobre el ambiente, en comparación con algunos otros métodos de producción, sino también porque pueden ser utilizadas para producir grandes cantidades de nanopartículas libres de contaminación, con una morfología y tamaño definido. Las nanopartículas sintetizadas por estos métodos son muy estables y generalmente no hay necesidad de utilizar ningún agente externo que las estabilice (Sastry et al., 2004). Es conocido que la fuente del extracto de la planta influye en las características de las nanopartículas (Kumar et al., 2009). Diferentes extractos contienen combinaciones y concentraciones de diversos agentes reductores orgánicos como compuestos fenólicos, terpenos, polisacáridos y flavonas (Kumar et al., 2012; Mukunthan et al., 2012). Por lo general, una biorreducción mediada por extractos de plantas en solución acuosa, bajo la presencia de la sal metálica precursora, se produce a temperatura y presión ambiental, en tiempos cortos de reacción (Figura 6).

Fuente: Elaboración de la autora.
Figura 6 Esquema general de la biorreducción mediada por extractos de plantas.
Más recientemente, se menciona un caso interesante, la biosíntesis de “óxidos metálicos porosos” empleando el extracto acuoso de la Stevia rebaudiana Bertoni. Los glicósidos de esteviol, principales constituyentes de la S. rebaudiana (planta nativa de ciertas regiones de Paraguay y Brasil), han demostrado actuar como autenticas plantillas biológicas en la síntesis de nanomateriales. Estas moléculas poseen la particularidad de interaccionar entre ellas mediante sus porciones hidrofílicas y los fragmentos hidrofóbicos, logrando formar estructuras supramoleculares (Figura 7a) (Rodríguez et al., 2013). Estas estructuras poseen la particularidad de ensamblarse con las especies inorgánicas (Figura 7b y c), agregarse y formar unidades tubulares (nanovarillas o nanofibras) (Figura 7d). La obtención del sólido nanométrico finalmente logra ser completada mediante la eliminación de la fracción orgánica o “plantilla” a través de la aplicación de un tratamiento térmico a altas temperaturas. Esta nueva metodología verde ha permitido la preparación de nanomateriales (Figuras 8 y 9) con una porosidad elevada cuyas potenciales aplicaciones en el área de catálisis y afines resulta ser prometedora.
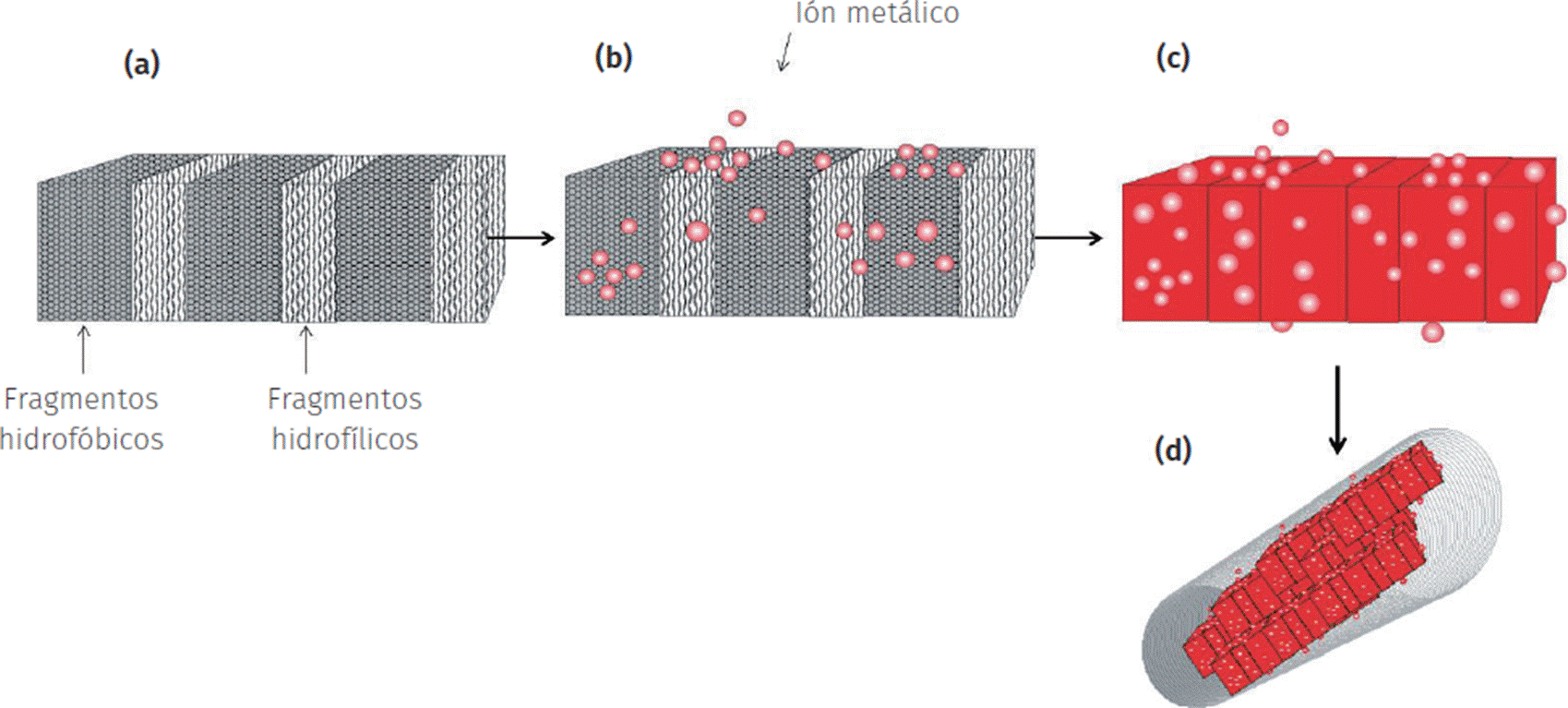
Fuente: Elaboración de la autora.
Figura 7 Esquema de la biosíntesis de “óxidos metálicos porosos” empleando el extracto acuoso de la S. rebaudiana.
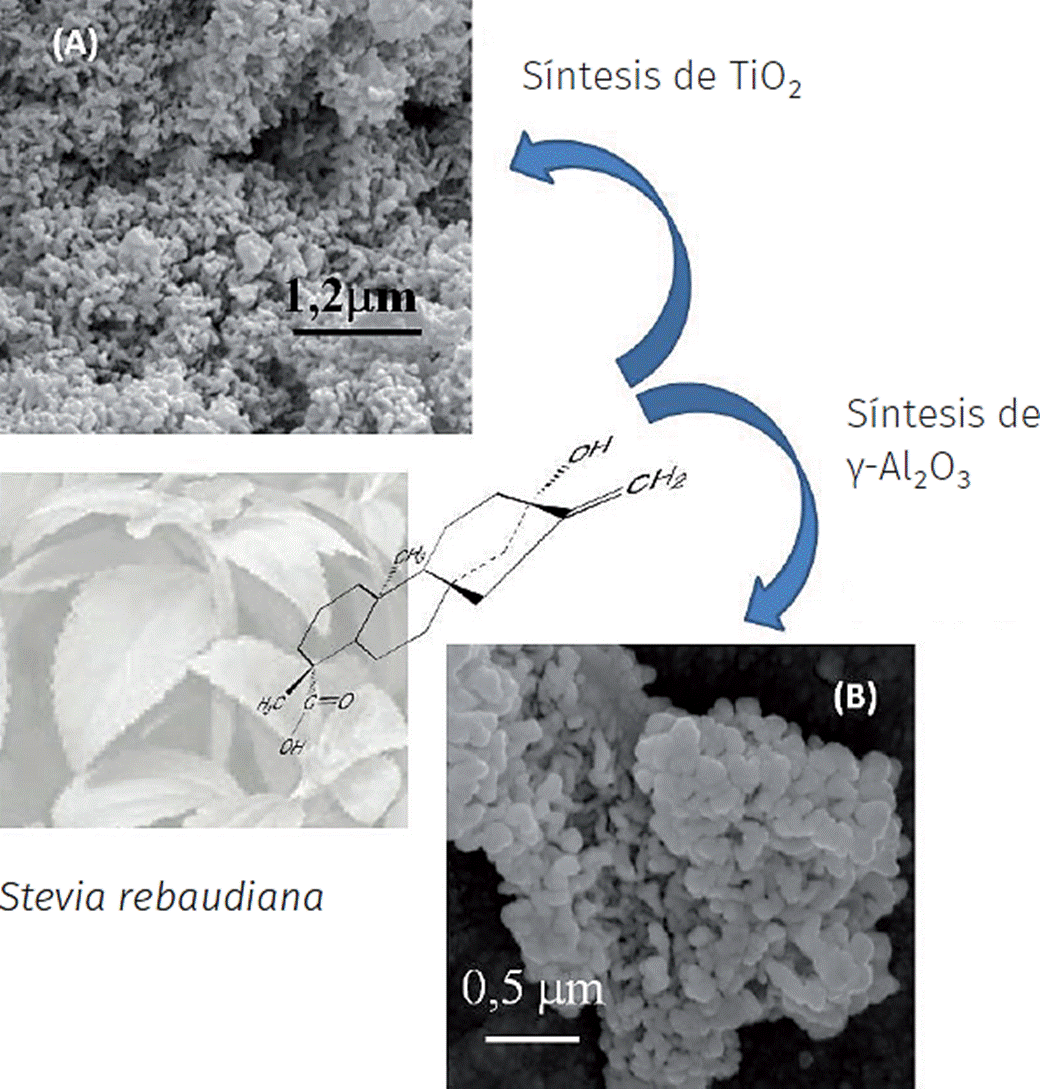
Fuente: Imágenes obtenidas por la autora y su grupo de investigación.
Figura 8 Micrografías FE-SEM de óxido de titanio fase anatasa a) y óxido de aluminio fase gamma b), sintetizados empleando el extracto acuoso de la S. rebaudiana.
Síntesis de materiales cerámicos y el empleo de plantillas biológicas
Los actuales avances en la utilización de plantillas biológicas para procesos aplicados a la síntesis de materiales demuestran la ventaja de la especificidad estructural o actividad catalítica de los sistemas biológicos para crear nuevos tipos de materiales inorgánicos. La riqueza de muchas estructuras jerarquizadas halladas en las plantas celulares abre grandes perspectivas respecto a su obtención y aplicación en el área industrial, especialmente para aquellos materiales que se generan a escala nanométrica.
Un ejemplo interesante sobre la biosíntesis de materiales es la formación reproducible de zeolitas usando como “semillas” los esqueletos de algas diatomeas (Wang et al., 2001). Las diatomeas marinas son algas microscópicas conocidas por su amplia variedad de estructuras tridimensionales. Ellas están recubiertas por una pared celular única, constituida de sílice amorfa hidratada, conocida con el nombre de frústula. Estas intrincadas estructuras muestran patrones característicos, reproducibles en el rango de microescala a nanoescala. Además, poseen un ensamblaje de nanopartículas de sílice que podrían ser utilizadas en una amplia gama de aplicaciones tecnológicas. Por ejemplo, máscaras para litografías, en sistemas de filtración y como soportes catalíticos (De Stefano et al., 2011; Schröfel et al., 2011). Finalmente, el mecanismo de formación de la frústula de diatomea es investigado hoy en día como modelo para la síntesis biomimética de nanoestructuras de sílice (Schröfel et al., 2011).
En síntesis, la riqueza de las estructuras biomoleculares nos ofrece un campo ilimitado para la creación de materiales nanoestructurados y nanopartículas, con nuevas funcionalidades. Los procesos naturales y la evolución, han dado como resultado materiales biológicos y rutas de síntesis, en esencia, superiores a las técnicas convencionales de procesamiento de materiales inorgánicos. Es por ello que, aprender de lo que ofrece la naturaleza, nos permitirá sentar las bases para un futuro desarrollo tecnológico, pero de una manera consciente y equilibrada, respetando el ambiente.











 nueva página del texto (beta)
nueva página del texto (beta)



