Editor asociado: Sergio Alvarado Orellana
Introducción
La teledetección es una técnica que ha tenido un amplio uso en los estudios ambientales durante las últimas décadas. Por ejemplo, los satélites de la serie Landsat figuran entre los más usados en estudios ecológicos (e.g.Gómez 2003, Álvarez-Bermúdez et al. 2015) y han permanecido hasta la actualidad recolectando información multiespectral de la superficie terrestre. En un inicio la tecnología satelital fue utilizada mayormente para estudios ecológicos en países desarrollados (e.g.Cardillo et al. 1999, Clark et al. 2004) y lentamente su uso se ha extendido hacia las regiones menos desarrolladas (e.g.Romero-Berny et al. 2015, Texeira et al. 2015), ha sido aplicada en el estudio de la mayoría de los grupos taxonómicos (e.g.Weishampel et al. 2016).
Particularmente, en el grupo de las aves, la teledetección se ha utilizado para relacionar los patrones de distribución de la riqueza de especies con índices derivados de la información espectral (Seto et al. 2004), o para relacionar la pérdida de la vegetación y su impacto sobre las especies endémicas (Buchanan et al. 2008). Los índices de vegetación, derivados de información satelital, son excelentes estimados de la productividad y pueden cuantificar la heterogeneidad ambiental de la vegetación, dos factores importantes que moldean los patrones de distribución de especies (Mittelbach et al. 2001). Estudios recientes han demostrado también el uso potencial del enfoque de la teledetección en la predicción de la riqueza de especies en paisajes antropizados (e.g.Hilgert-Moreira et al. 2014, Lima Magalhães et al. 2015), lo que puede contribuir en los planes de manejo, monitoreo y estrategias de rescate y conservación de muchas especies.
El monitoreo es un componente esencial para la conservación, necesario para identificar las amenazas a la biodiversidad, así como para desarrollar respuestas apropiadas a dichas amenzas; además, sirve para evaluar la efectividad y facilita el manejo adaptativo de las acciones. Tradicionalmente, los datos de monitoreo y de estudios ecológicos en países neotropicales han sido colectados únicamente a través de muestreos de taxones claves y sus hábitats (e.g.Gradstein 1992, Carrillo et al. 2000, Marini et al. 2009). Los costos y recursos asociados y el empleo de tiempo requeridos en estos muestreos y monitoreos tradicionales de extensas áreas son muy elevados (Brouwer et al. 1999). Razón por la cual hay muy pocos estudios y programas en los países del Neotrópico que puedan apoyar las estrategias de conservación, adecuadas y necesarias, para especies amenazadas y ecosistemas degradados.
Las comunidades de aves están asociadas a características específicas del hábitat, principalmente la disponibilidad de alimentos, los tipos de vegetación, los factores abióticos como la humedad, la temperatura y las precipitaciones (Morrison et al. 1992, Hattori y Mae 2001). Por otra parte, los sensores satelitales son capaces de medir la reflectancia en diferentes longitudes de onda del espectro electromagnético, que constituyen variables espectrales a partir de las cuales pueden calcularse índices de humedad, de temperatura y de vegetación (Chuvieco 2007). Entonces, la estrecha relación entre las características de las comunidades y el hábitat donde éstas se localizan y, a su vez, entre el hábitat y las variables espectrales, permitiría utilizar esta última información para predecir características específicas de las comunidades de aves, útiles para el diseño de programas de monitoreo que identifiquen cambios en la estructura y composición de las comunidades de aves y en la cobertura vegetal.
En Cuba son pocos los estudios en los que se ha utilizado esta tecnología para especies o hábitats (e.g.Cerdeira et al. 2008, García-Quintas y Denis 2012) y para comunidades (e.g.García-Quintas y Parada 2013, Ferrer-Sánchez 2015). El sitio Ramsar Gran Humedal del Norte de Ciego de Ávila afronta la problemática de avance de la frontera agrícola que ha ocasionado la pérdida y reducción de hábitats y de especies raras y especialistas de recursos (e.g.Ferrer-Sánchez y Rodríguez-Estrella 2015). La ausencia de planes de manejo en este humedal identifica una necesidad urgente de preservar los remanentes de fragmentos de hábitat naturales y de la biodiversidad asociada. Sin embargo, la protección de humedales extensos e inaccesibles, en muchas partes, requiere costos y esfuerzos de muestreo elevados y por un largo periodo. A partir de esta problemática, el uso de técnicas de teledetección puede proveer a los planificadores y biólogos de métodos eficientes para predecir la biodiversidad a través de zonas amplias y heterogéneas. Estimaciones de la cobertura de suelos y de la riqueza de especies son costosas y consumidoras de recursos, especialmente en áreas extensas y a múltiples escalas espaciales. Bien se podría aplicar la teledetección para monitorear áreas extensas a bajos costos. Por lo tanto, el objetivo de esta investigación fue determinar la composición y estructura de las comunidades de aves de tres localidades ubicadas dentro del Gran Humedal del Norte de Ciego de Ávila (GHNCA), Cuba, y su relación con las variables espectrales relacionadas con el hábitat.
Métodos
Área de estudio
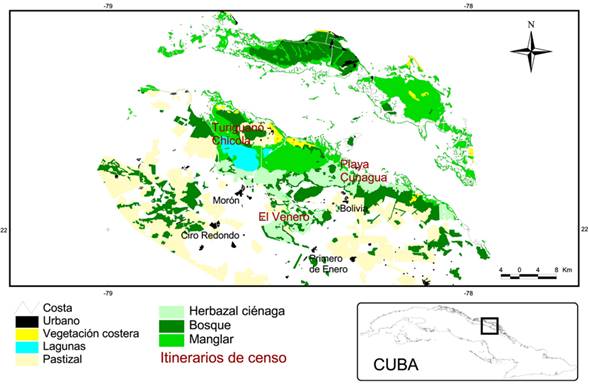
Los datos de campo los registramos en tres zonas dentro del sitio Ramsar Gran Humedal del Norte de Ciego de Ávila, Cuba: El Venero, Turiguanó-Chicola y Playa de Cunagua (Figura 1), del 4 al 10 de julio de 2010, periodo de anidación de la mayoría de las aves acuáticas cubanas (Mugica et al. 2006). El GHNCA tiene un área de 226,875 ha y ocupa la mayor parte de la costa norte de Ciego de Ávila, Cuba (22º19’ N y 78º28’ W). Fue declarado sitio Ramsar por su abundancia y riqueza de aves acuáticas y, en especial, porque ahí anida la Grulla Cubana (Antigone canadensis nesiotes), subespecie endémica en peligro de extinción (Gálvez y Ferrer 2012). Esta área presenta siete áreas protegidas de varias categorías, de las cuales tres son Refugios de Fauna, donde habitan temporal o permanentemente aves endémicas, migratorias y en peligro de extinción (Rodríguez et al. 2008).
Muestreo de las comunidades de aves
Para el muestreo de las comunidades de aves realizamos 78 transectos lineales independientes de ancho y largo variables (Ralph et al. 1996), de 10 min de duración cada uno, entre las 06:00 h y las 10:00 h, en los cuales contamos e identificamos todas las aves observadas o escuchadas. La distribución de los transectos fue 43 itinerarios en El Venero, 18 en Turiguanó-Chicola y 17 en Playa Cunagua. Tomamos las coordenadas geográficas iniciales y finales, con un GPS (sistema de coordenadas geográficas, datum WGS84), de todos los transectos, y obtuvimos la distancia recorrida para poder estandarizarlos. En cada una de las zonas muestreadas clasificamos la vegetación de forma general según la vegetación dominante: bosque, manglar, herbazal de ciénaga, herbazal con palmas, pastizal, palmar, sabana inundada, vegetación de laguna y vegetación de costa, ya que todas son consideradas hábitats para las especies.
Bosque: Formaciones vegetales en las que predominó el arbóreo. Cobertura cercana al 100%, pocas especies predominantes, altura mayor a 6 m y suelo de tierra, lodo o rocoso.
Manglar: Vegetación predominante arbórea. Cobertura de total a media, pero con dominancia de mangle rojo (Rhizophora mangle) y mangle prieto (Avicennia germinans). La altura de la vegetación, según la zona, varió entre 3 y más de 6 m, y el suelo era de tierra o lodo, salino o salobre.
Herbazal de ciénaga: Formación vegetal con predominancia de plantas herbáceas. Altura media de 1 m. Entre las especies que caracterizan esta formación se encuentra Thypha dominguensis, Cladium jamaicense, Cyperus spp. y Erianthus giganteus.
Herbazal con palmas: Vegetación predominante herbácea, pero a diferencia de la anterior el grado de anegamiento fue mayor y presentó una alta densidad de palmas.
Pastizal: Vegetación predominante herbácea. Cobertura poca o nula y predominancia de gramíneas de menos de 1 m de altura, pero sin anegamiento permanente. Pastizales dedicados a la ganadería y en la mayoría de los casos tuvieron asociados fragmentos de bosques de diferentes tamaños y parches de la planta exótica Dicrostachys cinerea.
Palmar: La formación vegetal predominante fueron las palmas. El tipo de suelo era tierra o lodo.
Sabana inundada: Vegetación predominante herbácea, rodeada de bosque. El suelo fue fangoso y en algunas zonas estaban anegadas completamente.
Vegetación de laguna: Lagunas rodeadas de vegetación boscosa y A. germinans con cobertura vegetal media. Presentaba como vegetación emergente a las herbáceas, arbustos de Annona glabra y predominó la presencia de espejos de agua en el interior de la laguna.
Vegetación de costa: Vegetación arbustiva (A. germinans). Cobertura vegetal variable pero generalmente rala. La vegetación estaba interrumpida por playazos de fondo lodoso y abundante materia orgánica y niveles de salinidad elevados.
Para el análisis de las comunidades calculamos la abundancia absoluta y relativa de aves, así como la riqueza total de especies por tipo de vegetación. Para describir la estructura de la comunidad de aves clasificamos las especies en los gremios descritos por Kirkconnel et al. (1992): insectívoros-granívoros (IG), zancudas-sondeadores (ZS), buceadores (B), rapaces (R), otras depredadoras (D), entre otras (Anexo 1).
Procesamiento de la imagen satelital
Empleamos una imagen multiespectral del satélite Landsat 7 con fecha 3 de julio de 2010, obtenida en el Global Land Cover Facility (GLCF). Este satélite porta un sensor ETM+, que presenta información en nueve bandas espectrales con una resolución espacial de 30 m. A esta imagen, previamente corregida geográficamente (ortorrectificada), le realizamos el pre-procesamiento para la calibración radiométrica. Para ello seguimos los siguientes pasos: 1. Llevar la imagen de Nivel Digital (ND) a valores físicos de reflectancia; 2. Realizar la corrección atmosférica mediante el método FLASSH (Fast Line-of-sight Atmospheric Analysis of Spectral Hypercubes) para eliminar las distorsiones espectrales de las imágenes, provocadas por la atenuación atmosférica (aerosoles, vapor de agua, polvo) y 3. Aplicar la substracción de cuerpo oscuro para eliminar los ruidos provocados por sombras. La imagen estaba georreferenciada en coordenadas UTM, datum WGS84 y tenía un tamaño de escena de 185 x 185 km. Recortamos una subescena, en la que incluimos las tres áreas de estudio y que constituyó la imagen de trabajo. Ubicamos sobre la subescena los transectos y sobre éstos marcamos regiones de interés (ROI). Calculamos para cada roi los siguientes índices espectrales: Índice de Humedad (Crist y Cicone 1984), Índice de Vegetación Verde (Crist y Cicone 1984), Índice Normalizado de Diferencia de Vegetación (NDVI, Rouse et al. 1973), Índice Normalizado de Diferencia de Agua (NDWI, Gao 1996) e Índice de Densidad de Arbustos Vivos (SHRUB, Hale 2006). Los tres primeros índices se calcularon a partir de la transformación Tasseled Cap (véase Cohen y Goward 2004).
Manejo de datos
Para el análisis de la estructura comunitaria medimos la heterogeneidad de especies con el índice de Brillouin y calculamos el índice inverso de Simpson para evaluar la equitatividad. En ambos casos usamos el programa Ecological Methodology (Krebs 1999). Obtuvimos las curvas de rango-abundancia (Whittaker 1965) de las aves en cada formación vegetal, en las cuales determinamos las pendientes de las regresiones de curvas logarítmicas de mejor ajuste, ya que es el método más simple (Preston 1948, Wilson 1991, He y Tang 2008). Estas curvas son usadas para desplegar la abundancia proporcional de cada especie y es una forma de visualizar y comparar su riqueza y equidad, pues se identifican especies raras y especies dominantes. Realizamos un Análisis de Componentes Principales (ACP) con las siguientes variables: especies, abundancia por gremios, abundancia, riqueza de especies, coeficientes de regresión de las curvas de rango de abundancia y los índices de Simpson y de Brillouin y extrajimos el primer componente como una variable derivada integradora para correlacionarlo con una variable homóloga obtenida con las variables espectrales. Para evaluar las relaciones de similitud entre formaciones vegetales a partir de estas variables, realizamos un Análisis de Agrupamiento con la distancia euclidiana y el algoritmo UPGMA.
Análisis de las variables espectrales
Calculamos los estadísticos descriptivos de las variables que incluyeron la media, el error estándar y los intervalos de confianza. Comparamos la información espectral de cada formación vegetal con un análisis de varianza no paramétrico por permutaciones (NPMANOVA) con 10,000 permutaciones. Hicimos un análisis de agrupamiento a partir de las medias de las variables espectrales para representar las distancias entre formaciones vegetales (distancia euclideana, algoritmo UPGMA). Finalmente, realizamos un ACP y al primer componente lo correlacionamos con el obtenido a partir de la información de las comunidades de aves.
Asociación entre las variables espectrales y ecológicas
Evaluamos la asociación entre ambos tipos de información por dos vías. Primero, realizamos una prueba de Mantel (Mantel 1967) para hallar la asociación entre las distancias espectrales y comunitarias entre todos los conteos y se usó el addinsoft PopTools de Excel (distancia euclideana, 10,000 permutaciones). Segundo, realizamos una correlación lineal simple entre los componentes que explicaban la mayor proporción de varianza de los ACP de los grupos de variables analizados. El procesamiento estadístico lo realizamos con el programa Past 1.99 (Hammer et al. 2010). El nivel de significancia (α) empleado en las pruebas estadísticas fue de 0.05.
Resultados
Caracterización de las comunidades de aves
Durante los muestreos contabilizamos 1,298 aves pertenecientes a 73 especies, distribuidas en 14 órdenes y 33 familias (Anexo 1). Los órdenes mejor representados en cuanto a número de especies y abundancia fueron los Passeriformes con 19 especies y 254 individuos, Charadriiformes con 13 especies y 323 individuos y Ciconiiformes con 12 especies y 323 individuos. A diferencia de éstos, los órdenes Columbiformes y Phoenicopteriformes, aunque tuvieron una baja riqueza de especies de seis y una, respectivamente, presentaron una abundancia total de 176 y 130 individuos, respectivamente. La familia mejor representada fue Ardeidae con 10 especies y 204 individuos (Anexo 1). Fuera del conteo observamos otras especies: Platalea ajaja (seviya), Dendrocygna bicolor (yaguasín), Colinus virginianus (codorniz), Mycteria americana (cayama), Gallinula chloropus (gallareta de pico rojo), Tringa semipalmata (zarapico real) y Todus multicolor (cartacuba). Del total de especies registradas siete fueron endémicas (Anexo 1) y cinco estuvieron catalogadas en alguna categoría de amenaza nacional o mundial. Estas últimas fueron Fregata magnificens, Mycteria americana, Egretta thula, Egretta tricolor y Antigone canadensis nesiotes.
Las formaciones vegetales con mayor riqueza de especies y abundancia relativa fueron la vegetación emergente de lagunas y la vegetación de costa (Figura 2). Las medidas de tendencia central mostraron que existió mayor variación en las abundancias promedios y una ligera variación en la media del número de especies detectadas (Cuadro 1). Los índices de Simpson, calculados por formación vegetal, fueron mayores para el herbazal con palmas y la vegetación de laguna, mientras que el menor valor se obtuvo en el herbazal de ciénaga. Los valores medios del índice de Simpson fueron mayores para el bosque y el manglar y menores para la vegetación de laguna (Cuadro 1).
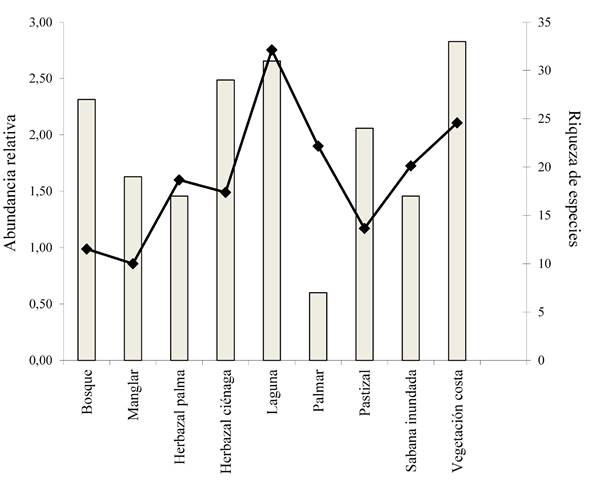
Figura 2 Abundancia relativa (número de individuos/minuto) y riqueza de especies (barras) de las comunidades de aves observadas en nueve formaciones vegetales del Gran Humedal del Norte de Ciego de Ávila, Cuba.
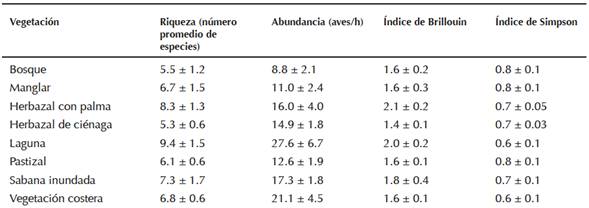
Cuadro 1 Estadísticos descriptivos (media ± error estándar) de los índices de diversidad de aves por formación vegetal en las localidades muestreadas en el Gran Humedal del Norte de Ciego de Ávila, Cuba.
Con las curvas de rango de abundancia comprobamos que las formaciones vegetales donde hubo mayor equidad fueron: el manglar, el herbazal con palmas y el bosque (Figura 3). La formación vegetal de menor equidad fue la vegetación costera (Figura 3). El gremio que predominó fue el de insectívoros-granívoros, para la mayoría de las formaciones vegetales.

Figura 3 Curvas de rango de abundancia de las comunidades de aves por formación vegetal en el Gran Humedal del Norte de Ciego de Ávila, Cuba.
Los dos primeros ejes del ACP, realizados con las variables comunitarias, explicaron 59.5% y 29.2 % de la varianza, respectivamente. Las formaciones vegetales de menor similitud fueron la vegetación de costa, el herbazal de ciénaga y la vegetación de laguna. Las formaciones restantes presentaron gran similitud y se agruparon hacia el centro del eje de los componentes. Esto pudo comprobarse con los resultados del análisis de agrupamiento.
Análisis de las variables espectrales de acuerdo con la formación vegetal
Cada formación vegetal tuvo una combinación propia y específica de valores en sus índices espectrales (Cuadro 2). El índice de verdor, relacionado con la coloración de la vegetación, mostró su menor valor en la vegetación costera (-20.3 ± 2.7). El valor mayor que obtuvimos para este índice perteneció al herbazal de ciénaga (-60.8 ± 2.1). El NDVI tuvo su mayor valor e intervalo en los manglares (0.4 ± 0.02). En cuanto a la humedad, la formación más representativa fue la vegetación de costa (-71.8 ± 2.8), mientras que el herbazal de ciénaga tuvo el mayor índice de diferencia de agua (0.7 ± 0.1).
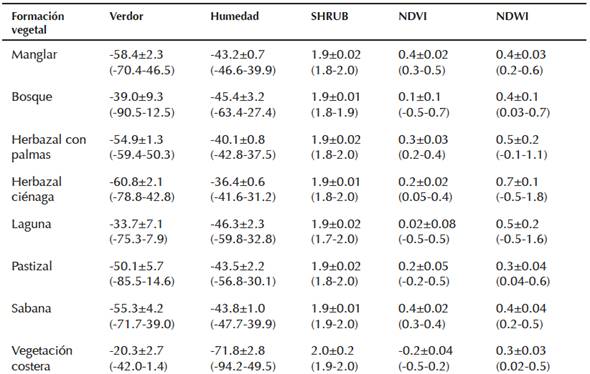
Cuadro 2 Estadísticos descriptivos (media ± error estándar [intervalos de confianza]) para las variables espectrales por formación vegetal. Verdor: Índice de Vegetación Verde; Humedad: Índice de Humedad; SHRUB: Índice de Densidad de Arbustos Vivos; NDVI: Índice Normalizado de Diferencia de Vegetación; NDWI: Índice Normalizado de Diferencia de Agua.
La vegetación costera, los bosques y la vegetación de las lagunas quedaron en el mismo grupo. Por otra parte, se agruparon los pastizales, las sabanas, los herbazales de ciénaga, los herbazales con palmas y los manglares. La vegetación costera se diferenció notablemente de las demás (F = 12.8; P < 0.0001), mientras que los bosques, los manglares y los herbazales con palmas presentaron semejanzas con el resto de las formaciones vegetales. Los herbazales de ciénaga tuvieron características espectrales similares a los herbazales con palmas. La sabana difirió únicamente de los herbazales de ciénaga. Los pastizales se diferenciaron de los herbazales de ciénaga y de la vegetación de laguna, quienes a su vez sólo se asemejan con los bosques.
Con el ACP de las variables espectrales los dos primeros ejes explicaron 74.2% y 24. % de la varianza, respectivamente. La vegetación costera se diferenció marcadamente del resto de las formaciones vegetales, mientras que entre el resto de los grupos de vegetación existió una fuerte superposición. La prueba de Mantel entre las matrices de distancias obtenidas a partir de las variables comunitarias y espectrales indicó que existe 85% de probabilidad de que la asociación observada fuese aleatoria (rm = 0.06; P (igualdad) = 0.85). La correlación entre los valores del primer componente de los ACP a partir de las variables ecológicas y espectrales no resultó significativamente diferente de cero, lo cual indica la ausencia de relación entre ambos tipos de información (y = 0.06x - 6E-08; r = 0.03; R2= 0.003; p = 0.8).
Discusión
Los humedales son lugares críticos para las aves, principalmente, por su alta productividad primaria y en consecuencia gran disponibilidad de recursos que favorecen la coexistencia de cientos de especies (Gatto et al. 2008). Las aves de humedales observadas hacen un uso diferenciado de las formaciones vegetales de acuerdo con la presencia de tipos de hábitats específicos, lo que muestra una respuesta especie-específica más similar entre especies con requerimientos ecológicos semejantes (Brandolin y Blendinger 2016). La mayor riqueza de especies y abundancia relativa de aves en la vegetación de laguna y la vegetación de costa reportada en este estudio la podemos asociar a la presencia de grandes cuerpos de agua que proveen una alta variedad de nichos. La escasa heterogeneidad de plantas que componen el herbazal de ciénaga (Zavaro y Oviedo 1993) explicaría la baja riqueza de aves que lo habitan y a su alta abundancia; se mantienen las mejor adaptadas a este hábitat y las generalistas. La variación de la abundancia relativa de aves en la laguna estuvo relacionada con la época de reproducción para algunas especies (Acosta et al. 1992). Por otro lado, en la vegetación de costa esta variación estuvo influenciada por el elevado número de flamencos que se alimentan en la zona hipersalina, debido probablemente a la elevada cantidad de materia orgánica acumulada en el fondo y a la disponibilidad de alimento. La salinidad afecta la composición de invertebrados y plantas presentes en los humedales y por lo tanto afecta indirectamente su uso como sitio de alimentación (Takekawa et al. 2006). Algunas especies como los flamencos pueden beneficiarse de los altos niveles de sal, ya que estos hábitats son favorables para invertebrados como los ostrácodos y crustáceos (Artemia sp.) que constituyen parte importante de su dieta (Esté et al. 2014).
Las condiciones del hábitat son importantes para entender que las aves usen o no los humedales. La variación en cuanto a la proporción de gremios en la laguna y la vegetación costera se relaciona con la disponibilidad de recursos tróficos asociados a estos hábitats (Abarca y Herzig 2001). La poca profundidad del agua en las áreas cubiertas por la vegetación costera justifica que predomine el gremio de las zancudas-sondeadoras. En este hábitat, las aves carnívoras pueden utilizar métodos versátiles de pesca y conductas cleptoparásitas. La profundidad del agua afecta la eficiencia de forrajeo (Holm y Burger 2002), ya que determina el acceso a los sitios de alimentación para aquellas aves con características morfológicas específicas como cuellos y patas largas (Ma et al. 2010).
La diferenciación de la vegetación costera, la laguna y el herbazal de ciénaga respecto a las demás formaciones vegetales, es razonable, ya que las variables que se midieron se relacionan directa e indirectamente a la presencia del agua. El herbazal de ciénaga tiene características distintivas que lo diferencian de las demás formaciones en cuanto a la dinámica de las comunidades de aves que lo utilizan, pues tiene periodos en los cuales está completamente inundado y otros en los que se seca (Zavaro y Oviedo 1993). En este estudio, el periodo de muestreo coincidió con la época de lluvias y las comunidades de aves observadas son típicas durante la inundación del herbazal.
La vegetación interior de las lagunas y la vegetación del borde fueron factores importantes para explicar la abundancia de aves en las lagunas del humedal. Muchas aves utilizan la vegetación y también necesitan áreas de aguas abiertas para alimentarse y nadar. La estructura de la vegetación acuática influye directamente en el uso de hábitat de las aves, ya que incrementa la heterogeneidad del hábitat (e.g.Naugle et al. 2000) y la disponibilidad de alimentos como semillas, hojas, tubérculos y rizomas (Ma et al. 2010). Por otra parte, la vegetación acuática provee camuflaje a los depredadores, refugio a las presas, protección ante condiciones climáticas severas y de materiales y sitios para la anidación. Todos estos factores crean relaciones complejas en las lagunas, lo que las convierte en hábitats particularmente importantes (e.g.Brandolin y Blendinger 2016).
El alto valor de verdor en los herbazales de ciénaga se puede atribuir a la presencia de mayor cantidad de vegetación de manera continua, contrario a lo observado en las lagunas y en la vegetación costera donde la vegetación está restringida y en la última se evidencia la presencia de saladares (áreas con elevadas concentraciones de sal). Los altos valores del índice de humedad en la vegetación costera pueden estar asociados a la proximidad con el mar, que junto con la naturaleza porosa del sustrato se combinan para producir una condensación de rocío (Crawford 1989). Este rocío puede aportar cantidades importantes de humedad a las plantas (Martínez et al. 1994), compensando su potencial hídrico (Barbour et al. 1985). El índice de matorrales (Shrub) también fue mayor en la vegetación costera por el predominio de este tipo de vegetación achaparrada. Los mayores valores del NDVI en los manglares se relacionan con la gran biomasa y productividad de estas formaciones vegetales. El NDVI está estrechamente correlacionado con la biomasa de las plantas y con la productividad primaria neta, la diferencia entre el carbono fijado por la fotosíntesis y el carbono perdido por la respiración de los autótrofos (Evans y Lange 2001). De esta forma, es uno de los mejores estimadores de energía y productividad del ecosistema, aunque en este estudio no estuvo relacionado con alguna variable comunitaria, de manera agrupada y en la forma analizada.
Las variables comunitarias y espectrales no estuvieron relacionadas quizás por una selección inapropiada de las variables, dado que éstas, de forma individual, no fueron capaces de discriminar entre la mayoría de las formaciones vegetales. Además, para este caso en particular, la presión antrópica en el área de estudio puede haber provocado variaciones en las comunidades de aves que habitan los remanentes de hábitats naturales, lo cual modifica de alguna manera la relación natural especie-ambiente. La relación entre energía, productividad, riqueza y diversidad de especies ha sido abordada y probada en múltiples sistemas ecológicos y escalas espaciales (e.g.Oindo y Skidmore 2002, Seto et al. 2004, Evans y Lange 2001). Sin embargo, a diferencia de estos estudios, el uso de medidas de textura basadas en el índice de vegetación reforzado (EVI: enhanced vegetation index) resultaría más eficiente y con mayor significado ecológico. Este índice optimizado fue diseñado para reforzar la señal de vegetación con una sensibilidad mejorada en regiones con gran biomasa. Se demostró recientemente que esta medida puede ser un indicador de la variabilidad y arreglo espacial de las características de la vegetación en un área (Tuanmu y Jetz 2015), por lo que sugerimos explorar su efectividad en el área de estudio.
Nuestros resultados no implican que el método sea poco eficiente o inútil para el monitoreo de la biodiversidad. Por el contrario, es válido como recurso metodológico y ofrece ventajas para profundizar en estudios ecológicos con fines de manejo y conservación. Aunque la teledetección no reemplaza el trabajo de campo y no identifica las especies de aves, su rareza y composición, sugerimos que dada la utilidad de las imágenes satelitales, se empleen con mayor frecuencia como herramienta complementaria en todos los estudios ecológicos en busca de patrones espaciales de la biodiversidad.











 nueva página del texto (beta)
nueva página del texto (beta)