Antecedentes
El síndrome de alergia oral (SAO) constituye una forma de presentación clínica única de alergia alimentaria que se caracteriza por síntomas orofaríngeos provocados por la exposición a alérgenos alimentarios específicos.1
Los estudios más antiguos que reconocen al SAO como entidad datan de 1987. Amlot et al. fueron los primeros en reconocer la presencia de un grupo de pacientes con alergia alimentaria que presentaban síntomas únicamente en cavidad oral, acuñando en ellos el término.2 Anderson et al., en 1970, establecieron por primera vez la correlación antigénica entre pólenes y frutas. 3 Kazemi-Shirazi et al. identificaron los epítopos de múltiples alimentos, mediante pruebas de RAST e inhibición de inmunoblot, que mostraban parecido con antígenos polínicos.4 De esta forma concluyeron que los alérgenos polínicos eran los responsables del desarrollo de SAO.
En 1996 surgió el concepto de síndrome de polen-frutas (SPF), por Lessof et al., quienes lo utilizaron para describir a un grupo de pacientes con alergias alimentarias causadas por reactividad cruzada entre los antígenos contenidos en los pólenes y frutas debido a proteínas homólogas.5 Desde entonces, la definición de ambas entidades ha constituido un desafío.
Algunos autores consideran que en SAO, los síntomas deben estar confinados estrictamente a la cavidad oral y que los cuadros con síntomas extraorales o sistémicos deben considerarse como anafilaxia. La anterior consideración deriva de la preocupación de que un mal diagnóstico pueda llevar a un tratamiento inadecuado de cuadros de anafilaxia inducida por alimentos, con sus consecuencias potencialmente fatales.6
Actualmente se sugiere que los pacientes con síntomas debidos a sensibilización primaria a pólenes que presentan reactividad cruzada con ciertos componentes alimentarios deben catalogarse como síndrome de polen-alimentos (SPA), lo cual corresponde a un mecanismo de alergia alimentaria tipo 2;7 y que los pacientes con sintomatología exclusivamente orofaríngea relacionada con la ingesta de cualquier alimento deben diagnosticarse con SAO, pudiendo ser consecuencia jgia alimentaria tipo 1 o 2. Cualquiera que sea la definición, es importante evaluar el riesgo de cada paciente para guiar su educación y tratamiento.
En la actualidad se ha descrito un gran número de antígenos capaces de producir SAO. De estos, el grupo más grande e importante lo constituyen las proteínas de respuesta a patógenos (PR). Estas proteínas se forman de manera natural en las plantas de órdenes mayores en respuesta a infecciones bacterianas o fúngicas o factores estresantes, como sequías, inundaciones, temperaturas bajo cero, rayos UV-B, ozono y trauma mecánico, entre otros. El grupo más largo de proteínas PR responsable de SAO corresponde a la familia PR-10. Un miembro clave de esta familia es el alérgeno mayor del abedul, Betula verrucosa (Bet v) 1. La sensibilización a dicho alérgeno causa reactividad cruzada con proteínas homólogas presentes en varios alimentos, entre ellos frutas del grupo Rosaceae como la manzana (Mal d 1), la cereza (Pru av 1), el durazno (Pru ar 1) y la pera (Pyr c 1); vegetales del grupo Apiaceae como la zanahoria (Dau c 1), el apio (Api g 1) y la papa (pSTH), así como la avellana (Cor a 1). Aunque Bet v 1 es un aeroalérgeno estable, las proteínas de la familia PR-10 son sensibles al calor y la digestión. Esta característica posiblemente explica la naturaleza temporal y autolimitada de los síntomas de SAO que causan estos alérgenos, al ser rápidamente desnaturalizados y destruidos por el proceso de digestión.8,9,10
Otro grupo importante lo constituyen las proteínas de la familia PR-5, en las cuales existen reactividad cruzada entre el alérgeno del cedro de montaña (Jun a 3), la cereza (Pru av 2), la manzana (Mal d 2) y el pimiento (P23). Por otro lado, también están las profilinas, proteínas de 12 a 15 kDa, monoméricas, de unión a actina, que se encuentran en células eucariotas y que median la interacción entre la membrana y el citoesqueleto; se encuentran involucradas en el síndrome de apio-artemisa-especias (AAE) y de igual forma tienen homología con otras proteínas de la manzana, pera (Pyr c 4), zanahoria (Dau c 4), apio (Api g 4), papa y tomate. Al igual que las PR son consideradas lábiles a la digestión gástrica, por lo que se han asociado con SAO.6,11,12
El común denominador de todas esas proteínas es su labilidad, la cual limita su potencial para causar síntomas sistémicos, sin embargo, pueden ocurrir. Por este motivo se hicieron estudios en los pacientes con SAO y reacciones sistémicas frecuentes, los cuales revelaron un nuevo grupo de panalérgenos: las proteínas de transferencia lipídica (LTP). Estas proteínas tienen la función de transportar fosfolípidos de los liposomas a las mitocondrias, pero también participan en la defensa contra hongos y bacterias, por lo que se han clasificado como familia PR-14. Por su estructura tridimensional son estables al calor y a la proteólisis, pudiendo ser causa de alergia alimentaria por mecanismos tipos 1 y 2.2,6 En países del sur de Europa, como España y Portugal, constituyen los alérgenos alimentarios más comunes relacionados con frutas y provocan síntomas moderados a severos de SAO, urticaria y anafilaxia.
Los síntomas típicos del SAO involucran únicamente a la mucosa oral y faríngea y consisten principalmente en prurito o sensación de quemazón de labios, boca, lengua o garganta, pero también puede presentarse hinchazón o angioedema de boca y lengua. Su progresión a síntomas sistémicos como vómito, diarrea, asma y urticaria es rara y el desarrollo de anafilaxia es excepcional.6,5,13 De acuerdo con las revisiones de Ortolani14 y Ma,7 hasta 9 % de los pacientes con SAO presenta síntomas extraorales, 3 % síntomas sistémicos sin síntomas orales y 2 % anafilaxia. De ahí la importancia de la adecuada caracterización de estos pacientes con manifestaciones potencialmente fatales.
En el diagnóstico de las alergias alimentarias, el reto oral doble ciego placebo controlado (RODCPC) es considerado el estándar de oro, que aplica también para el SAO. Algunos autores consideran que una historia clínica completa constituye el recurso más adecuado para establecer el diagnóstico en SAO, ya que evidenciaría la presencia de verdadera enfermedad6 debido a que por la fisiopatogenia única del SAO el proceso de cegamiento puede no garantizar la estabilidad del alérgeno implicado y el contacto necesario capaz de provocar la sintomatología clásica. Hay estudios que atribuyen un valor predictivo positivo de 100 % a la historia clínica y un valor predictivo negativo de 92 % al compararla con el RODCPC, por lo que en un futuro pudiera llegar a considerarse como el estándar de oro para el diagnóstico de esta entidad.15
Otro recurso importante es la prueba cutánea (PC), la cual ha sido utilizada en el apoyo diagnóstico de SAO, con sensibilidad y especificidad de 92 a 98 % y 82 a 100 %, respectivamente.15,16,17 La determinación de la IgE específica es otro método diagnóstico útil en SAO. Al igual que la PC, su sensibilidad y especificidad varían de acuerdo con el alimento probado, sin embargo, su principal utilidad radica en que permite hacer aproximaciones pronósticas más precisas en la valoración de la posibilidad de superar la alergia y el riesgo de presentar reacciones graves.16,18 De tal forma, el uso del diagnóstico molecular permitiría determinar qué pacientes con SAO, SPA o SPF presentan mayor riesgo de presentar reacciones graves, lo que haría posible establecer la conducta terapéutica más adecuada.
Hoy por hoy, el manejo del SAO consiste en la exclusión del alimento en cuestión, así como en la educación del paciente en cuanto a la identificación y manejo de la anafilaxia conforme a la determinación del riesgo de cada paciente, de ahí la importancia del diagnóstico molecular.19 Sin embargo, dadas las características fisiopatogénicas del SAO existen otras oportunidades de manejo específico en investigación, como la inmunoterapia.20,21,22,23,24
Dado que el SAO se debe a sensibilización primaria a aeroalérgenos, la inmunoterapia constituye una posibilidad de tratamiento específico. El primero en reportar tolerancia a alimentos tras un año de inmunoterapia fue Kelso.20 Desde entonces, en múltiples estudios se ha investigado el papel de la inmunoterapia subcutánea y sublingual en el manejo de SAO. En un estudio de 1995 realizado por Hermman et al.,21 45 % de los pacientes con SAO sometidos a inmunoterapia subcutánea para abedul por 3 años demostraron mejor tolerancia, aunque de manera transitoria. Por otro lado, Asero et al.22 reportaron una mejoría en 84 % de los pacientes. Desde entonces, varios autores han informado resultados favorables del manejo del SAO con inmunoterapia subcutánea, con aumento en la tolerancia en 69 a 89 % de los casos, algunos incluso con remisión completa de los síntomas.23 Sin embargo, los resultados a largo plazo todavía son cuestionables, con pérdida de la tolerancia a los 6 meses en 10 % de los casos y a los 3 años en 70 %; algunas investigaciones incluso señalan que menos 1 % de los pacientes mantiene la tolerancia tras 4 años de haber suspendido el tratamiento con inmunoterapia.24
Actualmente se estima que el SAO afecta a 5 % de la población pediátrica y a 8 % de la adulta.7 Sin embargo, la verdadera epidemiología del SAO es difícil de estimar dada la naturaleza leve de los síntomas, la dificultad de estos de ser reconocidos por los médicos y el mismo paciente, así como las controversias en su definición. Esta frecuencia es aún mayor, hasta de 70 %, en pacientes con otras comorbilidades alérgicas como rinitis alérgica y asma asociada con polinosis.25 En México, en el estudio Mexipreval se reportó que de los pacientes con sospecha de alergia alimentaria, 70 % correspondió a pacientes en edad pediátrica, presentándose como síndrome de alergia oral en 37.2 %.26 Un estudio en población adulta reportó una incidencia de 8 % en pacientes con poliposis nasal y sensibilización a olivo o abedul.27 Como puede observarse, es poco lo que se conoce todavía acerca de las características epidemiológicas del SAO en el mundo; en México es menor aún la información que existe, especialmente en población pediátrica.
Dado que cada vez más son más frecuentes los casos de alergia alimentaria y de SAO que se informan en el mundo, surge la necesidad de conocer las características clínicas y epidemiológicas de estos pacientes en la población mexicana, así como tratar de identificar los alérgenos y alimentos principalmente implicados, de forma que sea posible determinar la mejor ruta diagnóstica y terapéutica.
Métodos
Diseño
Estudio prospectivo, observacional, transversal y descriptivo en el que se incluyeron pacientes de 6 a 18 años con sospecha diagnóstica de SAO que acudieron a la consulta externa del Servicio de Alergia del Instituto Nacional de Pediatría entre marzo de 2015 y marzo de 2016. A los pacientes se les realizó historia clínica completa, la cual comprendió un interrogatorio dirigido a la semiología y síntomas de SAO, así como a las características de los alimentos asociados a este.
En todos los pacientes sospechosos se realizaron pruebas cutáneas a aeroalérgenos, prueba de punción cutánea con aplicación de alimentos frescos y prueba de reto oral abierta. Se diagnosticó SAO en los pacientes con cuadro clínico compatible, prueba cutánea y prueba de reto oral positivas, considerados en conjunto actualmente como el método diagnóstico de referencia.15,29
Se excluyeron los pacientes con alergia a látex y comorbilidades que contraindicaran la realización de alguna de las pruebas: asma no controlada, condición médica grave preexistente y uso de betabloqueadores; se eliminaron los pacientes con datos incompletos.
Todas las actividades relacionadas con este protocolo se regularon de acuerdo con lo establecido en el capítulo 1 del Reglamento de la Ley General de Salud publicado en el Diario Oficial el 6 de enero de 1987, así como en la Declaración de Helsinki de la World Medical Association y las Buenas Prácticas Clínicas de la International Conference on Harmonization. Para la realización de las pruebas cutáneas y prueba de reto oral abierto se obtuvo el consentimiento informado de uno de los padres (o tutor) y asentimiento informado del paciente cuando fue mayor de 16 años.
Historia clínica
Se realizó una historia clínica completa por un médico especialista en alergia, que incluyó un interrogatorio dirigido de las principales manifestaciones clínicas reportadas en la literatura para esta entidad (cosquilleo, entumecimiento, prurito, ardor, eritema, urticaria, hinchazón u otras) y las características de estas en cuanto a localización (labios, boca, paladar o lóbulo de la oreja), intensidad (leve, moderada, severa), tiempo de inicio (al contacto, con la masticación, en los primeros 5 minutos de la deglución de los alimentos, después de 15 minutos de haber sido ingeridos, dentro o después de los primeros 30 minutos de haber sido ingeridos) y duración (menos o más de 30 minutos); así como su asociación con signos y síntomas de eccema, rinitis, asma, síntomas gastrointestinales y signos y síntomas de anafilaxia. De igual forma, se interrogó respecto a los antecedentes personales patológicos en cuanto a la presencia de otras patologías alérgicas: rinitis alérgica, asma, dermatitis atópica y otras alergias alimentarias. Se obtuvo, además, información acerca de la preparación de los alimentos implicados (crudos, cocidos o en ambas presentaciones).
Pruebas cutáneas
Se realizaron pruebas cutáneas con un estándar de extractos aeroalergénicos que incluyó Quercus rubor, Fraxinus excelsior, Cupressus arizonica, Ligustrum vulgaris, Olea europea, Phleum pratense, Artemisa vulgaris y Ambrosia sp de la marca IPI; así como Alnus glutinosa y Betula verrucosa, de la marca ALK. Para lo anterior se sumergió una lanceta Duotip® (Lincoln Diagnostics, Inc. distribuido en México por la compañía ALK Bello) en el extracto alergénico y posteriormente se pinchó la piel, previa antisepsia, en un ángulo de 45º, levantando la piel al mismo tiempo de la puntura, tratando de evitar sangrado. Entre cada punción hubo una separación mínima de 2 cm. Para la prueba de punción cutánea con alimentos frescos primero se espoleó el alimento en cuestión con una lanceta Duotip® y después la piel con la punta embebida de la lancenta. La prueba se realizó en cada paciente con todos los alimentos que ellos asociaban a los síntomas de SAO. Se llevó a cabo un control negativo con solución glicerinada, así como un control positivo con histamina a una concentración de 1 mg/mL. La prueba fue leída entre los 15 y 20 minutos de haber sido realizada y se consideró como positiva si se manifestaron pápulas con diámetro mayor a 3 mm al promedio (D) del control negativo, siempre y cuando hubiera una respuesta igualmente positiva en la punción correspondiente al control positivo. El D se obtuvo de la sumatoria del diámetro mayor y el diámetro perpendicular a este, dividiendo la cifra entre 2.
Prueba de reto oral
La prueba de reto oral se hizo abierta para cada uno de los alimentos que el paciente asoció con los síntomas de SAO. Dado que esta prueba no se encuentra estandarizada para la mayoría de las frutas y vegetales implicados, se diseñó un protocolo de 4 pasos calculando las dosis en cada uno a partir de la porción total. Para ello se demedió a partir de la porción total a administrar consecutivamente y en un total de 4 ocasiones, de tal forma que la sumatoria de las porciones fuese igual a la porción total calculada por administrar. Para calcular el tamaño de la porción total para cada alimento se tomaron como referencia las porciones referidas en la Base Nacional de Datos de Nutrientes para Referencias Estandarizadas del Departamento de Agricultura de los Estados Unidos (U.S. Department of Agriculture, Agricultural Research Service. 2000. USDA Nutrient Database for Standard Reference, Release 13. The Service, Washington, D.C), tomando en cuenta la edad de cada paciente. Las porciones se administraron en dosis crecientes cada 15 minutos hasta completar las 4 dosis, para un total de 1 hora.
La prueba se dio por terminada si se presentaron datos objetivos de SAO (eritema, urticaria o edema) y se consideró positiva; en caso de presentarse síntomas subjetivos (cosquilleo, entumecimiento, prurito o ardor), si las características de los mismo lo permitían (intensidad leve o remisión antes de la siguiente toma) se continuo con el procedimiento hasta que se presentasen datos objetivos o se completara la dosis total, considerando la prueba en ambos escenarios como positiva; en caso de no presentar signos ni síntomas de SAO durante el reto oral, la prueba se consideró negativa.
Resultados
De marzo de 2015 a marzo de 2016 se revisaron 538 pacientes, de los cuales 53 cumplieron con los criterios de inclusión, corroborándose el diagnóstico de SAO de acuerdo con el método diagnóstico de referencia en 29 de ellos (5.3 %). De estos 29 pacientes con SAO, 45 % correspondió al sexo femenino y 55 % al masculino, con una relación hombre:mujer de 1:1.2. La edad promedio fue de 10 ± 3 años de edad, con una mínima de 6 y máxima de 15 años; 58.6 % de los pacientes se encontraba entre los 6 y 10 años de edad, 34.5 % entre los 11 y 14 años y 6.9 % entre los 15 y 18 años (Cuadro 1).

Cuadro 1 Características epidemiológicas de los pacientes con diagnóstico de síndrome de alergia oral
El promedio de alimentos implicados por paciente, de acuerdo con la historia clínica fue de 6.8 ± 4.1 y en la mayoría de las veces se asociaron 6 alimentos, con mínimo de 1 y máximo 14. La familia de las rosáceas fue responsable en 76 % de los casos, seguida de las musáceas con 48 %, lauráceas con 45 % y cucurbitáceas y fabáceas con 41 %. Los alimentos más frecuentemente reportados fueron manzana en 55 % de los casos, durazno y plátano en 48 %, pera y melón en 35 %, aguacate, almendra y nuez en 31 %; zanahoria, jícama y kiwi en 24 %; fresa, mango, papaya y uva en 20 %; naranja, ciruela, sandía y cacahuate en 14 %; capulín, guayaba, piña, jitomate, papa, lenteja, frijol, soya y trigo en 10 %; y cereza, coco, arándano, nopal, tuna, girasol, avellana y cacao en 3.5 % (Figura 1). En 90 % de los casos, los síntomas se presentaron con el consumo de alimentos crudos y 10 % en su forma cruda y cocida; ningún paciente refirió el desarrollo de síntomas solo con alimentos cocidos.
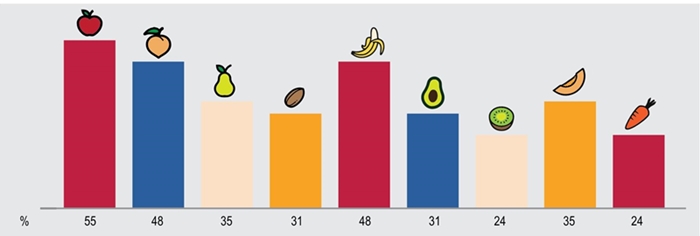
Figura 1 Alimentos más comunes en síndrome de alergia oral de acuerdo con la historia clínica y corroborados por prueba de punción cutánea con aplicación de alimentos frescos
De los 105 alimentos sospechosos como desencadenantes de síntomas de SAO, se documentó sensibilización por punción cutánea con aplicación del alimento en 87 (82.8 %). De los restantes 18 en los que no se pudo documentar la sensibilización mediante esta prueba, el reto oral abierto fue positivo para 4 (3.9 %) (Figura 2). De tal forma, se demostró sensibilización en 86.6 % de los alimentos sospechosos.

Figura 2 Porcentaje de sensibilizaciones comprobadas de los 105 alimentos sos-pechosos, por prueba de punción cutánea con aplicación de alimentos frescos o prueba de reto oral abierta, en la población estudiada.
En cuanto a las características clínicas, el síntoma predominante fue prurito (90 %), seguido de hinchazón (24 %), entumecimiento, cosquilleo, sensación extraña (17 %) y rash urticariforme (10 %). En todos los pacientes, las molestias se presentaron antes de los 15 minutos: en 58.6 % al morder o masticar los alimentos, en 34.5 % antes de 5 minutos de haberlos consumido y en 7 % antes de los 15 minutos. El 76 % de los pacientes refirió síntomas leves y 24 %, moderados; ninguno consideró sus síntomas graves ni haber presentado datos clínicos sugestivos de anafilaxia, eccema, rinitis ni asma. Entre las comorbilidades encontradas, 96.5 % de los pacientes presentó rinitis alérgica, 52 % asma, 34.5 % dermatitis atópica, 24 % las 3 entidades y 10 % otro tipo de alergia alimentaria (Cuadro 2).

Cuadro 2 Características clínicas del síndrome de alergia oral en la población estudiada de acuerdo con la historia clínica
Se documentó sensibilización a pólenes en todos los pacientes; se encontró más frecuentemente pruebas cutáneas positivas a Quercus robur y Alnus glutinosa, con 41 % para cada uno, a Fraxinus excelsior en 34.5 % y a Betula verrucosa en 31 %; además, a Cupressus arizonica en 24 % y a Phleum pratense, Ligustrum vulgaris y Olea europea en 20.6 % (Figura 3).
Discusión
El término SAO fue acuñado por primera vez en 1987 por Amlot et al. En 1988, Ortolani describió su asociación con rinitis alérgica y sensibilización a pólenes. Desde entonces, el término ha sido utilizado para describir la alergia que se relaciona con pólenes y frutas y se caracteriza por síntomas orofaríngeos. Sin embargo, actualmente se han descrito casos en los que dichos síntomas constituyen solo el inicio de una reacción alérgica sistémica grave, también se han observado pacientes que los presentan con alimentos diferentes a las frutas o que ni siquiera son vegetales. Se acuñaron otros términos como SPF, SPA, síndrome de hipersensibilidad por contacto a alimentos (SHCA), entre otros.1,5,29 Derivado de esto, surgió la necesidad de establecer el término más adecuado para describir al fenómeno derivado de la reactividad cruzada entre pólenes y alimentos o, incluso, entre alimentos y otro tipo de aeroalérgenos. Por otro lado, el conocimiento que se tenía acerca de las alergias alimentarias ha ido evolucionando en los últimos años.
De tal forma, actualmente sabemos que estas pueden producirse por un mecanismo de sensibilización primaria que ocurre en la mucosa intestinal, lo cual se conoce como alergia alimentaria tipo 1. En este mecanismo, los alérgenos suelen ser resistentes a la digestión, por lo que pueden producir síntomas graves, pero también pueden ser resultado de un mecanismo de sensibilización que ocurre fuera del tubo digestivo, principalmente en el tracto respiratorio o en la piel, lo que se conoce como alergia alimentaria tipo 2. A esta última corresponde el SAO, SPF, SPA o SHCA.
Dado que las enfermedades alérgicas cada vez son más frecuentes y la rinitis alérgica es la más común de ellas, es de esperar que el SAO sea una entidad más común de lo que actualmente se reconoce. No obstante, la información acerca de esta entidad en general es escasa. La prevalencia mundial estimada en la población pediátrica es de 5 %;7 en México, hasta el momento no existen estudios en dicha población. Existe una investigación realizada en adultos con poliposis nasal que identificó una prevalencia de 8 %.27 En la población analizada encontramos una prevalencia de 5.3 %, muy cercana a la estimada en el ámbito internacional en los niños.3,7 Según se identificó, se trata de una entidad frecuente en niños y el grupo etario más afectado es el de los escolares (entre 6 y 10 años), a diferencia de los informes internacionales en población pediátrica, en los cuales el SAO se presentó principalmente en el grupo de los adolescentes.
Similar a lo informado en la literatura internacional, en nuestra población su prevalencia fue discretamente mayor en mujeres y la rinitis alérgica fue la comorbilidad alérgica más importante.28
En el mundo, los alimentos más frecuentes que desencadenan SAO son la manzana, la cereza, el durazno, el melón y el kiwi;3,27 sin embargo, existen diferencias de acuerdo con la región y la población estudiada. En países del centro y norte de Europa, la manzana está implicada en 83 a 100 % de los casos y la sensibilización a abedul, la polinosis más común. En esta población, la presentación del cuadro se caracteriza por síntomas leves y transitorios, asociados con profilinas de la familia PR-10 y rinitis alérgica en la mayoría de los pacientes. En países del sur, como España, Italia, y Portugal, el durazno y la cereza fueron más frecuentes y la sensibilización a pólenes de pastos y malezas. Aunque también en esta región las profilinas son frecuentes, la participación de las LTP suele ser más importante; los cuadros de alergia alimentaria son más severos y no siempre se asocian con síntomas en el tracto respiratorio.30 Estudios efectuados en México indican que los alimentos más implicados son la manzana (37 %), el durazno (27 %), el plátano (23 %), el camarón (18 %) y el kiwi (18 %) (5).
En nuestra investigación, al igual que los registros internacionales, la manzana (55 %) y el durazno (48 %) fueron los más comunes,7,8,9,10,11,12,13,14 sin embargo, el plátano, que no fue un alimento común en otras poblaciones, ocupó el tercer lugar en orden de frecuencia (48 %), lo cual coincide con los estudios nacionales de Rodríguez et al., donde también ocupó el tercer lugar (23 %).5 De igual forma, a diferencia de las investigaciones en el norte de Europa, donde el abedul constituyó la polinosis más común en SAO, en nuestra población fue más frecuente la sensibilización al aliso y al roble, seguidos por el fresno y el abedul.
En SAO, por lo general los síntomas son de naturaleza leve y transitoria, 28 lo cual pudimos corroborar en nuestro estudio. Skypala et al. realizaron en 2011 un estudio con el objetivo de desarrollar y validar un cuestionario y algoritmo diagnóstico para pacientes con SAO, considerando el término de SPF como más adecuado por las características de su población. Dichas herramientas mostraron una sensibilidad y especificidad de 92 y 86 %, respectivamente, con valor predictivo positivo y negativo de 92 y 86 %. Al efectuar la comparación con el método diagnóstico de referencia,28 encontraron que la variable que mejor correlacionaba con el diagnóstico definitivo de SPF era la reacción con la ingesta de alimentos vegetales crudos y, en menor grado, la reacción a frutas y vegetales y como síntomas, el prurito oral y la comezón en la garganta. El inicio de los síntomas al morder o masticar los alimentos, así como la asociación de más de 4 alimentos fueron otras variables significativas.
Aunque no fue el objetivo de nuestro estudio, al comparar de manera retrospectiva las características clínicas de nuestra población con la de Skypala, observamos que en 90 % de los pacientes los síntomas se presentaron como reacción a la ingesta de los alimentos crudos y que el síntoma principal en 90 % de los casos fue el prurito oral; en 60 %, los síntomas iniciaron al morder o masticar los alimentos; el promedio de alimentos implicados fue de 6.8 ± 4.1; en 83 % se registraron más de 4 alimentos involucrados. Al parecer, similar a lo que sucede con la población del Reino Unido, la sensibilización a pólenes y la reacción cruzada de estos con las profilinas de las frutas, pudieran ser las responsables del desarrollo de SAO en nuestra población. El término SPF pudiera, de igual forma, ser apropiado para describir a este grupo de pacientes en nuestro país. Se requieren más estudios para determinar el componente alergénico polínico y alimentario responsable del SAO en México.
Una de las limitaciones de nuestro estudio es que el diagnóstico de SAO no se corroboró con la prueba de RODCPC, la cual si bien todavía es controversial, sigue considerándose como el estándar de oro para el diagnóstico en alergias alimentarias. Ahora bien, todos los pacientes analizados contaban con historia clínica compatible con SAO y evidencia de sensibilización a los alimentos por prueba de punción cutánea con exposición a alimentos frescos y por prueba de reto oral abierta, que en conjunto son consideradas por algunos autores como el procedimiento diagnóstico de referencia. Además, muchas de las diferencias encontradas pudieran estar asociadas con el sesgo derivado del tipo y grupo de pacientes que se atiende en la institución donde se efectuó la investigación.
Conclusiones
El SAO es una entidad común en la población mexicana, incluida la pediátrica, en la cual tradicionalmente se cree que son más comunes las alergias alimentarias mediadas por un mecanismo de sensibilización tipo 1. En nuestra población, el SAO se manifestó como una entidad de naturaleza leve y transitoria, asociada en más de 90 % de los casos con rinitis alérgica y evidencia de sensibilización a pólenes, por lo que el término de SPF pudiera también ser adecuado. No obstante lo anterior, en México están por ser identificados los alérgenos responsables del desarrollo del SAO, ya que probablemente sean diferentes a lo reportado en otros países. Por otro lado, aunque no fue el objetivo principal de nuestro estudio, el cuestionario y algoritmo diagnóstico de Skypala et al. podrían ser utilizado en el futuro como herramientas diagnósticas en la población mexicana. Nuestro trabajo nos permite estimar la prevalencia y características clínicas y etiopatogénicas del SAO en población pediátrica de nuestro país, por lo que se requieren más investigaciones para determinarlas claramente en los pacientes mexicanos en edad pediátrica.











 nueva página del texto (beta)
nueva página del texto (beta)



