En México, el bosque mesófilo de montaña (BMM, sensu Rzedowski 1978) es la formación vegetal que presenta mayor riqueza de especies de licofitas y helechos (pteridobiontes s.l., por compartir el mismo ciclo de vida) por unidad de área, pues, aunque ocupa sólo 0.4 % del territorio nacional alberga 630 de las 1,030 especies reconocidas (Riba 1998, Tejero-Díez et al. 2014, Villaseñor 2010). Sin embargo, la riqueza de pteridobiontes en las entidades federativas con mayor superficie de BMM de México: Chiapas, Oaxaca, Guerrero, Hidalgo, Veracruz, Jalisco y Puebla (INEGI 2016) no es proporcional a su superficie.
En el estado de Hidalgo se han realizado algunos estudios sobre flora vascular en general en varios municipios con BMM (Luna-Vega et al. 1994, Alcántara-Ayala & Luna-Vega 1997, 2001, Mayorga et al. 1998, Ponce-Vargas et al. 2006), donde se destaca la elevada riqueza de pteridobiontes. Además, existen varios trabajos en el BMM enfocados a conocer la composición de pteridobiontes en los municipios de Calnali (Pérez-Cervantes 2009), San Bartolo Tutotepec (Gutiérrez-Lozano et al. 2017), Tenango de Doria (Zúñiga-Salvatierra 2009), Tlanchinol (Álvarez-Zúñiga et al. 2012) y Zacualtipán de Ángeles (Pérez-Paredes et al. 2012). Aún con estos antecedentes, gran parte de la superficie estatal en donde se distribuye el BMM permanece sin estudios florísticos (Luna-Vega et al. 2000, Sánchez-González et al. 2016).
Aunque se reconoce la enorme importancia del BMM, por los servicios ecosistémicos a la sociedad mexicana, la cobertura original de esta formación vegetal ha mermado drásticamente en las últimas décadas (Aldrich et al. 1997, Toledo-Aceves 2010), debido sobre todo al cambio de uso del suelo y el estado de Hidalgo no escapa a esta tendencia (Arriaga et al. 2000, Luna-Vega et al. 2000, León-Paniagua et al. 2010, Villaseñor 2010, Leal-Jiménez 2014). Es probable que la carencia de iniciativas de manejo y conservación del BMM se deba a que no se han ponderado en forma cuantitativa la relación entre dichos servicios ambientales y el impacto antrópico. El grado de perturbación del BMM puede ser monitoreado en forma sencilla y robusta con estudios de su pteridoflora, ya que las especies que la conforman son vulnerables a cambios en las condiciones de humedad, luz y temperatura, por lo que son excelentes indicadoras de la “calidad del hábitat” (Karst et al. 2005, Hietz & Briones 1998), aspectos físicos que se alteran en los procesos de deforestación (Hietz-Seifert et al. 1996, Rodríguez-Romero et al. 2008, Carvajal-Hernández et al. 2017).
Los estudios sobre la composición y distribución de especies de licofitas y helechos en ecosistemas templados húmedos pueden servir también de referencia para evaluar los efectos del cambio climático y de uso de suelo sobre las poblaciones de plantas, con lo que pueden funcionar como primera aproximación para desarrollar programas de manejo y conservación de su diversidad (Sanginés-Franco et al. 2011). Por ello, los objetivos del presente estudio fueron: (1) realizar un inventario de las especies de licofitas y helechos del BMM del estado de Hidalgo y (2) estimar el valor del índice de diversidad taxonómica de ambos grupos de plantas en el BMM de Hidalgo y contrastarlo con el de otros estudios realizados en el mismo tipo de vegetación en diferentes estados de la República Mexicana.
Materiales y métodos
Área de estudio. El BMM primario en el estado de Hidalgo ocupa una superficie de aproximadamente 71,283.42 ha (INEGI 2016) y se distribuye en 24 de sus municipios. En este trabajo se realizó exploración de campo en 14 municipios que presentan BMM y se incluyó información sobre la composición de la pteridoflora de cinco municipios más, que contaban con estudios previos: Calnali (Pérez-Cervantes 2009), Tenango de Doria (Zúñiga-Salvatierra 2009), Tlanchinol (Álvarez-Zúñiga et al. 2012), Zacualtipán de Ángeles (Pérez-Paredes et al. 2012) y San Bartolo Tutotepec (Gutiérrez-Lozano et al. 2017). Los 19 municipios analizados en el presente estudio contienen más del 90 % de la superficie total estatal con cobertura de BMM primario (INEGI 2016), por lo que el inventario florístico puede ser considerado a nivel estatal. La elevada capacidad de dispersión de las licofitas y helechos (Page 1979, Karst et al. 2005, Walker & Sharpe 2010), refuerza la aseveración anterior.
La mayoría de las localidades visitadas para la recolección de ejemplares se encuentran en el extremo sur de la Sierra Madre Oriental (SMOr), dentro de la sub-cuenca del río Moctezuma, que pertenece a la región hidrológica del río Panuco. Además, se visitó el municipio de Tenango de Doria, que se localiza en la vecindad con la Faja Volcánica Transmexicana (FVT) (Luna-Vega & Alcántara 2004, Zúñiga-Salvatierra 2009). En el estado de Hidalgo el BMM se desarrolla en el intervalo altitudinal de 730 a 2,500 m, en sierras y montañas de topografía irregular y que presentan diferentes tipos de suelos derivados de rocas sedimentarias marinas (calizas, lutitas y margas del Cenozoico y Mesozoico en la SMOr) y de origen volcánico (desde ígneas andesitas, basaltos y riolitas hasta tobas del Cenozoico y Pleistoceno en la FVT), pero generalmente con horizontes superficiales oscuros con una capa gruesa de material orgánico en forma de humus y ricos en nutrimentos. El clima va de templado a semicálido húmedo, con temperaturas que oscilan entre 16 (17.1)-20 ºC y con precipitación acumulada anual desde 1,800 hasta 2,385 mm: la mayor parte se presenta en verano-otoño y en menor cantidad en invierno-primavera. Las condiciones de humedad señaladas y las neblinas características, provienen de los vientos húmedos alisios del Golfo de México, que en esta región chocan con la SMOr y se condensan por fenómenos adiabáticos (Ruiz-Jiménez et al. 2012).
Trabajo en campo. Consistió en la búsqueda de ejemplares de licofitas y helechos en distintas localidades de 14 municipios del estado de Hidalgo con BMM. En cada localidad se exploraron con detalle distintos tipos de microambientes (taludes, áreas rocosas, cuerpos de agua, escurrimientos, troncos de árboles, entre otros), con la finalidad de recolectar el mayor número posible de especies. Los ejemplares fueron herborizados de acuerdo con la técnica sugerida por Lorea & Riba (1990). Los municipios en los que se realizó la búsqueda y recolección de ejemplares en campo fueron: Acaxochitlán, Agua Blanca de Iturbide, Chapulhuacán, Eloxochitlán, Huazalingo, Huehuetla, Jacala de Ledezma, Juárez Hidalgo, La Misión, Lolotla, Molango de Escamilla, Tepehuacán de Guerrero, Tianguistengo y Xochicoatlán (Figura 1). En la selección de los sitios de recolección se consideró como característica principal, que no existieran señales evidentes de perturbación provocada por actividades humanas (Walker & Sharpe 2010).
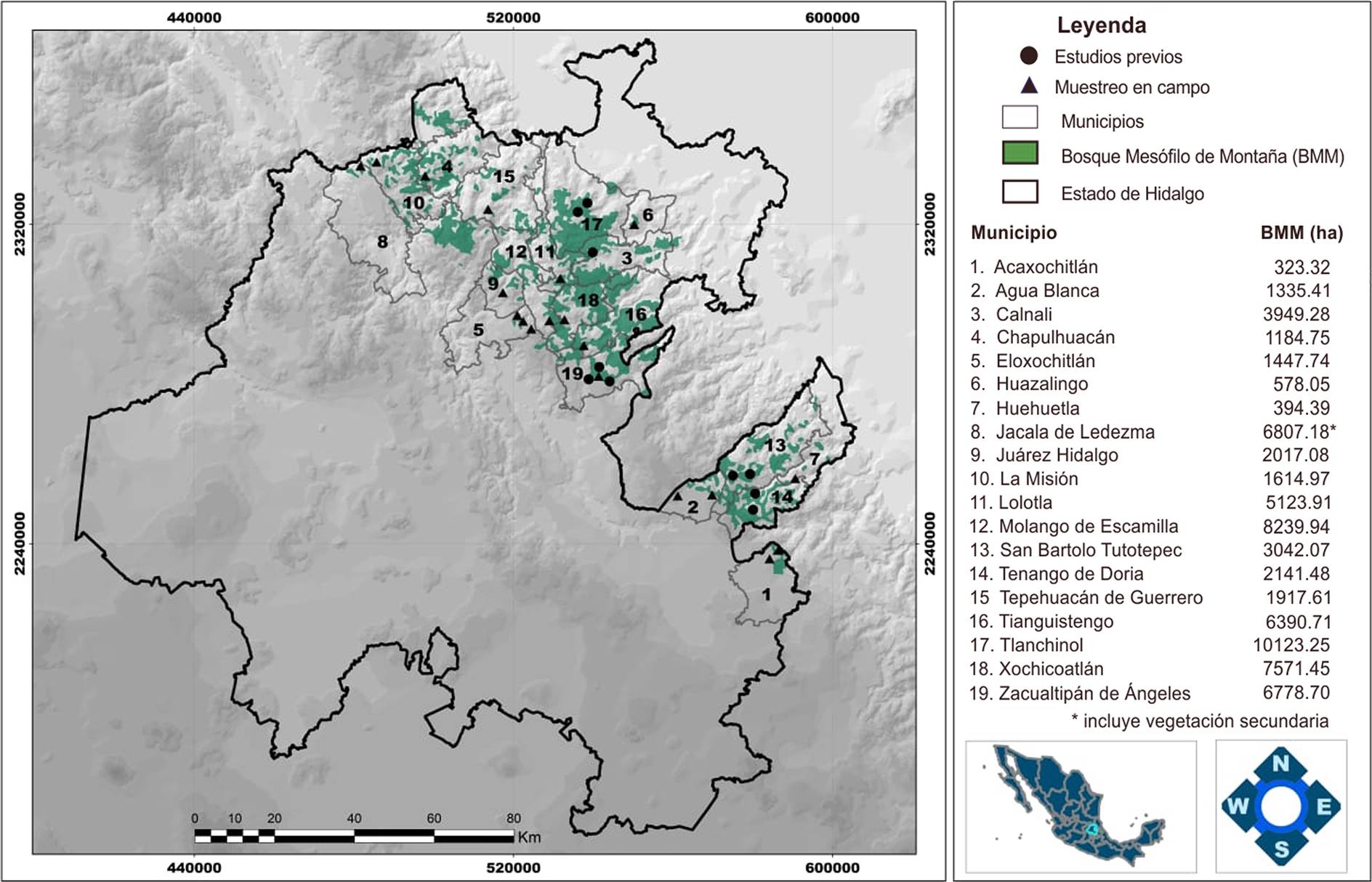
Figura 1 Área de estudio, que incluye 19 municipios con presencia de bosque mesófilo de montaña en el estado de Hidalgo, México.
Trabajo de laboratorio. El proceso de determinación de los especímenes se realizó con base en la obra de Mickel & Smith (2004) y los nombres fueron verificados con ejemplares tipo en JSTOR Global Plants (2018). En el listado florístico se consideró la clasificación de PPG 1 (2016). La pertinencia de la nomenclatura fue actualizada de acuerdo con las bases de datos Catalogue of Life (Roskov et al. 2015) y la forma de abreviar los autores con la base de datos en Tropicos (2018).
Índice de diversidad taxonómica. Para comparar la riqueza de especies de licofitas y helechos del BMM de distintos estados, fue necesario considerar el tamaño del área, para ello se utilizó el índice de diversidad taxonómica o IB, que se obtiene dividiendo el número de especies registradas (S) entre el logaritmo natural (ln) del tamaño del área (A); preferentemente en hectáreas: IB = S/ln A, que nos indica la proporción de especies existentes por unidad de área considerada (Squeo et al. 1998). Los estados con BMM considerados en la comparación, con la respectiva fuente de información fueron los siguientes: Estado de México (Tejero-Díez & Arreguín-Sánchez 2004), Puebla (Rodríguez-Acosta et al. 2004), Chiapas, Guerrero, Jalisco, Oaxaca, Querétaro y Veracruz (Tejero-Díez et al. 2014). La superficie (ha) que ocupa el BMM en cada una de las entidades consideradas, fue obtenida de INEGI (2016).
Resultados
Composición florística. Se recolectaron 205 ejemplares de licofitas y helechos, que una vez determinados correspondieron a 118 especies, 52 géneros y 19 familias. Este número de taxa, junto con los recopilados en los trabajos de Mickel & Smith (2004), Pérez-Cervantes (2009), Zúñiga-Salvatierra (2009), Álvarez-Zúñiga et al. (2012), Pérez-Paredes et al. (2012) y Gutiérrez-Lozano et al. (2017) suman un total de 279 especies de pteridobiontes (con 14 variedades) que se agruparon en 91 géneros y 29 familias. En Lycopodiopsida se incluyen dos familias, 6 géneros y 31 especies; mientras que en Polypodiopsida son 27 familias, 84 géneros y 248 especies (Tabla 1, Figura 2, Apéndice 1).
Tabla 1 Número de especies de licofitas y helechos en el BMM de Hidalgo, con respecto a los registrados en México, en el BMM de México y en el estado de Hidalgo.
| México | BMM de México | Hidalgo | BMM de Hidalgo | |
|---|---|---|---|---|
| Especies de licofitas y helechos: | 1,0301 | 6301 | 3622 | 2793 |
| Porcentaje de especies de licofitas y helechos del BMM de Hidalgo con respecto a: | 27.08 | 44.29 | 77.07 | 100 |
1 Tejero-Díez et al. (2014); 2Sánchez-González et al. (2016); 3presente estudio.

Figura 2 Algunas especies de helechos característicos del BMM del estado de Hidalgo, México. A. Polypodium rhodopleuron Kunze, B. Cyathea fulva (M. Martens & Galeotti) Fée, C. Pleopeltis angusta Humb. & Bonpl. ex Willd. var. angusta, D. Psilotum complanatum Sw., E. Gleichenella pectinata (Willd.) Ching, F. Alansmia senilis (Fée) Moguel & M. Kessler, G. Adiantopsis radiata (L.) Fée, H. Diplazium ternatum Liebm. I. Marattia laxa Kunze, J. Cyathea fulva (M. Martens & Galeotti) Fée, K. Lophosoria quadripinnata (J. F. Gmel.) C. Chr., L. Elaphoglossum peltatum (Sw.) Urb.
En Polypodiopsida, las familias más representativas fueron: Pteridaceae, Polypodiaceae, Dryopteridaceae, Aspleniaceae y Thelypteridaceae con 50, 50, 38, 20 y 18 especies, respectivamente y en Lycopodiopsida, Selaginellaceae con 24 especies. Nueve de los 91 géneros definidos en el BMM de Hidalgo poseen ocho o más especies: Selaginella (24), Asplenium (19), Elaphoglossum (16), Pleopeltis (14), Pecluma (10) Pteris (9), Adiantum (8), Polypodium (8) y Amauropelta (8); 16 géneros entre 3 y 7 especies y el resto (66) entre 1 y 2 especies (Tabla 2).
Tabla 2 Familias y géneros con mayor riqueza especies en el BMM del estado de Hidalgo
| Familia | Número de especies | Géneros | Número de especies | |
|---|---|---|---|---|
| Pteridaceae | 50 | Selaginella | 24 | |
| Polypodiaceae | 50 | Asplenium | 19 | |
| Dryopteridaceae | 38 | Elaphoglossum | 16 | |
| Selaginellaceae | 24 | Pleopeltis | 14 | |
| Aspleniaceae | 20 | Pecluma | 10 | |
| Thelypteridaceae | 18 | Pteris | 9 | |
| Hymenophyllaceae | 11 | Adiantum | 8 | |
| Blechnaceae | 9 | Amauropelta | 8 | |
| Dennstaedtiaceae | 9 | Polypodium | 8 | |
| Athyriaceae | 7 | Myriopteris | 7 | |
| Lycopodiaceae | 7 | Anemia | 6 | |
| Anemiaceae | 6 | Campyloneurum | 5 | |
| Gleicheniaceae | 5 | Christella | 5 | |
| Cyatheaceae | 3 | Diplazium | 5 | |
| Cystopteridaceae | 2 | Dryopteris | 5 | |
| Dicksoniaceae | 2 | Gaga | 5 | |
| Equisetaceae | 2 | Phanerophlebia | 5 | |
| Marattiaceae | 2 | Dennstaedtia | 4 | |
| Ophioglossaceae | 2 | Hymenophyllum | 4 | |
| Psilotaceae | 2 | Pityrogramma | 4 |
El sustrato de crecimiento en el que se encontró el mayor número de especies fue el terrícola, con 136 (49.27 %), 73 especies (26.44 %) crecen en dos o tres sustratos, 31 (11.23 %) sólo sobre forófitos (corticícolas o epífitas) y 26 (9.42 %) tienen como único sustrato las rocas (rupícola). Sólo 16 (5.8 %) no muestran especificidad por algún tipo de sustrato (es decir, que crecen en 2 o 3 sustratos). El resto de los pteridobiontes se encontraron en dos sustratos: 30 especies son rupícolas o terrícolas, 16 son corticícolas o terrícolas y 11 tienen hábito corticícola o rupícola.
Índice de diversidad taxonómica. A partir de la información de estudios florísticos realizados en el BMM en diferentes entidades federativas de la República Mexicana, se estimó que el BMM del Hidalgo es el tercero más rico de especies por unidad de área o índice de diversidad taxonómica (IB) al alcanzar 24.96 especies (ha), antecedido por Oaxaca (32.17) y Veracruz (34.53) y seguido por Puebla (21.79) y Chiapas (21.75), estados cuya ubicación geográfica corresponde en general a las principales regiones montañosas del país: Sierra Madre del Sur, Sierra Madre Oriental, Sierra Madre Occidental y Serranías Transístmicas (Tabla 3).
Tabla 3 Índice de diversidad de pteridobiontes de los estados con mayor cobertura de BMM en México
| Estado | Superficie con BMM (ha)1 | Número de especies | Región de procedencia del BMM | IB= S/lnA |
|---|---|---|---|---|
| Chiapas | 224493,8 | 2682 | Serranías Trans-ístmicas | 21.75 |
| Guerrero | 104684,1 | 2232 | Sierra Madre del Sur occidente | 19.29 |
| Hidalgo | 71541,4 | 2793 | Sierra Madre Oriental centro | 24.96 |
| Jalisco | 33465,1 | 1152 | Sierra Madre Occidental sur/ Faja Volcánica Transmexicana occidente | 11.04 |
| México | 10828,5 | 1494 | Faja Volcánica Transmexicana centro-occidente | 16.04 |
| Oaxaca | 221839,6 | 3962 | Sierra Madre del Sur oriente y occidente | 32.17 |
| Puebla | 29163,8 | 2245 | Sierra Madre Occidental sur | 21.79 |
| Querétaro | 327,8 | 1102 | Sierra Madre Occidental centro | 18.99 |
| Veracruz | 43787,8 | 3692 | Sierra Madre Oriental/Sierra Madre del Sur | 34.53 |
1 INEGI (2016), 2Tejero-Díez et al. (2014), 3 Presente estudio, 4Tejero-Díez & Arreguín-Sánchez (2004), 5Rodríguez Acosta et al. (2004).
Discusión
Los resultados indican que el BMM del estado de Hidalgo posee 27.1 % de las especies que componen la Pteridoflora de México (1,030 especies: Tejero-Díez et al. 2014), 77.1 % de la estatal (362 especies: Sánchez-González et al. 2016) y 83.2 % de la región III que comprende los estados de Hidalgo, Puebla, Querétaro y parte San Luis Potosí (Tejero-Díez et al. 2014), de acuerdo con la regionalización del BMM en México de la CONABIO (2010). Esta riqueza de especies representa, además, 44.3 % del total de especies presentes en el BMM de México (Tejero-Díez et al. 2014).
Tal como ocurre en entidades como Querétaro (Cartujano et al. 2002), Veracruz (Tejero-Díez et al. 2011) y a nivel Nacional (Tejero-Díez et al. 2014), en Hidalgo el BMM es el tipo de vegetación que contiene la mayor riqueza de especies de licofitas y helechos (Sánchez-González et al. 2016). Los factores que están asociados con esta elevada riqueza taxonómica de pteridobiontes en el BMM son probablemente la alta heterogeneidad ambiental del gradiente de altitud (Bickford & Laffan 2006, Kluge et al. 2006), la elevada humedad ambiental-atmosférica en el intervalo de distribución del bosque, que favorece a los dos grupos de plantas en su reacción estomática y presencia de luz (Kawai et al. 2003, Brodribb et al. 2005) y la ocupación del estrato vertical de vegetación (epifítico), que en Hidalgo contiene al menos 31 % de las especies registradas, aspectos que generalmente no se dan a mayores o menores altitudes (Jean-Yves et al. 2009, Schneider et al. 2004, Tejero-Díez et al. 2014).
En el presente estudio, los nueve géneros más representativos de licofitas y helechos contienen 41.7 % de las especies (ocho o más especies cada uno). La existencia de una alta proporción de géneros con pocas especies no tiene relación con el grado de completitud del inventario de especies de pteridobiontes. En cambio, corrobora un patrón biogeográfico ampliamente documentado en diferentes regiones templadas del planeta, según el cual una secuencia de pocos taxones comprende la mayoría de las especies de una flora determinada (Tolmatschew 1971, Rzedowski 1978). Estos nueve géneros representativos y característicos del BMM de Hidalgo, podrían ser considerados como indicadores ambientales, dado que su espectro taxonómico coincide con el observado a nivel nacional para este tipo de vegetación (Tejero-Díez et al. 2014): en el que los géneros más comunes son Adiantum, Asplenium, Diplazium, Elaphoglossum, Hymenophyllum, Pecluma, Pleopeltis, Polypodium, Pteris, Selaginella y Thelypteris (s.l.).
Las características que se pueden considerar como típicas de la pteridoflora del BMM en Hidalgo, son: a) Selaginella es el género con mayor riqueza de especies, b) la presencia notable de especies de Asplenium y Elaphoglossum, c) la prevalencia del complejo Polypodium-Pleopeltis, d) la elevada riqueza de especies de los géneros que antes se consideraban como Thelypteris (16), entre lo que destaca Amauropelta con 8 especies, y e) el bajo número de especies de Diplazium e Hymenophyllum. De acuerdo con Korall & Kenrick (2002) y Walker & Sharpe (2010), Selaginella (el grupo heterófilo homeohídrico) y Thelypteris (s.l.) son géneros comunes en climas cálidos y en áreas abiertas, el primero en sotobosque y el segundo en ríos, arroyos, escurrimientos de agua y zonas ruderales, aspecto que define bien al BMM en Hidalgo, el cual está sumamente impactado (CONABIO 2010). Los géneros Asplenium y Elaphoglossum, aunque son los más diversos en México (Mickel & Smith 2004), tienen a su vez un lugar prominente en el sotobosque de la zona montañosa húmeda (Rouhan et al. 2004, Mehltreter 2008a), mientras que el complejo Polypodium-Pleopeltis domina el estrato vertical o epifito (Smith & Tejero-Díez 2014). Los géneros Diplazium e Hymenophyllum son comunes en el límite altitudinal inferior cálido-húmedo del BMM, por lo que su menor riqueza específica puede estar asociada con el hecho de que el estado de Hidalgo no tiene salida al mar (Nieder et al. 1999, Krömer & Kessler 2006, Mehltreter 2008a). En contraste, los géneros de pteridobiontes típicos de otros tipos de vegetación en climas subhúmedos, como por ejemplo en bosques de Quercus, de coníferas (Ramírez-Cruz et al. 2009), matorral xerófilo (Pérez-Paredes et al. 2012, Pérez-Atilano et al. 2015) o bosque tropical, son diferentes y la mayoría pertenecen a Pteridaceae (Adiantum y Myriopteris), Dryopteridaceae (Ctenitis) y Thelypteridaceae (Goniopteris).
En general, las poblaciones de las especies de pteridobiontes no presentan alta densidad y/o cobertura. Sin embargo, en el BMM de Hidalgo Pteridium spp., Selaginella spp., Lophosoria quadripinnata y las especies de Gleicheniaceae prosperan bien en sitios perturbados (Walker & Sharpe 2010, Rodríguez-Romero et al. 2008, Tejero-Díez et al. 2011, Mehltreter 2008a, 2008b, Gutiérrez-Lozano et al. 2017), producto de actividades como la agricultura, ganadería, tala ilegal y construcción de casas a que está sujeta esta vegetación en la entidad (León-Paniagua et al. 2010, observación personal). La evaluación de estas especies tiene interés como bioindicador sinantrópico y será conveniente desarrollar índices al respecto en el futuro.
Si bien, en lo general el número de especies tiende a incrementarse conforme el tamaño del área aumenta (Whittaker et al. 2001), en el BMM actúan otros factores adicionales como la productividad, la disponibilidad de energía (clima) y el grado de la heterogeneidad ambiental (incluido el impacto antrópico), por lo que sólo así se puede explicar que el estado de Hidalgo, con el cuarto lugar de superficie con BMM a nivel nacional, ocupe el tercer lugar en riqueza de especies de licofitas y helechos (IB: 24.96) en México, sólo después de Oaxaca y Veracruz (García-Franco et al. 2008, Anta-Fonseca et al. 2010, Challenger et al. 2010, Pérez-Farrera & Gómez-Dominguez 2010, Álvarez-Zúñiga et al. 2012).
A nivel mundial y en México, la mayoría de las especies de pteridobiontes se desarrollan sobre suelo y un porcentaje menor (desde 0 hasta cerca de 40 % en México, dependiendo de la humedad y calidad del forófito) son epífitas (Pérez-García et al. 1995, Watkins et al. 2006). Acorde con lo anterior, un alto porcentaje de especies de Pteridobiontes del BMM del estado de Hidalgo son de hábito terrestre (71.15 %) y en segundo lugar epífitas (26.79 %) (Vázquez et al. 2006, Pérez-Cervantes 2009, Zúñiga-Salvatierra 2009, Álvarez-Zúñiga et al. 2012, Tejero-Díez et al. 2014). Algunas especies epífitas tienen también la capacidad de crecer sobre rocas (Asplenium), cerca de escorrentías donde adquieren el agua necesaria para su desarrollo (Page 1979, Mehltreter 2008a, Tejero-Díez et al. 2014), por lo que sistemas con presencia de estos microambientes promueven el aumento del número de taxones en cada localidad.
De las 279 especies de licofitas y helechos determinadas, ocho (2.87 %) se encuentran en alguna categoría de riesgo de la NOM-059 (SEMARNAT 2010), lo que representa sólo 3.6 % con respecto al total de la pteridoflora registrada en el BMM de México (Tejero-Díez et al. 2014): Nephrolepis cordifolia se considera en peligro de extinción; Campyloneurum phyllitidis y Psilotum complanatum amenazadas y Alsophila firma, Cyathea fulva, Dicksonia sellowiana, Marattia laxa y M. weinmanifolia bajo protección especial.
Aunque el porcentaje de especies de licofitas y helechos que se encuentran en alguna categoría de riesgo en la Norma Oficial Mexicana (SEMARNAT 2010) es bajo, este indicador no es robusto en México pues incluye algunas especies que no requieren de protección e ignora otras en riesgo inminente de extinción (Tejero-Díez et al. 2011, Tejero-Díez et al. 2014). Es necesario considerar más especies, en particular las endémicas de escasa densidad y/o frecuencia por el elevado grado de fragmentación y perturbación de su hábitat. Hace casi dos décadas la cobertura del BMM en el estado de Hidalgo era de aproximadamente 21,641 ha (Ortega-Escalona & Castillo-Campos 1996), lo que representaba cerca de 1.03 % de la superficie estatal. Datos más recientes aportados por León-Paniagua et al. (2010) indican que menos de 0.5 % del territorio que ocupa se encuentra “protegido”. Actualmente existen iniciativas para la protección de este ecosistema que todavía no se han concretado (León-Paniagua et al. 2010, Leal-Jiménez 2014). Durante los recorridos de campo se observó que el grado de perturbación es muy elevado, en algunos sitios sólo existe vegetación secundaria. Es importante resaltar que en el pequeño espacio que ocupa el BMM de Hidalgo, se concentra 77.1 % de las especies de licofitas y helechos presentes en la entidad. Varios autores han llamado la atención sobre la urgencia de establecer programas de manejo y conservación del BMM de Hidalgo y de México en general, debido a la enorme riqueza de especies por unidad de área que posee, los servicios ambientales que brinda y al enorme deterioro y perdida de la cubierta vegetal a la que está siendo sometido (Myers 1997, Luna-Vega et al. 2000, Rodríguez-Ramírez et al. 2013). A partir de los datos emitidos en este estudio, un monitoreo sistemático en intervalos de tiempo podría indicar el grado de deterioro que el BMM desarrolla por el impacto de las actividades humanas. El creciente deterioro de los bosques puede provocar que varias especies se extingan localmente o bien que otras se vuelvan comunes (Arcand & Ranker 2008).











 nueva página del texto (beta)
nueva página del texto (beta)


