Introducción
La enfermedad granulomatosa crónica (EGC) es un error innato de la inmunidad caracterizado por la disfunción de los fagocitos para producir especies reactivas de oxígeno. La causa radica en un deterio ro funcional del complejo enzimático NADPH oxidasa y de la chaperona Eros.1 El complejo está conforma do por cinco subunidades (p22phox, p40 phox , p47 phox , p67 phox y gp91phox). El gen CYBB codifica para subunidad gp91 phox , sus variantes patogénicas se transmiten con una herencia recesiva ligada al X. Los genes EROS, NCF1, NCF2, NCF4 o CYBA codifican para Eros, p47 phox , p67 phox , p40 phox , p22 phox respectivamente, sus variantes patogénicas se trasmiten con un patrón de herencia autosómica recesiva. Las variantes patogénicas en los genes CYBB y NCF1 son la causa más frecuente de EGC; NCF2 es el gen menos frecuentemente asociado a EGC. La ausencia de especies reactivas de oxígeno tiene como consecuencia una falta en la regulación de las diferentes vías de inflamación y una falla en la destrucción de determinados microorganismos.2,3 Los pacientes afectados tienen inflamación granulomatosa y una mayor susceptibilidad genética a infecciones fúngicas y bacterianas (incluyendo las micobacterias como Mycobacterium tuberculosis y Mycobacterium bovis-Bacilo de Calmette y Guérin [BCG].4,5,6 Los mi croorganismos que infectan a los pacientes con EGC pueden variar entre las diferentes regiones geográficas, por ejemplo, en Europa y Estados Unidos de Norte América las infecciones micobacterianas son raras; sin embargo, en Latinoamérica son frecuentes (7, 8). Presentamos dos lactantes de dos familias no relacionadas de la etnia Maya con EGC e infección por BCG; las variantes patogénicas responsables de la enfermedad se hallaron en NCF2, hasta donde es de nuestro conocimiento, dos de ellas no se han descrito previamente en la literatura.
Pacientes y métodos
Métodos. Previo a la firma de consentimientos, se procedió a la extracción de sangre periférica de pacientes y controles sanos en Mérida, Yucatán; las muestras se enviaron por paquetería a temperatura ambiente y se procesaron 24 horas después de su toma. Se realizó la medición de peróxido de hidrógeno en neutrófilos de sangre periférica por la técnica de 1,2,3 dihidrorrodamina usando como estímulos forbol 12-miristato-13 acetato y zimosán opsonizado, según el protocolo descrito previamente (4). Se realizó la medición intracelular de las diferentes subunidades de la enzima NADPH oxidasa en neutrófilos de sangre periférica usando citometría de flujo, según el protocolo descrito previamente.4 La extracción de ADN se realizó usando el equipo comercial AxyPredTMBlood genomic DNA miniprep kit. La amplificación y la secuenciación Sanger de los diferentes exones del gen NCF2 se realizó según el protocolo descrito anteriormente.4
Paciente I. Lactante masculino de dos años, unigénito, ambos padres no son consanguíneos y pertenecen a la etnia maya de la comunidad Akil, Yucatán (Figura 1 ). El paciente I recibió la vacuna de BCG al nacer; a los 10 meses de vida presentó gastroenteritis infecciosa aguda que requirió hospitalización durante dos semanas, en el coprocultivo se aisló Salmonella spp. Seis meses después reingresó, el diagnóstico fue una gastroenteritis y fiebre, recibió inicialmente amikacina y clindamicina sin respuesta terapéutica. Durante el abordaje diagnóstico se detectó una adenopatía axilar derecha (20 x 20 mm), su estudio histopatológico mostró una linfadenitis crónica granulomatosa con células gigantes de tipo Langerhans y necrosis caseosa; la prueba intradérmica de tuberculina (PPD) fue positiva (10 mm) a las 48 horas (consideramos que los pacientes vacunados con BCG pueden presentan un resultado falso positivo.9 Se concluyó que el paciente cursaba una infección micobacteriana ganglionar y se inició isoniazida, etambutol, rifampicina y pirazinamida (la mezcla de los cuatro medicamentos se comercializa en México en una tableta con el nombre de DOTBAL; en el mercado no está disponible una presentación sin pirazinamida para tratar la infección por BCG).
Figura 1 Ubicación de las localidades de origen de los casos clínicos. A) Mapa del estado de Yucatán. B) Municipios de Kanasín y Akil, Yucatán.
Durante su hospitalización el paciente persistió febril, se continuó el abordaje diagnóstico y se aisló Serratia marcescens en secreción bronquial, así que se decidió suspender los antifímicos y se agregó meropenem; sin embargo no hubo mejoría, así que se solicitó una tomografía axial computarizada (TAC) de tórax (simple y contrastada) que evidenció imágenes de consolidación parenquimatosa en los lóbulos tercio medio y superior de pulmón derecho, sugestivas de infección fúngica; por lo anterior se administró anfotericina B durante tres semanas, observando una respuesta clínica favorable. Dos meses después de su ingreso, el paciente se egresó a su domicilio con profilaxis antimicrobiana con trimetoprima / sulfametoxazol e itraconazol.
Ante las múltiples infecciones graves que no mejoraban con los antimicrobianos se consideró descartar un error innato de la inmunidad (también conocidos como inmunodeficiencias primarias). La inmunidad humoral se evaluó midiendo inmunoglobulinas séricas IgA 82.9 mg/dL (14-106), IgG 1500 mg/dL (345 -1213) e IgM 302 mg/dL (43-1739); el valor de IgG se halló por arriba del valor normal. La fagocitosis se evaluó a través de la medición del estallido respiratorio en los neutrófilos, los resultados se describen abajo.
Paciente II. Lactante masculino de 1 año 8 meses de edad, hijo de padres no consanguíneos, pertenecientes a la etnia maya de la comunidad Kanasín (Fi gura 1); su hermano primogénito falleció al año de vida con el diagnóstico de tuberculosis diseminada. El paciente II recibió la vacuna de BCG al nacer; a los 10 meses de edad fue evaluado en el hospital por presentar fiebre, a la exploración física se encontró retraso en la cicatrización en el sitio de la aplicación de la vacuna de BCG, crecimiento ganglionar axilar derecho (15 x 15 mm) y cervical izquierdo (2 x 2 mm). La prueba de tuberculina (PPD) fue positiva (13 mm). La TAC toracoabdominal simple y contrastada mostró imágenes de consolidación apical posterior de lóbulo superior izquierdo del pulmón con un área de cavitación central, engrosamientos centrolobulillares e imagen en vidrio despulido en segmentos inferiores; además aumento de volumen de los ganglios linfáticos paratraqueales, mesentéricos, pélvicos e inguinales; el ganglio axilar derecho de 15 x 16 mm de aspecto necrótico. Posteriormente, se le realizó una broncoscopía; el análisis del líquido recuperado del lavado broncoalveolar, por un lado, mostró lesiones endobronquiales caseosas compatibles con infección por micobacterias, y por otro lado, se detectó el complejo M. tuberculosis (Xpert MTB/RIF). Con base a los hallazgos clínicos, microbiológicos y radiológicos se diagnosticó una infección diseminada por micobacterias, probablemente por BCG; Se inició el tratamiento antifímico con isoniazida, etambutol, rifampicina y pirazinamida (DOTBAL). A los 15 meses de vida, presentó artritis séptica en rodilla derecha y una prueba de PCR positiva para el complejo M. tuberculosis en liquido articular, por lo que se reinició la fase intensiva del tratamiento antifímico y administró ciprofloxacino por 14 días; sin embargo, la rodilla derecha aumentó de volumen, la artrocentesis permitió salida pus, se escaló la terapia antimicrobiana con meropenem por 14 días con una respuesta fue satisfactoria. El paciente se egresó a su domicilio con el tratamiento antifímico en fase de sostén y la profi laxis con trimetoprima-sulfametoxazol e itraconazol. Debido al antecedente de un hermano finado por tuberculosis diseminada y a las infecciones graves se sospechó que el paciente podría cursar con un error innato de la inmunidad.2 Se evaluó la fagocitosis, los resultados se muestran a continuación.
Resultados
Estudio molecular de los pacientes
La evaluación del estallido respiratorio se evaluó a través la técnica de oxidación de dihidrorrodamina, ambos pacientes no produjeron peróxido de hidrógeno (Figura 2), confirmando así el diagnóstico de EGC. Procedimos a medir las diferentes subunidades del complejo enzimático NADPH oxidasa (p22 phox , p40 phox , p47 phox , p67 phox , gp91 phox ) en los neutrófilos; ambos pacientes mostraron una ausencia de la proteína p67 phox (Figura 3). El resto de las subunidades NADPH oxidasa evaluadas fueron normales (datos no incluidos en la figura).
Posteriormente, se procedió a amplificar y a secuenciar los exones codificantes del gen NCF2. En el paciente I se demostraron dos variantes patogénicas diferentes en cada uno de los alelos (heterocigotas compuestas) la primera en el exón 4, c.304 C>T (p.Arg102*) y la segunda en el exón 11, c.979 G>T (p.Gly327*). La madre fue portadora de la variante patogénica c.304 C>T y no contamos con el ADN paterno (Figura 4y5). En el paciente II se demostraron dos variantes patogénicas diferentes en cada uno de los alelos (heterocigotas compuestas) la primera en el exón 11, c.979 G>T (p.Gly327*) y la segunda en el exón 15, c.1369 A>T (p.Lys457*); ambos padres fueron portadores de una de las variantes patogénicas en estado heterocigoto, el padre c.979 G>T y la madre c.1369 A>T (Figura 4y5). De las tres variantes patogénicas halladas en el gen NCF2, c.304C>T ya fue descrita,10 sin embargo, c.979 G>T y c.1369 A>T aún no. No realizamos estudios funcionales del estallido respiratorio en la madre del paciente I, ni en los padres del paciente II, debido que ya se ha descrito que los portadores heterocigotos de variantes patogénicas en NCF2 no presentan alteraciones celulares in vitro.11
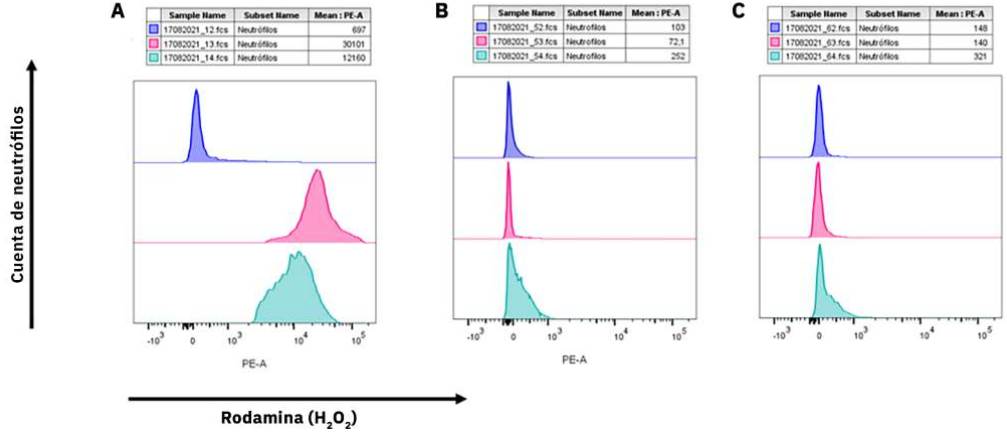
Figura 2 Análisis de la producción de peróxido de hidrógeno (H2O2) en neutrófilos de sangre periférica, mediante la técnica 1,2,3 dihidrorodamina (DHR). Los histogramas sin estimulación se muestran en color gris-morado, con estimulación de forbol-12-miristato-13-acetato (PMA) en rosa, y con estimulación con zimosán en turquesa. A) Control sano, con incremento de rodamina posterior a la estimulación con PMA y zimosán. B y C) Casos 1 y 2 sin aumento en la producción de rodamina después de la estimulación con PMA y zimosán.
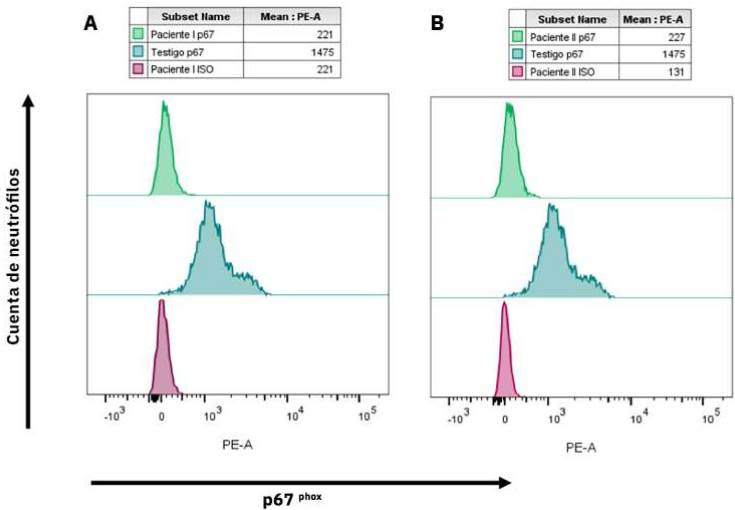
Figura 3 Análisis de la subunidad p67phox en neutrófilos de sangre periférica, a través de tinción intracelular por citometría de flujo. Los histogramas representan, en verde, neutrófilos sin tinción; en turquesa (testigo) y en púrpura (paciente) neutrófilos teñidos con anti-p67phox. A) Caso 1 versus control sano. B) Caso 2 versus control sano. Ambos pacientes no mostraron incremento en la intensidad media de fluorescencia en ficoeritrina (PE) versus testigo.

Figura 4 Electroferogramas con las variantes patogénicas. A) Electroferograma del exón 4: control sano, Caso 1 y su madre. En el paciente y la madre se observa una variante patogénica en uno de los alelos y el cambio de una citosina por una timina en la posición c.304 (c.304C>T), lo que produce un cambio de una arginina por un codón de paro (p.Arg102*). B) Electroferograma del exón 11: control sano y Caso 1. En el paciente se observa una variante patogénica en uno de los alelos, un cambio de una guanina por una timina en la posición c.979 (c.979G>T), lo que genera un cambio de una glicina por un codón de paro (p.Gly327*). C) Electroferograma del exón 11 del control sano, Caso 2 y su padre. En el paciente y su padre se observa una variante patogénica, el cambio de una guanina por una timina en la posición c.979 (c.979G>T), lo que provoca un cambio de una glicina por un codón de paro (p.Gly327*). D) Electroferograma del exón 15: control sano, Caso 2 y su madre. En el paciente y su madre se observa una variante patogénica, un cambio de una adenina por una timina en la posición c.1369 (c.1369A>T), que produce un cambio de una lisina por un codón de paro (p.Lys457*)
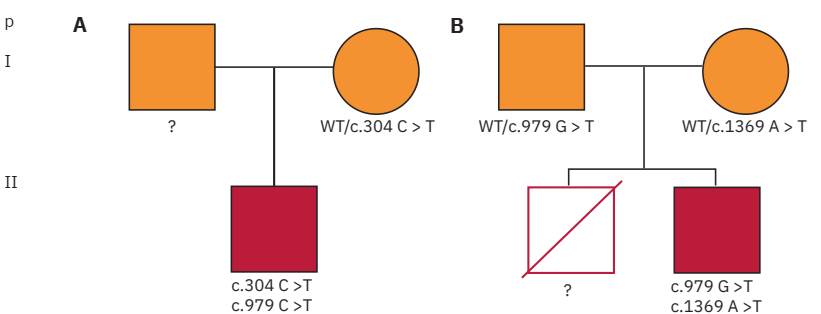
Figura 5 Pedigríes de familias con enfermedad granulomatosa crónica por variantes patogénicas en NCF2. Los símbolos sólidos indican los probandos. Los individuos en quienes se desconoce su estado genético se identificaron con el símbolo (?). A) Familia del Caso 1, heterocigoto compuesto con una variante en el exón 4 (c.304C>T) y 11 (c.979G>T), cuya madre tiene la variante patogénica c.304C>T. B) Familia del Caso 2, heterocigoto compuesto con la variante en el exón 11 (c.979G>T) y 15 (c.1369A>T), cuyos padres tienen las siguientes variantes patogénicas: padre c.979G>T y madre c.1369A>T. El hermano falleció por tuberculosis diseminada en la infancia.
Discusión
Hasta donde es de nuestro conocimiento, estos son los primeros pacientes indígenas mayas con diagnóstico de EGC. Consideramos que existe un sub-diagnóstico en la región de Yucatán, al igual que en otras provincias de México. La implementación de técnicas para el diagnóstico de EGC en aquellos hospitales que cuenten con un servicio de infectología pediátrica mejorará su detección.
Los dos pacientes que presentamos son de etnia maya, originarios de la península de Yucatán, México, con diagnóstico de EGC por ausencia de la subunidad de la NADPH oxidasa afectada p67 phox e infección por BCG. La herencia autosómica recesiva (NCF2) se relaciona frecuentemente con consanguinidad, por tanto, es más frecuente en los matrimonios consanguíneos.12,13,14Los casos de EGC presentados en ese artículo, no se relacionan con consanguinidad debido a que sus variantes patogénicas fueron heterocigotas compuestas, es decir cada uno de los dos alelos tuvo una variante diferente.
Los errores innatos de la inmunidad deben ser sos pechados en pacientes con infecciones recurrentes, graves, que no responden a tratamientos habituales y que son causadas tanto por agentes oportunistas como no oportunistas (15). En México, las manifestaciones más frecuentes de la EGC son la linfadenitis, la infección por BCG y la neumonía. Las infecciones por BCG pueden localizarse o diseminarse.4 Los pacientes descritos presentaron tuberculosis diseminada, la cual fue una de las evidencias para que el pediatra tratante sospechara en un error innato de la inmunidad.
Los pacientes con EGC vacunados con el bacilo vivo de BCG tienen un riesgo alto de ser infectados por él. En México la incidencia de M. tuberculosis es alta (23 casos por 100, 000 habitantes)16 lo cual justifica la administración obligatoria de la vacuna de BCG para prevenir casos de meningitis y formas diseminadas de tuberculosis en niños.17
El Dr. Jean Laurent Casanova ha demostrado que algunos pacientes que padecen infecciones micobacterianas tienen una predisposición genética que explica esa mayor susceptibilidad.18,19 Los padres siendo portadores de una variante patogénica en NCF2 en un solo alelo no son susceptibles a padecer infecciones micobacterianas o por otro microorganismo.11
Es de llamar la atención que no existe un consenso de expertos para el tratamiento de la infección mico- bacteriana por BCG en pacientes con EGC, como en otros errores innatos de la inmunidad,20 cada clínico trata a los pacientes de acuerdo con su propio criterio (combinación de antituberculosos y duración del tratamiento). Bustamante J et al. propusieron usar en el síndrome de predisposición mendeliana a infecciones micobacterianas (otro error innato de la inmunidad que predispone a infecciones micobacterianas) una combinación de cuatro a cinco anti-micobacterianos (incluyendo aquellos con sensibilidad para M. bovis-BCG) durante un periodo prologando (no menos de 2 años) según la evolución clínica-biológica-radiológica.21 Consideramos necesario establecer un consenso internacional de expertos en México para el tratamiento de la infección por el complejo M. tuberculosis o complicaciones de BCG en pacientes con EGC.
En pacientes con infección micobacteriana con BCG debemos sospechar en un error innato de la inmunidad, como la EGC. El diagnóstico de EGC se realiza a través de la detección de una falta de producción de radicales libres en los neutrófilos. Los pacientes reportados tuvieron variantes patogénicas en el gen NCF2, dos de ellas no han sido reportadas previamente en la literatura.











 nueva página del texto (beta)
nueva página del texto (beta)


