Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Veterinaria México OA
versión On-line ISSN 2448-6760
Veterinaria México OA vol.2 no.1 Ciudad de México ene./mar. 2015
Artículos originales
Aislamiento de Chlamydia abortus en rebaños caprinos lecheros y su relación con casos de aborto en Guanajuato, México
Juan Carlos Mora Díazª 0000-0002-0725-122X, Efrén Díaz Apariciob 0000-0002-1669-1323, Enrique Herrera Lópezb 0000-0003-2969-8767, Francisco Suárez Güemesª 0000-0003-0118-2494, Cristina Escalante Ochoac 0000-0002-6491-3453, Susana Jaimes Villarreald, Beatriz Arellano-Reynosoa* 0000-0002-3067-2719
a Departamento de Microbiología e Inmunología, Facultad de Medicina Veterinaria y Zootecnia, Universidad Nacional Autónoma de México, Avenida Universidad 3000, 04510, DF, México. * Autor para correspondencia: Beatriz Arellano-Reynoso. Tel: + 52 55 56 22 58 96.
b CENID Microbiología, Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias Carretera Federal México-Toluca Km. 15.5 Cuajimalpa, 05110, DF, México.
c Práctica privada, Lizzy Ansinghstraat 5, 1902MN Castricum, The Netherlands.
d Práctica privada, DF, México.
Recibido: 2014-06-04.
Aceptado: 2015-03-04.
Publicado: 2015-03-12.
Resumen
Chlamydia abortus se clasifica como un agente exótico en México; sin embargo, existe cada vez más evidencia de su presencia en los rebaños caprinos. El objetivo de este estudio fue aislar a C. abortus en cabras lecheras de rebaños con problemas de abortos en el estado de Guanajuato, México, y desarrollar pruebas diagnósticas adecuadas para su detección. Se tomaron muestras de suero e hisopos vaginales de seis rebaños caprinos. La prueba ELISA mostró 9.60% de animales seropositivos a C. abortus. El PCR a partir del ADN de moco vaginal dio como resultado 30 animales positivos de 126 (23.8%). Se aisló Chlamydia spp. en 34 de 126 animales muestreados (26.98%). Los tres métodos diagnósticos probados resultaron complementarios y de gran valor ya que se pueden aplicar en las zonas donde se sospecha que Chlamydia está causando abortos. En el trabajo se demostró que este patógeno está presente en los rebaños lecheros de México, por lo que las autoridades sanitarias veterinarias deberían considerar la clamidiosis como endémica, con la finalidad de establecer los procedimientos sanitarios apropiados para evitar que la enfermedad se propague y evitar también el contagio a los humanos.
Palabras clave: Caprinos; Chlamydia abortus; Aborto; México.
Introducción
El aborto enzoótico de los pequeños rumiantes (AEPR) es una enfermedad infecciosa ocasionada por Chlamydia abortus, anteriormente llamada C. psittaci tipo I o Chlamydophila abortus (Andersen, 1991; Everett et al., 1999). Esta enfermedad afecta a ovinos, caprinos y bovinos; causa abortos durante el último tercio de la gestación o el nacimiento de crías débiles, que generalmente mueren durante los primeros días de vida (Kuo et al., 2011; Longbottom and Coulter, 2003; Rodolakis, 2001; Chisu et al., 2013).
La transmisión entre animales ocurre principalmente durante el parto o el aborto, debido a las bacterias que se excretan en las descargas vaginales, la placenta y la piel de los fetos abortados (Longbottom y Coulter, 2003; Rodolakis, 2001; Gutierrez et al., 2011). En México, esta enfermedad se considera exótica y, por lo tanto, se incluye en el Grupo 1 del acuerdo en el que se enlistan y clasifican las enfermedades y plagas de los animales que se consideran exóticas y endémicas y cuya notificación es obligatoria (SAGARPA, 2007). Sin embargo, en México se han realizado diversos reportes de la enfermedad en pequeños rumiantes. En 1996 se realizó el aislamiento de C. psittaci en rebaños ovinos de cinco estados del país (Escalante-Ochoa et al., 1996), mientras que en 1997 se reportó la presencia de C. psittaci en rebaños caprinos (Escalante-Ochoa et al., 1997).
Después se realizaron otros estudios de esta enfermedad en caprinos. En 2005 se demostró la presencia de la bacteria en el estado de Michoacán, en donde se logró el aislamiento de la bacteria en heces, fetos abortados y cabritos muertos prematuramente (antes de los cinco días de edad) (Lazcano, 2006; Lazcano et al., 2005). En 2008 se hizo un estudio serológico en rebaños caprinos lecheros de seis estados del país y se encontraron anticuerpos contra la bacteria (Mora et al., 2008). En 2001 se demostró la participación de Chlamydia spp. en infecciones zoonóticas en México, que se relacionaron con ganado caprino y ovino infectado con este agente (Escalante et al., 2001; Barbosa Mireles et al., 2013).
Debido a que el AEPR se considera una enfermedad exótica en México, no se cuenta con los reactivos, anticuerpos y técnicas de diagnóstico que permitan la rápida identificación de un caso donde C. abortus esté involucrada. Aunado a esto, el aislamiento del agente es difícil, ya que el personal técnico requiere entrenamiento especializado y necesita un medio biológico vivo para su cultivo, como embriones de pollo o cultivo celular. Toma semanas el obtener su aislamiento e identificación (Biberstein y Hirsh, 2004; Longbottom y Coulter, 2003). Por estos motivos, el objetivo del presente estudio fue determinar la presencia de C. abortus mediante aislamiento bacteriológico, Reacción en Cadena de la Polimerasa (PCR, por sus siglas en inglés) y Ensayo por Inmunoabsorción Ligado a Enzimas (ELISA, por su acrónimo en inglés), en rebaños caprinos lecheros con problemas de abortos sugerentes de clamidiosis, en el estado de Guanajuato, México, y establecer los métodos diagnósticos apropiados para su detección.
Materiales y métodos
Animales
Se seleccionaron seis rebaños caprinos lecheros de Guanajuato, México, con historia previa de abortos. Los rebaños, de producción intensiva, tenían como fin zootécnico la producción de pie de cría, la recría y la obtención de leche para la elaboración de quesos.
Se obtuvo información de las granjas mediante dos cuestionarios aplicados a los propietarios: el primero para obtener información de aspectos generales de la granja, tales como las medidas del manejo, la genética, la nutrición, la salud del rebaño, reproducción e instalaciones. El objetivo del segundo cuestionario fue recabar información individual de cada uno de los animales muestreados, como edad, número de partos, historia clínica, en caso de existir, y datos de producción (Mora, 2011). Esta información permitió establecer los diagnósticos diferenciales para estos rebaños con problemas. El número de animales muestreados por cada unidad de producción se observa en el cuadro 1.
Muestras clínicas
Se analizaron un total de 126 muestras de exudados vaginales por medio del aislamiento en cultivo celular y PCR para la identificación de C. abortus; mientras que 125 muestras de suero de los mismos animales se utilizaron para la detección de anticuerpos contra este microorganismo por medio de ELISA (cuadro 1).
Las cabras seleccionadas para ser muestreadas debían cumplir las siguientes condiciones: haber tenido uno o más partos; estar dentro de las dos semanas próximas al parto, haber parido como máximo cuatro semanas antes o haber tenido un aborto.
Las muestras vaginales se tomaron con hisopos estériles y se transportaron en tubos con 2 ml de medio de sacarosa-fosfato/glutamato (SPG) (sacarosa 217 mM, KH2PO4 4 mM, KH2PO4 7 mM y L-glutamina 1%) suplementados con 10% de suero fetal bovino (SFB) y antibióticos –100 µg/ml estreptomicina, 50 µg/ml gentamicina– (Sachse et al., 2009).
Una vez en el laboratorio, los hisopos se escurrieron: con una pinza estéril se ejerció presión en las paredes de un tubo de ensayo, luego los hisopos se desecharon. Posteriormente, los tubos se centrifugaron a 3000 x G durante 40 minutos a 4 °C. Se tomaron 500 µl del sobrenadante y se transfirieron a un microtubo estéril, que se identificó y congeló a -70 °C hasta su utilización para el aislamiento bacteriológico. El resto del contenido del tubo se transfirió a otro microtubo estéril y se congeló a -70 °C para su posterior extracción de ADN.
Pruebas serológicas
El diagnóstico serológico se realizó con el estuche comercial "IDEXX Chlamydiosis Verification Test" (antes llamado "Pourquier® ELISA Chlamydiosis Serum Verification", IDDEX Laboratories, Inc., Westbrook, Maine, US), el cual utiliza un antígeno recombinante y permite detectar la proteína de membrana externa de 80-90 kDa; ésta es específica de C. abortus y no cruza con los antígenos de Chlamydia pecorum.
Se realizó la prueba de Rosa de Bengala al 3% (Aba test card 3%, PRONABIVE, DF, Mexico) para descartar la presencia de brucelosis en los rebaños.
Aislamiento e identificación de Chlamydia spp
Para el aislamiento se utilizaron cultivos celulares de la línea de fibroblastos de ratón L929, los cuales se cultivaron en Medio Mínimo Esencial de Eagle (MEM, GIBCO, Life Technologies, Carlsbad, CA, USA), suplementado con 10% de SFB, 1% de aminoácidos no esenciales, 1% de L-glutamina y antibióticos (50 µg/ml gentamicina y 100 µg/ml penicilina-estreptomicina) (MEM-C), todos de Life Technologies, en condiciones de humedad a 37 °C con 5% CO2 (Escalante-Ochoa et al., 1996).
La infección de la monocapa se llevó a cabo en placas de poliestireno de 24 pozos (NUNCTM Thermo Scientific, Waltham, MA, USA), con cubreobjetos estériles de 12 mm de diámetro para realizar las inmunofluorescencias. Las células se colocaron en una concentración inicial de 5×104 células por pozo y se incubaron por un período de 24 horas, hasta alcanzar una confluencia de 60-70%. De forma paralela, se prepararon placas sin cubreobjetos para realizar pases ciegos de los cultivos en caso de ser necesario.
Proceso de infección
Para realizar la infección se retiró el medio MEM-C de los pozos y se añadieron 100 µl del sobrenadante de las muestras clínicas. Se usaron dos pozos por muestra, tanto para el diagnóstico mediante inmunofluorescencia como para los pases ciegos subsecuentes. Cada placa contó con dos pozos infectados con la cepa C. abortus A22 como controles positivos y una muestra testigo negativa, también por duplicado.
Las microplacas se colocaron en una incubadora con rotación orbital a 50 rpm, durante una hora a 37 °C en condiciones de humedad. Posteriormente se añadieron 900 µl de MEM-C a cada pozo y se incubaron a 37 °C en condiciones de humedad y 5% de CO2 por 72 horas más. Pasado este tiempo, las placas sin cubreobjetos se conservaron a -70 °C; las placas con cubreobjetos se lavaron tres veces con PBS, durante cinco minutos cada vez. Se aspiró el PBS y las monocapas se fijaron con 1 ml de metanol a -20 °C por 10 minutos. El metanol se retiró y las placas se dejaron secar a temperatura ambiente.
Inmunofluorescencia directa
La identificación de las inclusiones intracitoplasmáticas producidas por Chlamydia spp. se realizó utilizando inmunofluorescencia directa con el estuche comercial IMAGENTM Chlamydia DakoCytomation LTD (Cambs, UK), el cual detecta el lipopolisacárido de la bacteria por medio de anticuerpos monoclonales marcados con fluoresceína. Se tomaron 25 µl de los anticuerpos marcados con fluoresceína-5-isotiocianato, se diluyeron 1/10 en PBS y se agregaron 2 µl de azul de Evans (0.5%) para contrastar la tinción; éstos se añadieron a cada pozo de la placa, seguido de la incubación en una cámara húmeda durante 30 minutos a 37 °C. Se lavaron tres veces durante cinco minutos con PBS y los cubreobjetos se sacaron de los pocillos y se dejaron secar a temperatura ambiente (Vanrompay et al., 1994).
Luego los cubreobjetos se montaron en laminillas de vidrio con el medio de montaje Vectashield® (Vector Laboratories,Inc, Burlingame, CA, USA) y se fijaron con barniz de uñas transparente. Las preparaciones se analizaron en un microscopio de fluorescencia Leica DM1000 (magnificación 40X).
En caso de no observar inclusiones citoplasmáticas en la primera lectura, se llevó a cabo un segundo pase tomando las células de los pozos sin cubreobjetos, previamente conservadas a -70 °C. Estas placas se congelaron y descongelaron cinco veces para lisar las células y liberar las bacterias. El contenido se transfirió a microtubos estériles y se infectó un nuevo cultivo siguiendo el procedimiento antes descrito. Las muestras sólo se consideraron como negativas después de haber llevado a cabo dos pases ciegos sin observación de inclusiones citoplasmáticas.
Identificación de C. abortus por PCR
El ADN se extrajo de fibroblastos de ratón L929 infectados con las cepa ATCC de C. abortus A22. Se tomaron 200 µl del cultivo celular infectado y se inactivó por calor en baño María a 80 °C durante 20 minutos.
La extracción del ADN de las muestras clínicas se realizó con el método de fenol-cloroformo y se utilizaron 500 µl de las muestras de exudado vaginal en medio de transporte, de acuerdo con el protocolo descrito por Sambrook y Russell, 2001. También se extrajo el ADN de fibroblastos de ratón L929 sin infectar, para usarlo como testigo negativo en el PCR, siguiendo el mismo procedimiento.
Primers
Los primers utilizados para la identificación de C. abortus se diseñaron a partir del gen 16S RNAr con el programa IDT SciTools Primer QuestSM, que amplifica 342 pb:
"forward" (5'-TGAGGCTGATGACTGGGATGAAGT-3') y
"reverse" (5'-GTCAATGCCAAGGCATCCACCAAT-3').
La PCR se realizó en un termociclador Thermo Hybaid PCR Express. Las reacciones se llevaron a cabo en un volumen de 50 µl con amortiguador de PCR 1X, MgCl2 3 mM, dNTP 400 µM, 25 pmol de cada primer, 1 U de Taq Polimerasa (Invitrogen, Life Technologies) y 25 ng de ADN del cultivo infectado con la cepa ATCC de C. abortus A22 como testigo positivo o bien con el cultivo de fibroblastos de ratón L929 sin infectar.
Adicionalmente, se utilizó el ADN de diferentes bacterias que pudieran estar involucradas en abortos en caprinos, incluyendo a Brucella abortus, Leptospira hardjo, Histophilus somni, Salmonella typhy, Campylobacter jejuni, Campylobacter fetus y Mycoplasma bovis. El programa para la amplificación del ADN de C. abortus con los primers del gen 16S RNAr fue el siguiente: una desnaturalización inicial de cinco minutos a 95 °C, seguida de 40 ciclos que incluyeron un minuto a 95 °C, 30 s a 63 °C y un minuto a 72 °C, para concluir con un paso de extensión final de 10 minutos a 72 °C.
Los productos de la amplificación se observaron en un gel de agarosa al 1%, teñidos con bromuro de etidio (0.5 µg/ml) (Sambrook y Russell, 2001) y se analizaron en un fotodocumentador (Kodak, Gel Logic200, Rochester, New York, USA) con el programa Kodak Molecular Imaging v.4.0.2.
Análisis estadístico
La PCR utilizada en este estudio se evaluó con un cuadro corriente de concordancia. Se consideraron tres parámetros: sensibilidad, especificidad y el valor predictivo de la prueba (positiva y negativa). También se determinó la validez de la PCR (Armijo, 1994; Greenberg et al., 2002). Con la finalidad de establecer el grado de concordancia entre las pruebas diagnósticas, se determinó el coeficiente de Kappa (Cohen, 1960).
Resultados
Pruebas serológicas y aislamiento bacteriológico
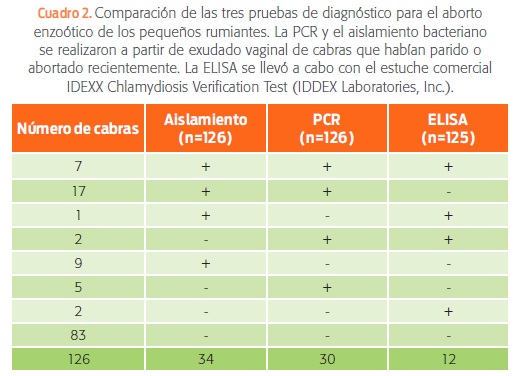
Los 125 sueros de las cabras fueron negativos a brucelosis. Sin embargo, en el ELISA, para el diagnóstico de C. abortus, 12 de las 125 cabras fueron positivas (9.60%). El proceso para el aislamiento e identificación de Chlamydia spp. en cultivo celular e inmunofluorescencia directa dio como resultado 34 animales positivos de 125 (26.98%) (cuadro 2).
La PCR no amplificó el ADN de L. hardjo, H. somni, S. typhi o M. bovis; sin embargo, sí se observó amplificación con el ADN de B. abortus, C. jejuni y C. fetus. También se identificó C. abortus pues los amplicones para esos agentes bacterianos fueron de 900 pb para B. abortus, 400 pb para C. jejuni y 800 pb para C. fetus.
El resultado de las pruebas a partir del exudado vaginal de las cabras fue de 30 animales positivos (23.8%) (cuadro 2), lo cual demostró una sensibilidad de 70.58% y una especificidad de 93.47% (utilizando el aislamiento a partir de cultivos celulares como la prueba de referencia). El valor predictivo positivo de la PCR fue de 80% y el valor predictivo negativo de la PCR fue de 89.58%. Así, la validez de la prueba fue de 87.30%.
Como se muestra en el cuadro 2, sólo siete cabras fueron positivas a las tres pruebas diagnósticas (ELISA, aislamiento bacteriano y PCR).
El grado de concordancia entre los tres métodos diagnósticos con el coeficiente de Kappa fue el siguiente: (Landis y Koch, 1977):
• Aislamiento bacteriológico (considerado como la prueba de oro) y PCR = 0.91, (muy alto)
• ELISA y aislamiento bacteriológico = 0.80 (alto)
• ELISA y PCR = 0.20 (bajo)
Discusión
En México, la clamidiosis en caprinos causada por C. abortus es considerada como una enfermedad exótica por las autoridades sanitarias (SAGARPA, 2007); sin embargo, cada vez existe más evidencia de su presencia en el país. Esta investigación demostró, por medio del aislamiento e identificación del microorganismo, la presencia de C. abortus en los rebaños estudiados y este resultado incrementó la posibilidad de que los abortos ocurridos poco antes de la toma de las muestras pudieran estar ocasionados por C. abortus.
Se han reportado pocos aislamientos de Chlamydia y sólo se cuenta con pruebas moleculares y serológicas; por el momento no existe evidencia de la enfermedad causada por C. pecorum (Mora-Díaz et al., 2009; Aguilar et al., 2011; Campos-Hernandez et al., 2014).
En 2007, se analizaron mediante ELISA un total de 1105 sueros de cabras provenientes de diferentes estados mexicanos donde la caprinocultura es una actividad importante (Tlaxcala, Estado de México, San Luis Potosí, Guanajuato y Querétaro). Para ello se usó el estuche comercial IDEXX Chlamydiosis Verification Test (IDDEX Laboratories Inc.). A partir de los sueros se obtuvo una seropositividad global de 3.17% hacia C. abortus, con una variación de 0 a 24% entre los rebaños estudiados (Mora-Díaz et al., 2009).
En 2010 y 2011, la prueba ELISA se usó en un estudio de seis regiones mexicanas consideradas como las más importantes zonas caprinas: Puebla, Guerrero, Baja California Sur, Comarca Lagunera, Tlaxcala y San Luis Potosí. En este caso se encontraron los siguientes porcentajes para cada una de las regiones mencionadas: 0.18%, 4%, 5%, 7.3%, 10%, y 11%, respectivamente. En dicho estudio, los investigadores tomaron muestras de cabras mayores de dos años en unidades de producción con historiales de abortos (Aguilar et al., 2011). Campos-Hernandez et al. (2014) demostraron una alta seroprevalencia e hicieron la identificación molecular de C. abortus en granjas comerciales de caprinos lecheros de una región tropical en México, aunque no se llegó al aislamiento bacteriológico del microorganismo. Sus resultados, aunados a los de este análisis, indican con claridad que el AEPR está presente en México.
Sin embargo, como se considera una enfermedad exótica, aún no existen pruebas validadas y aprobadas en México que puedan usar los laboratorios para el diagnóstico rutinario, hecho que hace la identificación oportuna más complicada. Es importante contar con pruebas estandarizadas que se apliquen de forma rápida cuando se sospeche de la presencia de una enfermedad exótica.
Aquí se demuestra también la utilidad de la PCR como herramienta para evidenciar la existencia de C. abortus en una región considerada en riesgo. No obstante, es importante emplear varias técnicas durante el proceso de diagnóstico, ya que la prueba ELISA es muy sensible, pero no indica la presencia de la enfermedad, sino solamente demuestra la exposición al agente etiológico. Así que los tres métodos de diagnóstico empleados resultan complementarios y son de gran valor en zonas donde se sospecha que C. abortus es la causa de los abortos.
La razón de trabajar con estos seis rebaños del estado de Guanajuato se debió a que sus propietarios mencionaron que habían tenido problemas de abortos en años recientes, particularmente en el último tercio de la gestación y además con cabritos nacidos débiles que murieron poco después del alumbramiento. Esta es una zona endémica de brucelosis y esta bacteria pudiera ser la causante de los abortos, pero se descartó esta causa, porque son rebaños libres de la enfermedad y cuentan con su certificado oficial.
Cabe resaltar que, de los siete animales que fueron positivos a todas las pruebas aplicadas, dos habían abortado un mes antes de extraer las muestras. Esto indica que, aún un mes posterior al aborto, los animales podrían seguir excretando las bacterias a través de los fluidos vaginales.
Es importante enfatizar que estos seis rebaños poseían animales de alto valor genético, cuyo potencial reproductivo se vio disminuido por la infección con C. abortus. Se estima que las pérdidas causadas por un aborto son de US$ 300.00 dólares. Estas unidades de producción son proveedoras de pie de cría para rebaños en otras regiones de México, por lo que es de suma importancia implementar un programa para controlar la enfermedad.
Conclusiones
Aunque otros agentes causantes de abortos en cabras se consideran exóticos en México –y, por lo tanto son difíciles de investigar debido a la falta de reactivos y pruebas diagnósticas–, en este trabajo se demostró, por medio de pruebas serológicas, moleculares y finalmente por aislamiento bacteriano, que C. abortus está presente en los rebaños caprinos mexicanos. Aunque la mejor concordancia de la prueba Kappa fue entre el aislamiento bacteriano y la PCR, se considera que las tres pruebas diagnósticas son complementarias. De esta manera, las autoridades sanitarias veterinarias de México deberían considerar a la clamidiosis como endémica, con el propósito de establecer los procedimientos sanitarios para controlar su diseminación y prevenir la transmisión a los humanos.
Financiamiento
Este trabajo fue financiado por el proyecto SAGARPA-CONACYT No. 48599. Juan Carlos Mora Díaz agradece la beca de tesis del Consejo Nacional de Ciencia y Tecnología (CONACyT).
Agradecimientos
Agradecemos a Pablo Vera Sánchez por el apoyo técnico.
Conflictos de interés
Francisco Suárez Güemes es Secretario de Investigación, Innovación y Desarrollo Tecnológico en la Facultad de Medicina Veterinaria y Zootecnia. Los demás autores declaran que no tienen conflictos de interés.
Contribución de los autores
Juan Carlos Mora Díaz: Llevó a cabo el trabajo experimental y escribió el manuscrito.
Efrén Díaz Aparicio: Diseñó la investigación y escribió el manuscrito.
Enrique Herrera López y Susana Jaimes Villarreal: Llevaron a cabo el trabajo experimental.
Francisco Suárez Güemes y Cristina Escalante Ochoa: Analizaron la información.
Beatriz Arellano-Reynoso: Dirigió la investigación y escribió el manuscrito.
1) Aguilar RF, Arellano RB, Bibriesca RE, Diaz AE et al. 2011. Estudio epidemiológico de las principales enfermedades bacterianas que afectan a los caprinos en México. Resultados preliminares. XXVI Reunión Nacional Sobre Caprinocultura Querétaro, México, 5-8 octubre. Juriquilla: Facultad de Ciencias Naturales, Universidad Autónoma de Querétaro. [ Links ]
2) Andersen AA. 1991. Serotyping of Chlamydia psittaci isolates using serovar-specific monoclonal antibodies with the microimmunofluorescence test. Journal of Clinical Microbiology 29:707-711. [ Links ]
3) Armijo R. 1994. Epidemiología básica en atención primaria de la salud. Spain: Ediciones Díaz de Santos. [ Links ]
4) Barbosa Mireles M, Salazar García F, Fernández Rosas P, Montes de Oca R. 2013. Detección de anticuerpos serológicos contra Chlamydophila abortus en dos grupos de personas expuestas a riesgo en explotaciones ovinas en Xalatlaco, México. Tropical and Subtropical Agroecosystems 16:483-486. [ Links ]
5) Biberstein LE, Hirsh CD. 2004. Chlamydiae. In: Hirch CD, Maclachlan NJ, Walter LR. (editors) Veterinary Microbiology. 2nd ed. USA: Blackwell Publishing. [ Links ]
6) Campos-Hernandez E, Vazquez-Chagoyan C, Salem AZ, Saltijeral-Oaxaca JA, Escalante-Ochoa C, Lopez-Heydeck SM, De Oca-Jimenez RM. 2014. Prevalence and molecular identification of Chlamydia abortus in commercial dairy goat farms in a hot region in Mexico. Tropical Animal Health and Production. 46:919-924. [ Links ]
7) Chisu V, Porcu R, Tanda A, Masala G. 2013. First isolation and characterization of Chlamydophila abortus from abortion tissues of sheep in Sardinia, Italy. Veterinaria Italiana 49(4):331-4. [ Links ]
8) Cohen J. 1960. A coefficient of agreement for nominal scales. Educational and Psychological Measurement 20:37-46. [ Links ]
9) Escalante-Ochoa C, Diaz-Aparicio E, Segundo-Zaragoza C, Suarez-Guemes F. 1997. Isolation of Chlamydia psittaci involved in abortion of goats in Mexico: first report. Revista Latinoamericana de Microbiología 39:117-121. [ Links ]
10) Escalante-Ochoa C, Rivera-Flores, A, Trigo-Tavera F, Romero-Martinez J. 1996. Detection of Chlamydia psittaci in enteric subclinical infections in adult sheep, through cell culture isolation. Revista Latinoamericana de Microbiología 38:17-23. [ Links ]
11) Escalante OC, Lazcano C, Soberón A. 2001. Chlamydophila spp. como agente zoonótico en México (Chlamydophila spp as a zoonotic agent in Mexico). XXXVIII Reunión Nacional de Investigación Pecuaria. Tuxtla Gutiérrez, Chiapas, México. [ Links ]
12) Everett KD, Bush RM, Andersen AA. 1999. Emended description of the order Chlamydiales, proposal of Parachlamydiaceae fam. nov. and Simkaniaceae fam. nov., each containing one monotypic genus, revised taxonomy of the family Chlamydiaceae, including a new genus and five new species, and standards for the identification of organisms. International Journal of Systematic Bacteriology 49:415-440. [ Links ]
13) Greenberg SR, Flanders DW, Daniels SR, Eley JW. 2002. Epidemiología médica. México: El Manual Moderno. [ Links ]
14) Gutierrez J, Williams EJ, O'Donovan J, Brady C, Proctor AF, Marques PX, Worrall S, Nally JE, Mcelroy M, Bassett HF, Sammin DJ, Markey BK. 2011. Monitoring clinical outcomes, pathological changes and shedding of Chlamydophila abortus following experimental challenge of periparturient ewes utilizing the natural route of infection. Veterinary Microbiology 147:119-26. [ Links ]
15) Kuo CC, Stephens RS, Bavoil PM, Kaltenboeck B. 2011. Genus Chlamydia. In: Krieg NR, Staley JT, Brown DR, Hedlund BP, Paster BJ, Ward NL, Ludwig W, Whitman WB. (editors) Bergey's manual of systematic bacteriology. Volume 5: the actinobacteria, part A. 2nd ed. New York, Springer: Heidelberg. [ Links ]
16) Landis J, Koch G. 1977. The measurement of observer agreement for categorical data. Biometrics 33:159-174. [ Links ]
17) Lazcano AC. 2006. Detección de Chlamydophila spp. en rebaños caprinos del estado de Michoacán mediante técnica inmunodiagnóstica ELISA y aislamiento bacteriológico [tesis de licenciatura]. DF, México: FMVZ-UNAM. [ Links ]
18) Lazcano AC, Escalante OC, Ducöing WA, Trejo A. 2005. Inmunodetección de Chlamydophila abortus en caprinos de Ecuandureo, Michoacán, México, mediante prueba de ELISA. XLI Reunión Nacional de Investigación Pecuaria, 14-18 Noviembrre. Cuernavaca, Morelos, México: INIFAP, SAGARPA. [ Links ]
19) Longbottom D, Coulter LJ. 2003. Animal chlamydioses and zoonotic implications. Journal of Comparative Pathology 128:217-44. [ Links ]
20) Mora DJC. 2011. Determinación de Chlamydophila abortus en rebaños caprinos lecheros de Guanajuato, México, con casos de aborto sugerentes de clamidiosis [tesis de licenciatura]. DF, México: FMVZ-UNAM. [ Links ]
21) Mora-Díaz JC, Escalante-Ochoa C, Diaz-Aparicio E, Jaimes MS, Martínez G, Trujillo AB. 2008. Determinación serológica de Chlamydophila abortus en ganado caprino lechero en México. XXI Congreso Panamericano de Ciencias Veterinarias. Guadalajara, Jalisco, México. [ Links ]
22) Mora-Díaz JC, Escalante-Ochoa C, Diaz-Aparicio E, Jaimes MS, Martínez G, Trujillo AB. 2009. Chlamydophila abortus serological determination in dairy goats in Mexico: preliminary advances. Caro MR, Salinas J, Buendía AJ (editors) First European Meeting on Animal Chlamydioses and Zoonotic Aspects. Murcia, Spain. [ Links ]
23) Rodolakis A. 2001. Caprine Chlamydiosis In: Tempestra M. (editor). Recent Advances in Goat Diseases. Ithaca, NY: International Veterinary Information Service (IVIS). http://www.ivis.org/advances/Disease_Tempesta/rodolakis_chlamydiosis/IVIS.pdf [accessed: 26 Nov 2014] [ Links ].
24) Sachse K, Vretou E, Livingstone M, Borel N, Pospischil A, Longbotton D. 2009. Recent developments in the laboratory diagnosis of chlamydial infections. Veterinary Microbiology 135:2-21. [ Links ]
25) SAGARPA. 20 de septiembre de 2007. Acuerdo mediante el cual se enlistan las enfermedades y plagas de los animales, exóticas y endémicas de notificación obligatoria en los Estados Unidos Mexicanos. México: Diario Oficial de la Federación.
26) Sambrook J, Russell D. 2001. Molecular cloning a laboratory manual. USA: CSHC Press. [ Links ]
27) Vanrompay D, Van Nerom A, Ducatelle R, Haesebrouck F. 1994. Evaluation of five immunoassays for detection of Chlamydia psittaci in cloacal and conjunctival specimens from turkeys. Journal of Clinical Microbiology 32:1470-4. [ Links ]
 Dirección para correspondencia:
Dirección para correspondencia:
Beatriz Arellano-Reynoso
Correo electrónico: arerey@yahoo.com
Nota
Este artículo puede ser consultado en versión completa en http://www.revistas.unam.mx/index.php/Veterinaria-Mexico











 texto en
texto en 


