Introducción
El desarrollo de nanopartículas metálicas (NPs) como agentes antimicrobianos es altamente valorado por la comunidad científica debido a su potencial microbiano contra bacterias, hongos y virus (Subramaniyan et al., 2018). También por sus propiedades dependientes del tamaño para aplicación en optoelectrónica, fotocatálisis o biomedicina (Ayoghya y Veerabhadram, 2016; Huo et al., 2018).
El sulfuro de plata (Ag2S) es un calcogenuro metálico semiconductor con tres acomodos cristalográficos: monoclínico, cúbico centrado en el cuerpo y cúbico centrado en la cara (Sadovnikov et al., 2018). El Ag2S presenta una banda de energía directa de 1.1 eV, es químicamente estable y presenta excelente emisión en la segunda región del infrarrojo cercano que va de 1000 a 1400 nm (NIR-II) (Feng Lu et al., 2019). El Ag2S puede ser utilizado en biomedicina debido a sus propiedades antimicrobianas contra una amplia gama de microrganismos Gram positivos y Gram negativos (Subramaniyan et al., 2018; Xiong et al., 2019) y por su baja citotoxicidad con diversas células (Vardar et al., 2018; Aydemir et al., 2020). Puntos cuánticos (QDs) de este tipo de semiconductor se han aplicado en sistemas de imagen in vivo para la detección de células cancerosas en etapa temprana (Javidi et al., 2017; Zhong et al., 2020). Imágenes de vasos sanguíneos de cuerpo entero e imágenes de tumores fueron obtenidos con puntos cuánticos de sulfuro de plata pegilados (Ag2S-PEG) (Feng Lu et al., 2019).
El Ag2S puede tener varias aplicaciones en diferentes áreas de la ciencia, sin embargo, la conjugación de estas nanopartículas con otras nanoestructuras o agentes limitantes pueden otorgarle propiedades diferentes. Por ejemplo, nanopartículas recubiertas con oleamina con un tamaño mayor a 10 nm no presentan propiedades fotoluminiscentes, mientras que una mezcla 1-dodecanotiol y octadeceno, una banda de emisión a 1190 nm está presente bajo una excitación de 500 nm (Mohamed et al., 2017). A pesar de que la oleamina afecta las propiedades fotoluminiscentes del sufuro de plata, esta previene la formación de plata, lo cual facilita el manejo de la síntesis (Feng Lu et al., 2019).
El objetivo de esta revisión sistemática es conocer las propiedades de las nanopartículas de sulfuro de plata con o sin un agente adicional, así como la concentración adecuada para su aplicación en los biomateriales y conocer su efectividad como agente antimicrobiano.
Métodología
La revisión sistemática se realizó considerando los lineamientos de la declaración PRISMA (Preferred Reporting Items for Systematic Reviews and Meta-Analyses)[https://n9.cl/n1np]. Se incluyeron artículos publicados en los últimos 6 años, en texto completo y en idioma inglés. También artículos con estudios in-vitro o in-vivo sobre biocompatibilidad o actividad antimicrobiana de nanopartículas o puntos cuánticos de sulfuro de plata con o sin agentes adicionales.
Se excluyeron artículos de revisiones sistemáticas y meta-análisis, así como estudios con nanopartículas diferentes al sulfuro de plata.
En octubre de 2020, se realizó una búsqueda de información científica en tres bases de datos: ScienceDirect, Web of science y PubMed con la siguiente estrategia PICO:
Problema: Crecimiento microbiano y citotoxicidad.
Intervención: Sulfuro de plata con o sin agentes adicionales.
Comparación: Sulfuro de plata con y sin agentes adicionales.
O (resultados): Efecto antimicrobiano y biocompatibilidad de nanopartículas de sulfuro de plata en función de la concentración para aplicarse en biomateriales.
Las palabras clave utilizadas fueron: silver sulfide, biocompatibility, antimicrobial activity, cytotoxicity, antifungal effect, cell viability. En todas las bases de datos se conjuntaron palabras clave para la búsqueda con el operador de búsqueda AND.
Para la selección de los estudios individuales, primero se revisaron los títulos y después la información que aportaban en el resumen con base en los criterios de inclusión.
Para extraer datos de los artículos seleccionados, se leyeron el resumen, objetivo, materiales y métodos, resultados y conclusiones; obteniendo los siguientes: métodos de síntesis, tamaño y morfología del sulfuro de plata, así como los agentes o compuestos adicionales utilizados para su obtención. Asimismo, se obtuvieron las técnicas o métodos utilizados en los ensayos, así como la concentración de nanopartículas empleada para comparar la efectividad antimicrobiana y viabilidad celular con los microrganismos y células expuestos, respectivamente.
La calidad de la evidencia de los estudios individuales se evaluó con el sistema GRADE (Grades of Recommendation, Assessment, Development, and Evaluation).
Resultados
Los frutos de esta indagación se muestran en la Figura 1. Se encontraron un total de 16,736 artículos, en las tres bases de datos, que contenían las palabras clave de interés. Después de filtrar la información de los últimos 6 años, obtuvimos 2,100 artículos, de los cuales, al realizar el cribado por título, resumen y texto completo, solo 91 fueron seleccionados. Para esta revisión sistemática se incluyeron solo 13 artículos que cumplían los criterios de elegilibilidad.
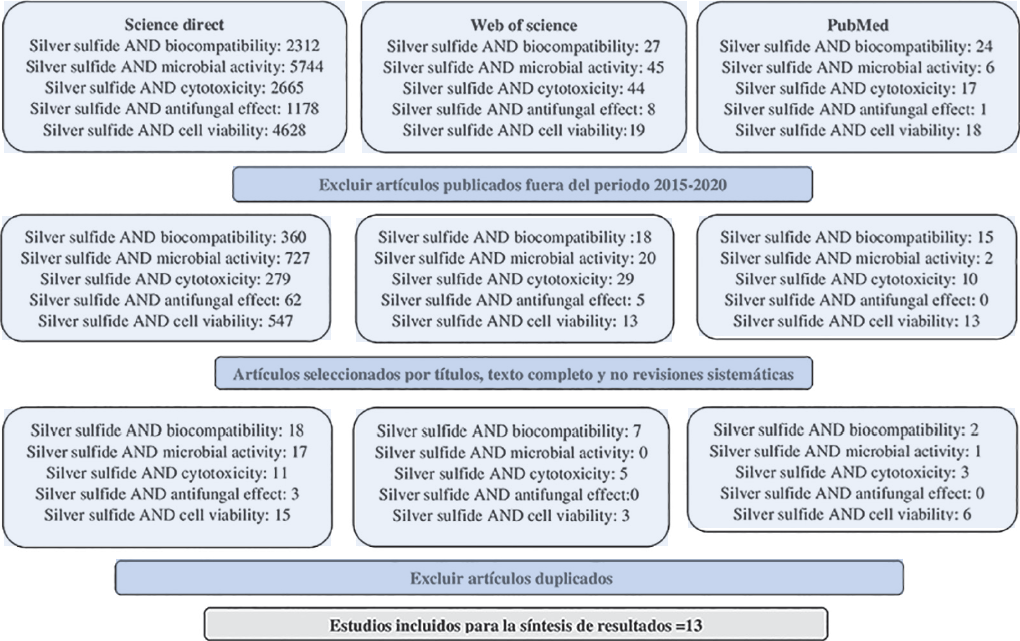
Fuente: Elaboración de los autores.
Figura 1 Diagrama PRISMA que representa la selección de los estudios.
Esto se resume en la Tabla 1, donde se exhibe la evidencia de los estudios individuales. Se encontró presencia de riesgo de sesgo en la mayoría de los artículos seleccionados, debido a que 8 de los 13 artículos incluidos no especificaron claramente si los ensayos de actividad microbiana y biocompatibilidad se realizaron por triplicado. En la mayoría no se incorporaba un grupo control positivo para un análisis completo. Por otro lado, el tiempo de seguimiento de los ensayos antimicrobianos y de biocompatibildida fue de 12, 24 y 48 horas (Javidi et al., 2016, Delgado-Beleño, et al., 2018, Vardar et al., 2018, Vardar et al., 2019, Zhong et al., 2020), sin embargo, en esta revisión solo se reportan los datos a las 24 horas.
Tabla 1 Análisis de calidad de los estudios incluidos para la síntesis de resultados.
| Referencia | Tamaño de muestra 1=Inespecifica/estudio piloto 2=Presente |
Cegado 0=No presenta 1=Intención a tratar/ otro método de análisis 2=Presente y descrito |
Seguimiento 0=Incomplet 1=Intención de tratar/otro método 2=Completo |
Variable de respuesta 0=Cualitativa subjetiva 1=Cualitativa objetiva 2=Cuantitativa |
Concordancia en los métodos de medición 0=No presenta 1=No es claro 2=Presente |
Resultados 0=Incompleto 2=Completo |
Total |
|---|---|---|---|---|---|---|---|
| Javidi et al., 2016 | 1 | 2 | 2 | 1 | 2 | 2 | 10 |
| Ayoghya y Veerabhadram, 2017 | 1 | 0 | 1 | 2 | 2 | 2 | 8 |
| Jafari et al., 2017 | 2 | 0 | 1 | 1 | 2 | 2 | 8 |
| Delgado-Beleño, et al., 2018 | 1 | 1 | 2 | 1 | 2 | 2 | 9 |
| Huo, et al., 2018 | 1 | 1 | 1 | 2 | 2 | 2 | 9 |
| Subramaniyan et al., 2018 | 2 | 1 | 1 | 2 | 1 | 2 | 9 |
| Vardar et al., 2018 | 2 | 1 | 2 | 2 | 2 | 2 | 11 |
| Iqbal et al., 2019 | 1 | 0 | 1 | 1 | 2 | 2 | 7 |
| Xiong et al., 2019 | 1 | 2 | 1 | 2 | 2 | 2 | 10 |
| Wiercigroch-Walkosz et al., 2019 | 2 | 0 | 1 | 1 | 1 | 2 | 7 |
| Vardar et al., 2019 | 1 | 1 | 2 | 2 | 2 | 2 | 10 |
| Aydemir et al., 2020 | 1 | 2 | 1 | 2 | 2 | 2 | 10 |
| Zhong et al., 2020 | 2 | 1 | 2 | 2 | 2 | 2 | 11 |
Fuente: Elaboración de los autores.
El tamaño y la morfología del sulfuro de plata varía en función del agente o compuesto adicional que se utilizó durante la síntesis (Tablas 2, 3, 4). Por caso, aglomerados o nanopartículas cuasi-esféricas son obtenidas al utilizar como soporte óxido de grafeno reducido (rGO) (Huo et al., 2018), goma de kondagogu (GK) (Ayoghya y Veerabhadram, 2017), agentes limitantes (capping agents, por sus siglas en inglés) o zeolitas (Delgado-Beleño et al., 2018). Mientras que, puntos cuánticos esféricos con diámetros menores a 5 nm fueron obtenidos en medios acuosos u orgánicos al utilizar ácidos orgánicos (Javidi et al., 2016; Vardar et al., 2018; Vardar et al., 2019), fosfolípidos (Wiercigroch-Walkosz et al., 2019) o aminoácidos (Aydemir et al., 2020) (Figura 2).
Tabla 2 Métodos de síntesis de nanoestructuras de sulfuro de plata con o sin un compuesto adicional.
| Referencia | Nanoestructuras Ag2S/Agente o compuesto adicional |
Método síntesis | Descripción | Estructura cristalina/ información relevante |
|---|---|---|---|---|
| Javidi et al., 2016 | QDs esféricos/MAA | Síntesis por co-precipitación con agente estabilizador MAA | 0.2 g de AgNO3 se disolvieron en una solución de PEG y agua (20:80 v/v), la solución se puso en agitación continua a 800 rpm, 100 °C, 0.5 hora mientras se agregaba gota a gota el ácido mercaptoacético (MAA). Los puntos cuánticos (QDs) fueron centrifugados a 14,000 rpm, 20 min. | La cristalinidad es mostrada por rayos X, pero solo hace referencia a que es similar a la reportada por otros autores. |
| Ayoghya y Veerabhadram, 2017 | NPs esféricas/GK | Síntesis verde y método hidrotermal | 50 mL de AgNO3 (0,1 mol/L) se le agrega 1% (w/v) de polvo de goma Konda Goku (GK); después de 2 horas de agitación a temperatura ambiente, se añadieron gota a gota 50 mL de Na2S (0,1 mol/L) y se dejó en agitación 1 hora. El producto se introdujo a una autoclave a 15 libras de presión a 120 °C, 1 hora, después el producto se dejó enfriar para lavarlo con agua bidestilada y filtrarlo. | Ag2S de estructura cristalina monoclínica (acantita) JCPDS: 00-014-0072 |
| Jafari et al., 2017 | NPs/RHA-MCM-41 | Síntesis verde y método de intercambio iónico | Una solución de 50 mL de AgNO3 (0.05mol/L) con 1 g de RHA-MCM-41 se agitó a 25 °C, 5 horas. La muestra se lavó y se secó al aire y posteriormente se extrajo 1g del Ag+/ RHA-MCM-41 para mezclar con 50 mL de 0.1M de Na2S, se agitó 5 horas a una temperatura constante. El producto se lavó con agua desionizada y se recolectó por filtración. | Estructura cristalina monoclínica (acantita) JCPDS: 00-014-0072. Las micrografías de TEM mostraron NPs de Ag2S incorporadas a las RHA- MCM-41. |
| Delgado- Beleño et al., 2018 | NPs cuasi-esféricas-zeolita A4 | Síntesis de intercambio iónico | Se realizó la incrustación de iones de plata en la zeolita A4 mezclando 8g de A4 hidratado y 25 mL de AgNO3 a 0.02M y se dejó en agitación magnética durante 0.5 horas a 50 °C. La muestra se filtró y se lavó con 200 mL de agua desionizada. 0.2g del producto obtenido (A4 + Ag+) se expusieron a un tratamiento térmico a 400 °C, 3 horas. Se colocó A4 + Ag+ en 0.5 mL a 0.05M de tiourea (TU), 0.5 horas a 50 °C, para obtener los nanocompuestos de la zeolita con Ag2S. | Por medio de imágenes de HRTEM se identificaron las distancias
interplanares de 2.18, 2.35 y 2.61 Å, que concuerdan con los
planos (031), (120) y (120) de la estructura monoclínica
(acantita) del α-Ag2S. JCPDS:
00-014-0072. Morfología causi-esférica, se encontraron NPs de Ag2S en la matriz de zeolita A4. |
| Huo et al., 2018 | Ag/Ag2S/rGO | Método hidrotermal a baja temperatura | 10 mL de AgNO3 y 10 mL de TU fueron depositados gota a gota en una solución de óxido de grafeno y se dejó agitar2 horas. 50 mL de la solución fue transferido a un reactor de teflón, el cual se puso en un horno de aire seco 10 horas a 170 °C. El producto de óxido de grafeno con las nanopartículas de sulfuro de plata (Ag2S/rGO) fue filtrado y lavado con alcohol etílico absoluto y agua desionizada 3 veces y se dejó secar toda la noche a 80 °C. El compuesto Ag/Ag2S/rGO fue obtenido por reducción del Ag2S/rGO usando una luz UV con potencia de 250W, 3 minutos. | Estructura cristalina monoclínica (acantita) JCPDS:
00-014-0072. Las NPs de Ag2S mostraron una morfología irregular. |
| Subramaniyan et al., 2018 | NPs/N14E | Síntesis por reducción con agente estabililizador N14E | 0.3 mM de N-miristoiletanolamina (N14E) disuelto en hidróxido de sodio 1mM y 1mL de etanol se mezclaron en 50 mL de una solución acuosa de AgNO3 (0.25mM). A la solución se añadió NaBH4 (10 µM) y se dejó reposar 24 horas para obtener AgNPs. Para la sulfuración se extrajeron 25 ml de AgNPs y se mezclaron con 0.25mM de sulfuro de sodio (Na2S). | No presenta difracción rayos X. Nanopartículas semiesféricas. |
| Vardar et al., 2018 | QDs esféricos/2-MPA | Síntesis química | Se disolvió el ácido 2-mercaptopropiónico (2-MPA) (1.25 mmol) en 375 mL de agua desionizada, desoxigenada; se ajustó el pH a 7.5 usando las soluciones de NaOH y CH3COOH (2M). Después se añadió el precursor AgNO3 (0.25mmol) y se ajustó de nuevo el pH a 7.5, posteriormente la mezcla se puso en agitación 5 horas a temperatura ambiente y se añadieron 125 mL de solución acuosa desoxigenada de Na2S (0.0625 mmol) con agitación vigorosa. Finalmente, la muestra se lavó con agua desionizada usando filtros centrífugos y los QDs de Ag2S/2-MPA fueron almacenados en la oscuridad a 4 °C y secados en un liofilizador. | En la micrografía realizada por TEM se observó que los QDs de Ag2S/2-MPA presentaban una morfología esférica. |
| Iqbal et al., 2019 | NPs/CdS | Método de co-precipitación | Se agregaron 60 mL de Na2S (0.1M) y 0.2g de polivinilpirrolidona (PVP) a una solución de 120 mL de AgNO3 0.1M con agitación vigorosa, 1 hora a temperatura ambiente. Después se añadieron gota a gota 60 mL de acetato de cadmio (Cd(CH3COO)2) 0.5 M y se dejó en agitación 2.5 horas. Se obtuvo una precipitación de color marrón oscuro la cual fue filtrada y lavada muchas veces con etanol y acetona, después se dejó secar a una temperatura de 50°C, 4 horas. | Los resultados de XRD concordaron con la estructura monoclínica
(acantita) JCP DS: 00-014-0072. Morfología esférica del sulfuro de plata. |
| Xiong et al., 2019 | NPs/NC(ZIF-8) | Método de síntesis asistida por ultrasonido | 20 mg de nanocubos (NC) de imidazolato zeolítico (ZIF-8) se
depositaron en 5 mL de etanol y se dejó con tratamiento
ultrasónico 1 hora. Posteriormente se añadieron 2 mL de etanol
de AgNO3 (34 mg) y la mezcla fue sometida a
ultrasonido 2 horas para obtener un precipitado, el cual fue
lavado con agua y extraído por medio de centrifugación a 8000
rpm. El producto se dejó secar al vacío a temperatura
ambiente. Los nanocubos con plata (Ag+/NC) fueron sulfurados agregando 5 mL de etanol, 5 mL de tioacetamida (TA) en etanol (0.5 mg/mL). Se dejó reaccionar durante 8 horas y el polvo resultante se lavó tres veces con etanol, fue recolectado por centrifugación a 8000 rpm, 15 minutos y se dejó secar a 60 °C. |
NPs se encuentran homogéneamente distribuidas en la superficie del nano-cubos de ZIF-8 que presentan una morfología de dodecaedro rómbico. |
| Wiercigroch- Walkosz et al., 2019 | QDs esféricos/ PhLd | Método de descomposición térmica y método de hidratación con agente de recubrimiento dodecanotiol | 0.1 mmol de plata recubierta con dodecanotiol (C2H5) 2NCS2Na 3H2O (Na (DDTC)) se añadieron a un matraz schlenk con 12 mL de dodecanotiol, se calentó a 70 °C y se desgasificó 1 hora al vacío. después el matraz se llenó con N2 y la temperatura se elevó a 150 °C en 3 minutos y se mantuvo por 2 minutos más. La solución fue enfriada rápidamente sumergiendo el matraz en agua fría y la mezcla fue centrifugada y lavada con metanol obteniendo así la precipitación de los puntos cuánticos de Ag2S. Luego fueron dispersados con cloroformo con una concentración de 1.3 mg/mL. Los QDs de Ag2S se cargaron en nanoestructuras de fosfolípidos (Phld) mediante una técnica de hidratación de película delgada. Primero se disolvieron en 10 mL de cloroformo y para la encapsulación se mezcló 1 mL de la suspensión de los QDs con una solución de cloroformo de fosfolípidos en un matraz de fondo redondo. Después se usó un evaporador rotatorio al vacío en baño de agua a temperatura ambiente para evaporar el cloroformo, luego se calentó en un baño de agua a 75 °C, 5 minutos. Después se agregó 1 mL de agua caliente a 75 °C de calidad HPLC, se agitó a 75 °C durante 15 minutos y la mezcla resultante se extrajo a través de un filtro con poros de 200 nm de diámetro. Finalmente, se centrifugó a 12.000 rpm, 10 minutos, el sobrenadante fue descartado y el precipitado fue puesto en agua o tampón PBS y fue almacenado a 4 °C. | Los QDs de Ag2S fueron eficazmente encapsulados y las estructuras de fosfolípidos presentaron un tamaño de 134 ± 28 nm. |
| Vardar et al., 2019 | QDs esféricos/DMSA | Método en un solo paso con agente estabilizador DMSA | Se disolvió la cantidad de 42.5 mg de AgNO3 (0.25 mmol) en 75 mL de agua desionizada. Después se disolvieron 113.89 mg de ácido meso-2,3-dimercaptosuccínico (DMSA) (0.625 mmol), se agregaron a 25 mL de agua desionizada a un pH de 7.5 y se añadieron a la mezcla con AgNO3. El pH fue ajustado a 7.5 usando las soluciones de NaOH y CH3COOH (2M), posteriormente la mezcla fue agitada 4 horas a 70 °C, luego fue lavada con agua desionizada y fue centrifugada para obtener los puntos cuánticos coloidales de Ag2S/DMSA y fueron almacenados toda una noche a 4 °C. | El tamaño de los QDs fue medido por dispersión dinámica de luz la cual mostró que los QDs no se aglomeraban en el medio de cultivo celular. |
| Aydemir et al., 2020 | QDs esféricos/ GSH | Síntesis química | Se disolvieron 0.25 mmol de AgNO3 en 75 mL de agua desoxigenada y 0.125 mmol de Na2S en una solución de 25 mL de agua desoxigenada. Después se agregaron 0.5 mmol de glutatión (GSH) a la solución de AgNO3 y luego se ajustó el pH a 9 utilizando NaOH y CH3COOH (1M) a 50 °C. Después se añadió la solución de Na2S a la solución de AgNO3. Con agitación mecánica vigorosa a 500 rpm, 2 horas. Para la extracción de los puntos cuánticos de GSH-Ag2S se utilizaron filtros centrífugos sartorius (corte de 3kDa) y fueron lavados con agua desionizada. El producto de GSH-Ag2S QDs fue almacenado en la oscuridad a 4 °C | Los QDs presentaron una morfología esférica cristalina, pero no muestran patrones de rayos X. |
| Zhong et al., 2020 | NDs/QE-PEG | Síntesis química y ultrasonido con agente estabilizador PEG | A un matraz de tres bocas se agregaron 20mmol de 1-octadecano
(ODA), 10 mmol de octadecilamina (ODE) y 10 mmol de ácido oléico
(OA). La mezcla se calentó a 70 °C y se desoxigenó durante 10
minutos. Se inyectaron 0.1 mmol de dietilditiocarbamato de plata
(Ag-DDTC) en 1.5 ml de piridina, se puso al vacío 30 minutos a
200 °C. El producto se lavó tres veces con exceso de etanol y
fue dispersado en 10 mL de ciclohexano. Después se realizó una
mezcla con 3 mg de poli (etilenglicol) - poli (β-amino ésteres)
(PEG 5k-PAE 10K) y 1.5 mg del producto, y se puso en ultrasonido
10 minutos. Posteriormente, se agregó 1 mg de quercetina (QE),
se dejó otros 10 minutos en ultrasónico. La solución obtenida se
añadió gota a gota en agua ultrapura a 40 °C, se dejó otros 10
minutos en ultrasónico y luego la mezcla se sometió a
evaporación rotatoria. Se mezclaron 3 mg de PEG 5k-PAE 10k y 1.5 mg de nanodots (NDs) Ag2S hidrófobos y se dejó en ultrasónico 10 minutos, luego se le añadieron 0.5 mg de QE y 0.25 mg de DCM-NH2 y fue ultrasonicada 10 minutos. Posteriormente, la mezcla fue añadida gota a gota a agua ultrapura a una temperatura de 40 °C. Después la mezcla fue agitada otros 10 minutos en ultrasonido, se sometió a evaporación rotatoria y el producto fue dispersado en agua. |
No se menciona estructura cristalina. |
Notas: NPs: nanopartículas; GK: goma de ondagogu (Cochlospermum gossypium); RHA-MCM-41: nanopartículas de la ceniza de cáscara de arroz; rGO: óxido de grafeno reducido.
Fuente: Elaboración de los autores.
Tabla 3 Comparación de propiedades antimicrobianas de los artículos de estudio a una incubación de 24 h.
| Referencia | Nanoestructuras Ag2S/Agente o compuesto adicional |
Tamaño nanopartículas de Ag2S (nm) |
Método de ensayo antimicrobiano |
Control positivo |
Microrganismos de estudio |
Concentración de Ag2S |
Zona de Inhibición (mm) |
|---|---|---|---|---|---|---|---|
| Ayoghya y Veerabhadram, 2017 | NPs esféricas/ GK | 25 nm | Método difusión de disco (Kirby- Bauer) | Ampicilina |
E. coli (Gram -) |
10 μL | NPs = 10.34 mm |
| NPs /GK = 22.38 mm | |||||||
|
P. aeruginosa (Gram -) |
NPs = 13.68 mm | ||||||
| NPs /GK = 28.82 mm | |||||||
|
S. aureus (Gram +) |
NPs = 15.81 mm | ||||||
| NPs /GK = 38.34 mm | |||||||
|
B. thuringiensis (Gram +) |
NPs = 8.43 mm | ||||||
| NPs /GK = 24.48 mm | |||||||
| Jafari et al., 2017 | NPs/RHA- MCM-41 | 70 nm | Método de difusión de disco (Kirby-Bauer) | Gentamicina |
E. coli (Gram -) |
MIC = 15 μg/mL |
11 mm |
|
S. aureus (Gram +) |
11 mm | ||||||
| Huo et al., 2018 | Ag/Ag2S | Aglomerados con morfología irregular | En tubo de ensayo (Test tube) | No menciona |
E. coli (Gram -) |
100 μg/mL | 86.14 % |
| Ag2S/rGO | 79.12 % | ||||||
| Ag/Ag2S/rGO | 97.76% | ||||||
| Delgado-Beleño et al., 2018 | NPs cuasi- esféricas-zeolita A4 | 9.2 ± 3.5 nm | Método de difusión de disco (Kirby-Bauer) | Gentamicina |
E. coli (Gram -) |
20,000 μg | 9.5 mm |
|
K. pseudomona (Gram -) |
10 mm | ||||||
|
S. aureus (Gram +) |
15 mm | ||||||
|
S. agalactiae (Gram +) |
11 mm | ||||||
| Subramaniyan et al., 2018 | NPs/N14E | 8-30 nm | Ensayo en placa microtitulación de resazurina (REMA) | No menciona |
E. coli (Gram -) |
MIC = 50 μM | ~ 62% Fluorescencia (λex = 350 nm) |
|
P. aeruginosa (Gram -) |
~ 65% Fluorescencia (λex = 350 nm) |
||||||
|
S. aureus (Gram +) |
~ 65% Fluorescencia (λex = 543 nm) |
||||||
|
B. subtilis (Gram +) |
~ 72% Fluorescencia (λex = 543 nm) |
||||||
| Iqbal et al., 2019 | NPs/CdS | ~ 50-100 nm | Método difusión en Agar (Agar Well diffusion) | No menciona |
E. coli (Gram -) |
NPs MIC=135 μg/mL |
28.10 mm |
| NPs/CdS (10%) MIC=169 μg/mL |
39.24 mm | ||||||
|
P. aeruginosa (Gram -) |
NPs MIC=69 μg/ml |
25.10 mm | |||||
| NPs/CdS (10%) MIC=87 μg/mL |
35.88 mm | ||||||
|
S. aureus (Gram +) |
NPs MIC=470 μg/mL |
22.77 mm | |||||
| NPs/CdS (10%) MIC=565 μg/mL |
30.23 mm |
Nota: NPs: nanopartículas; GK: goma de kondagogu (Cochlospermum gossypium); RHA-MCM-41: nanopartículas de la ceniza de cáscara de arroz; rGO: óxido de grafeno reducido.
Fuente: Elaboración de los autores.
Tabla 4 Viabilidad celular y citotoxicidad del sulfuro de plata a 24 h.
| Referencia | Tipo de Ag2S/ Agente o compuesto adicional |
Tamaño nanopartículas de Ag2S (nm) |
Método de ensayo |
Células de estudio |
Concentración (µg/mL) |
Resultados de biocompatibilidad |
|---|---|---|---|---|---|---|
| Javidi et al., 2016 |
QDs esféricos/ MAA |
< 5 | MTT | HCL A549 | 6.25-200 | ~ 95-90% |
| Hep G2 | ~ 80-100% | |||||
| Vardar et al., 2018 |
QDs esféricos/ 2-MPA |
3.74 ± 0.33 | MTT | V79 | IC50 = 1361 | 80%-40% a 200-2000 μg/mL |
| NRU | IC50 = 1269 | 60%-40% a 800-2000 μg/mL |
||||
| Xiong et al., 2019 | NPs/NC(ZIF-8) | 15 nm | MTT | NIH3T3 | 50-200 | ~ 68-78% |
| Wiercigroch- Walkosz et al., 2019 |
QDs esféricos/ PhLd |
< 5 nm | MTS | NIH3T3 | 1300 | No cambió la morfología celular en la mayoría de las células tratadas, los cambios fueron visibles solo en las células NIH3T3. |
| HCT116 | ||||||
| Vardar et al., 2019 |
QDs esféricos/ DMSA |
2.9 nm | MTT | V79 | 5-2000 | 54.0 ± 4.8% a 2000 µg/mL |
| NRU | 65.7 ± 4.1% a 2000 µg/mL |
|||||
| Aydemir et al., 2020 |
QDs esféricos/ GSH |
3.16 nm | MTT | 293 T | 0-300 | ~ 98-65 % |
| CFPAC-1 | ~ 98-75% | |||||
| Zhong et al., 2020 | NDs/QE-PEG | 52 nm | MTT | HepG-2 | 10-300 | ~ 90% |
| HL-7702 |
Nota: Se considera la viabilidad superior al 80% como base no tóxica en ISO 10993-5. MTT: método colorimétrico que utiliza Bromuro de 3- (4,5-dimetiltiazol-2-il) -2,5-difeniltetrazolio; NRU: ensayos de captación de rojo neutro; MTS: ensayo de proliferación celular; CellTiter 96 AQueous One Solution. NIH3T3: línea celular de fibroblastos embrionarios de ratón; HCT116: línea celular de carcinoma colorrectal humano; 293 T: células de riñón embrionario humano; CFPAC-1: células de adenocarcinoma ductal humano; HCL A549: células humanas A549 (lung carcinoma). QE-PEG: inhibidor de HSP70; GSH: glutation; NC: nanocubos; PhLd: nanoestructuras de fosfolípidos.
Fuente: Elaboración de los autores.

Fuente: Elaboración de los autores.
Figura 2 Representación esquemática de los agentes limitantes utilizados en la síntesis de puntos cuánticos de sulfuro de plata con un tamaño < 5 nm.
En la Tabla 2, se describen los métodos de síntesis y las propiedades estructurales del sulfuro de plata obtenidos de los estudios individuales. Para la síntesis, el nitrato de plata fue utilizado como precursor de plata, mientras que la tiourea, la tioacetamida y el sulfuro de sodio como precursores de azufre. La fase cristalina monoclínica ((-Ag2S) conocida como acantita (JCPDS: 00-014-0072) fue la más utilizada debido a su gran estabilidad a temperaturas < 178 °C (≈ 450K) (Sadovnikov et al., 2017; Ibrahim et al., 2016).
En la Tabla 2, se describen los métodos de síntesis y las propiedades estructurales del sulfuro de plata obtenidos de los estudios individuales. Para la síntesis, el nitrato de plata fue utilizado como precursor de plata, mientras que la tiourea, la tioacetamida y el sulfuro de sodio como precursores de azufre. La fase cristalina monoclínica ((-Ag2S) conocida como acantita (JCPDS: 00-014-0072) fue la más utilizada debido a su gran estabilidad a temperaturas < 178 °C (≈ 450K) (Sadovnikov et al., 2017; Ibrahim et al., 2016).
Los resultados de la actividad antimicrobiana y de citotoxicidad del sulfuro de plata se presentan en las Tablas 3 y 4, respectivamente.
Actividad antimicrobiana
Al momento de comparar los resultados del efecto antimicrobiano se observa que todos los estudios utilizaron Staphylococcus aureus (S. aureus) y Escherichia coli (E. coli) como microrganismos Gram-positivos y Gram-negativos, respectivamente. Otros microrganimos Gram-positivos, tales como Bacillus thuringiensis (B. thuringiensis), Streptococcus agalactiae (S. agalactiae) y Bacillus subtilis (B. subtilis), así como especies de la familia de pseudomonas (Gram-negativos) se han utilizado para los ensayos de inhibición.
El método para el ensayo antimicrobiano más empleado para las nanopartículas de Ag2S es el de difusión en disco o en placa, pero no en todos los estudios compararon los resultados con un control positivo como la ampicilina o la gentaminicina (Ayoghya y Veerabhadram, 2016; Jafari et al., 2017). La actividad antimicrobiana del sulfuro de plata se potencializa cuando es sintetizado con agentes estabilizadores o con un compuesto adicional para formar nanocompuestos. No obstante, la zona de inhibición para S. aureus varía de 11 a 38 mm independientemente del tamaño y del agente o compuesto adicional con el que se encuentre el Ag2S. Podemos citar el trabajo de Jafari y colaboradores (2017), quienes reportaron un halo de inhibición de 11 mm y una concentración mínima inhibitoria (MIC) de 15 μg/mL en Ag2S sintetizadas con nanopartículas de cáscara de arroz (RHA -MCM-41) con un tamaño de 70 nm. Iqbal y colaboradores (2019) reportaron un halo de 22 mm y un valor de MIC de 470 μg/mL en nanopartículas de Ag2S de 50-100 nm. Mientras que, Ayodhya y Veerabhadram (2016) reportaron 38 mm a 10 μL de nanopartículas Ag2S/GK con un tamaño de 25 nm. Los mismos autores Jafari et al. (2017), Ayoghya Veerabhadram (2016) e Iqbal et al. (2019) reportan la inhibición contra E. Coli de 11 mm, MIC=15 μg/mL (Ag2S-RHA-MCM-41); 28 mm, MIC=135 μg/mL (Ag2S) y 22.38 mm y 10 μL (Ag2S/GK), respectivamente.
Viabilidad celular
La comparación de los resultados de viabilidad celular en función de la concentración de sulfuro de plata en los estudios individuales se describe en la Tabla 4. Se observa que los puntos cuánticos < 5 nm de sulfuro de plata y el método de MTT para determinar la biocompatibilidad son los más utilizados. Los estudios que usaron ácidos orgánicos (ácido mercaptoacético, MAA; ácido meso-2,3-dimercaptosuccínico, DMSA; ácido 2-mercaptopropiónico, 2-MPA) como agentes estabilizadores en la síntesis de los puntos cuánticos, mostraron porcentajes bajos de viabilidad celular. Puntos cuánticos esféricos de Ag2S/DMSA de 2.9 nm presentan el 65% de viabilidad celular a 2000 µg/mL con células de fibroblastos de pulmón de hámster chino (V79) (Vardar et al., 2019). En un rango de 10 a 300 µg/mL de nanopuntos (NDs) de Ag2S/QE-PEG (52 nm de diámetro) exhibieron alrededor del 90% de viabilidad celular con una línea celular de carcinoma hepatocelular (HepG-2) (Zhong et al., 2020). La concentración utilizada en los estudios varía de 5 a 2000 µg/mL de nanopartículas de sulfuro de plata.
Discusión
En los artículos seleccionados se observó una gran variedad de resultados, tanto en los métodos de síntesis como en los métodos de los ensayos biológicos y antimicrobianos. A pesar de que en algunos estudios utilizaron diferentes microrganismos Gram (+) y Gram (-), no se observan diferencias en las medidas de los halos de inhibición.
Por otro lado, la comparación de la viabilidad celular y el rango de concentración de nanopartículas fue complicada debido a la utilización de distintas células. Sin embargo, se pudo observar que el tamaño de la partícula de Ag2S influye en la viabilidad celular. Al exponer fibroblastos NIH3T3 con nanopartículas Ag2S/NC(ZIF-8) de 15 nm, se presentó una viabilidad celular entre el 68 y el 78% en un rango de concentración de 50-200 μg/mL (Xiong et al., 2019). Mientras que con una concentración de 1300 µg/mL de QDs -Ag2S (< 5 nm) no se observó un cambio en la morfología celular con el mismo tipo de fibroblastos (Wiercigroch-Walkosz et al., 2019). Javidi y Zhong reportaron una biocompatibilidad de 80-100% con células Hep G2 en un rango de concentración de 6.25 a 300 µg/mL (Javidi et al., 2016, Zhong et al., 2020).
Aunque la falta de evidencia es abundante, se puede decir que el tamaño de las partículas de sulfuro de plata influye, efectivamente, en su biocompatibilidad y efecto inhibitorio, pero sin dependencia clara alguna.
Limitaciones
Las restricciones encontradas en esta revisión sistemática fueron: a) una insuficiente cantidad de artículos que estudiaran específicamente las partículas de sulfuro de plata sin algún agente o compuesto; b) descripción cualitativa o cuantitativa de los resultados de citotóxicidad, de efecto antimicrobiano de las partículas de sulfuro de plata, esto es, falta de un formato universal para la expresión de los resultados, con el fin de comparar entre estudios con la misma bacteria o células.
Otra de las limitaciones es la falta de artículos que hablaran sobre las diferentes estructuras cristalinas del sulfuro de plata (monoclínica, cúbica centrada en el cuerpo y cúbica centrada en las caras), pues solo se estudiaron partículas con estructura monoclínica. Por lo cual, también es importante evaluar los resultados que presentarían cada una de las estructuras cristalinas al ser sometidas a estudios de citotoxicidad, inhibición bacteriana y genotoxicidad.
Conclusiones
La mayoría de los artículos seleccionados revelan que las nanoestructuras de Ag2S poseen efectividad contra microrganismos Gram(+) y Gram(-) independientemente del tamaño de la partícula y la concentración. La viabilidad celular que presentan los puntos cuánticos menores a 5 nm no muestran una tendencia clara con el tamaño y la concentración.
Por otro lado, la síntesis para obtener las nanopartículas de sulfuro de plata no muestran una modificación en la inhibición bacteriana y viabilidad celular, pero sí representan una importante diferencia en el tamaño del Ag2S.
Es necesario realizar nuevos estudios in vitro o in vivo para determinar si existe dependencia de la concentración y del tamaño de las nanoestructuras en las propiedades biológicas y antimicrobianas de sulfuro de plata.











 nueva página del texto (beta)
nueva página del texto (beta)



