Introducción
Las especies forrajeras leñosas pueden usarse en sistemas silvopastoriles para la alimentación de rumiantes, son una alternativa para disminuir los costos de producción debido a que reduce el uso de insumos externos (Gil et al., 2005). La asociación de leguminosas arbustivas con pasturas mejora la calidad nutritiva para el ganado de una forma sustentable. La leucaena, por su alta capacidad para fijar nitrógeno, contenido de proteína, valor nutritivo y potencial de producción de materia seca, se ha usado eficientemente para la alimentación animal en el trópico mexicano debido a que mejora la dieta consumida por el ganado, la cual es a base de pastos de calidad nutritiva baja (Shelton et al., 1991). Por otro lado, aunque los forrajes son la fuente principal de minerales para el rumiante, el desbalance mineral en suelos y forrajes del trópico causa un comportamiento productivo y reproductivo pobre de rumiantes en pastoreo (McDowell y Arthington, 2005), pero en los sistemas silvopastoriles la producción de leche y la ganancia diaria de peso incrementan (Ibrahim et al., 2006).
No obstante, con el fin de aplicar un sistema silvopastoril intensivo basado en el uso de Leucaena leucocephala asociada con Cynodon nlemfuensis mediante pastoreo rotacional (Solorio et al., 2009); es conveniente analizar la asimilación ruminal de tales forrajes en función de la edad del rebrote y el contenido nutrimental, por lo que en esta investigación se determinó, como una primer etapa, la fermentación in vitro por la técnica de producción de gas y su correlación con el contenido mineral y nutritivo de Leucaena leucocephala y Cynodon nlemfuensis de seis edades de rebrote, durante la época de nortes, las cuales estuvieron asociadas en un sistema silvopastoril en la región huasteca potosina de México.
Materiales y métodos
El experimento se realizó en el módulo silvopastoril, cuya área total es de una hectárea con 62 hileras Leucaena leucocephala a una densidad de 52 000 plantas ha-1 (distancia entre plantas de 12 cm y 1.6 m entre hileras) asociada con Cynodon nlemfuensis entre las hileras. La pradera fue establecida en octubre de 2010 en la Unidad de Producción “El Gargaleote” de la Universidad Autónoma Chapingo, ubicado en Tamuín, San Luis Potosí, México. El clima es cálido sub- húmedo con lluvias en verano, temperatura media anual de 25 °C y la precipitación promedio anual es de 990 mm (García, 1981). El periodo de lluvias va de julio a octubre, la época de nortes de noviembre a febrero y el periodo de secas de marzo a junio. Los suelos del área de estudio son fluvisoles y vertisoles, profundos y bien drenados, con textura limo arcillosa o areno limosa, con pH alcalino superior a 7.5.
Unidad experimental: el módulo se dividió en 18 lotes de 550 m2 cada uno (11 x 50 m), con siete hileras de leucaena por lote. Los tratamientos (6) y repeticiones (3) se distribuyeron aleatoriamente. Los tratamientos fueron 35, 42, 49, 56, 63 y 70 días de rebrote a partir de la última poda de la leucaena y del pasto estrella, durante la época de nortes (noviembre, 2011 a enero, 2012). Para el muestreo de forrajes se seleccionaron por lote, tres sitios de 3.2 m2 (2 x 1.6 m) sobre las hileras 2, 3 y 5 de leucaena. El muestreo se hizo removiendo material vegetativo de la leucaena (hojas y puntas tiernas de los rebrotes) y del pasto estrella (hojas y tallos) (Jiménez y Ortiz, 2012).
Determinación de rendimiento de forraje: el total de material removido de cada especie se pesó en fresco, se secó a peso constante en una estufa de aire forzado a 65 °C, y se molió con una criba de 2 mm. Con estos datos se estimó los kg de MH y MS por hectárea de cada especie forrajera y total (la suma de ambas).
Digestibilidad y producción de gas in vitro: se investigó la cinética de fermentación de ambos forrajes, indirectamente por la técnica de producción de gas (Menke y Steigass, 1988), para lo cual se usaron frascos color ámbar de 125 mL de capacidad a los que se les colocó 0.5 g de MS de cada sustrato (Leucaena leucocephala o Cynodon nlemfuensis) de los DR ya indicadas. Posteriormente y bajo un flujo continuo de bióxido de carbono (CO2), a cada frasco se le agregaron 90 mL de inóculo ruminal diluido (1:10) el cual se obtuvo de dos ovinos Rambouillet con cánula ruminal, se filtró a través de ocho capas de tela de gasa y se adicionó en una proporción de 1:9 a una solución mineral reducida compuesta de K2HPO4 (0.45 g L-1), KH2PO4 (0.45 g L-1), NaCO3 (0.6 g L-1), (NH4)2SO4 (0.45 g L-1), NaCl (0.9 g L-1), MnSO4 (0.18 g L-1), CaCl2 (0.12 g L-1), L-cisteína (0.25 g L-1) yNa2S(0.25gL-1).
Se incluyeron cuatro frascos blancos sin sustrato, se cerraron herméticamente con un tapón de goma y un aro de aluminio. El exceso de CO2 de cada frasco se extrajo con el manómetro para igualar la presión a cero y se incubaron en baño maría a 39 °C. La presión de gas de fermentación se midió con el manómetro (0 a 1 kg cm-2) a 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 23, 26, 29, 33, 37, 43, 49, 55, 61 y 72 h de incubación. Al final del período de incubación el residuo de cada frasco se filtró a través de papel de filtrado previamente pesado. Los papeles con residuo se secaron a 65 °C por 48 h y se pesaron. Por diferencia de peso se obtuvo la MS residual para determinar la DIVMS72 de 72 h de incubación.
Determinación del contenido mineral y nutrimentos: se tomaron submuestras molidas de 2 g de cada especie forrajera y cada DR por separado y se secaron totalmente a 105 °C por 12 h. Posteriormente, las muestras se incineraron en una mufla a 500o C durante 8 horas para cuantificarla proporción de cenizas y materia orgánica (MO) (AOAC, 1990). La cuantificación de Ca, Mg, Na, K, Cu, Zn, Fe y Mn se realizó mediante espectrofotometría de absorción atómica (Fick et al., 1979); el P se determinó utilizando el método colorimétrico (Clesceri et al., 1992); y mediante el método fluorométrico (Tamari et al., 1986). Extracto etéreo (EE) se determinó por el método de Goldsfich (AOAC, 2000), nitrógeno total por Kjeldahl (Harris, 1970), con el cual se obtuvo el porcentaje de proteína cruda (PC) multiplicando por 6.25, fibra detergente neutro (FDN), fibra detergente ácido (FDA) y lignina en H2SO4. El contenido de hemicelulosa y celulosa se estimó por diferencia de FDN y FDA, y FDA y Lignina-permanganato (Robertson y Van Soest, 1981).
Variables analizadas: los valores de presión (kg cm-2) se transformaron a volumen de gas (mL g-1 sustrato) con la ecuación de regresión (volumen= presión/0.019). Por un lado, se analizó el volumen fraccional del gas, se observa la gráfica donde podría encontrarse diferencias (p< 0.05), para Leucaena leucocephala se determinó el volumen fraccional (Va) de 0 a 12 h mientras que para Cynodon nlemfuensis fueron (Va) de 0 a 14 h, (Vb) de 16 a 33 h y (Vc) de 37 a 61 h de incubación. Por otro lado, se obtuvo el volumen acumulado de gas de 0 a 72 h de incubación, y se estimaron los parámetros de la cinética de producción de gas: volumen máximo (Vm; mL g-1), tasa (S; h-1) y tiempo de retardo (L; h), para el modelo logístico V=Vm/1+e (2-4S (T-L)) (Schofield y Pell, 1995) y utilizando el paquete estadístico SAS.
Otras variables fueron la digestibilidad in vitro de la MS (DMSIV; %). Rendimiento de MS de forrajes (kg MS ha-1) del material vegetativo colectado en los sitios y, eficiencia de producción de gas (mL g-1 de sustrato digerido). Además, se estimó la digestibilidad de la materia orgánica y energía metabolizable con los modelos matemáticos:
DMO (%) = 14.88+0.889GP+0.45PC+0.0651CEN (R2= 0.92)
EM (MJ kg-1MS) = 2.20+0.136GP+0.057PC (R2= 0.94).
Donde: GP= gas producido por 0.2 g de sustrato en 24 h; PC= contenido de proteína cruda del sustrato; CEN= cantidad de cenizas del sustrato (Sallam et al., 2007).
Diseño experimental y análisis estadístico: se hizo un análisis de varianza con un diseño completamente al azar para seis tratamientos y tres repeticiones, utilizando el paquete estadístico y la prueba de comparación múltiple de medias Tukey (SAS, 2004).
Resultados
Los valores de los parámetros Vm, L y S se muestran en el Cuadro 1.
Cuadro 1 Parámetros (S, L y Vm) de la cinética de producción de gas de fermentación, DIMS, DMO y EM de Leucaena leucocephala (LI) y Cynodon nlemfuensis (Cn) de seis periodos de rebrote.
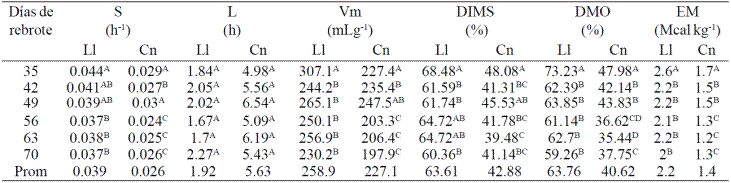
ABC Valores con literal distinta en la misma columna son diferentes (p< 0.05). S= tasa de producción de gas; L= fase lac o tiempo de retardo; Vm= volumen máximo de gas; DIMS= digestibilidad in vitro de la materia seca a 72 h de incubación; DMO= digestibilidad de la materia orgánica; DMO= 14.88+0.889GP+0.45CP+0.651XA, R2= 0.92. Donde: GP= producción de gas a 24 h, CP= proteína cruda, XA= cenizas. EM= energía metabolizable; EM= (MJ/KgDM)= 2.2 + 0.136GP + 0.057CP, R2= 0.94; donde GP= producción de gas a 24 h; EM (Mcal kg-1)= EM (MJ)*0.238.
L. leucocephala se fermenta más pronta (L= 1.92 h) y rápidamente (S= 0.039 h-1) que C. nlemfuensis (S= 0.026 h-1; L= 5.63 h). Igualmente, su potencial de fermentación dado por el volumen máximo de gas (Vm), fue mayor para L. leucocephala (Vm= 259.8 mL g-1) respecto a C. nlemfuensis (Vm= 227.1 mL g-1).
En contraste, la eficiencia de producción de gas fue mayor para C. nlemfuensis que para L. leucocephala (897.29 y 771.4 mL g-1 de MS digerida). Con respecto a la digestibilidad in vitro de la materia seca (DIVMS) de los forrajes, la L. leucocephala tuvo una digestibilidad mayor que el C. nlemfuensis (63.61 vs. 42.88 %).
Los valores estimados de DMO y EM (Cuadro 1) mediante modelos matemáticos (Sallam et al., 2007) mostraron que la digestibilidad de la materia orgánica fue similar a la DIVMS para ambos forrajes, manteniéndose la diferencia entre ellos. La energía metabolizable fue mayor en L. leucocephala que la de C. nlemfuensis (2.21 y 1.4 Mcal kg-1 MS). Por otro lado, respecto a la edad de rebrote, ambos forrajes de 35 DR tuvieron los parámetros de fermentación mejores (p< 0.05): mayor Vm, S, DIVMS, DMO, EM y menor L (Cuadro 1).
Con base en la Figura 1, se pudo determinar que L. leucocephala alcanza su mayor fermentación 20 h antes que C. nlemfuensis.
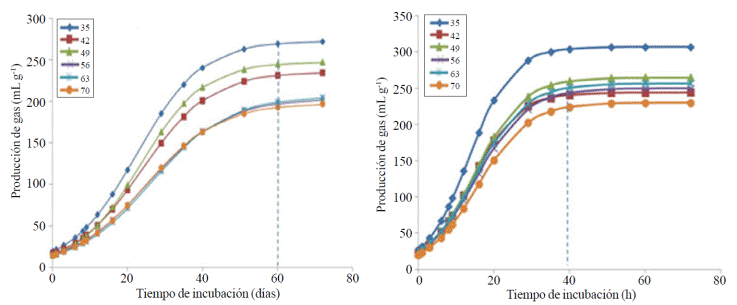
Figura 1 Producción de gas durante la fermentación in vitro de (A) Cynodon nlemfuensis; y (B) Leucaena leucocephala de 35, 42, 49, 56, 63 y 70 días de rebrote, por bacterias ruminales.
El tiempo para alcanzar las VM en L. leucocephala fue de 32 h y de 51 h para C. nlemfuensis.
En L. leucocephala la tasa (S) de los forrajes entre 35 y 49 DE son similares (p> 0.05), pero la de 35 DR es mayor (p< 0.05) a la de los forrajes de 56, 63 y 70 DR. El tiempo de retardo (L) no fue diferente (p> 0.05) entre DR, y el potencial de fermentación dado por Vm y de DIVMS, fue mayor (p< 0.05) solo para la L. leucocephala de 35 DR, con respecto a los demás DR (Cuadro 1, Figura 1). Un comportamiento similar se obtuvo para la DMO y EM de L. leucocephala, donde fueron mayores (p< 0.05) para las plantas de 35 DR.
Aunque, al igual que L. leucocephala, las plantas de C. nlemfuensis con 35 DR, tuvieron los mejores parámetros de fermentación y DIVMS, se observó que los DR mayores a 35 días afecta más el comportamiento fermentativo de éste pasto que el de la leguminosa, de tal manera que se pudo conformar tres grupos de: alta (35 DR), media (42 y 59 DR) y baja (56, 63 y70DR)fermentación,paraC.nlemfuensis (Figura1Avs1B).
Lo anterior se reflejó en el volumen fraccional de gas (Figura 2), por lo regular los forrajes presentan tres fracciones de fermentación: de rápida, media y lenta fermentación; atribuidas a azúcares y oligosacáridos solubles, polisacáridos de reserva como almidón, dextranas, pectina, y polisacáridos de pared celular (celulosa y hemicelulosa ligadas a lignina), respectivamente. L. leucocephala solo mostró un pico de alta producción fraccional de gas durante el periodo de 0 a 12 h (Figura 2B y Cuadro 2), el cual fue atribuido a azúcares y polisacáridos de reserva; en tanto que C. nlemfuensis mostró tres picos de mayor producción fraccional de gas: 0 a 14, 16 a 33 y de 37 a 61 h de incubación (Figura 2A y Cuadro 2).
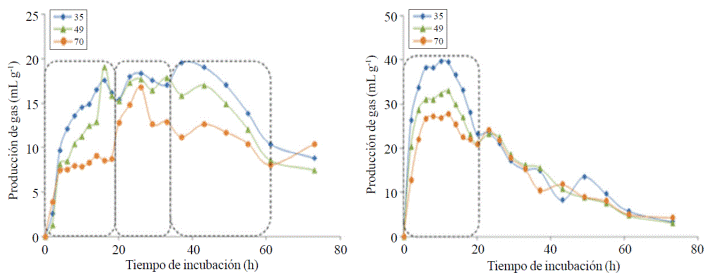
Figura 2 Producción fraccional de gas de fermentación in vitro de (A) Cynodon nlemfuensis; y (B) Leucaena leucocephala de 35, 49 y 70 días de rebrote, por bacterias ruminales.
Cuadro 2 Volumen fraccional acumulado de gas producido durante la fermentación in vitro de C. nlemfuensis (PE) y L. leucocephala (LE) en función de la edad de rebrote.
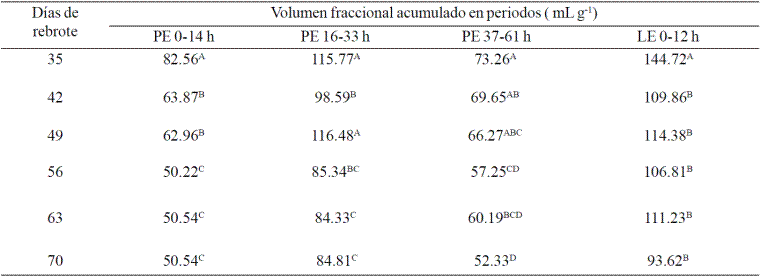
A, B y C = Valores con literal distinta en la misma columna son diferentes ( p< 0.05).
El volumen fraccional de 0-14 h, en C. nlemfuensis fue mayor (p<0.05) en el DR de 35d seguida por las de 42 y 49 d y, finalmente por las de 56, 63 y 70 d. Una tendencia similar se encontró para las otras dos fracciones (16 a 33 y 37 a 61 h), en el que las plantas de mayor DR produjeron menor gas y, por consiguiente, se fermentaron menos (Cuadro 2). En L. leucocephala solo se distingue la DR de 35 días comparándola con el resto de los DR analizadas.
La DMO estimada con el modelo matemático mostró un comportamiento similar a la DIVMS calculada (Cuadro 1). Para ambos forrajes, la DMO fue mayor (p< 0.05) a 35 DR, en leucaena sólo las plantas de 35 DR tuvieron la DMO mayor que las los otros DR, mientras que en C. nlemfuensis se formaron más grupos de acuerdo con la DMO. La EM mantuvo igual (p> 0.05) en leucaena independientemente los DR de 42 a 70 (p> 0.05), pero en C. nlemfuensis la EM disminuyó conforme los DR fueron mayores (Cuadro 1).
Las correlaciones significativas (p< 0.01) entre las variables de la cinética de fermentación (Vm, S y L), fraccional y DIVMS, con los nutrimentos orgánicos y minerales, para Cynodon nlemfuensis y Leucaena leucocephala se muestran en los Cuadros 3 y 4, respectivamente.
Cuadro 3 Correlaciones significativas para las variables de fermentación y contenido de nutrientes de Cynodon nlemfuensis.
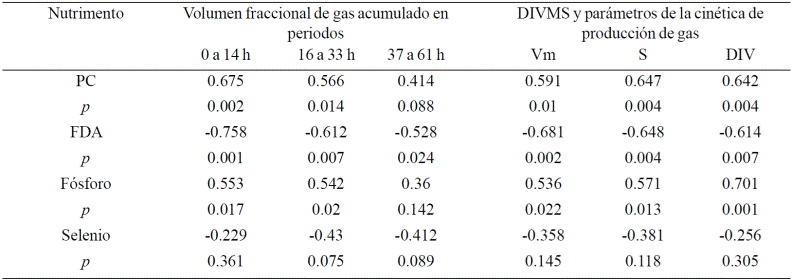
p= probabilidad: altamente significativa (<0.01), significativa (0.01< p< 0.1), no significativa (p> 0.1) S= tasa de producción de gas; L= fase lac ó tiempo de retardo; Vm=volumen máximo de gas; DIVMS= digestibilidad in vitro de la materia seca a 72 h de incubación.
Cuadro 4 Correlaciones significativas para las variables de fermentación y nutrientes de Leucaena leucocephala.
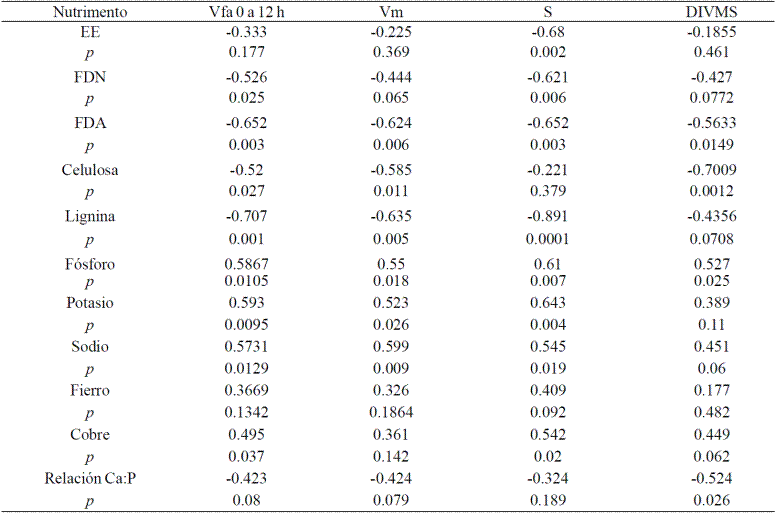
p= probabilidad: altamente significativa (<0.01), significativa (0.01< p< 0.1), no significativa (p> 0.1) S= tasa de producción de gas; L= fase lac ó tiempo de retardo; Vm=volumen máximo de gas; DIVMS= digestibilidad in vitro de la materia seca a 72 h de incubación.
La PC es el único componente nutritivo que se correlaciona positivamente (R= 0.566 a 0.675, p< 0.02) con las variables de fermentación y DIVMS, pero solo en Cynodon nlemfuensis. La FDA, FDN, Celulosa y Lignina se correlacionan negativamente (p< 0.03) con dichas variables. Es de destacar que la FDA, en ambos forrajes, y la lignina en leucaena son los de mayor correlación (R de -0.528 a -0.758; Cuadros 3 y 4). También es de resaltar que la celulosa solo se correlacionó negativamente con L. leucocephala y no con C. nlemfuensis. Respecto a los minerales, la relación Ca:P se correlacionó negativamente (R= -0.524; p= 0.026) con la DIVMS de L. leucocephala, aunque también hubo una tendencia de correlación negativa (R=0.424; p= 0.08) con el volumen de gas (Vm y V0-12). Con C. nlemfuensis, el selenio también mostró una tendencia de correlación negativa (R= 0.43 y -0.412; p= 0.075 y 0.089) para con la producción de gas fraccionalde16a32h,yde37a61h.
El fósforo se correlacionó positivamente en ambos forrajes (R= 0.536 a 0.701; p< 0.03). La fermentación y DIVMS de L. leucocephala fue más sensible al contenido de Fe, Na, K y Cu, porque mostraron una correlación positiva (Cuadro 4).
Discusión
En virtud de que las muestras L. leucocephala fueron menos fibrosas y tuvieron una composición más rica en componentes químicos, su fermentación y DIVMS fue mayor a la de C. nlemfuensis. Entre las razones de que L. leucocephala fuera más fermentable y digestible, es que este forraje compone el estrato alto del sistema silvopastoril; mientras que C. nlemfuensis desarrolla en el estrato bajo y la incidencia de luz solar es menor al del estrato alto. Este hecho se acrecienta conforme los DR son mayores, y la incidencia de luz al estrato bajo se reduce más, debido a la altura y espesor de la copa mayores que alcanzan las plantas de L. leucocephala. Es por esta razón que tanto la DIVMS como las variables de producción de gas por la fermentación, prácticamente no varían (p> 0.05) para L. leucocephala, pero se reducen (p< 0.05) en C. nlemfuensis. Esto se corroboró con el volumen fraccional de gas (Figura 2) donde se apreció que el mayor volumen de gas, en L. leucocephala, es del material de fácil fermentación (menos de 20 h de incubación); mientras que en C. nlemfuensis la fracción fibrosa (>40 h de fermentación) produce más gas que con leucaena (Figura 2).
La energía metabolizable estimada con los modelos matemáticos se comparan a los calculados por otros autores para estos mismos forrajes (Maya et al., 2005).Apesar de que hay que continuar evaluando dichos modelos matemáticos para determinar su confiabilidad, los datos obtenidos en esta investigación son apropiados para las condiciones de trabajo.
Al igual que en otros trabajos, la FDA se correlacionó negativamente con la fermentación y digestibilidad de los forrajes, debido a que este componente químico contiene lignina y celulosa, esta última puede contener mayor proporción de la forma cristalina que de la amorfa, los cuales sirven de impedimento físico para la penetración y actividad de las enzimas fibrolíticas. Parece ser que la celulosa de C. nlemfuensis es más fermentable que L. leucocephala dado que, en esta última se correlacionó negativamente con las variables de fermentación y, no hubo correlación en C. nlemfuensis.
Muchos de los minerales intervienen en funciones celulares importantes como en el transporte de nutrimentos a través de la membrana, la conformación de estructuras, transporte de electrones y como cofactores en la actividad enzimática. En este sentido es factible que el contenido de minerales en los forrajes pudieran afectar la actividad fermentativa de los microorganismos ruminales; de tal modo que se encontraron correlaciones positivas (p< 0.05) con varios minerales (P, K, Na, Fe y Cu) y solo hubo una tendencia (p< 0.1) de correlación negativa con selenio y Ca:P, en C. nlemfuensis (Cuadro 3) y L. leucocephala (Cuadro 4). En el caso del selenio la correlación se encontró con el volumen de las fracciones de media y lenta fermentación (V16-33, V37-61), correspondientes a polisacáridos de reserva y fibrosos, pero no con la DIVMS, S, Vm y V0-14 (Cuadro 3). Lo que indica que él Se no afecta la actividad enzimática de las enzimas de la digestión ni de la fermentación de la facción soluble.
Por el contrario la relación Ca:P si afecta la digestibilidad. Existen reportes de mediados de siglo pasado que indican (Burroughs et al., 1951) que demuestran que elementos como Fe, Na, K, Ca afectan la fisiología de las bacterias ruminales. Mucho se ha investigado sobre el efecto de minerales en la actividad, fisiología, digestión de celulosa por microorganismos ruminales, se ha llegado a estimar las concentraciones apropiadas para optimar dicha actividad, o los niveles tóxico, muy pocos trabajos han investigado la liberación de tales minerales durante la digestión de los forrajes y su efecto en la actividad microbiana, por lo que la presente investigación da evidencia de que el contenido de minerales en los forrajes puede estar relacionado con la actividad fermentativa de los microorganismos del rumen; no obstante, es necesario realizar más investigaciones al respecto y determinar su efecto en sistemas in vivo e in situ, ya que esto pudiera estar determinado por la composición mineral del rumen y este a su vez por el origen o región donde se cultivó el forraje que consume y la formulación de las dietas en las que se incluyen mezclas minerales.
Conclusión
La fermentación y digestibilidad in vitro por consorcios microbianos del rumen, de Cn y Ll cultivados en un sistema silvopastoril, están determinadas por los DR. Dado que la fermentación C. nlemfuensis es más afectada por DR mayores, éste forraje determina los DR a los que debería pastorearse el sistema (35 a 42 DR), y para estimular su utilización ruminal se sugiere buscar alternativas de manejo para incrementar el contenido de PC en Cn y de P en Ll, lo cual puede lograrse fertilizando con P e inoculando con micorriza, dada la alta correlación que se encontró en esta investigación, entre las variables de fermentación y digestibilidad con el contenido de éstos nutrimentos.











 texto en
texto en 


